25-羟基维生素D化学发光检测试剂盒的研发
2017-10-16宋翠翠白仲虎杨艳坤
宋翠翠, 李 昕, 卢 菲, 白仲虎, 杨艳坤
(1. 江南大学 粮食发酵工艺与技术国家工程实验室, 无锡 214122; 2. 江南大学 工业生物技术教育部重点实验室, 无锡 214122; 3. 江南大学 糖化学与生物技术教育部重点实验室,无锡 214122)
25-羟基维生素D化学发光检测试剂盒的研发
宋翠翠1,2,3, 李 昕1,2,3, 卢 菲1,2,3, 白仲虎1,2,3, 杨艳坤1,2,3
(1. 江南大学 粮食发酵工艺与技术国家工程实验室, 无锡 214122; 2. 江南大学 工业生物技术教育部重点实验室, 无锡 214122; 3. 江南大学 糖化学与生物技术教育部重点实验室,无锡 214122)
研制了用于定量检测人血清中25-羟基维生素D(25-OHD)水平的化学发光法检测试剂盒,并对试剂盒各项性能指标进行验证。试剂盒建立的方法为:将25-OHD单克隆抗体包被于微孔板中,将血清样品与释放剂同时加入微孔板中进行孵育,使样品的25-OHD充分释放出来并与包被板上的25-OHD抗体相结合。再加入酶结合物(生物素化25-OHD和链霉亲和素化过氧化物酶(SA-HRP)的混合物),使之与25-OHD抗体相结合,形成竞争免疫复合物,随后洗涤除去未结合的物质,加入化学发光底物,使用化学发光免疫分析仪读取相对发光强度(RLU)。制备的25-OHD检测试剂盒最低检出限为4.9 ng/mL,准确度相对偏差在±10%以内,批内变异系数小于10%,批间变异系数小于15%,2℃~8℃存放有效期为1年。对200份临床血清样本进行检测,与参比试剂盒检测结果的相关系数R=0.9717。试剂盒各项性能指标均符合行业标准要求,具有灵敏,稳定,快速,简便等特点。
25-羟基维生素D;化学发光法;试剂盒
AbstractIn this paper, a chemiluminescent immunoassay (CLIA) kit for quantitative assay of 25-hydroxyvitamin D(25-OHD)in serum was developed and evaluated. The kit is established as follows: first, 25-hydroxyvitamin D monoclonal antibodies was coated with the 96 well microplate, then the serum sample and the release reagent were added into the microplate. After incubation, the 25-OHD of the sample was fully released and combined with the 25-OHD antibody coated on the microplate. HRP conjugate (mixture of biotinylated 25-OHD and streptavidin-labeled HRP ) compete with the 25-OHD released from sample to antibodies. After washing and adding the CLLIA substrate, the relative luminous intensity was read with chemiluminescent immunoassay analyzer. The minimum detection limit of the kit is 4.9 ng.mL-1, with the bias of less than 10%. The intra-assay and inter-assay coefficients of variation were less than 10%, and 15%, respectively. Its preserving duration could be as long as 12 months at 2-8℃. Two hundred clinical serum specimens were tested with this kit and a foreign made serum ferritin kit, the correlation coefficient was 0.9717. 25-hydroxy vitamin D (CLIA) quantification detection kit was successfully prepared, and all the technical parameters reached the industrial standards. The developed kit is sensitive, stable, fast and simple.
Keywords25-hydroxyvitamin D; chemiluminescent immunoassay; kit
维生素D(Vitamin D,VD)是一种固醇类衍生物,是人体代谢所必需的营养物质[1]。其主要形式有维生素D2和维生素D3。维生素D2是由酵母菌中的麦角固醇经阳光或紫外线照射后的产物,维生素D3主要是由高等动物表皮或皮肤组织中7-脱氢胆固醇在紫外线或阳光照射下经光化学反应生成[2]。人体获得VD的主要途径为:食物摄入与经阳光照射皮肤合成。人体获取的维生素D在体内经血液循环转运至肝脏,在肝酶的作用下转化为25-OHD,25-OHD再转运到肾脏,经第二次羟基化转化为具有活性的1,25-二羟基维生素D(1,25-(OH)2D)[3],1,25-(OH)2D通过与靶细胞维生素 D受体结合发挥其强大的生物学作用[4-5]。人体内维生素D、25-OHD和1,25-(OH)2D的半衰期分别为24 h、3周和4 h[6]。其中25-OHD半衰期较长且波动较小,因此血清25-OHD含量是目前国际公认的衡量机体VD营养状态的指标[7-8]。
维生素D的经典作用是调节钙磷水平,影响骨骼健康。但近来研究发现,除了传统的骨骼效应,维生素D还与自身免疫疾病[9]、糖尿病[10]、心血管疾病[11-12]、癌症[13]等疾病相关。而现今维生素D缺乏现象非常普遍,据调查,全球约有10亿人处于VD缺乏状态[7]。血清中25-OHD最佳水平并没有明确的定义,但很多文献报道普遍定义血清25-OHD水平低于20 ng/mL时为维生素D缺乏,21~29 ng/mL时为不足, 大于等于30 ng/mL为充足[7-8]。
现已有的25-OHD检测方法有放射免疫法(RIA),酶联免疫法(ELISA),化学发光法(CLIA),液相色谱-串联质谱法(LC-MS)。其中化学发光法以其灵敏度高,线性范围宽,无污染,操作方便等优势,成为发展趋势。本试剂盒的研制采用竞争化学发光法,以25-羟基维生素D抗体包被微孔板,制成固相抗体,用生物素化25-OHD和SA-HRP的混合物与抗原竞争性结合到固相抗体上,以鲁米诺和过硼酸钠为化学发光底物,建立了快速简便的用于定量检测人血清中25-羟基维生素D水平的检测方法。
1 材料与方法
1.1 材料
空白化学发光板购于美国Costar公司。25-羟基维生素D、链酶亲和素、牛血清白蛋白(BSA)购于美国Sigma公司。25-羟基维生素D单克隆抗体定制于镇江博安特生物技术有限公司。生物素化25-OHD受赠于江南大学药物化学与药物分析研究室。辣根过氧化物酶(HRP)购自于美国Thermo Fisher公司。马血清购于北京索莱宝公司。200例临床血清样本及参比试剂检测值来自于上海交通大学医学院附属仁济医院和复旦大学附属金山医院。
1.2 仪器
厦门天中达化学发光免疫分析仪,检测仪器型号为TZD-CL-200S。洗板机购于英国Anthos公司,型号为Fluido2。平板震荡仪购于上海汉林,型号为Mix-1500。
1.3 方法
1.3.1 包被板的制备
将25-羟基维生素D抗体溶于0.1 mol/L的PB缓冲液(pH 7.0)中,稀释至最佳浓度,磁力搅拌器搅拌30 min,确保包被液充分混匀。包被板微孔中每孔加入100 μL包被液,2℃~8℃静置过夜。倒掉包被液,用洗液洗板一次,每孔加入200 μL封闭液(含2%BSA,5%蔗糖的PB缓冲液),2℃~8℃静置过夜。倒掉封闭液,吹干,密封。
1.3.2 校准品的制备
将浓度为1 mg/mL的25-羟基维生素D的溶液,添加到马血清中,配制校准品1~5,理论浓度分别为7.5、15、30、60和120 ng/mL。校准品0为含4% BSA的磷酸盐缓冲液。将校准品0~5分装于棕色瓶中,低温冻干。冻干校准品加入去离子水复溶后,用罗氏的25-OHD检测体系进行赋值。
1.3.3 质控品的制备
取经标定的高值校准品,用校准品0配制成浓度为15、30和60 ng/mL的25-羟基维生素D质控品。
1.3.4 链酶亲和素标记辣根过氧化物酶(SA-HRP)的制备
取5 mg辣根过氧化物酶(HRP)溶于2 mL无菌水中,并加入0.2 mL NaIO4(21 mg/mL), 0℃冰浴放置15 min; 将反应物置于醋酸钠缓冲液中,4℃透析 12~24 h; 小心吸出混合液,加入0.3 mL乙二醇(0.16 mol/mL),0℃封闭1 h; 混合液加入10 mg链酶亲和素,于碳酸缓冲液中4℃透析 12~24 h; 结合物加0.1 mL NaBH4,混匀,4℃还原3 h; 加入等体积饱和硫酸铵,4℃盐析24 h; 次日取出混合物6000 r/min离心20 min,弃上清,沉淀用0.5 mL生理盐水溶解备用; 整个操作步骤注意避光[15]。
1.3.5 最佳抗体包被浓度、生物素化25-OHD工作浓度的确定
以棋盘滴定法通过检测校准品0和校准品5的光子数来确定最佳抗体包被浓度和生物素化25-OHD工作浓度。包被抗体稀释到1、2、3和4 μg/mL;生物素化25-OHD浓度选用: 100、50和25 ng/mL;根据实验室已有基础,选择的SA-HRP稀释倍数为1∶10 000(1 W)。
1.3.6 最佳SA-HRP工作浓度的确定
以单因素实验通过检测校准品0和校准品5的光子数来确定SA-HRP最佳工作浓度。选用最佳抗体包被浓度,最佳生物素化25-OHD工作浓度;SA-HRP稀释倍数选用:1∶10 000(1W)、1∶20 000(2W)、1∶40 000(4W)。
1.3.7 样本前处理方法
由于血清中几乎所有循环的25-羟基维生素D都是与维生素D结合蛋白(DBP)和白蛋白结合存在的。想要测定血清中25-羟基维生素D的浓度,首先需要将其从DBP和白蛋白上释放出来。本实验采用的样本前处理方法为:30 μL血清中加入100 μL释放剂震荡(500 bp)反应120 min,能够使血清中的25-羟基维生素D完全释放。
1.3.8 试剂盒原理
本试剂盒采用竞争化学发光法体外定量检测血清中的25-羟基维生素D的浓度。在预包被了25-OHD单克隆抗体的微孔板中,加入校准品、血清样品及释放剂后,样品中释放出来的25-OHD与包被板上的25-OHD抗体相结合。洗涤去除未结合的物质,再加入酶结合物(生物素化25-OHD和SA-HRP的混合物),使之与25-OHD抗体相结合,形成竞争免疫复合物,随后洗涤去除未结合的物质,加入化学发光底物后,使用化学发光免疫分析仪读取相对发光强度(RLU)。
1.3.9 试剂盒操作步骤
首先在预包被了25-OHD抗体的微孔板中,加入30 μL校准品、血清样品和100 μL释放剂,在平板震荡仪上(500 bp)震荡反应120 min。加样完成后的10 min之内完成酶结合物工作液的配制(生物素化25-OHD和SA-HRP混合物工作液),避光放置。然后洗板5次,去除未结合的物质,再每孔加入200 μL酶结合物工作液,平板震荡仪上(500 bp)反应30 min。洗板5次后,加入100 μL底物(50 μL底物A与50 μL底物B),使用化学发光免疫分析仪读取相对发光强度(RLU)。
1.3.10 数据分析
应用四参数曲线模型对结果进行分析,根据已知不同浓度的25-OHD校准品的RLU值绘制校准曲线,通过曲线计算血清样品中的25-羟基维生素D浓度。
1.3.11 试剂盒性能
1)最低检出限
平行测定10孔0 ng/mL 25-羟基维生素D校准品的相对发光强度(RLU),计算RLU的平均值(M)与RLU标准差(SD)。利用剂量-反应曲线计算出(M-2SD)对应的浓度值为最低检出限。
2)准确度
使用浓度为15 ng/mL和30 ng/mL的25-OHD质控品作为样本按照上述实验步骤进行检测,各重复测定3次,测量浓度结果的平均值记为(Mi),根据公式(1)分别计算相对偏差(Bi)。
Bi(%)=(Mi-T)/T×100%
(1)
式中:Bi—相对偏差;
Mi—测量浓度的平均值;
T—标定浓度。
3)精密度
选用高、中、低(60、30和15 ng/mL)3个水平的质控品,在同一次试验中各重复检测10次,计算各质控品的变异系数(CV),即为批内精密度。选用3个不同批次的试剂盒,测定同一质控品(30 ng/mL)的浓度,各重复检测10次,计算30次测量浓度结果的平均值和标准差,可得3批试剂盒间的变异系数,即为批间精密度。
4)热稳定性
选用同一批试剂盒在37℃分别放置5 d和10 d,与在4℃放置的试剂盒进行比较,分别检测试剂盒的最低检出限、准确度和精密度。
5)临床应用
取200份临床血清分别用参比试剂盒和本试剂盒进行检测。以参比试剂(罗氏)检测值作为X轴,以本试剂盒检测值作为Y轴,计算本试剂盒与参比试剂盒检测值的相关性。
2 结果与分析
2.1 校准品的赋值及校准曲线的绘制
25-OHD冻干校准品复溶后,用罗氏的25-OHD检测体系进行赋值。校准品理论值与实测值见表1。以实测值为准,所以定义25-OHD校准品0~5的浓度分别为0、7.53、14.32、28.42、58.48和115.3 ng/mL。以校准品浓度为X轴,测得光子数为Y轴,绘制25-OHD校准曲线,见图1,校准曲线线性相关系数R2=0.9997。
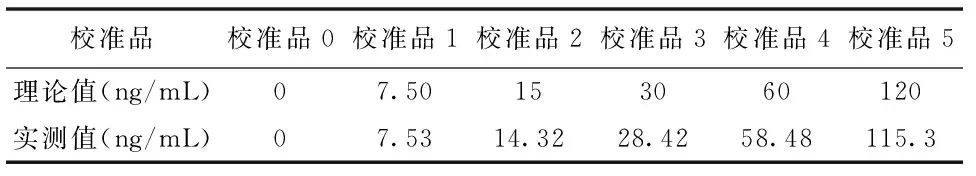
表1 校准品赋值结果
2.2 最佳抗体包被浓度、生物素化25-OHD工作浓度的确定
用棋盘滴定法,筛选包被抗体和生物素化25-OHD的最佳浓度,结果见表2。当 RLU(115.3 ng/mL)/RLU(0 ng/L)的比值在 0.1~0.2时,选择生物素化25-OHD的最小浓度作为最佳工作浓度。从表2看出,当抗体包被浓度为3 μg/mL,生物素化25-OHD浓度为25 ng/mL 时,RLU(115.3 ng/mL)/RLU (0 ng/mL)=2 107 565/133 750=0.157,因此生物素化维生素D衍生物最佳工作浓度为25 ng/mL。 从图2看出,当抗体包被浓度为3 μg/mL时,包被基本达到饱和,所以确定抗体的最佳包被浓度为3 μg/mL。
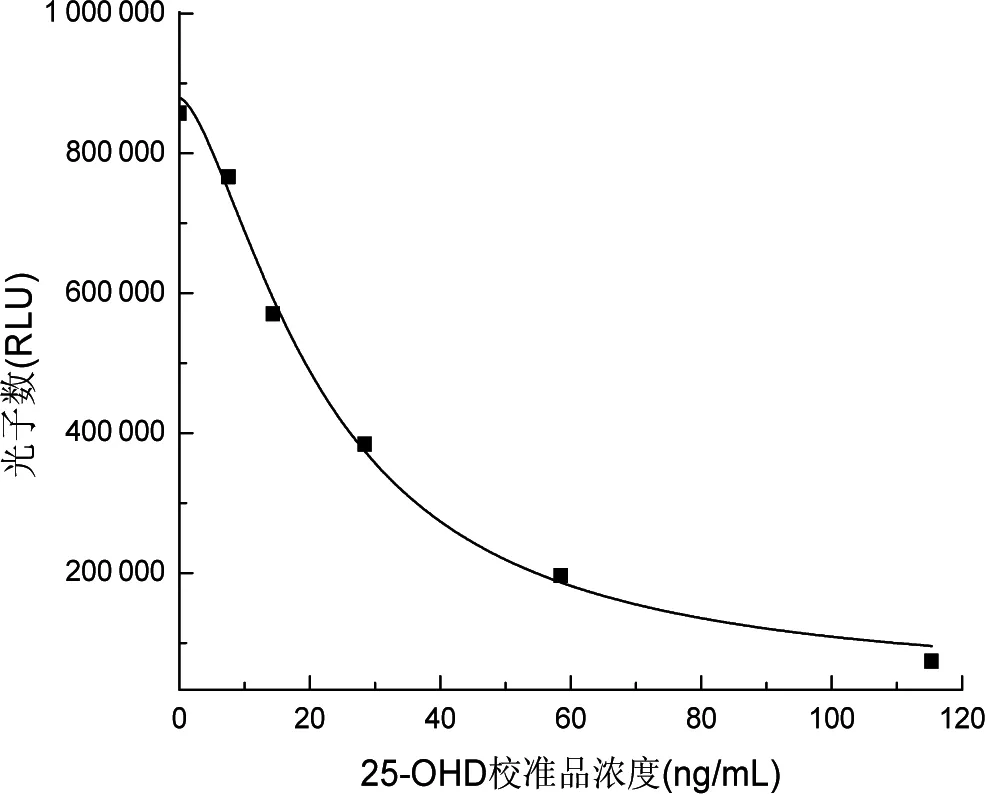
图1 25-羟基维生素D校准曲线
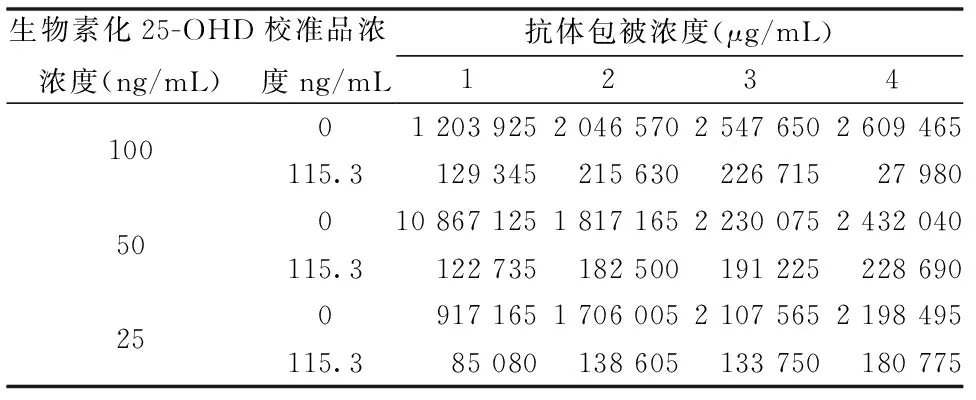
生物素化25-OHD浓度(ng/mL)1005025校准品浓度ng/mL0115.30115.30115.3抗体包被浓度(μg/mL)12341203925204657025476502609465129345215630226715279801086712518171652230075243204012273518250019122522869091716517060052107565219849585080138605133750180775
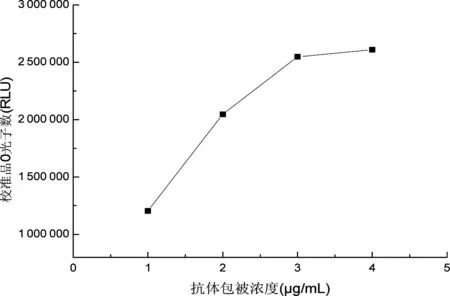
图2抗体包被量对0值校准品光子数的影响
Fig 2 The influence of antibody coating concentration on zero standard RLU
2.3 SA-HRP最佳工作浓度的确定
选择最优的抗体包被量3 μg/mL及生物素化25-OHD工作浓度25 ng/mL。SA-HRP稀释倍数选择:1W、2W和4W。测定校准品0和校准品5的RLU,结果见表3。
当RLU( 115.3 ng/mL) /RLU ( 0 ng/mL) 的比值在 0.1~0.2时,SA-HRP稀释倍数最大时为最佳工作浓度。由表3可知,SA-HRP稀释倍数为4W时, RLU(115.3 ng/mL)/RLU(0 ng/mL)=835 430/56 370=0.148,符合要求,故确定链酶亲和素标记HRP工作浓度为1:4W。
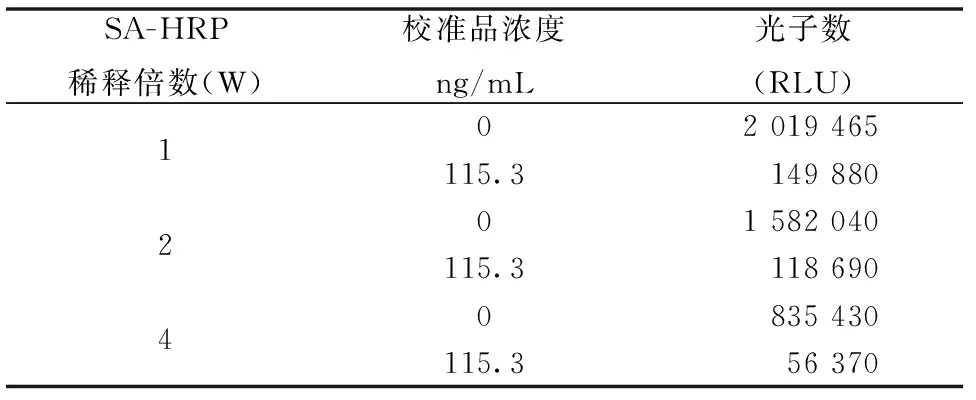
表3 SA-HRP稀释倍数检测结果
2.4 试剂盒的验证
2.4.1 最低检出限
经检验,本试剂盒的灵敏度为4.90 ng/mL,符合行业要求。
2.4.2 准确度
用已知浓度为15 ng/mL和30 ng/mL的质控品作为样本进行检测,其检测结果见表4,理论值与实测值的相对偏差均在±10%范围内。证明本试剂盒准确度符合行业标准要求。
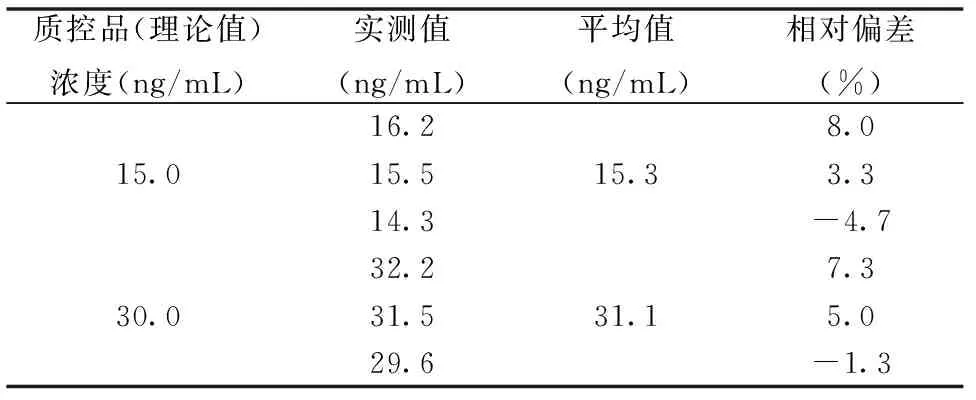
表4 试剂盒准确度检测
2.4.3 精密度
经检验,本试剂盒批内和批间的变异系数分别为6.5%和8.9%。批内精密度小于10%,批间精密度小于15%,表明本试剂盒精密度良好,符合行业标准要求。
2.4.4 热稳定性
在37℃放置5 d和10 d的试剂盒与在4℃放置的试剂盒比较,各项指标均符合行业标准要求,检测内部质控品结果均稳定,结果见表5。
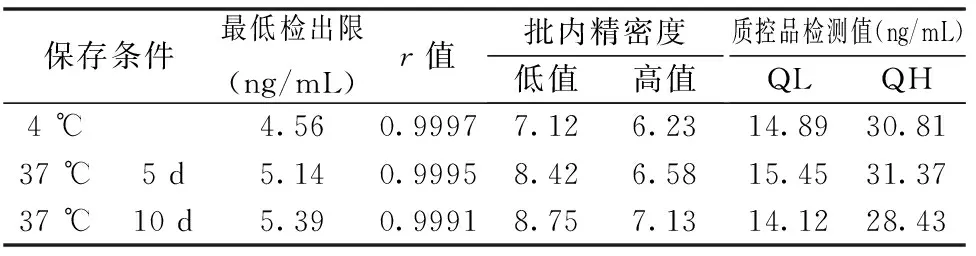
表5 热稳定性考察结果
2.4.5 试剂盒的临床应用
200份血清样本的检测结果如图3,本试剂盒与参比试剂盒检测结果的相关系数R=0.9717,说明两者的测定结果有良好的一致性。
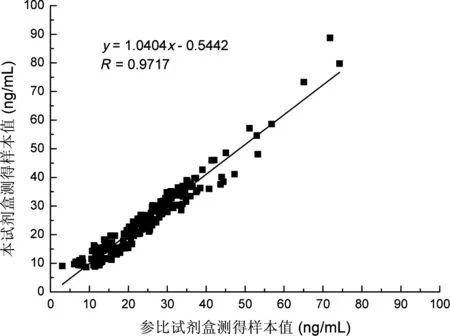
图3 本试剂盒与参比试剂盒检测血清样本测定结果
3 讨论
25-羟基维生素D(25-OHD)是维生素D(VD)的一种代谢中间产物,由于其在血液中含量相对较高且半衰期长、波动较小,因此血清25-OHD含量是目前国际公认的衡量机体维生素D营养状态的指标。维生素D是人体代谢不可或缺的重要营养物质,主要生理作用是调节钙磷代谢。近年来研究发现,维生素D还参与人体炎症反应、免疫反应、脂质代谢等生理过程,维生素D的缺乏与多种疾病相关。但调查研究发现全球范围内维生素D缺乏症状普遍存在,据估计全球约有10亿人处于维生素D缺乏或不足状态。所以维生素D的检测在临床的地位显得日益重要。目前国内临床应用的25-OHD检测试剂盒主要来源于国外供应商,价格昂贵。所以开发国产化质量合格的25-OHD检测试剂盒替代进口试剂盒,可降低检测成本,减轻病患负担,具有一定的社会和经济学意义。
本试剂盒采用竞争化学发光法,用25-OHD抗体包被微孔板,制成固相抗体,酶结合物(生物素化25-OHD与SA-HRP的混合物)与样本中的25-OHD竞争性结合到固相抗体上,以鲁米诺和过硼酸钠为发光底物,实现对25-OHD的定量检测。采用将样本与释放剂同时加入微孔板中的方法,使样本、释放剂与微孔板中的抗体同时孵育,以便于样本中的25-OHD释放出来后直接与固相抗体结合,省去了样本单独处理的过程,节约了时间,简化了实验操作。本研究还对试剂盒的各项性能指标进行了验证,经验证试剂盒最低检出限为4.90 ng/mL,准确度相对偏差在±10%以内,批内变异系数为6.5%,批间变异系数为8.9%,有效期为1 年,各项指标均符合行业标准要求。同时临床实验结果证实本试剂盒与参比试剂盒(罗氏)的检测结果呈高度相关性。此研究为本试剂盒的临床应用提供了理论支持。
[1]ZAREI M, JAVANBAKHT M H, CHAMS-DAVATCHI C, et al. Evaluation of vitamin D status in newly diagnosed pemphigus vulgaris patients [J]. Iranian Journal of Public Health, 2014, 43(11):1544-1549.
[2]廖二元. 维生素 D 制剂的药理机制与临床应用 [J]. 中南药学, 2003, 1(2):98-102.
[3]宋爱华. 全自动生化法检测 25-羟基维生素 D 的方法学评估 [J]. 标记免疫分析与临床, 2015,22(10):1051-1055.
[4]ZITTERMANN A. Vitamin D and disease prevention with special reference to cardiovascular disease [J]. Progress in Biophysics & Molecular Biology, 2006, 92(1):39-48.
[5]DELUCA H F. Overview of general physiologic features and functions of vitamin D [J]. American Journal of Clinical Nutrition, 2004, 80(6,Suppl):1689S-1696S.
[6]ZERWEKH J E. Blood biomarkers of vitamin D status [J]. The American Journal of Clinical Nutrition, 2008, 87(4):1087S-1091S.
[7]CAVA R C, JAVIER A N. Vitamin D deficiency [J]. New England Journal of Medicine, 2007, 357(19):1981.
[8]李水军, 王思合, 周建烈, 等. 维生素 D 代谢及 25-羟基维生素 D 测定方法研究进展 [J]. 国际检验医学杂志, 2012, 33(24):3028-3030.
[9]CUTOLO M. Further emergent evidence for the vitamin D endocrine system involvement in autoimmune rheumatic disease risk and prognosis [J]. Annals of the Rheumatic Diseases, 2013, 72(4):473-475.
[10]GRIZ L H M, BANDEIRA F, Gabbay M A L, et al. Vitamin D and diabetes mellitus: an update 2013 [J]. Arquivos Brasileiros de Endocrinologia & Metabologia, 2014, 58(1):1-8.
[11]ZITTERMANN A. Vitamin D and disease prevention with special reference to cardiovascular disease [J]. Progress in Biophysics and Molecular Biology, 2006, 92(1):39-48.
[12]WANG T J, PENCINA M J, BOOTH S L, et al. Vitamin D deficiency and risk of cardiovascular disease [J]. Circulation, 2008, 117(4):503-511.
[13]HOLICK M F. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis [J]. The American Journal of Clinical Nutrition, 2004, 79(3):362-371.
[14]HOLICK M F, BINKLEY N C, BISCHOFF-FERRARI H A, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an endocrine society clinical practice guideline [J]. The Journal of Clinical Endocrinology & Metabolism, 2012, 96(7):1911-1930.
[15]刘雅莉, 刘 芳, 刘 箐, 等. 两种酶标抗体制备方法的比较及李斯特菌TASELISA试剂盒性能的优化 [J]. 食品工业科技, 2012, 33(15):301-307.
The development of chemiluminescent immunoassay detection kit for 25-hydroxy vitamin D
SONG Cui-cui1,2,3, LI Xin1,2,3, LU Fei1,2,3, BAI Zhong-hu1,2,3, YANG Yan-kun1,2,3
(1. National Engineering Laboratory for Cereal Fermentation Technology; 2. The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology; 3. The Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
R446.6
B
2095-1736(2017)05-108-05
2016-10-11;
2016-10-24
江苏省政策引导类计划(产学研合作)——前瞻性联合研究项目(BY2015019-17)
宋翠翠,硕士研究生,主要从事体外诊断试剂研发工作,E-mail: 906861617@qq.com
杨艳坤,副教授,硕士生导师,主要从事微生物学、基因工程、分子遗传、蛋白质的分离纯化及特性研究等相关领域科研工作,E-mail:yangyankun@jiangnan.edu.cn
doi∶10.3969/j.issn.2095-1736.2017.05.108
