ZnO纳米粒子抑制体外小鼠光感受器细胞MnSOD的表达及活性
2017-10-13孙园园郭大东刘滨丁红燕徐溢毕宏生
孙园园,郭大东,刘滨,丁红燕,徐溢,毕宏生,*
1. 山东中医药大学第二临床医学院,济南 2500142. 山东中医药大学眼科研究所,济南 2500023. 淮阴工学院 江苏省介入医疗器械研究重点实验室,淮安 2230034. 山东大学临床医学院,济南 250012
ZnO纳米粒子抑制体外小鼠光感受器细胞MnSOD的表达及活性
孙园园1,郭大东2,刘滨1,丁红燕3,徐溢4,毕宏生2,*
1. 山东中医药大学第二临床医学院,济南 2500142. 山东中医药大学眼科研究所,济南 2500023. 淮阴工学院 江苏省介入医疗器械研究重点实验室,淮安 2230034. 山东大学临床医学院,济南 250012
随着纳米技术的发展,纳米材料在生物医药以及化工中已得到广泛应用。作为一类新型材料,其安全性也日益受到人们的高度关注。为探索氧化锌(ZnO)纳米粒子对小鼠视网膜光感受器细胞的毒性作用,本文通过MTT、荧光染色、流式细胞术、实时荧光定量PCR和酶联免疫吸附试验(ELISA)等技术,分别对经不同浓度ZnO纳米粒子处理的小鼠光感受器细胞活性、活性氧水平、锰超氧化物歧化酶(MnSOD)的基因和蛋白表达及活性进行了检测。结果表明,ZnO纳米粒子可通过诱导细胞线粒体产生过多的活性氧,降低线粒体膜电位,导致小鼠视网膜光感受器细胞损伤;ZnO纳米粒子能显著减少MnSOD在mRNA和蛋白质水平的表达,降低MnSOD活性,加剧氧化应激介导的细胞损伤。因此,氧化应激水平的提高导致了过量的活性氧产生及MnSOD表达和活性的下降,与ZnO纳米粒子引起的细胞毒性作用有关。
氧化锌纳米粒子;小鼠光感受器细胞;线粒体;活性氧;锰超氧化物歧化酶
ZincOxideNanoparticlesInhibittheExpressionandActivityofMnSODinMurinePhotoreceptorCellsinVitro
Sun Yuanyuan1, Guo Dadong2, Liu Bin1, Ding Hongyan3, Xu Yi4, Bi Hongsheng2,*
1. The Second Clinical Medical College of Shandong University of Traditional Chinese Medicine, Jinan 250014, China2. Eye Institute of Shandong University of Traditional Chinese Medicine, Jinan 250002, China3. Jiangsu Provincial Key Laboratory for Interventional Medical Devices, Huaiyin Institute of Technology, Huaian 223003, China4. School of Clinical Medicine, Shandong University, Jinan 250012, ChinaReceived29 November 2016accepted5 January 2017
Abstract: Nanomaterials have been widely used in areas of biology, pharmacy and chemical industry due to its rapid development. As a new type of material, the toxicity of nanomaterials is also attracting enormous attention. In the present study, the effects of ZnO nanoparticles (NPs) on murine photoreceptor cell viability and on the expression and activity of MnSOD were investigated by using 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay, fluorescent analysis, flow cytometry, quantitative real-time PCR and enzyme-linked immunosorbent assay (ELISA) techniques. ZnO NPs exhibited high cytotoxicity on the target cells in concentration- and time-dependent manners. ZnO NPs elevated intracellular levels of reactive oxygen species (ROS) and collapsed the mitochondrial membrane potential, thus leading to murine photoreceptor cell damage. Moreover, ZnO NPs significantly reduced the expression of MnSOD at both mRNA and protein levels, attenuated its activity, and further aggravated the oxidative stress-mediated cell damages. Overall, ZnO NPs-induced cytotoxicity on murine photoreceptor cells was closely associated with elevated levels of oxidative stress via the overproduction of ROS and decreased expression and activity of MnSOD.
Keywords: zinc oxide nanoparticle; murine photoreceptor cell; mitochondrion; reactive oxygen species; manganese superoxide dismutase
目前,氧化锌(ZnO)纳米粒子在生物医学领域的应用已受到广泛关注,研究已证实ZnO纳米粒子具有较强的抗糖尿病[1-2]和抗癌作用[3-5]。然而,有研究发现,ZnO纳米粒子可通过产生过量的活性氧(reactive oxygen species, ROS)损伤宿主DNA,进而对机体产生潜在的基因毒性[6-9]。大量研究表明,纳米材料在未进入细胞前,对细胞的局部环境造成损伤;进入细胞后,对细胞、基因都存在潜在的损伤和危害[10]。虽然目前对ZnO纳米粒子的研究已经取得了一些进展,但其作用机制仍不清楚。
氧化应激是由活性氧的生成和抗氧化防御之间的失衡造成的,而线粒体在活性氧的产生和清除过程中占重要地位[11]。为保护机体免受活性氧的有害影响,细胞进化出许多防御机制,包括具有清除活性氧能力的酶(如过氧化氢酶)和用于去除过氧化氢或过氧化物歧化酶的多种过氧化物酶,以消除过氧化物自由基[12]。超氧化物歧化酶(SOD)是一种线粒体内清除自由基的酶,在线粒体中调控细胞器产生活性氧的类型,调节细胞的氧化还原平衡,以维持正常的线粒体功能[13]。
氧化应激可以明显促进活性氧的产生,过量的活性氧被认为是由纳米材料介导细胞毒性中最重要的损伤机制之一[14-15]。线粒体中存在清除活性氧的各种抗氧化酶系统,其中锰超氧化物歧化酶(MnSOD)是线粒体抗氧化酶中重要的活性氧清除酶[16]。在本实验中,我们研究了ZnO纳米粒子对活性氧的产生和MnSOD表达的影响,并进一步阐释了ZnO纳米粒子介导的细胞毒性和通过放大氧化应激来降低MnSOD表达及活性的作用机制。
1 材料与方法(Materials and methods)
1.1 主要试剂和材料
ZnO纳米粒子(上海谱振生物科技有限公司,纯度大于99.7%),661W小鼠视网膜光感受器细胞(美国俄克拉荷马大学健康卫生中心Muayyad教授惠赠),胎牛血清(HyClone公司,美国),自动细胞计数仪(TC10,Bio-Rad,美国),倒置荧光显微镜(IX71,Olympus,日本),场发射扫描电子显微镜(SU8020,Hitachi,日本),流式细胞仪(FACSVerse,BD公司,美国),酶标仪(ELX800,BioTek,美国),Trizol试剂(Invitrogen,美国),RevertAid逆转录酶(Fermentas,德国),SYBR Green I(Takara,日本),实时荧光定量PCR仪(Mx3000P,安捷伦科技有限公司,美国)。引物由Primer5.0软件设计并由上海生工生物工程技术服务有限公司合成,锰超氧化物歧化酶ELISA试剂盒(武汉基因美生物科技有限公司),锰超氧化物歧化酶活性检测试剂盒(南京建成生物工程研究所,中国),紫外分光光度计(UV4802,尤尼科上海有限公司,中国)。
1.2 细胞培养
661W细胞培养在DMEM培养基(1.0 g·L-1葡萄糖,10%胎牛血清,100 U·mL-1青霉素,100 μg·mL-1链霉素)中,条件为37 ℃、5%二氧化碳培养箱中培养,细胞计数统一用自动细胞计数仪。
1.3 MTT分析
为研究ZnO纳米粒子对661W细胞活性的影响,实验组将661W的细胞接种于96孔板(每孔1.0×104细胞)中。培养过夜后,各组细胞分别用浓度为0、31.25、62.5和125.0 μmol·L-1的ZnO纳米粒子溶液干预,对照组细胞不加入ZnO纳米粒子。细胞均在37 ℃、5%二氧化碳的培养箱中分别培养24 h、48 h和72 h。每天使用倒置相差显微镜观察并记录细胞形态,到达指定的培养时间后,各孔的细胞中分别添加20 μL MTT溶液(5 mg·mL-1),37 ℃条件下继续培养4 h,然后去除上清液,每孔加入200 μL二甲基亚砜(DMSO)并振摇10 min,然后用酶标仪在490 nm(参考650 nm)处测定吸光度值。细胞活性计算公式如下:细胞活性(%)=[A]实验组/[A]对照组×100%,A代表吸光度值。实验重复3次,结果用平均值±标准差表示。
1.4 细胞内活性氧检测
通过流式细胞术,用2',7'-二氯荧光黄双乙酸盐(DCFH-DA)检测ZnO纳米粒子对细胞内活性氧水平的影响。将661W细胞接种于6孔板(每孔3.0×105细胞)中,培养过夜,弃掉上清液,分别用浓度0、31.25、62.5和125.0 μmol·L-1ZnO纳米粒子干预细胞2 h,然后PBS洗2遍,加入DCFH-DA溶液后37 ℃避光温育30 min,再用PBS洗2遍后上机检测。用525 nm的荧光检测各组细胞信号。实验重复3次,结果用平均值±标准差表示。
1.5 线粒体膜电位分析
线粒体膜电位是细胞内负外正的电位差,是反映线粒体功能状态的直观指标,正常生理情况下保持稳态,当纳米颗粒进入细胞损伤线粒体时,会导致线粒体膜电位降低[17]。使用亲脂性阳离子探针(JC-1)可在各种刺激条件下进行线粒体膜电位的测定。在正常细胞中,当线粒体膜电位较高时,JC-1可以聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates)并产生红色荧光;当线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1成为单体(monomer),可以产生绿色荧光。在早期的细胞凋亡中,线粒体膜电位降低导致JC-1聚合物不能聚集在线粒体中,从而失去红色荧光。因此,红绿荧光的比率可表明线粒体膜电位的变化。实验时,将661W细胞接种于6孔板中(密度为2×105细胞/孔),培养过夜,加入不同浓度(即0,31.25,62.5,125.0 μmol·L-1)的ZnO纳米粒子溶液2 mL,37 ℃培养24 h后用PBS洗2遍,然后加入JC-1染色工作液,37 ℃条件下继续孵育20 min。孵育完成后,加入PBS缓冲液漂洗细胞2~3次,然后在倒置荧光显微镜下观察细胞线粒体膜电位的情况。
1.6 MnSOD mRNA的表达
将661W细胞接种于6孔板(密度为5×105细胞/孔)中培养过夜,加入不同浓度(即0,31.25,62.5,125.0 μmol·L-1)的ZnO纳米粒子溶液,继续培养2 h后,收集细胞。细胞经PBS漂洗后,加入Trizol溶液,提取细胞的总RNA,微量紫外分光光度计检测总RNA的浓度和纯度,使用RevertAid逆转录酶试剂盒合成cDNA。将cDNA样品与SYBR Green I等溶液配成20 μL的PCR反应体系,使用实时荧光定量PCR仪进行PCR扩增反应。引物序列如下:MnSOD,上游引物5′-gtggtggagaacccaaagga-3′,下游引物5′- gcgtgctcccacacatcaat-3′;GAPDH,上游引物5′-gaccacagtccatgacatcact-3,下游引物5′-tccaccaccctgttgctgtag-3′。PCR程序设置如下:95 ℃ 10 min,95 ℃变性20 s,56 ℃退火30 s,72 ℃延伸为30 s,共进行45个循环。每个样品设3个复孔,实验重复3次。以GAPDH作为内参计算661W细胞MnSOD基因表达倍数的变化。
1.7 测定细胞内MnSOD蛋白质水平和活性
用不同浓度(即0,31.25,62.5,125.0 μmol·L-1)ZnO纳米粒子与661W细胞共培养6 h,然后PBS洗涤细胞,用0.25%胰酶消化细胞,4 ℃、4 000 g条件下离心收集细胞,重悬于冷的PBS溶液中,冰浴超声15 min,5 000 g离心,取上清液100 μL,ELISA检测细胞中MnSOD蛋白水平;取上清液50 μL,用MnSOD活性检测试剂盒测定MnSOD的活性,每个实验重复3次。
1.8 统计分析
数据来自至少3次独立的实验,结果表示为平均值±SD(标准差),One-way ANOVA和Dunnett用于显著性检验,P<0.05被认为是有统计学意义。
2 结果(Results)
2.1 ZnO纳米粒子的表征
通过场发射扫描电子显微镜获得ZnO纳米粒子的形貌图(如图1A);通过马尔文激光粒度仪测量粒子大小。结果发现,ZnO纳米粒子分布范围在15到50 nm,平均粒径为30 nm(如图1B)。
2.2 细胞生存率测定
首先,分析ZnO纳米粒子对661W细胞活性的影响。倒置相差显微镜观察发现,与正常对照组细胞相比,ZnO纳米粒子干预组细胞的数量均下降,且细胞形态发生皱缩。ZnO纳米粒子在靶细胞中的浓度越高,对细胞生存率抑制作用越强(图2A~D);MTT分析的结果显示,随着ZnO纳米粒子浓度和作用时间的增加,细胞生存率明显降低(图2E)。

图1 ZnO纳米粒子表征图(A)和粒子大小分布(B)Fig. 1 Image of ZnO nanoparticles characterized by a field emission scanning electron microscope (A) and the histogram of size distribution determined by a Malvern Zetasizer (B)
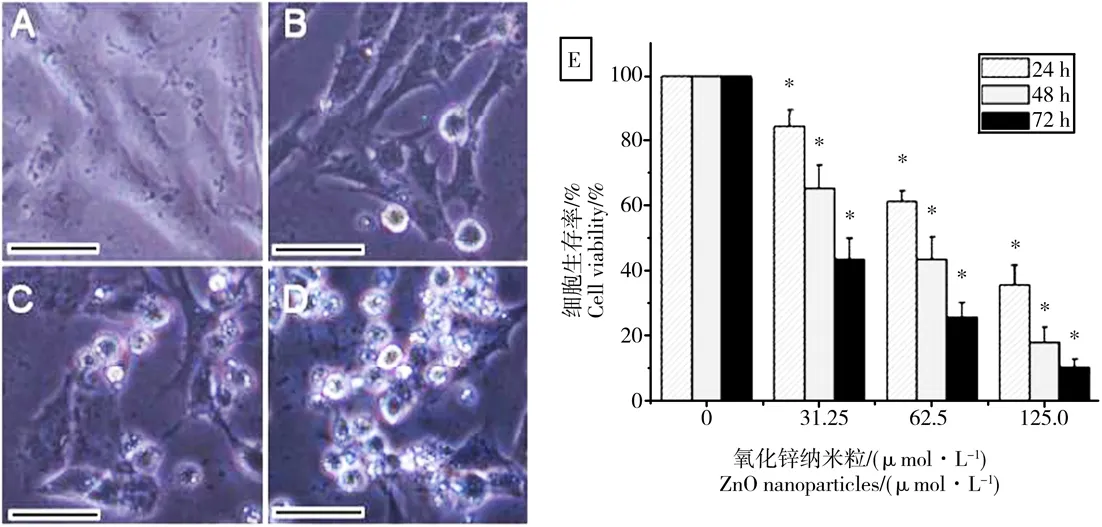
图2 不同浓度的ZnO纳米粒子对小鼠光感受器细胞生存率的抑制作用注:A为正常对照组;B为31.25 μmol·L-1 ZnO干预组;C为62.5 μmol·L-1 ZnO干预组;D为125.0 μmol·L-1 ZnO干预组; E为小鼠光感受器细胞经不同浓度的ZnO纳米粒子干预不同时间后的细胞生存率。 A~D的干预时间为72 h,且标尺为20 μm;*P<0.05,与正常对照组相比具有统计学意义。Fig. 2 Different concentrations of zinc oxide nanoparticles inhibit the viability of photoreceptor cellsNote: A, untreated cells; B, cells treated with 31.25 μmol·L-1 of ZnO NPs; C, cells treated with 62.5 μmol·L-1 of ZnO NPs; D, cells treated with 125.0 μmol·L-1 of ZnO NPs; E, histogram of cell viability determined by MTT assay. For A-D, treatment time is 72 h, and bar = 20 μm. For E, * P < 0.05 versus relevant control samples.
2.3 细胞内活性氧的变化
在不同浓度的ZnO纳米粒子干预661W细胞2 h后,细胞内活性氧的表达水平明显增高,并呈剂量依赖性(图3A~D)。ZnO纳米粒子处理后细胞内活性氧的表达水平与对照组相比,有统计学差异(图3E)。
2.4 线粒体膜电位的改变
为探索不同浓度ZnO纳米粒子对661W细胞的影响,我们进一步分析了ZnO纳米粒子在干预靶细胞24 h后线粒体膜电位的改变,发现对照组细胞具有更高的红色荧光(在细胞周围红色荧光密度高,图4A);在经ZnO纳米粒子干预后靶细胞线粒体膜电位降低(绿色荧光,图4B~D),绿色荧光强度与ZnO纳米粒子干预靶细胞浓度成比例,表明线粒体膜电位的降低与ZnO纳米粒子显著相关。
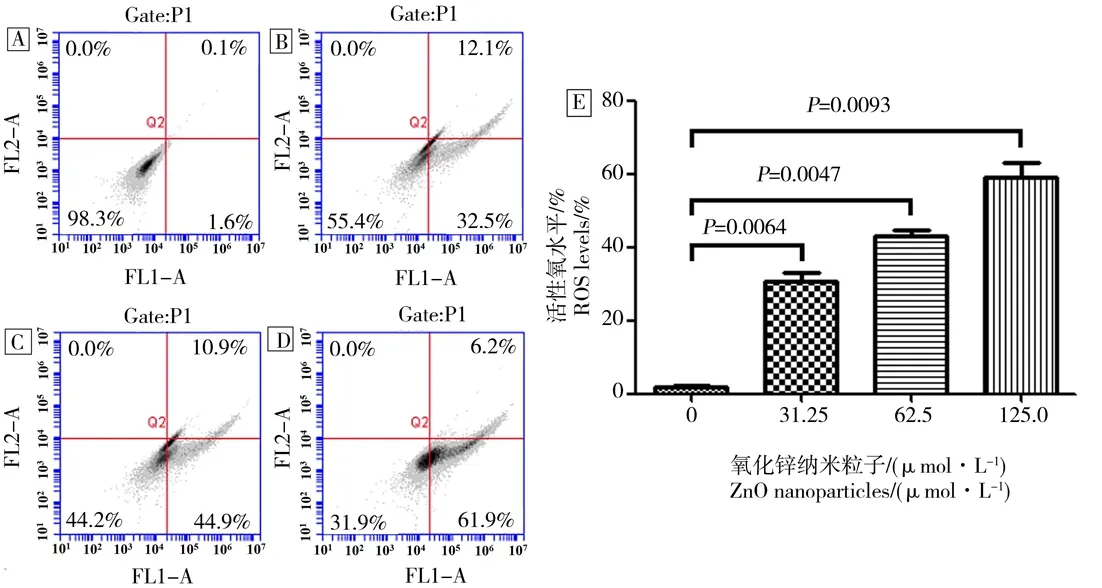
图3 小鼠光感受器细胞经不同浓度ZnO纳米粒子干预后细胞内活性氧的表达增加注:A为正常对照组;B为31.25 μmol·L-1 ZnO干预组;C为62.5 μmol·L-1 ZnO干预组;D为125.0 μmol·L-1 ZnO干预组; E为小鼠光感受器细胞经不同浓度的ZnO纳米粒子干预2 h后的统计分析结果。Fig. 3 The expression of reactive oxygen species in murine photoreceptor cells was increased after the intervention of ZnO nanoparticles at different concentrationsNote: A, untreated cells; B, cells treated with 31.25 μmol·L-1 of ZnO NPs; C, cells treated with 62.5 μmol·L-1 of ZnO NPs; D, cells treated with 125.0 μmol·L-1 of ZnO NPs. E, The murine photoreceptor cells after treatment with different concentrations of ZnO NPs for 2 h.

图4 不同浓度的ZnO纳米粒子可降低细胞线粒体的膜电位注:A为正常对照组;B为31.25 μmol·L-1 ZnO干预组;C为62.5 μmol·L-1 ZnO干预组;D为125.0 μmol·L-1 ZnO干预组。 E为线粒体膜电位在不同浓度的ZnO纳米粒子中的表达水平。图中标尺为20 μm (A~D)。Fig. 4 The mitochondrial membrane potential of murine photoreceptor cells before and after treatment with different concentrations of ZnO NPsNote: A, untreated cells; B, cells treated with 31.25 μmol·L-1 of ZnO NPs; C, cells treated with 62.5 μmol·L-1 of ZnONPs; D, cells treated with 125.0 μmol·L-1 of ZnO NPs. E, mitochondrial membrane potential level after treatment with different concentrations of ZnO NPs. Bar = 20 μm (A-D).
2.5 MnSOD的mRNA表达和蛋白质减少
Q-PCR检测不同浓度的ZnO纳米粒子对细胞内MnSOD mRNA表达水平的影响。如在图5A中所示,细胞内MnSOD mRNA表达的减少与ZnO纳米粒子的浓度相关。31.25、62.5和125.0 μmol·L-1的ZnO纳米粒子干预细胞后,细胞内MnSOD的mRNA表达水平分别下降至0.384、0.225和0.076倍,对照组和ZnO纳米粒子处理组细胞之间存在着显著性差异(如图5A)。
ELISA检测不同浓度的ZnO纳米粒子干预661W细胞后MnSOD蛋白质表达的变化。图5B显示在0、31.25、62.5和125.0 μmol·L-1的ZnO纳米粒子干预处理后,661W细胞内MnSOD蛋白水平从56.23 ng·mL-1分别下降到39.08、19.11和12.79 ng·mL-1,说明MnSOD蛋白的表达水平随着ZnO纳米粒子的浓度的增加而降低(如图5B)。
2.6 细胞内MnSOD活性的降低
与对照组细胞相比,经不同浓度ZnO纳米粒子处理的细胞中MnSOD活性降低。图6表明,经0、31.25、62.5和125.0 μmol·L-1的的ZnO纳米粒子处理后,MnSOD活性从79.30 U·mL-1分别减少到41.18、26.48和15.02 U·mL-1,表明ZnO纳米颗粒能显著降低MnSOD活性。
3 讨论(Discussion)
前期研究发现,氧化铈纳米粒子能降低过氧化氢引起的氧化应激,使光感受器细胞的生存率升高[18]。另有研究表明,硫化锌纳米粒子能显示出剂量依赖性细胞毒性,导致小鼠视网膜色素上皮细胞损伤[19];ZnO纳米粒子诱导的活性氧可对靶细胞产生细胞毒性,从而造成细胞损伤[20],因此ZnO纳米粒子可能通过参与氧化应激,对靶细胞产生细胞毒性作用[20-22]。因此,我们研究了ZnO纳米粒子对小鼠光感受器细胞(661W)的活性和MnSOD的表达及活性的影响。
研究已证明,金属氧化物纳米粒子通过增加活性氧的生成导致细胞毒性。线粒体功能障碍是由于线粒体膜电位的降低导致线粒体去极化和多个促凋亡蛋白释放到胞质中,进而激活凋亡通路[23]。线粒体是细胞内活性氧的主要来源,线粒体膜电位和活性氧可以为检测细胞的生理状态和线粒体的功能提供重要的线索[24]。我们研究发现,ZnO纳米粒子处理组可导致细胞线粒体膜电位的降低,ZnO纳米粒子的浓度越高,靶细胞的线粒体膜电位越低。这一结果表明,活性氧引起的氧化应激是ZnO纳米粒子促进661W细胞死亡的重要机制。
正常细胞内的MnSOD能够维持正常的线粒体功能和清除过多的活性氧,进而抑制细胞凋亡。我们的研究结果表明,ZnO纳米粒子处理后的靶细胞中产生了大量的活性氧,且MnSOD表达水平和活性均降低。同时,MnSOD的表达和活性降低不能及时清除过多的活性氧,进而导致细胞内活性氧水平的积累。活性氧水平的增高可通过破坏DNA、脂类和蛋白质,影响细胞代谢,导致细胞损伤,最后诱导细胞凋亡或坏死。
综上所述,ZnO纳米粒子可诱导细胞死亡,并呈剂量依赖性。ZnO纳米粒子干预的靶细胞会产生大量的活性氧,高水平的活性氧导致线粒体膜电位下降,抑制MnSOD mRNA、蛋白的表达和活性,MnSOD表达水平和活性的降低导致无法清除过量的活性氧,进而引起活性氧积累与细胞凋亡信号通路激活,最终导致细胞损伤。
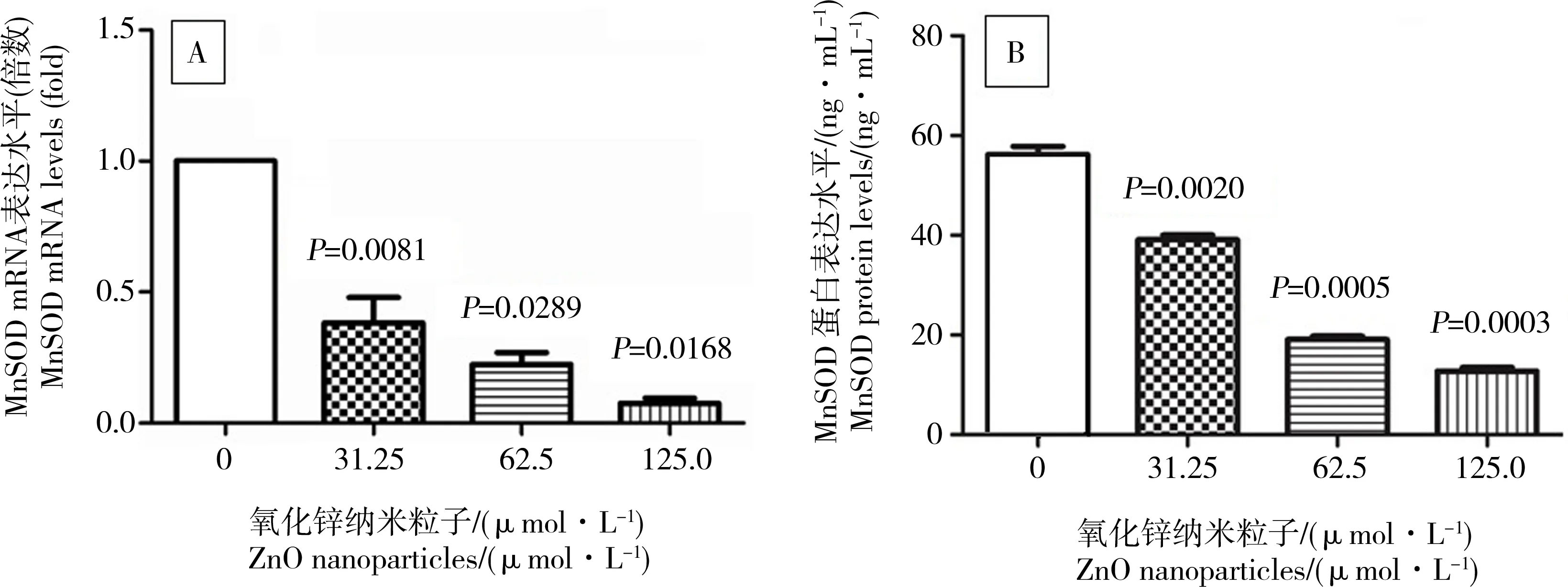
图5 不同浓度的ZnO纳米粒子对MnSOD mRNA表达和蛋白质表达的抑制作用Fig. 5 The expression of MnSOD at mRNA and protein levels during the ZnO nanoparticle treatment
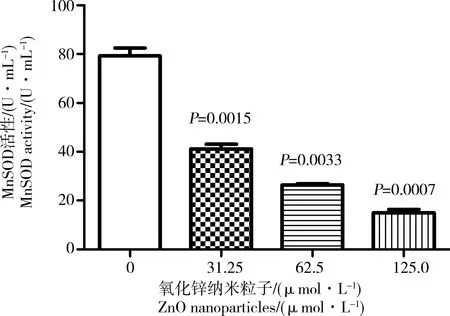
图6 不同浓度的ZnO纳米粒子对MnSOD活性的抑制作用Fig. 6 Determination of MnSOD activity after treatment with different concentrations of ZnO nanoparticles
致谢:感谢江苏省介入医疗器械研究重点实验室开放基金课题(jr1602)资助。
[1] Alkaladi A, Abdelazim A M, Afifi M. Antidiabetic activity of zinc oxide and silver nanoparticles on streptozotocin-induced diabetic rats [J]. International Journal of Molecular Sciences, 2014, 15(2): 2015-2023
[2] Nazarizadeh A, Asri-Rezaie S. Comparative study of antidiabetic activity and oxidative stress induced by zinc oxide nanoparticles and zinc sulfate in diabetic rats [J]. AAPS PharmSciTech, 2015, 17(4): 834-843
[3] Guo D, Wu C, Jiang H, et al. Synergistic cytotoxic effect of different sized ZnO nanoparticles and daunorubicin against leukemia cancer cells under UV irradiation [J]. Journal of Photochemistry and Photobiology B: Biology, 2008, 93(3): 119-126
[4] Guo D, Wu C, Li X, et al. In vitro cellular uptake and cytotoxic effect of functionalized nickel nanoparticles on leukemia cancer cells [J]. Journal of Nanoscience and Nanotechnology, 2008, 8(5): 2301-2307
[5] Akhtar M J, Ahamed M, Kumar S, et al. Zinc oxide nanoparticles selectively induce apoptosis in human cancer cells through reactive oxygen species [J]. International Journal of Nanomedicine, 2012, 7: 845-857
[6] Heim J, Felder E, Tahir M N, et al. Genotoxic effects of zinc oxide nanoparticles [J]. Nanoscale, 2015, 7(19): 8931-8938
[7] Guo D, Bi H, Wu Q, et al. Zinc oxide nanoparticles induce rat retinal ganglion cell damage through bcl-2, caspase-9 and caspase-12 pathways [J]. Journal of Nanoscience and Nanotechnology, 2013, 13(6): 3769-3777
[8] Senapati V A, Kumar A, Gupta G S, et al. ZnO nanoparticles induced inflammatory response and genotoxicity in human blood cells: A mechanistic approach [J]. Food and Chemical Toxicology, 2015, 85: 61-70
[9] Uzar N K, Abudayyak M, Akcay N, et al. Zinc oxide nanoparticles induced cyto- and genotoxicity in kidney epithelial cells [J]. Toxicology Mechanisms and Methods, 2015, 25(4): 334-339
[10] 张艳芳, 金婵, 马春旺, 等. 几种纳米材料细胞毒性效应的研究现状[J]. 第二军医大学学报, 2010, 11(31): 1234-1238
Zhang Y F, Jin C, Ma C W, et al. Study on cytotoxic effects of several types of nano-materials: The current status [J]. Academic Journal of Second Military Medical University, 2010, 11(31): 1234-1238 (in Chinese)
[11] Demarquoy J, Le Borgne F. Crosstalk between mitochondria and peroxisomes [J]. World Journal of Biological Chemistry, 2015, 6(4): 301-309
[12] Bresciani G, da Cruz I B, González-Gallego J. Manganese superoxide dismutase and oxidative stress modulation [J]. Advances in Clinical Chemistry, 2015, 68: 87-130
[13] Hart P C, Mao M, de Abreu A L, et al. MnSOD upregulation sustains the Warburg effect via mitochondrial ROS and AMPK-dependent signalling in cancer [J]. Nature Communications, 2015, 6: 6053
[14] Guo D, Bi H, Liu B, et al. Reactive oxygen species-induced cytotoxic effects of zinc oxide nanoparticles in rat retinal ganglion cells [J]. Toxicology in Vitro, 2013, 27(2): 731-773
[15] Guo D, Zhang J, Huang Z, et al. Colloidal silver nanoparticles improve anti-leukemic drug efficacy via amplification of oxidative stress [J]. Colloids and Surfaces B: Biointerfaces, 2015, 126: 198-203
[16] Holley A K, Bakthavatchalu V, Velez-Roman J M, et al. Manganese superoxide dismutase: Guardian of the powerhouse [J]. International Journal of Molecular Sciences, 2011, 12(10): 7114-7162
[17] 周子靖, 张金波, 朱金玲, 等. 纳米材料的细胞毒性研究进展[J]. 中国优生与遗传杂志, 2016, 4(24): 5-11
Zhou Z J, Zhang J B, Zhu J L, et al. Research progress on cytotoxicity of nano-materials [J]. Chinese Journal of Birth Health & Heredity, 2016, 4(24): 5-11 (in Chinese)
[18] Bhargava N, Shanmugaiah V, Saxena M, et al. Nanocerium oxide increases the survival of adult rod and cone photoreceptor in culture by abrogating hydrogen peroxide-induced oxidative stress [J]. Biointerphases, 2016, 11(3): 031016
[19] Bose K, Lakshminarasimhan H, Sundar K, et al. Cytotoxic effect of ZnS nanoparticles on primary mouse retinal pigment epithelial cells [J]. Artificial Cells, Nanomedicine, and Biotechnology, 2016, 44(7): 1764-1773
[20] Guo D, Bi H, Liu B, et al. Reactive oxygen species-induced cytotoxic effects of zinc oxide nanoparticles in rat retinal ganglion cells [J]. Toxicol in Vitro, 2013, 27(2): 731-738
[21] Guan R, Kang T, Lu F, et al. Cytotoxicity, oxidative stress, and genotoxicity in human hepatocyte and embryonic kidney cells exposed to ZnO nanoparticles [J]. Nanoscale Research Letters, 2012, 7(1): 602
[22] Guo D, Bi H, Wang D, et al. Zinc oxide nanoparticles decrease the expression and activity of plasma membrane calcium ATPase, disrupt the intracellular calcium homeostasis in rat retinal ganglion cells [J]. The International Journal of Biochemistry & Cell Biology, 2013, 45(8): 1849-1859
[23] Ly J D, Grubb D R, Lawen A. The mitochondrial membrane potential (Δψm) in apoptosis; an update [J]. Apoptosis, 2003, 8(2): 115-128
[24] Joshi D C, Bakowska J C. Determination of mitochondrial membrane potential and reactive oxygen species in live rat cortical neurons [J]. Journal of Visualized Experiments, 2011, 23(51): e2704
◆
10.7524/AJE.1673-5897.20161129001
2016-11-29录用日期2017-01-05
1673-5897(2017)3-747-08
X171.5
A
毕宏生(1960-),男,博士,泰山学者岗位教授、主任医师,主要从事眼科临床、教学与科研,发表SCI论文80余篇。
江苏省介入医疗器械研究重点实验室开放基金课题资助项目(项目编号jr1602);山东省高校中医药抗病毒协同创新中心资助项目(项目编号:XTCX2014A04-04)
孙园园(1992-),女,2015级在读硕士研究生,研究方向为白内障及屈光不正,E-mail: yankesyybs@163.com;
*通讯作者(Corresponding author), E-mail: hongshengbi1@163.com
孙园园, 郭大东, 刘滨, 等. ZnO纳米粒子抑制体外小鼠光感受器细胞MnSOD的表达及活性[J]. 生态毒理学报,2017, 12(3): 747-754
Sun Y Y, Guo D D, Liu B, et al. Zinc oxide nanoparticles inhibit the expression and activity of MnSOD in murine photoreceptor cells in vitro [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 747-754 (in Chinese)
