视网膜脱离后光感受器细胞死亡规律的实验研究
2014-11-13董凯柯根杰武立云朱子诚许迅孙晓东
董凯 柯根杰 武立云 朱子诚 许迅 孙晓东
视网膜脱离(retinal detachment,RD)是一种常见的眼科疾病,病理过程复杂,致盲率高,光感受器细胞的不可逆损伤是导致RD患者视力损伤的主要原因[1-2]。本课题组根据前期研究[3],提出如下假说:RD后光感受器细胞不仅有凋亡,同时存在有程序性坏死,如坏死性凋亡。但是,目前在RD中尚不清楚光感受器细胞坏死的时间分布规律,所以本研究拟通过建立RD模型,研究光感受器细胞凋亡和坏死的时间分布规律,为进一步研究程序性坏死提供较为理想的干预和检测的时间靶点。
1 材料与方法
1.1 实验动物 实验动物选用雄性健康的 Sprague-Dawley大鼠24只,体质量260~280 g,由上海交通大学附属第一人民医院提供,所有实验操作均严格遵守美国视觉眼科研究学会对动物实验的要求和上海交通大学及安徽医科大学对动物实验的规定。
1.2 实验方法
1.2.1 视网膜脱离动物模型的建立 实验大鼠由腹腔内注射 100 g·L-1水合氯醛麻醉,5 g·L-1托吡卡胺和5 g·L-1肾上腺素眼液散瞳;术前可乐必妥眼液冲洗结膜囊(中国苏州参天制药有限公司),置角膜接触镜,30-G针穿刺视网膜下,沿视网膜下注入10 g·L-1透明质酸钠50 μL(中国山东博士伦公司),可见局部RD约占1/2范围,脱离范围于结膜面用10-0缝线做标记,以备取材时定位用[4-6]。每只实验大鼠右眼建立 RD模型,左眼作为对照组。
1.2.2 电镜检测 按照文献报道的方法进行电镜检测[4,7]。(1)取材:腹腔内注射 100 g·L-1水合氯醛麻醉,摘除眼球,沿缝线标记范围取出视网膜组织。(2)固定:体积分数25%戊二醛固定12 h,制成1 mm×3 mm条块,重新固定液固定。(3)包埋:无水酒精和环氧树脂浸透、包埋,37℃过夜,45℃12 h、60℃24 h。(4)切片:切片,铜网捞片、枸橼酸铅和醋酸铀进行双重染色,JEM-1200EX透射电子显微镜(日本电子公司,日本东京)观察并拍照。
每张电镜切片随机选择200个光感受器细胞,通过形态学的改变观察RD后第1天、第3天、第5天、第7天光感受器细胞的死亡方式。形态学上,光感受器细胞皱缩、染色质边聚为凋亡细胞;细胞肿胀,质膜不完整、破裂,为坏死细胞[8-9]。进一步计算出各组间死亡细胞(凋亡和坏死细胞)的百分比。
2 结果
2.1 视网膜脱离模型的建立 通过视网膜下注射10 g·L-1透明质酸钠,我们成功建立了 RD的模型(图1),视网膜下注射约50 μL透明质酸钠可以形成稳定的约1/2范围的RD,持续时间约28 d。对照眼无视网膜脱离。
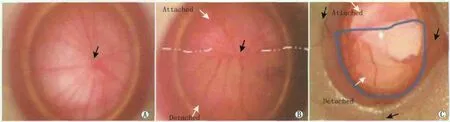
Figure 1 Ocular fundus and outer images.A:Ocular fundus image before retinal detachment,the black arrowhead indicated the optic nerve;B:Ocular fundus image after retinal detachment,the white arrowhead indicated attached and detached retina,the detachment extended approximately half of the retina;C:Outer ocular image,the scope and location of retinal detachment was marked by 10-0 sutures(black arrowhead)in order to facilitate the positioning of the follow-up test 造模前后眼底图与造模后外眼图。A:造模前的眼底图片,黑箭头为视神经;B:造模后眼底图,可见视网膜脱离区域和非脱离区域(白箭头),RD范围约1/2范围的视网膜;C:造模后外眼图,RD范围用10-0丝线标记(黑箭头),方便以后取材定位
2.2 RD后光感受器细胞的凋亡和坏死的分布规律电镜结果显示,在RD后的第3天,光感受器细胞的凋亡和坏死细胞数达到最高峰。造模后第1天凋亡率为 8.05%±0.98%,坏死率为 5.22%±1.58%;第3天凋亡率为20.98%±1.33%,坏死率为17.04%±0.81%;第 5天凋亡率为 7.82%±1.08%,坏死率为7.14%±0.89%;第7天凋亡率为5.40%±1.00%,坏死率为 4.07%±0.26%(P <0.01);同时,光感受器细胞的死亡数(凋亡和坏死细胞数总和)也于第 3天达到最高峰(37.99%±1.50%)(P <0.01)。
3 讨论
光感受器细胞的不可逆损伤是导致视功能损失的主要原因[1]。RD后光感受器细胞的死亡方式中,不仅有凋亡,同时可能存在有程序性坏死,如坏死性凋亡[3]。本研究通过视网膜下注入透明质酸钠成功建立RD模型,阐明了在RD中,光感受器细胞的存在有凋亡和坏死的死亡方式,在RD后第3天,凋亡和坏死细胞数达到最高峰,为进一步研究程序性坏死提供了干预和检测的时间靶点。
细胞的死亡有许多种,根据细胞核的改变主要分为凋亡及凋亡样程序性细胞死亡,坏死及坏死样程序性细胞死亡[10]。目前国内外的研究多集中在凋亡的调控方面,随着坏死性凋亡的出现,越来越多的证据表明,部分细胞坏死也是可以调控的。坏死性凋亡是新近发现的一种新的可调控的程序性细胞坏死,也受死亡受体通路的激活比如TNFα、FasL和TRAIL[11-12];坏死性凋亡的形态学表现与细胞坏死相类似,也表现为细胞肿胀,质膜不完整、破裂[13-14]。但是,目前尚不清楚RD后,光感受器细胞的坏死随时间变化的规律。
在以前的研究结果中,有学者已经发现,在实验性RD后的第3天,TUNEL阳性光感受器细胞数达到最高峰[4,15]。但是,TUNEL 检测有其局限性,部分坏死细胞也可以表现为TUNEL阳性,所以目前多倾向于电镜检测作为凋亡和坏死的鉴别方法[8]。本研究中,电镜检测结果显示:RD造模后的第3天,光感受器细胞的凋亡数达到最高峰,这与以前的研究结果是一致的。另一方面,同时也观察了光感受器细胞坏死的时间分布规律,结果显示,光感受器细胞的坏死和凋亡一致,都是在RD后的第3天达到最高峰。这些结果提示,在RD的模型中,光感受器细胞的总死亡数将在RD后第3天达到最高峰。
综上所述,在RD中,光感受器细胞的死亡是导致视功能不可逆损伤的重要原因。除凋亡外,光感受器细胞中可能存在有程序性坏死,如坏死性凋亡,所以对这部分坏死样细胞死亡进行干预和调控能为恢复视功能提供新的诊疗思路。本研究证明了RD后的第3天为光感受器细胞凋亡和坏死的最高峰,所以在今后的研究中可以将此时间节点作为干预或检测结果的时间节点。
1 Lo AC,Woo TT,Wong RL,Wong D.Apoptosis and other cell death mechanisms after retinal detachment:implications for photoreceptor rescue[J].Ophthalmologica,2011,226(Suppl 1):10-17.
2 Stone J,Maslim J,Valter-Kocsi K,Mervin K,Bowers F,Chu Y,et al.Mechanisms of photoreceptor death and survival in mammalian retina[J].Prog Retin Eye Res,1999,18(6):689-735.
3 Dong K,Sun,X.Targeting death receptor induced apoptosis and necroptosis:a novel therapeutic strategy to prevent neuronal damage in retinal detachment[J].Med Hypotheses,2011,77(1):144-146.
4 Hisatomi T,Sakamoto T,Murata T,Yamanaka I,Oshima Y,Hata Y,et al.Relocalization of apoptosis-inducing factor in photoreceptor apoptosis induced by retinal detachment in vivo[J].Am J Pathol,2001,158(4):1271-1278.
5 Arimura N,Ki-I Y,Hashiguchi T,Kawahara K,Biswas KK,Nakamura M ,et al.Intraocular expression and release of high-mobility group box 1 protein in retinal detachment[J].Lab Invest,2009,89(3):278-289.
6 Mantopoulos D,Murakami Y,Comander J,Thanos A,Roh M,Miller JW,et al.Tauroursodeoxycholic acid(TUDCA)protects photoreceptors from cell death after experimental retinal detachment[J].PLoS One,2011,6(9):e24245.
7 孙晓东,张皙,俞彰.实验性视网膜脱离复位后的视网膜细胞超微结构观察[J].眼科研究,2001,19(4):326-329.
8 Kroemer G,Galluzzi L,Vandenabeele P,Abrams J,Alnemri ES,Baehrecke EH,et al.Classification of cell death:recommendations of the Nomenclature Committee on Cell Death 2009[J].Cell Death Differ,2009,16(1):3-11.
9 Trichonas G,Murakami Y,Thanos A,Morizane Y,Kayama M,Debouck CM ,et al.Receptor interacting protein kinases mediate retinal detachment-induced photoreceptor necrosis and compensate for inhibition of apoptosis[J].Proc Natl Acad Sci U S A ,2010,107(50):21695-21700.
10 Hotchkiss RS,Strasser A,Mcdunn JE,Swanson PE.Cell death[J].N Engl J Med,2009,361(16):1570-1583.
11 Du Q ,Xie J,Kim HJ,Ma X.Type I interferon:the mediator of bacterial infection-induced necroptosis[J].Cell Mol Immunol,2013,10(1):4-6.
12 Christofferson DE,Yuan J.Necroptosis as an alternative form of programmed cell death[J].Curr Opin Cell Biol,2010,22(2):263-268.
13 Han W,Xie J,Li L,Liu Z,Hu X.Necrostatin-1 reverts shikonin-induced necroptosis to apoptosis[J].Apoptosis,2009,14(5):674-686.
14 Degterev A,Huang Z,Boyce M,Li Y,Jagtap P,Mizushima N,et al.Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J].Nat Chem Biol,2005,1(2):112-119.
15 Hisatomi T,Sakamoto T,Goto Y.Critical role of photoreceptor apoptosis in functional damage after retinal detachment.[J].Curr Eye Res,2002,24(3):161-172.
