植物-微生物修复石油烃污染土壤与根际微生态环境变化
2017-10-13孔德康王红旗刘自力许洁熊樱
孔德康,王红旗,*,刘自力,许洁,熊樱
1. 北京师范大学水科学研究院,北京 1008752. 北京京诚嘉宇环境科技有限公司,北京 100176
植物-微生物修复石油烃污染土壤与根际微生态环境变化
孔德康1,王红旗1,*,刘自力1,许洁1,熊樱2
1. 北京师范大学水科学研究院,北京 1008752. 北京京诚嘉宇环境科技有限公司,北京 100176
石油烃作为一类持久性难降解有机污染物对土壤环境质量产生严重的危害。以天津大港油田原油污染土壤中筛选出的耐低温高效石油烃降解菌为靶细胞,以小麦、紫花苜蓿作为供试植物,利用盆栽试验,对植物-外源菌协同修复体系中的脱氢酶活性和土壤微生物多样性进行研究,分析其变化及其与石油烃降解率的关系。结果表明植物-微生物协同修复对石油烃具有较好的降解能力,其中小麦-固定化外源菌组具有最高的降解率,石油烃含量从最初的30 600 mgkg-1下降为24 300 mgkg-1,降解率为20.6%,并且其试验后期石油烃的降解率最大,远远高于其他时期,表现出良好的修复潜力。外源菌投加的初始阶段会迅速提高脱氢酶活性,然而这种影响随着降解时间延长而逐渐减弱。初期脱氢酶活性与总石油烃的降解存在较好的相关性,脱氢酶活性可以在一定程度上表征土壤石油烃的降解情况。微生物多样性与总石油烃降解也存在一定的相关性。
石油烃;植物-外源菌协同修复;脱氢酶活性;微生物多样性
Received11 January 2017accepted28 May 2017
Abstract: Petroleum hydrocarbons are persistent refractory organic pollutants and have negative effect on soil environmental quality. The plant-bacteria combined method has been extensively investigated to remediate petroleum hydrocarbon contaminated soils in recent years for its high efficiency and safety. The bacteria that has low temperature-resistance and high efficiency for petroleum hydrocarbon degradation, were screened from crude oil contaminated soil in Dagang oil field of Tianjin, and selected as target cells. Wheat and alfalfa were used as target plants, and pot experiments were applied to study the dehydrogenase activity and soil microbial biodiversity. The results showed that petroleum hydrocarbons were reduced the most in wheat-bacteria remediation group with degradation rate of 20.6%. The degradation rate at final stage was much higher than that of other periods. The dehydrogenase activity was rapidly increased in the initial stage when exogenous bacteria was added, while this activity was gradually reduced with time. Dehydrogenase activity was related to the degradation of total petroleum hydrocarbons and it can be used to characterize the degradation of petroleum hydrocarbons in soils. There is a good correlation between the microbial biodiversity and the degradation of total petroleum hydrocarbons.
Keywords: petroleum hydrocarbons; plant-microbe combined remediation; dehydrogenase activity; microbial biodiversity
目前,植物-微生物的协同修复已是石油烃污染土壤生物修复领域中的研究热点。利用微生物和植物自身的特性,以及它们之间的协同作用对污染土壤进行修复,能够有效减少生物修复石油烃污染土壤的时间,极大提高修复效率[1]。植物-微生物协同修复石油烃污染土壤,主要是依靠植物的根系和根系分泌物共同促进土壤微生物的生长和繁殖[2]。Xu等[3]研究发现了Kocuria sp. P10和黑麦草的协同修复极大提高了多环芳烃(PAHs)的去除率,在75 d内对PAHs的去除率达到了69.6%。Tejeda-Agredano等[4]研究发现太阳花的种植使得微生物降解PAHs的效率提高了16%。
根际微生态环境包括了根际土壤的pH、温度、酶、微生物群落等,它们对土壤中石油烃的降解存在着重要意义[5-8]。土壤酶是参与土壤新陈代谢的重要物质,土壤中参与多环芳烃降解的酶主要是加氧酶、脱氢酶、磷酸酶和木质素酶等[9]。有研究表明,多酚氧化酶活性在种植植物的土壤中要显著高于不种植物的土壤,并且它们的活性变化趋势与石油烃降解菌的数量有关[10]。Wang等[11]发现植物根系分泌的低分子有机酸(LMWOAs)增强了土壤中脱氢酶的活性,并且LMWOAs和脱氢酶能够促进土壤对PAHs的去除。脱氢酶在环状有机化合物的分解转化过程中起着重要的作用,在多数情况下植物根系及微生物对石油污染物的降解都是从脱氢开始。因此,可以利用脱氢酶的活性反映植物-微生物系统降解石油烃的活性。土壤微生物群落特征可以直接展示环境体系生态功能特性,可用于评估生物修复土壤的效果。张宇宁等[12]采用Biolog分析理化因子如总氮、总磷、速效磷、pH、总有机碳等与土壤微生物群落碳代谢特性的关系。除此之外,Biolog还可以应用于石油烃降解菌的鉴定工作[13-14]。
本文以天津大港油田原油污染土壤中筛选出的耐低温高效石油烃降解菌为靶细胞,选取小麦、紫花苜蓿作为供试植物,构建植物-外源菌协同修复体系,对协同修复体系中的脱氢酶和微生物多样性进行研究,分析其变化及其与石油烃降解的相关关系。
1 材料与方法(Materials and methods)
1.1 试验材料
本次试验供试土壤为北京市昌平区沙河某玉米地中的清洁农田土壤。采集耕作层(20 cm)土壤样品,去除植物残体及大颗粒砾石后混合,风干过2 mm筛备用。通过人为投加污染物的形式,选取质量分数为3%的石油烃浓度作为试验浓度,将原油与清洁农田土壤按比例均匀混合后静置于4 ℃条件下30 d。原油样品采自天津大港油田某采油井。本次试验的供试植物为小麦、紫花苜蓿,高效降解菌DG17从天津大港油田原油污染土壤中筛选而出。试验开始前,测定土壤的理化性质、含水率等指标(表1)。控制初始的土壤含水率在30%左右。
表1 土壤理化性质(mgkg-1)Table 1 Some physical and chemical properties of tested soils (mgkg-1)

表1 土壤理化性质(mgkg-1)Table 1 Some physical and chemical properties of tested soils (mgkg-1)
指标IndexesCHNPK褐土Cinnamon462909070640583.4318606
1.2 试验设计
分别设置不同的试验条件,如表2所示,在试验室可控条件下进行盆栽试验,采用6个设计4个平行。选用白色陶土盆,直径为25 cm,高25 cm。每个盆中装入石油污染土壤2 500 g(石油烃的质量分数为3%)。小麦种子和苜蓿种子经过消毒处理后,播种在土壤中。模拟北方区的自然气候条件,试验条件设置为20 ℃、12 h光照,10 ℃、12 h黑暗,试验设计进行10周。为避免高浓度石油污染土壤对于小麦、紫花苜蓿的发芽抑制作用,本试验择在接种外源微生物后将浸泡至已微露白芽的小麦与苜蓿种子播种至土壤中,1周后种子陆续发芽。
分别于播种后第7天、第21天、第42天、第56天、第70天采集土壤样品。取样采用灭菌的抹刀,

表2 试验条件设计Table 2 Experimental condition design
小心去除表层土壤,然后取下圆柱型的土体。轻轻抖落植物根系附着的表土,小心收集根周围土壤,取20 g土壤样品放在冷冻干燥机中,冷冻干燥48 h,以进行后续的石油烃含量测定和酶活性测定的试验。试验初期(第0天)和试验进行70 d后分别采集土壤样品进行微生物生物多样性分析。
1.3 测试项目及方法
总石油烃的提取和测定采用快速溶剂萃取+重量法,溶剂选用正己烷∶丙酮=1∶1(V/V),分别称取6 g硅藻土和10 g冻干处理的土壤样品,放入干净研钵中充分混合、研磨,然后装入33 mL萃取池中进行快速溶剂萃取。采用收集瓶对萃取完成的样品进行收集,放在通风橱中,经氮吹扫,用分析天平称取收集瓶前后的质量差,3次恒重后计算总石油烃的质量。
2,3,5-三苯基四氮唑氯化物(TTC)作为氢的受体,会在土壤中脱氢酶的作用下形成红色的三苯基甲臜(TPF),两者在一定范围内呈线性关系,因此使用比色法测定其形成量作为土壤脱氢酶的活性指标。
称取相当于10 g风干土的新鲜土壤样品,盛于装有100 mL灭菌水的三角瓶中,250 rmin-1振荡1 h,静置15 min,按10倍系列梯度稀释制备土壤悬液。用自动多头移液器移取土壤提取液,吸取稀释10-3之后的样品,接种至微孔平板中。30 ℃培养,分别在培养后的1、2、3、4、7、10 d用Biolog自动读数装置在590 nm分析[15]。采用Biolog微孔平板孔中的吸光度值分别计算平均颜色变化率(AWCD),土壤微生物群落功能多样性指数(Shannon指数(H)),代谢剖面反应孔的数目代表微生物群落的丰富度(S)。
1.4 数据处理
为定量动态描述石油烃的抑制作用,采用活性抑制率予以表征,负值表示激活作用,正值表示抑制作用。计算公式如下:
脱氢酶活性抑制率= (1-A/A0) ×100%
式中,A为试验组脱氢酶活性,A0为对照组脱氢酶活性[16]。
采用Excel2016和Origin9.0制图,采用SPSS19.0进行相关性分析。
2 结果与讨论(Results and discussions)
2.1 石油烃的降解量
试验结束后,根据各组实验第7、21、42、56、70天的石油烃含量,对各组不同时段的降解率进行了计算,结果如图1所示。
整个试验阶段,种植小麦+固定化外源菌(A)对石油污染土壤有较好的修复效果,计算整个70 d降解率为20.59%。其次是紫花苜蓿+固定化外源菌的协同修复体系(B)以及只投加固定化外源菌(E),降解率分别为18.35%和18.04%。种植紫花苜蓿(D)去除率为16.88%,对土著菌降解石油烃有较好的促进作用,而种植小麦(C)的降解率为14.05%,对于土著菌的促进作用并不大,这可能与小麦的生长周期以及试验条件有关。对不同组别的降解率进行单因素方差分析,只有C组与对照组的差异不显著,表明单独种植小麦的效果不明显,同时A组相较于其他各组,具有较显著差异。

图1 不同处理条件下不同时段石油烃(TPH)的降解率注:A小麦+固定化菌剂,B苜蓿+固定化菌剂,C小麦, D苜蓿,E接种固定化菌剂,F原状土。Fig. 1 Degradation rate of total petroleum hydrocarbons (TPH) in different tests during each periodNote: A Wheat + Immobilized bacteria, B Alfalfa + Immobilized bacteria, C Wheat, D Alfalfa, E Immobilized bacteria, F Soil.
试验温度控制在20 ℃、12 h光照,10 ℃、12 h黑暗情况下,植物生长较为缓慢。本试验条件下,小麦经过3周的出苗期之后未进入自然状况下的越冬期,相比于自然状态下的小麦茎秆较为纤细。另一方面,小麦根系对于石油烃污染较为敏感,试验过程中发现小麦的生长情况不如正常条件。而当小麦和固定化外源菌同时存在时,一方面,小麦的根际环境可能使得固定化颗粒中包含的外源菌DG17得以缓慢释放,相比于只接种固定化外源菌而言,与土著微生物的融合有一个缓冲过程,而且具有更长久的作用效果;另一方面,外源菌的缓慢释放也增加了对石油烃的降解,有效减缓污染物对于小麦根系的胁迫作用,能够更好地保护小麦的根系。
另外,观察各组试验后期(56~70 d)的降解率,不难发现A组和B组有较高的后期降解率,分别为11.3%和6.5%,C组、D组和E组次之,分别为1.1%、1.1%和1.7%,F组后期降解率几乎为0。可以预言,如果试验继续进行,植物-微生物协同修复组的降解效率会更高。
2.2 根际微生态环境的变化
2.2.1 脱氢酶活性变化
分别对不同处理条件下,不同采样时间的土壤样品进行处理,分析其脱氢酶活性随时间的变化规律,如图2所示。
由图2可知,除了接种固定化菌剂外,脱氢酶活性在整个试验过程中都经历先升高后下降的趋势。其中,A组脱氢酶活性上升幅度最大,经历14 d(7 d至21 d)的降解后从初始的35.124 μg TPFg-1干土上升至55.822 μg TPFg-1干土,提高了0.59倍。如表3所示,整个试验中脱氢酶活性抑制率在-187%到52%之间,其中只接种固定化菌剂的土壤在第7天时酶活性抑制率最小,为-187%;小麦-固定化菌剂协同修复组污染土壤42 d时抑制率最大,为52%。
在种植植物的条件下,从第7天到第21天土壤脱氢酶活性都有较大的提高。其中,21 d时小麦、紫花苜蓿与固定化外源菌协同修复体系中脱氢酶活性比7 d时分别增加了20.698 μg TPFg-1干土、15.189 μg TPFg-1干土;在只种植小麦或紫花苜蓿,不接种外源菌的条件下,21 d时脱氢酶活性也比7 d时分别提高了12.092 μg TPFg-1干土、10.507 μg TPFg-1干土。清洁土壤中添加石油烃污染物时,土壤的脱氢酶活性会发生显著的变化。有研究发现,以柴油为污染物进行模拟试验,发现被污染后土壤荧光素双醋酸酯(FDA)、脱氢酶及过氧化氢酶活性均立即增加[17];而也有研究表明,中等程度的石油烃污染(4 000~8 000 mgkg-1)能明显抑制脱氢酶活性[18]。原油污染土壤中本身存在大量的土著微生物能够降解石油烃,当供试土壤置于适宜的环境条件下,土著菌开始发挥作用,能够在一定程度上利用石油烃作为碳源。因此,试验初期,土壤即具有一定的脱氢酶活性。

表3 植物-微生物修复石油烃污染土壤时脱氢酶活性抑制率Table 3 The inhibition rate of dehydrogenase activities during plant-microbial remediation of TPHs impacted soils
注:A小麦+固定化菌剂,B苜蓿+固定化菌剂,C小麦,D苜蓿,E接种固定化菌剂,F原状土。
Note: A Wheat + Immobilized bacteria, B Alfalfa + Immobilized bacteria, C Wheat, D Alfalfa, E Immobilized bacteria, F Soil.
种植植物的条件下,土壤脱氢酶活性能够有一定程度的提高,许多研究者在试验过程中也证实了这一点:例如王靖等[19]研究发现150 d的盆栽实验中,铺地黍、牛筋草和百丝3种草不同程度地加快了土壤中石油污染物的降解,与未种植植物土壤相比,土壤中脱氢酶的活性高出0.61~1.20倍。
由此可见,在土壤的脱氢酶活性变化过程中,植物起着非常重要的作用,外源菌的投加初始阶段会迅速提高脱氢酶活性,然而这种影响随着降解时间而逐渐减弱。当植物和外源菌同时存在条件下,植物对于土壤酶活性的影响起着主要作用。
2.2.2 生物多样性的变化
本研究分别选取了24 h、48 h、72 h、96 h、120 h、168 h、240 h的总平均光密度(AWCD)值进行比较。对于初始样品,在240 h培养期间,AWCD从24 h开始迅速提高,168 h左右达到稳定状态,本研究选择光密度指数增加时期72 h的光密度用于统计分析。对于70 d后的土壤样品,在240 h培养期间,AWCD从24 h开始迅速提高,240 h左右达到稳定状态,本研究选择光密度指数增加时期96 h的光密度用于统计分析。选取了表征微生物群落多样性最常见的多样性指数(H)、碳源利用丰富度指数(S),以AWCD的变化来表征微生物群落结构的变化。通常认为,多样性高的群落,对环境中不同资源利用得更充分,抗外界扰动的能力更高[20]。
如表4所示,由多样性指数H、丰富度指数S和平均颜色变化率AWCD可以看出,初始的土壤样品所有的处理组均高于对照组(F),种植植物以及接种外源菌处理都能够不同程度的提高微生物的多样性,然而影响幅度并不大。
如图5所示,分别对不同处理样品初期的多样性以及70 d之后的结果进行比较,发现小麦-固定化菌剂处理组、小麦处理组以及对照组的多样性指数与平均吸光度值较初期有所增加,而其余处理组的多样性指数、平均吸光度值均有不同程度的下降。总体而言,不同处理体系的微生物群落多样性之间差异较小,后期的土壤与初期土壤相比,多样性变化并不显著。有研究表明,土壤微生物群落代谢多样性可能受土壤条件如土壤类型、含水率、总碳、总氮以及植物根系成熟度等多种因素的影响[21-23]。

表4 初始土壤微生物群落多样性指数和72 h总平均光密度(AWCD)Table 4 Diversity indices for initial soil microbial communities and average well color development (AWCD) of 72 h
注:A小麦+固定化菌剂,B苜蓿+固定化菌剂,C小麦,D苜蓿,E接种固定化菌剂,F原状土。
Note: A Wheat + Immobilized bacteria, B Alfalfa + Immobilized bacteria, C Wheat, D Alfalfa, E Immobilized bacteria, F Soil.
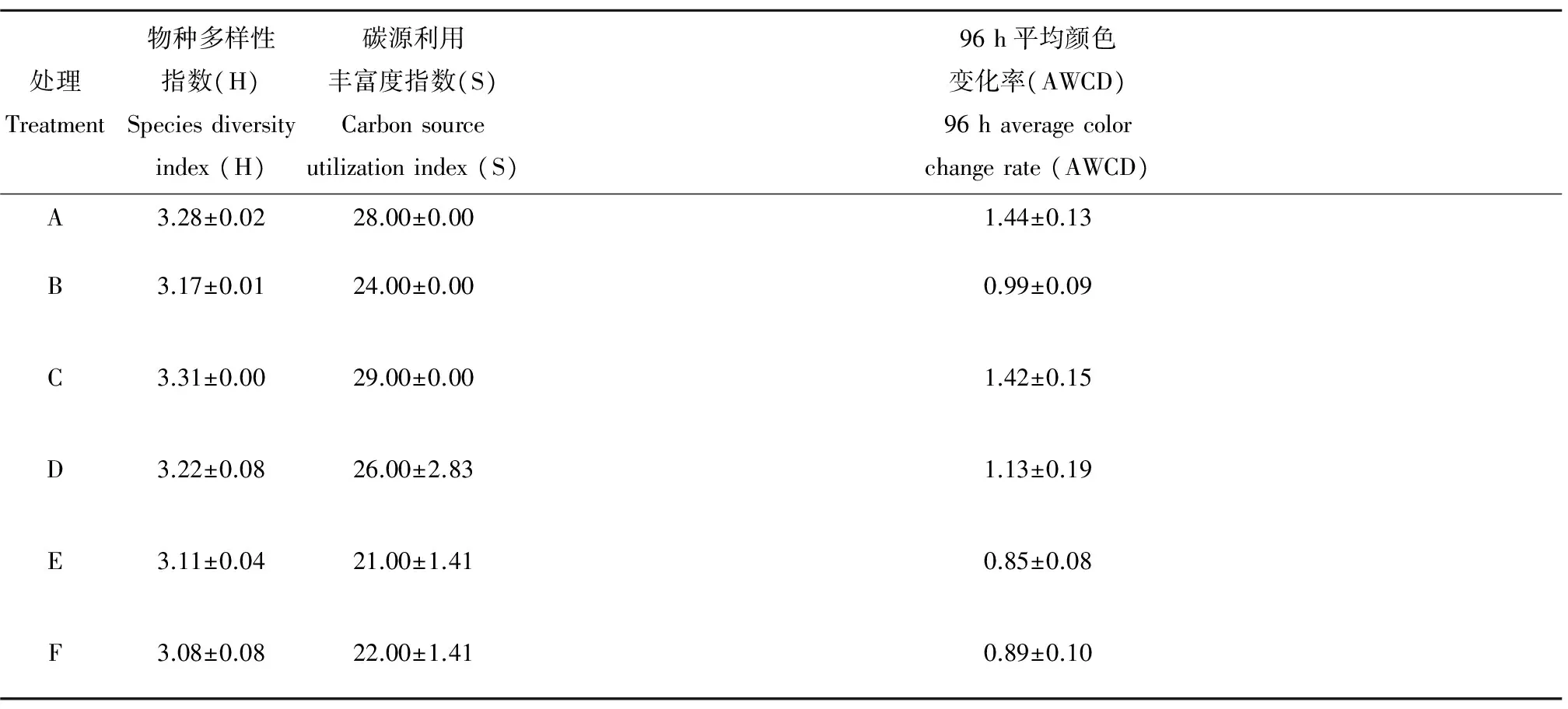
表5 降解70 d后土壤微生物群落多样性指数和96 h AWCDTable 5 Diversity indices for soil microbial communities and AWCD of 96 h after 70 d degradation
注:A小麦+固定化菌剂,B苜蓿+固定化菌剂,C小麦,D苜蓿,E接种固定化菌剂,F原状土。
Note: A Wheat + Immobilized bacteria, B Alfalfa + Immobilized bacteria, C Wheat, D Alfalfa, E Immobilized bacteria, F Soil.
另一方面,土壤中石油烃也可能影响微生物群落结构。通常认为,石油烃会刺激土壤中的微生物的生长,使得利用石油烃为碳源的微生物成为优势菌群,从而增加石油烃降解菌的数量,同时其毒害作用会抑制其他微生物的生长而降低微生物群落的多样性;然而也有研究发现石油污染土壤微生物群落功能的多样性高于无污染的土壤,并且在一定范围内随着石油污染程度的升高,微生物群落的丰富度、优势度以及均匀度均升高。
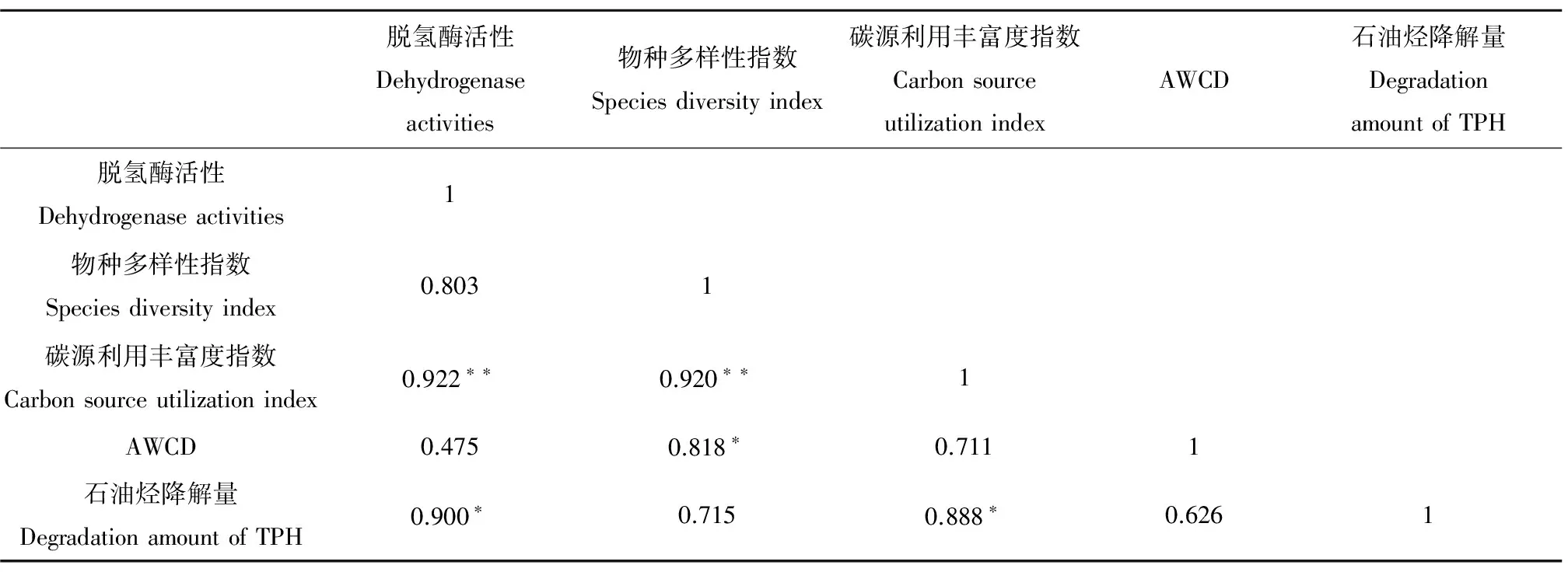
表6 试验初期(0 d)石油烃降解量与环境微生态要素的相关分析Table 6 Relationship between the removal amount of oil hydrocarbons and the micro-ecological environment factor (on 0 d)
注:**在0.01水平(双侧)上显著相关,*在0.05水平(双侧)上显著相关。
Note: ** significant correlation at the 0.01 level (bilateral), * significant correlation at the 0.05 level (bilateral).
本试验条件下,土壤的初始条件基本保持相同,外界的干扰主要来自植物以及外源菌的投加。土壤微生物功能多样性在试验初期与试验后期并没有呈现显著的差异。结合石油烃的降解情况分析,小麦-固定化外源菌协同修复体系具有良好的石油烃降解效果可能源于接种外源菌并种植小麦的条件下,微生物物种多样性以及碳源利用的丰富度均有所提高。多样性指数是微生物代谢多样性的一个表征,需要进一步分析微生物对不同碳源的利用情况进而了解微生物群落结构的动态变化。
2.3 根系生态环境与石油烃去除率间的相互关系
研究表明微生物降解石油烃的机制一方面可能是微生物分泌表面活性剂,例如鼠李糖脂等,对石油烃进行增溶和分散,增加石油烃的比表面积,从而利于微生物与石油烃接触,加速石油烃的降解[24]。另一方面,在石油烃的微生物降解过程中,微生物分泌的酶可能对石油烃的降解起重要的催化作用,例如石油烃降解过程中,脱氢酶能够促进石油烃活化氢原子而实现石油烃的氧化。脱氢酶活性与石油污染物中石油烃衰减量有良好的相关性,并且可以作为微生物对底物适应性的指标[25]。本文对试验初期土壤脱氢酶活性、物种多样性指数、碳源利用丰富度指数、AWCD与土壤石油烃降解量进行相关性分析,见表6。
许多研究者认为,土壤脱氢酶活性是反映微生物降解石油烃效率的重要指标,并且脱氢酶活性变化过程与石油烃的降解存在正相关关系。本文研究发现,在整个石油烃的降解过程中,土壤脱氢酶活性发生了一定的波动。初期脱氢酶活性与总石油烃的降解呈显著正相关(P<0.05)。因此,脱氢酶活性可以在一定程度上表征土壤石油烃的降解情况。
同时根据表6,我们发现石油烃降解与碳源利用丰富度指数呈显著相关(P<0.05),与物种多样性呈正相关,虽然未达到显著水平,但相关系数达到了0.715,与AWCD的相关系数也达到了0.626。说明石油烃降解量与土壤中微生物多样性有着一定的关系。
[1] Ying T, Shen Y, Luo Y, et al. Influence of Rhizobium meliloti, on phytoremediation of polycyclic aromatic hydrocarbons by alfalfa in an aged contaminated soil [J]. Journal of Hazardous Materials, 2011, 186(2-3): 1271-1276
[2] Gutiérrez-Ginés M J, Hernández A J, Pérez-Leblic M I, et al. Phytoremediation of soils co-contaminated by organic compounds and heavy metals: Bioassays with Lupinus luteus, L. and associated endophytic bacteria [J]. Journal of Environmental Management, 2014, 143(10): 197-207
[3] Xu Y, Sun G D, Jin J H, et al. Successful bioremediation of an aged and heavily contaminated soil using a microbial/plant combination strategy [J]. Journal of Hazardous Materials, 2014, 264(2): 430-438
[4] Tejeda-Agredano M C, Gallego S, Vila J, et al. Influence of the sunflower rhizosphere on the biodegradation of PAHs in soil [J]. Soil Biology & Biochemistry, 2013, 57(3): 830-840
[6] Wang Y, Fang L, Lin L, et al. Effects of low molecular-weight organic acids and dehydrogenase activity in rhizosphere sediments of mangrove plants on phytoremediation of polycyclic aromatic hydrocarbons [J]. Chemosphere, 2013, 99(3): 152-159
[7] Ling J, Jiang Y F, Wang Y S, et al. Responses of bacterial communities in seagrass sediments to polycyclic aromatic hydrocarbon-induced stress [J]. Ecotoxicology, 2015, 24(7): 1517-1528
[8] Xiao N, Liu R, Jin C, et al. Efficiency of five ornamental plant species in the phytoremediation of polycyclic aromatic hydrocarbon (PAH)-contaminated soil [J]. Ecological Engineering, 2015, 75(11A): 384-391
[9] Bisht S, Pandey P, Bhargava B, et al. Bioremediation of polyaromatic hydrocarbons (PAHs) using rhizosphere technology [J]. Brazilian Journal of Microbiology, 2015, 46(1): 7-21
[10] Lu Y F, Lu M. Remediation of PAH-contaminated soil by the combination of tall fescue, arbuscular mycorrhizal fungus and epigeic earthworms [J]. Journal of Hazardous Materials, 2015, 285: 535-541
[11] Wang Y, Fang L, Lin L, et al. Effects of low molecular-weight organic acids and dehydrogenase activity in rhizosphere sediments of mangrove plants on phytoremediation of polycyclic aromatic hydrocarbons [J]. Chemosphere, 2013, 99(3): 152-159
[12] 张宇宁, 梁玉婷, 李广贺. 油田土壤微生物群落碳代谢与理化因子关系研究[J]. 中国环境科学, 2010, 30(12): 1639-1644
Zhang Y N, Liang Y T, Li G H. Studies on relationship between carbon metabolism of soil microbial community and soil physicochemical factors [J]. China Environmental Science, 2010, 30(12): 1639-1644 (in Chinese)
[13] 阮志勇. 石油降解菌株的筛选、鉴定及其石油降解特性的初步研究[D]. 北京: 中国农业科学院, 2006: 32-36
[14] 夏颖. 多环芳烃菲对微生物生态毒理研究、菲降解菌的分离鉴定及降解基因克隆与表达[D]. 杭州: 浙江大学, 2004: 39-43
[15] 李振高. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008: 380-401
[16] 朱凡, 洪湘琦, 闫文德, 等. PAHs污染土壤植物修复对酶活性的影响[J]. 生态学报, 2014, 34(3): 581-588
Zhu F, Hong X Q, Yan W D, et al. Enzymatic activity during phytoremediation of polycyclic aromatic hydrocarbon impacted soil [J]. Acta Ecologica Sinica, 2014, 34(3): 581-588 (in Chinese)
[17] Margesin R, Zimmerbauer A, Schinner F. Monitoring of bioremediation by soil biological activities [J]. Chemosphere, 2000, 40: 339-346
[18] Megharaj M, Singleton I, McClure N C, et al. Influence of petroleum hydrocarbon contamination on microalgae and microbial activities in a long-term contaminated soil [J]. Archives of Environmental Contamination and Toxicology, 2000, 38: 439-445
[19] 王靖, 张忠智, 苏幼明, 等. 石油污染土壤植物修复根际效应研究[J]. 石油化工高等学校学报, 2008, 21(2): 36-40
Wang J, Zhang Z Z, Su Y M, et al.The rhizosphere effect in phytoremediation of the petroleum polluted soil [J]. Journal of Petrochemical Universities, 2008, 21(2): 36-40 (in Chinese)
[20] Bell T, Newman J A, Silverman B W, et al. The contribution of species richness and composition to bacterial services [J]. Nature, 2005, 436(7054): 1157-1160
[21] Kirk J L, Klironomos J N, Lee H, et al. The effects of perennial ryegrass and alfalfa on microbial abundance and diversity in petroleum contaminated soil [J]. Environmental Pollution, 2005, 133(3): 455-465
[22] 李世朋, 蔡祖聪, 杨浩, 等. 不同植被下红壤性质对细菌碳源利用的影响[J]. 应用与环境生物学报, 2008, 14(6): 793-797
Li S P, Cai Z C, Yang H, et al. Effect of red soil properties under different vegetation types on bacterial carbon source utilization [J]. Chinese Journal of Applied & Environmental Biology, 2008, 14(6): 793-797 (in Chinese)
[23] 米亮, 隋跃宇, 张兴义, 等. 施肥对模拟侵蚀黑土土壤微生物群落代谢活性的影响[J]. 土壤与作物, 2010, 26(1): 97-101
Mi L, Sui Y Y, Zhang X Y, et al. The effect of fertilization on the soil microbial activity under the simulation of black soil erosion [J]. System Sciences & Comprehensive Studies in Agriculture, 2010, 26(1): 97-101 (in Chinese)
[24] 陆昕, 陈立, 李娟, 等. 假单胞菌Nwu1-mu对陕北石油污染土壤的生物修复作用研究[J]. 农业环境科学学报, 2010, 29(5): 910-917
Lu X, Chen L, Li J, et al. Bioremediation of petroleum-contaminated soil in Northwest of China by Pseudomonas sp. Nwu1-mu [J]. Journal of Agro-Environment Science, 2010, 29(5): 910-917 (in Chinese)
[25] Marin J A, Hernandez T, Garcia C. Bioremediation of oil refinery sludge by landfarming in semiarid conditions: Influence on soil microbial activity [J]. Environmental Research, 2005, 98(2): 185-195
◆
RemediationofPetroleumHydrocarbonContaminatedSoilbyPlant-MicrobeandtheChangeofRhizosphereMicroenvironment
Kong Dekang1, Wang Hongqi1,*, Liu Zili1, Xu Jie1, Xiong Ying2
1. College of Water Sciences, Beijing Normal University, Beijing 100875, China2. Beijing Jing Cheng Jia Yu Environmental Technology Co. Ltd., Beijing 100176, China
10.7524/AJE.1673-5897.20170111001
2017-01-11录用日期2017-05-28
1673-5897(2017)3-644-08
X171.5
A
王红旗(1960-),男,浙江义乌人,博士。北京师范大学水科学研究院水生态与环境研究所所长、教授、博士生导师。主要从事污染土壤/地下水修复机理与修复技术、环境评价规划与管理、场地污染修复与地下水污染风险评价、可持续发展与环境教育等方向的科研与教学工作。主持国家科技支撑计划项目、“863计划”项目、国家基金项目、国家专项项目等重大项目与课题30余项,发表学术论文150余篇,撰写和合写专著15余部、教材30余部。
国家自然科学基金“包气带微生物跨膜运输多环芳烃的动态过程及膜蛋白功能调控研究”(41772234);国家自然科学基金“包气带微生物对多环芳烃的跨膜运输及膜蛋白传输方式的研究”(41372232)
孔德康(1993-),男,硕士研究生,研究方向为多环芳烃污染土壤生物修复,E-mail: 505682192@qq.com
*通讯作者(Corresponding author), E-mail: whongqi@126.com
孔德康, 王红旗, 刘自力, 等. 植物-微生物修复石油烃污染土壤与根际微生态环境变化[J]. 生态毒理学报,2017, 12(3): 644-651
Kong D K, Wang H Q, Liu Z L, et al. Remediation of petroleum hydrocarbon contaminated soil by plant-microbe and the change of rhizosphere microenvironment [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 644-651 (in Chinese)
