生物扰动作用对河口沉积物中荧蒽去除的影响
2017-10-13贾新苗李井懿杨宇张彤田胜艳
贾新苗,李井懿,杨宇,张彤,田胜艳,2,*
1. 天津科技大学海洋与环境学院,天津 3004572. 天津市海洋资源与化学重点实验室,天津 300457
生物扰动作用对河口沉积物中荧蒽去除的影响
贾新苗1,李井懿1,杨宇1,张彤1,田胜艳1,2,*
1. 天津科技大学海洋与环境学院,天津 3004572. 天津市海洋资源与化学重点实验室,天津 300457
通过室内微宇宙实验系统研究了天津厚蟹(Helice tientsinensis)和双齿围沙蚕(Perinereis aibuhitensis)生物扰动作用下河口沉积物中荧蒽的去除情况。实验结果显示,天津厚蟹扰动组中荧蒽的去除率显著高于沙蚕扰动组(P = 0.05)和对照组(P = 0.003),其中对表层(0~2 cm)和中层(3~5 cm)的促进效果最为显著;虽然各实验组表层沉积物中荧蒽的去除率均超过50%,但扰动组的去除更快,在36 d时就达最高去除率68%;双齿围沙蚕扰动组底层沉积物中荧蒽的去除率高于厚蟹扰动组和对照组,但差异不显著。研究表明表层沉积物中的荧蒽易去除,厚蟹生物扰动对荧蒽去除有显著促进作用;在距离表层5 cm以下的沉积物中荧蒽的持久性增强,但生物扰动作用可促进其去除。
多环芳烃;荧蒽;天津厚蟹;双齿围沙蚕;生物扰动
Received15 January 2017accepted13 March 2017
Abstract: The degradation of sediment-associated fluoranthene was investigated in microcosms with bioturbation of crab Helice tientsinensis and polychaete Perinereis aibuhitensis. The results indicated that the removal rate of fluoranthene in crab bioturbation microcosms was higher than that in polychaete bioturbation microcosms (P = 0.05) and control microcosms (P = 0.003), and the enhancement was more significant for surface (0-2 cm) and middle (3-5 cm) layer sediment. Though the removal rates were all more than 50% for surface sediment in all treatment microcosms, the fluoranthene was removed rapidly in crab bioturbation microcosms than controls with the most removal rate of 68% at 36 d. The fluoranthene in bottom layer sediment was removed more in polychaete bioturbation microcosms than that in crab bioturbation and control microcosms, but not significantly. It was manifested that the fluoranthene in surface sediment was labile and crab bioturbation could enhance the removal efficiently. Bioturbation could still enhance the removal of fluoranthene in sediment deep than 5 cm where the fluoranthene be more persistent.
Keywords: PAHs; fluoranthene; Helice tientsinensis; Perinereis aibuhitensis; bioturbation
河口与近海生态系统汇集来自海洋和陆源的各类污染物,尤其是工业发达地区的河口沉积环境,往往成为持久性有机污染物(Persistent Organic Pollutants, POPs)的重要蓄积地。多环芳烃(polycyclic aromatic hydrocarbons, PAHs)就是一类广泛分布于河口与近海沉积物中的POPs[1-3],此类化合物对生物具有致癌、致畸、致突变等毒性效应[4],已被欧盟和美国EPA列入优先控制污染物名单。河口与近海生境又是生态系统中重要并不可或缺的组成,如河口地区是多种海洋鱼类的洄游产卵地,也是候鸟迁徙的重要能量补给站。因此,河口沉积环境的治理与修复工作对于维持生态系统平衡、保护生物多样性等至关重要。
河口与近海沉积环境是多种底栖生物的栖息地,其群落组成与行为受沉积物的理化性质、污染程度等影响。而底栖动物在爬行、摄食、排泄、栖所建造与维护等活动中又改变了沉积物的结构、理化性质和生物特征,进而影响沉积层中的生物地球化学过程以及沉积层与水界面的物质交换[5-7]。底栖动物生命活动对沉积物结构与性质的改变被称为生物扰动作用[5]。生物扰动作用可促进沉积层中有机物的降解与矿化[5, 8],而且某些沉积食性的底栖动物可代谢转化沉积物中的石油[9]以及PAHs类污染物[10-17],因此生物扰动作用可望应用于沉积环境有机污染的修复与治理。
天津北塘河口是蓟运河、永定新河和潮白新河3条河流汇聚入海处,比邻天津港,沉积层为典型淤泥质。天津厚蟹(Helice tientsinensis)和双齿围沙蚕(Perinereis aibuhitensis)是北塘河口潮间带的优势底栖动物,并广泛分布于我国沿海地区,属于不同的生态功能类群。虽然关于这2种底栖动物的生物、生态特性已有大量研究[18-20],但关于它们的生物扰动作用对沉积物中有机污染物降解的影响尚未见报道。本研究通过室内微宇宙实验系统,选择近海环境中普遍存在的PAHs类污染物荧蒽为目标物,对天津厚蟹和双齿围沙蚕生物扰动作用下沉积物中荧蒽的去除过程进行监测,探讨生物扰动作用对沉积物中PAHs去除的影响,以评价这2种底栖动物生物扰动作用对河口沉积物中PAHs污染修复的可能性。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
实验所用试剂荧蒽、回收率指示物氘代菲、内标物氘代芘,均为标准品试剂,购自百灵威科技有限公司;样品前处理使用的试剂正己烷、二氯甲烷为色谱纯,由美国Biologic Reagent公司生产。样品检测用气相色谱-质谱联用仪(GC 7890A-MS 5975 C,美国安捷伦公司)进行。
1.2 沉积物采集与实验动物驯养
实验用沉积物采自天津北塘河口潮间带。选择落潮时间,用不锈钢铲挖取潮间带表层20 cm的沉积物,挑拣去除其中的碎石碎屑和底栖生物,运回实验室置于玻璃缸中避光保存。该沉积物类型为黏土质粉砂,有机碳含量为1.5% ± 0.14%。实验动物天津厚蟹采自同一地区。天津北塘河口潮间带天津厚蟹生物密度高,容易进行人工采集,采集的天津厚蟹在实验室内用人工海水(盐度为15,与北塘河口盐度相同)进行驯养。实验用另一种底栖动物双齿围沙蚕购自花鸟鱼虫市场。虽然北塘河口潮间带同样生存着大量双齿围沙蚕,但是其栖息处的沉积物非常泥泞,不便于人工采集。市场购买的双齿围沙蚕为人工养殖,同样在实验室内用人工海水进行驯养。驯养期间只喂食沉积物,其中的有机质以及小型和微型底栖动物可以满足实验动物的生活需要。
1.3 沉积物染毒
野外采集沉积物中16种优先控制PAHs总含量为154 ng·g-1干重,其中荧蒽含量相对较高,为(35±15) ng·g-1干重,整体而言,该沉积物PAHs污染不严重,因此对野外采集的沉积物进行染毒以增加污染物含量。采用湿法染毒:先将一定量的荧蒽丙酮溶液添加到少量冻干磨碎的沉积物中,待丙酮挥发后,将添加了荧蒽的干沉积物加入大量湿沉积物(含水量为55%)中,电动搅拌10 d,以保证污染目标物荧蒽在沉积物中混合均匀,然后避光低温保存。放置1个月后,从染毒沉积物不同位置分别取10个分样测定荧蒽含量,标准偏差<5%,表明沉积物中的荧蒽分布均匀。染毒沉积物中荧蒽的含量为(430±19.3) ng·g-1干重。
1.4 实验设计与微宇宙实验系统建立
设置3种实验组:天津厚蟹扰动组、双齿围沙蚕扰动组和对照组(不加入底栖生物),实验在圆柱形玻璃缸(内径为7 cm,高15 cm)内进行,加入10 cm厚度的荧蒽染毒的湿沉积物(含水量为55%),静置24 h后,加入底栖动物,扰动实验组设置5个平行,每个装置中加入1只动物,平行装置内加入动物的个体大小和重量相近,对照组设置2个平行。实验用天津厚蟹的湿重为(3.24±0.33) g(5只的平均值),双齿围沙蚕的湿重为(3.11±0.23) g(5只的平均值)。实验系统内不加上覆水,为保证沉积物的湿度,定期向系统中加入一定量人工海水(盐度为15)。实验持续62 d,期间不喂食。
在实验进行的第11、36和62天(放入动物的时间计时为第1天),用内径为1.5 cm的PVC管对实验系统内的沉积物进行插管采样,取柱状沉积物,根据距离沉积物表面的距离分为表层(0~2 cm)、中层(3~5 cm)和底层(6~8 cm)沉积物样品,测定其中的荧蒽含量。因为天津厚蟹洞穴较大(内径约1.5 cm),掘穴过程基本改变了沉积物原来的表面,采样时避开其洞穴位置进行插管。
1.5 沉积物中荧蒽的测定
沉积物样品经冷冻干燥后研磨粉碎,称取一定量研磨后的沉积物,加入少量铜粉,以1∶1(V∶V)的正己烷/二氯甲烷溶液为萃取剂进行超声萃取,以氘代菲为回收率指示物,萃取液经浓缩、净化处理后,氮吹浓缩装入样品瓶定容至1 mL,加入内标物氘代芘,用气相色谱-质谱联用仪(GC/MS)进行定量检测。GC/MS的检测条件为:DB-5 MS柱(30 m×0.25 mm×0.25 μm);选择离子扫描模式(SIM);内标法定量。
1.6 数据统计分析
实验结果为5个平行实验的平均值(对照组为2个平行),用SPSS 17.0软件进行单因素方差分析(One-way ANOVA)。
2 结果(Results)
2.1 实验动物的生活状况及对沉积物的扰动情况
实验动物天津厚蟹和双齿围沙蚕在微宇宙实验系统中生存良好,实验期间(62 d)未出现死亡现象。毒性预实验结果表明实验用荧蒽浓度(430 ng·g-1干重)不影响实验动物的正常生活。这2种底栖动物的掘穴行为迥异,因而对沉积物的扰动情况也截然不同。天津厚蟹进入实验系统1 d后开始掘穴,其方式是不断将底层的沉积物推出洞外,堆积于洞口周围,有的个体是将推出的沉积物堆放在洞口处,以至于洞口被掩蔽在推出的沉积物下面而不易被发现。因此在厚蟹掘穴过程中,沉积颗粒物发生大尺度位置迁移,即底层的沉积物被不断推至表面,而原本位于表层的沉积物则不断被掩埋。厚蟹进入实验系统2 d后,原本平坦的沉积物表面就呈起伏状,到实验进行到第10天的时候,沉积物表面已经变为泥堆状(如图1A、C所示)。厚蟹的穴道可至10 cm深,穴道直径约为1 cm,在穴道底部形成比穴道更宽大的洞穴(直径近2 cm),厚蟹藏身其中,时而在穴道内爬行,也会爬至洞口处,但白天基本都在洞穴内活动。洞穴内及穴道壁的沉积物含水量远远高于非洞穴处沉积物的含水率。经过一段时间(10 d或15 d不等),厚蟹会废弃原有洞穴而挖掘新洞穴,新洞穴有时会在原来穴道内挖掘,如在原来穴道中间的位置挖掘一个新洞穴;有时也会在近表层的地方重新挖掘;废弃的洞穴则会坍塌。整个实验期间,厚蟹就是在不停地进行挖掘洞穴、废弃洞穴、再挖掘洞穴的活动。与之不同,双齿围沙蚕在进入实验系统约6 h后逐渐钻入沉积物中,形成U或Y型的栖管(图1B),栖管直径略宽于其身体宽度(约0.5 cm),双齿围沙蚕在栖管内头部向下不断吞食沉积物,尾部向上,粪便排至栖管口的沉积物表面。沙蚕进入系统第5天时,其栖管即可深达沉积物底层,此时沉积物表面可见粪便颗粒(图1D),至第10天沉积物表面栖管口处已经遍布粪便颗粒。从实验装置侧面观察,沙蚕的栖管清晰可见,栖管周围的沉积物(约2 mm)呈褐色(图1B),说明呈氧化环境,而表层以下(约5 mm)无栖管处的沉积物基本为黑色,表明处于还原环境。
2.2 沉积物中荧蒽含量的变化
实验期间,各实验系统表层(0~2 cm)、中层(3~5 cm)和底层(6~8 cm)沉积物中荧蒽的含量见表1。所有实验系统沉积物中荧蒽的含量均低于初始值(430 ng·g-1干重),其中表层沉积物荧蒽的含量显著低于中层和底层沉积物中荧蒽的含量(P<0.001),而中层和底层沉积物中荧蒽含量无显著差异(P = 0.119)。不同实验组中荧蒽的含量亦有差异,厚蟹扰动组中荧蒽的含量最低,并与沙蚕扰动组(P = 0.05)和对照组(P = 0.003)存在统计性差异;沙蚕扰动组中荧蒽的含量也低于对照组,但无统计性差异(P = 0.228)。

图1 生物扰动后微宇宙实验系统中沉积物的外貌注:A 天津厚蟹扰动系统;B 双齿围沙蚕扰动系统;C天津厚蟹 扰动系统表面;D 双齿围沙蚕扰动系统位于表面的洞口及粪便颗粒。Fig. 1 The appearance of the sediments in the microcosms after bioturbationNote: A, Crab bioturbation microcosm; B, Polychaete bioturbation microcosm; C, The surface of crab bioturbation microcosm; D, The entrance and faecal pellet on the surface of polychaete bioturbaion microcosm.
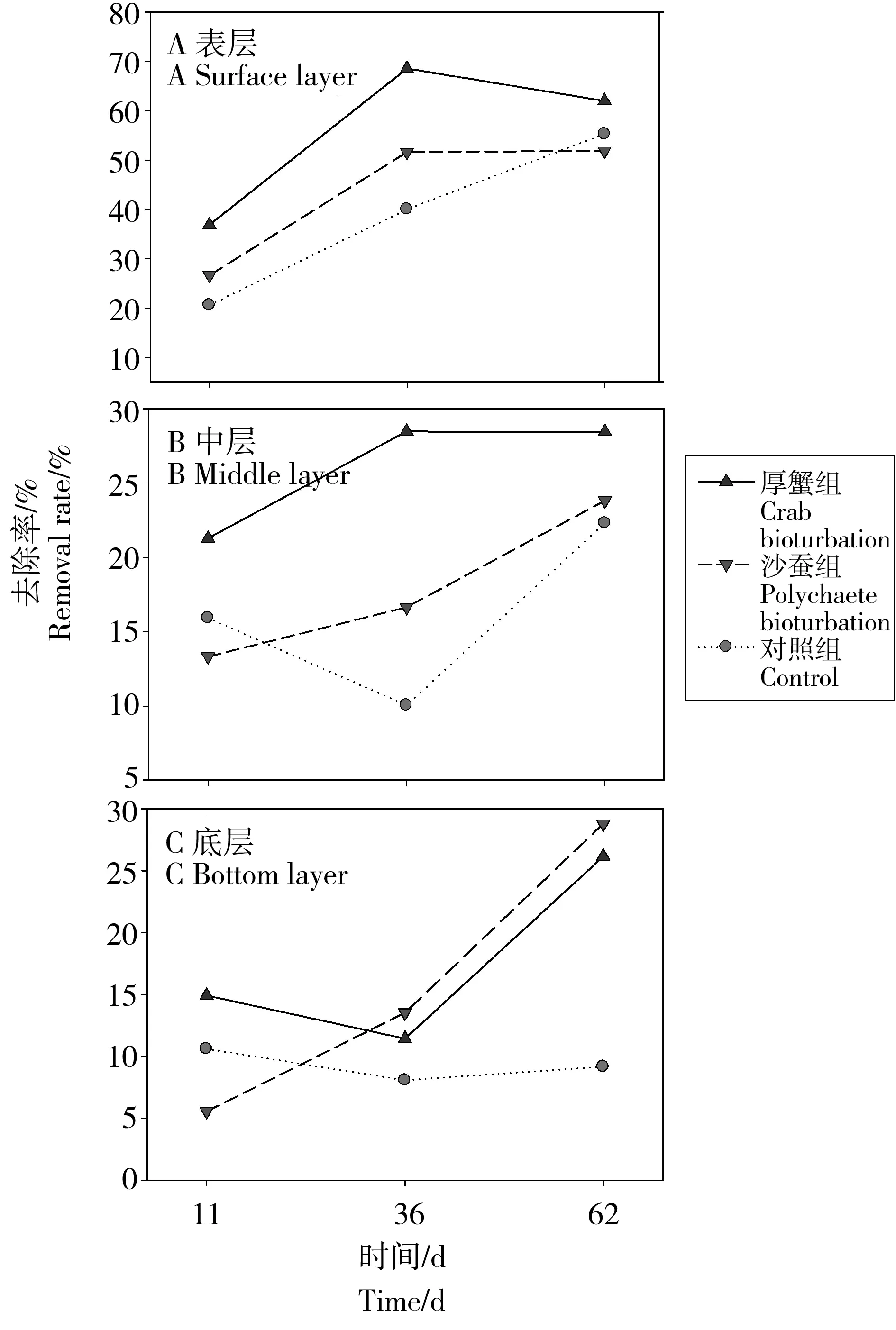
图2 实验系统不同深度沉积物中荧蒽的去除率Fig. 2 The removal rate of fluoranthene in sediments located at different depth in the microcosms

表1 实验系统不同深度沉积物中荧蒽的含量(ng·g-1干重)Table 1 The fluoranthene concentrations in sediments located at different depth in the microcosms (ng·g-1 dry wt)
注:数据为“均值±标准偏差”;厚蟹和沙蚕扰动组为5个平行,对照组为2个平行。
Note: Data are shown as average ± STDEV; 5 parallels for crab and polychaete bioturbation treatments, 2 parallels for control treatment.
根据实验期间荧蒽含量的变化计算去除率,各实验系统荧蒽的去除率如图2所示。由图可见,不同深度沉积物中荧蒽的去除及其与时间的关系在不同实验组间差异很大。各实验系统中表层沉积物荧蒽的去除率均超过50%,其中厚蟹扰动组中荧蒽的去除率最大,显著高于沙蚕扰动组(P = 0.05)和对照组(P = 0.021);沙蚕扰动组中荧蒽的去除率与对照组无显著差异(P = 0.365),至实验终止时对照组中荧蒽的去除率甚至略高于沙蚕扰动组。厚蟹扰动组和沙蚕扰动组中表层沉积物荧蒽的去除主要发生在36 d之前,在此之后去除率基本无变化,而对照组中荧蒽的去除率与时间正相关。中层沉积物中荧蒽的去除率显著低于表层沉积物,其中依然是厚蟹扰动组中的去除率最高,显著高于沙蚕扰动组(P = 0.04)和对照组(P = 0.005),沙蚕扰动组中的去除率也显著高于对照组(P = 0.04);厚蟹扰动组中的去除率还是在36 d时就达到最高值。厚蟹和沙蚕扰动组中的底层沉积物的去除率与中层沉积物的去除率相近,但对照组中底层的去除率远远低于中层的去除率。由此可知,荧蒽在表层沉积物中易发生降解转化,而厚蟹的生物扰动作用显著促进了荧蒽的降解;在距离表层5 cm以下的沉积物中,荧蒽的持久性增强,但底栖动物的生物扰动作用能有效促进其降解。
3 讨论(Discussion)
无论海洋还是淡水生态系统,沉积生境中常常栖息着数量丰富的底栖动物,这些动物的爬行、摄食、排泄、掘穴和栖所建造等活动造成沉积颗粒物迁移、混合,以及伴随这些活动而发生的上覆水不断涌入和排出穴道/栖管而产生的冲洗作用(即生物冲洗),造成沉积结构、理化性质和生物特征改变,这就是生物扰动[5-7]。生物扰动对沉积物的生物地球化学过程有重要影响,扰动生物被誉为“生态系统工程师”[5, 21]。底栖动物所掘的洞穴和建筑的栖管不是沉积物表面简单的延伸,而是有着特异理化性质的新界面,其中的微生物群落组成与周围沉积物中的菌群结构不同[21-22]。洞穴及穴道/栖管中经常变化的环境,如溶质交换、氧化还原条件周期性波动等,为微生物群落活力提供了物质基础[21]。此外,沉积食性的底栖动物要吞食大量沉积物,其消化液中含有促进大分子有机化合物溶解的物质,可提高有机物质的生物有效性[23]。研究发现生物扰动作用能够促进沉积物中的污染物向水层释放[24],也可能将表层污染物迁移至深层从而增加污染物的持久性[9, 25],同时也能够促进石油和PAHs等有机污染物的降解[15, 26-27],其影响与沉积物性质、污染物性质、底栖动物种类及其扰动方式有关,其中动物种类与扰动方式是关键因素[28]。
根据底栖动物的扰动方式,可分为4类功能类群:生物扩散者(biodiffusers)、上行输送者(upward conveyors)、下行输送者(downward conveyors)和沉积物再造者(regenerators)[5]。本研究中的实验动物天津厚蟹属于沉积物再造者,此类群主要包括穴居的物种,在掘穴和洞穴维护过程中时不断将穴内深层沉积物推出洞外,在沉积物-水界面形成较大的开口,在水流作用下洞穴内又被填入表层沉积物,或者由于洞穴坍塌导致上层沉积物迁移到下层,与本文实验中观察到的天津厚蟹的扰动行为一致;双齿围沙蚕则属于上行输送者,该类群的主要特点是动物头向下筑管,在栖管底部吞食沉积物,在沉积物-水界面处排泄,这也与实验中观察到双齿围沙蚕的扰动方式一致。天津厚蟹和双齿围沙蚕都是我国河口地区广泛分布的常见底栖动物,天津厚蟹主要栖息于高、中潮滩,更喜草滩,以有机碎屑、底栖藻类和软泥等为食,属沉积食性[20];双齿围沙蚕是潮间带高潮区的优势种,生活在细颗粒泥砂质黏土沉积物中的U形栖管中,深度可达15 cm,成体沙蚕要吞食大量沉积物摄取其中的有机物[18-19]。从这2种动物的生活习性分析,其生物扰动作用都可能影响河口沉积物中有机污染物的归趋,包括PAHs的降解,但目前尚未见相关研究报道。本研究的结果表明天津厚蟹对表层(≤5 cm)沉积物中荧蒽的去除具有显著促进作用。氧化降解通常是沉积物中烃类化合物的有效去除方式,需要氧或其他的电子受体,氧化环境有利于氧化降解反应发生。厚蟹掘穴和洞穴维护过程促使表层沉积物发生剧烈混合,就有利于表层沉积物保持较好的氧化条件[29]。Qin等[30]的野外调查研究发现天津厚蟹洞穴内沉积物中PAHs含量低于非洞穴沉积物中的含量,认为厚蟹生物扰动作用促进了PAHs的降解。而双齿围沙蚕是管栖动物,只有栖管周围的沉积物呈氧化状态,系统中多数沉积物处于还原条件,因此沙蚕扰动组中荧蒽的去除率并没有显著高于对照组。但是对深层沉积物而言,双齿围沙蚕生物扰动作用对荧蒽的去除取得了与厚蟹相似的促进效果(图2 C)。实验系统中沉积物的深度未及双齿围沙蚕的最大扰动深度,很有可能双齿围沙蚕生物扰动作用对更深的沉积物会产生比厚蟹更强的促进效果。此外,本研究没有对洞穴或栖管内的沉积物专门采样,而且取样时特意避开当时有效的洞穴和栖管,因此研究结果低估了生物扰动作用的影响。
正常河口生态系统的潮间带沉积物会周期性的被潮汐海水覆盖。生物扰动作用除了促进沉积物中污染物的降解,还可能促进其释放。如李俐俐等[31]通过室内实验发现沙蚕(Nereis diversicolor)的生物扰动作用促进了天津大沽排污河河口沉积物中菲向水体的释放,其中溶解态菲占释放总量的80%以上,以溶解态释放的菲是对照组的9.55~17.4倍。本研究的实验系统中没有加入上覆水,这也低估了生物扰动作用对沉积物中荧蒽去除的影响。另外,实验系统中没有上覆水也是对照组中表层沉积物荧蒽去除率达51%的主要原因,没有上覆水就增加了表层沉积物氧化层厚度,良好的氧化条件有利于氧化降解发生。而对于深层沉积物,对照组的去除率就远远低于生物扰动组,可以解释为氧化降解受限制。
综上所述,生物扰动作用可促进沉积物中荧蒽的去除,其促进效果与动物种类,尤其是扰动方式有关,如天津厚蟹等沉积物再造者对表层沉积物中污染物去除影响显著,而对于深层沉积物,如双齿围沙蚕这样的栖管较深的向上输送者促进效果更好。底栖动物生物扰动作用促进污染物去除过程中所引起的污染物释放及生物有效性增加等可能引起二次污染的问题需要进一步研究。
[1] Qian X, Liang B, Fu W, et al. Polycyclic aromatic hydrocarbons (PAHs) in surface sediments from the intertidal zone of Bohai Bay, Northeast China: Spatial distribution, composition, sources and ecological risk assessment [J]. Marine Pollution Bulletin, 2016, 112(1-2): 349-358
[2] Su P H, Lv B Y, Tomy G T, et al. Occurrences, composition profiles and source identifications of polycyclic aromatic hydrocarbons (PAHs), polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in ship ballast sediments [J]. Chemosphere, 2017, 168: 1422-1429
[3] Zhang A, Zhao S, Wang L, et al. Polycyclic aromatic hydrocarbons (PAHs) in seawater and sediments from the northern Liaodong Bay, China [J]. Marine Pollution Bulletin, 2016, 113(1-2): 592-599
[4] Balcioglu E B. Potential effects of polycyclic aromatic hydrocarbons (PAHs) in marine foods on human health: A critical review [J]. Toxin Reviews, 2016, 35(3-4): 98-105
[5] Kristensen E, Penha-Lopes G, Delofosse M, et al. What is bioturbation? The need for a precise definition for fauna in aquatic sciences [J]. Marine Ecology Progress Series, 2012, 446: 285-302
[6] 田胜艳, 张彤, 宋春诤, 等. 生物扰动对海洋沉积物中有机污染物环境行为的影响[J]. 天津科技大学学报, 2016, 31(1): 1-7
Tian S Y, Zhang T, Song C Z, et al. Influence of bioturbation on the environmental behavior of sediment-associated organic pollutants in marine ecosystem [J]. Journal of Tianjin University of Science & Technology, 2016, 31(1): 1-7 (in Chinese)
[7] 何怡, 门彬, 杨晓芳, 等. 生物扰动对沉积物中重金属迁移转化影响的研究进展[J]. 生态毒理学报, 2016, 11(6): 25-36
He Y, Men B, Yang X F, et al. Bioturbation effection on the migration and transformation of heavy metals in sediment: A review [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 25-36 (in Chinese)
[8] Banks J L, Ross D J, Keough M J, et al. Influence of a burrowing, metal-tolerant polychaete on benthic metabolism, denitrification and nitrogen regeneration in contaminated estuarine sediments [J].Marine Pollution Bulletin, 2013, 68(1-2): 30-37
[9] Grossi V, Massias D, Stora G, et al.Burial, exportation and degradation of acyclic petroleum hydrocarbons following a simulated oil spill in bioturbated Mediterranean coastal sediments [J]. Chemosphere, 2002, 48(9): 947-954
[10] Timmermann K, Banta G T, Johnsen A R, et al. Effects of the polychaetes Arenicola marina and Nereis diversicolor on microbial pyrene mineralization [J]. Aquatic Microbial Ecology, 2008, 50(2): 197-207
[11] Malmquist L M V, Christensen J H, Selck H. Effects ofNereis diversicolor on the transformation of 1-methylpyrene and pyrene: Transformation efficiency and identification of Phase I and II products [J]. Environmental Science & Technology, 2013, 47(10): 5383-5392
[12] Lyytikaeinen M, Pehkonen S, Akkanen J, et al. Bioaccumulation and biotransformation of polycyclic aromatic hydrocarbons during sediment tests with oligochaetes (Lumbriculus variegatus) [J]. Environmental Toxicology and Chemistry, 2007, 26(12): 2660-2666
[13] Jorgensen A, Giessing A M B, Rasmussen L J, et al. Biotransformation of polycyclic aromatic hydrocarbons in marine polychaetes [J]. Marine Environmental Research, 2008, 65(2): 171-186
[14] Ito K, Ito M, Onduka T, et al. Differences in the ability of two marine annelid species,Thalassodrilides sp and Perinereis nuntia, to detoxify 1-nitronaphthalene [J]. Chemosphere, 2016, 151: 339-344
[15] Granberg M E, Hansen R, Selck H. Relative importance of macrofaunal burrows for the microbial mineralization of pyrene in marine sediments: Impact of macrofaunal species and organic matter quality [J]. Canadian Journal of Anaesthesia, 2005, 55(10): 663-669
[16] Forbes V E, Andreassen M S H, Christensen L. Metabolism of the polycyclic aromatic hydrocarbon fluoranthene by the polychaete Capitella capitata species I [J]. Environmental Toxicology and Chemistry, 2001, 20(5): 1012-1021
[17] Christensen M, Andersen O, Banta G T. Metabolism of pyrene by the polychaetes Nereis diversicolor and Arenicola marina [J]. Aquatic Toxicology, 2002, 58(1-2): 15-25
[18] 蒋霞敏, 柳敏海. 沙蚕科的研究进展[J]. 海洋科学, 2008, 32(4): 82-86
Jiang M X, Liu M H. Research progress of nereididae [J]. Marine Sciences, 2008, 32(4): 82-86 (in Chinese)
[19] 张青田, 胡桂坤. 双齿围沙蚕摄食自然沉积物的研究[J]. 天津科技大学学报, 2008, 23(3): 26-29
Zhang Q T, Hu G K. Study on feeding natural sediment of Perinereis aibuhitensis [J]. Journal of Tianjin University of Science & Technology, 2008, 23(3): 26-29 (in Chinese)
[20] 袁兴中, 陆健健. 长江口岛屿湿地的底栖动物资源研究[J]. 自然资源学报, 2001, 16(1): 37-41
[21] Papaspyrou S, Gregersen T, Kristensen E, et al. Microbial reaction rates and bacterial communities in sediment surrounding burrows of two nereidid polychaetes Nereis diversicolor and N. virens [J]. Marine Biology, 2006, 148: 541-550
[22] Pischedda L, Militon C, Gilbert F, et al. Characterization of specificity of bacterial community structure within the burrow environment of the marine polychaete Hediste (Nereis) diversicolor [J]. Research in Microbiology, 2011, 162(10): 1033-1042
[23] Weston D P, Mayer L M. In vitro digestive fluid extraction as a measure of the bioavailability of sediment-associated polycyclic aromatic hydrocarbons: Sources of variation and implications for partitioning models [J]. Environmental Toxicology and Chemistry, 1998, 17(5): 820-829
[24] Hedman J E, Tocca J S, Gunnarsson J S. Remobilization of polychlorinated biphenyl from Baltic Sea sediment: Comparing the roles of bioturbation and physical resuspension [J]. Environmental Toxicology and Chemistry, 2009, 28(11): 2241-2249
[25] Timmermann K, Banta G T, Klinge L, et al. Effects of bioturbation on the fate of oil in coastal sandy sediments - An in situ experiment [J]. Chemosphere, 2011, 82(10): 1358-1366
[26] Ito M, Ito K, Ohta K, et al. Evaluation of bioremediation potential of three benthic annelids in organically polluted marine sediment [J]. Chemosphere, 2016, 163: 392-399
[27] Vorob'ev D S, Frank Y A, Lushnikov S V, et al. Oil decontamination of bottom sediments using Limnodrilus hoffmeisteri (Oligochaeta: Tubificidae) [J]. Contemporary Problems of Ecology, 2010, 3(1): 15-18
[28] Josefsson S, Leonardsson K, Gunnarsson J S, et al. Bioturbation-driven release of buried PCBs and PBDEs from different depths in contaminated sediments [J]. Envirinmental Science & Technology, 2010, 44: 7456-7464
[29] Mcgenity T J. Hydrocarbon biodegradation in intertidal wetland sediments [J]. Current Opinion in Biotechnology, 2014, 27: 46-54
[30] Qin X B, Sun H W, Wang C P, et al. Impacts of crab bioturbation on the fate of polycyclic aromatic hydrocarbons in sediment from the Beitang estuary of Tianjin, China [J]. Environmental Toxicology and Chemistry, 2010, 29(6): 1248-1255
[31] 李俐俐, 武安泉, 覃雪波. 沙蚕生物扰动对河口沉积物中菲释放的影响[J]. 环境科学学报, 2014, 34(9): 2355-2361
Li L L, Wu A Q, Qin X B. Influence of Nereis diversicolor bioturbation on release of phenanthrene from a field estuarine sediment [J]. Acta Scientiae Circumstantiae, 2014, 34(9): 2355-2361 (in Chinese)
◆
ImpactofBioturbationontheRemovalofFluorantheneinMuddyEstuarineSediment
Jia Xinmiao1, Li Jingyi1, Yang Yu1, Zhang Tong1, Tian Shengyan1,2,*
1. College of Marine and Environmental Sciences,Tianjin University of Science and Technology, Tianjin 300457, China2. Tianjin Key Laboratory of Marine Resources and Chemistry, Tianjin 300457, China
10.7524/AJE.1673-5897.20170115009
2017-01-15录用日期2017-3-13
1673-5897(2017)3-629-07
X171.5
A
田胜艳(1974-),女,博士,高级工程师,硕士研究生导师,主要研究方向为近海环境污染与修复。
国家自然科学基金(No. 21307045, 41303070);天津科技大学大学生实验室创新基金(No. 1505A211);中国博士后科学基金第六批特别资助(No. 2013T60256)
贾新苗(1991-),女,硕士研究生,研究方向为环境污染物修复,E-mail: 993444219@qq.com;
*通讯作者(Corresponding author), E-mail: tiansy@tust.edu.cn
贾新苗, 李井懿, 杨宇, 等. 生物扰动作用对河口沉积物中荧蒽去除的影响[J]. 生态毒理学报,2017, 12(3): 629-635
Jia X M, Li J Y, Yang Y, et al. Impact of bioturbation on the removal of fluoranthene in muddy estuarine sediment [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 629-635 (in Chinese)
