氯代阻燃剂得克隆对孔石莼(Ulva pertusa)繁殖及早期发育的影响
2017-10-13巩宁邵魁双张钰昆景德清孙野青
巩宁,邵魁双,张钰昆,景德清,孙野青,#
1. 大连海事大学环境科学与工程学院,大连1160262. 大连海事大学环境系统生物学研究所,大连1160263. 国家海洋环境监测中心,大连116023
氯代阻燃剂得克隆对孔石莼(Ulva pertusa)繁殖及早期发育的影响
巩宁1,2,*,邵魁双3,张钰昆1,2,景德清1,2,孙野青1,2,#
1. 大连海事大学环境科学与工程学院,大连1160262. 大连海事大学环境系统生物学研究所,大连1160263. 国家海洋环境监测中心,大连116023
得克隆(Dechlorane Plus, DP)是一种在全世界范围内广泛使用的氯代阻燃剂,具有潜在的毒性效应。但目前已有的生态毒理学数据还十分有限。本文选择分布广泛的大型绿藻孔石莼(Ulva pertusa)作为研究对象,探讨不同浓度DP对孔石莼繁殖细胞转化及早期发育的影响。结果表明,低浓度(10-6~10-8mol·L-1)DP暴露不同程度地影响孔石莼繁殖细胞的形成、释放及附着,在试验浓度范围内呈现一定的剂量效应关系。与空白对照组相比,DP处理(10-6mol·L-1)分别使繁殖细胞的形成率、释放率和附着率显著降低了76.76%、46.26%和85.64%。在丝状幼体阶段,DP处理组(10-8和10-7mol·L-1)幼体体长分别比对照组显著减少了32.74%和38.98%。结果表明,DP暴露抑制了孔石莼的繁殖及早期发育。基于绿藻繁殖特性及早期发育的生物学指标对DP暴露较为敏感,能够为海洋环境的DP生物学效应研究提供数据。
得克隆;孔石莼;繁殖;早期发育
Received14 January 2017accepted21 March 2017
Abstract: Dechlorane Plus (DP) is a highly chlorinated flame retardant which is globally ubiquitous. However, limited information is available on its toxicity in aquatic organisms, especially for marine algae. In this study, the common green macroalgae Ulva pertusa was used to evaluate possible eco-toxicological response, including the reproduction and early development with the low-dose DP exposure (10-6to 10-8mol·L-1). The results showed that DP inhibited the reproductive cells formation, release and adhesion in dose-effect manner. After exposure to DP in the concentration of 10-6mol·L-1, the rate of formation, release and adhesion were significantly decreased by 76.76%, 46.26% and 85.64%, respectively. The length of filaments was decreased by 32.74% and 38.98%, respectively with 10-8and 10-7mol·L-1of DP treatments. Our observations firstly indicated that DP disrupted the transformation of reproductive cells of U. pertusa as well as their early development. Reproductive cells formation, release and adhesion in macroalgae were sensitive biomarkers which can be used for assessing the marine ecological risks of DP.
Keywords: Dechlorane Plus; Ulva pertusa; reproduction; early development
得克隆(Dechlorane Plus, DP)是一种人工合成的脂肪族氯代阻燃剂,化学名为双(六氯环戊二烯)环辛烷,又名敌可燃。它呈白色粉末状,分子量为653.72 g·mol-1,分子式为C18H12Cl12,具有顺式(syn-DP)和反式(anti-DP)2种同分异构体,在商品中以一定比例混合[1]。早在20世纪70年代,DP作为灭蚁灵的替代品被美国OxyChem化学公司发明并开始生产。而后由于优异的电化学性能、阻燃性和热稳定性,又被添加于电线、电缆、电子元器件、建材等产品的塑料、尼龙中。近年来,DP的年产量保持在500~5 000 t之间,被美国环保局(EPA)划为高产量化学物(high production volume chemical, HPV)[2]。从2004年起,我国江苏安邦电化有限公司(JiangsuAnpon Electrochemical Co.)也开始投产生产,年产量大约300~1 000 t[3]。
作为一种添加型的阻燃剂,DP在产品的使用过程或废弃后很容易释放到环境中。人们发现,由于具有与持久性有机污染物(persistent organic pollutants, POPs)类似的结构特征,它可能成为广泛存在的环境污染物。但是直到2006年,Hoh等[1]才首次在北美五大湖地区的空气、鱼体及沉积物中发现DP。此后,DP陆续在全球多种环境介质中被检测到[4-10],并在生产厂及电子废弃物处理厂附近发现了较高浓度的DP[11-14],且发现DP具有潜在的生物富集能力[15]。在我国的海洋环境中,DP在黄海[16-18]、东海[19]的海水、沉积物及生物样品中均有检出,说明这些海域的生态系统受到了DP污染的威胁。
分布于近岸海域的底栖海藻是基岩食物链的基石,是植食动物的饵料和海洋动物的产卵场、孵化场及遮蔽所,对减缓近岸富营养化起到了重要作用。孔石莼(Ulva pertusa)是温带海域常见的一种大型绿藻,在潮间带及大干潮线附近常常优势分布[30],是进行水质监测、养殖污染控制及水生毒性测试的常用物种[31]。在我们的前期工作中,发现DP暴露(28 d)对孔石莼成体的生长产生了抑制,并引起细胞的氧化损伤、光合作用抑制及生物富集效应(数据另文发表)。但是,这些毒性效应均在远高于环境浓度的暴露条件下(100 mg·L-1)出现,说明对于DP这一类低毒的化合物来说,要明确其生态影响,需要选择敏感性更高的受试阶段进行低剂量的长期测试,更具有实际意义。
因此,本研究以孔石莼为受试生物,基于生活史进程中最脆弱且关键的早期阶段,通过对不同浓度DP暴露下繁殖细胞的转化、发育及早期幼体生长的连续观察及相关生物学指标的测定,探讨DP对潮间带绿藻的毒理学效应,进而分析其对孔石莼种群增长及海藻群落结构变化的影响机制,以期为评估得克隆的海洋生态风险提供参考。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 孔石莼的采集与室内驯化
实验用孔石莼(Ulva pertusa)采自辽宁省大连市黑石礁海域潮间带(N38°52’, E121°33’)。选取自然条件下生长状态良好的孔石莼成体,带回实验室后立即用消毒砂滤海水进行反复清洗,用软毛刷去除表面的杂质及附着物。再置于1%的KI-I2溶液(1 g I2溶于100 mL水,因为I2的溶解度低,加入KI增加溶解度)中浸泡5 min,用过滤消毒海水漂洗2~3次以去除原生动物及杂藻。将藻体置于光照培养箱中用消毒海水驯化培养1周,添加f/2营养盐,培养条件为(15±1) ℃,2 000 Lux,光暗周期为12 h∶12 h,盐度28~30。每3天补充一次因挥发而减少的海水。
1.1.2 DP测试液的配制
实验用得克隆(DP)由江苏安邦电化公司生产(纯度> 99%)。通过丙酮助溶法,获得浓度为10-3mol·L-1的DP母液。配制方法为:在200 mL丙酮(分析纯,天津科密欧化学试剂有限公司)中加入130.74 mg DP,置于磁力搅拌器上搅拌至全部溶解后转移到棕色试剂瓶中于4 ℃下保存备用。
暴露实验时,吸取一定量母液加入已添加营养盐的消毒过滤海水中,配制成10-6~10-8mol·L-1的测试液。因此,测试液中助溶剂丙酮的最高用量为0.1%(在前期实验中确定,体积分数< 0.1%丙酮不会对藻类生长产生影响)。
1.2 孔石莼繁殖细胞的制备及早期发育过程观察
挑选经人工驯化后健康的孔石莼藻体,在藻体边缘用手术刀片切割出边长< 5 mm的小片段,加入已添加营养盐的消毒过滤海水培养,培养条件为(22±1) ℃,3 000 Lux,光暗周期为12 h∶12 h,盐度28~30,每周更换一次培养液。定期将外植体片段置于显微镜(NIKON TE2000)下观察,拍照记录孔石莼繁殖细胞产生及发育进程。
1.3 DP的毒性暴露实验
挑选经人工驯化后健康的孔石莼藻体,在藻体边缘用打孔器打出直径约3 mm的藻片若干。选择边缘完整的藻片随机分成5组,放入6 cm培养皿中,每组30片,分别加入不同浓度的DP(0、10-6、10-7和10-8mol·L-1)测试液进行毒性暴露。同时设定助溶剂对照组(丙酮最高添加量0.1%)。每周更换一次测试液。
1.4 孔石莼繁殖细胞的形成与形成率的测定
培养1周左右后,藻片边缘营养细胞开始转化为繁殖细胞。二者在细胞形态结构上有显著差异,可通过镜下观察进行有效区分。在空白对照组藻片中有超过40%的营养细胞转化时,开始对各组的繁殖细胞形成率进行测定。每组观察30枚藻片,每枚藻片拍摄10张照片。实验结束后,利用Image J软件对所有照片进行分析、测定,划定繁殖细胞形成区域。将该区域面积记为S1,观察区域总面积记为S2。每枚藻片的繁殖细胞形成率(reproductive cellsformationrate, RCF)可表示为:
RCF% =S1/S2×100%
(1)
1.5 孔石莼繁殖细胞的放散与放散率的测定
孔石莼繁殖细胞成熟后会陆续放散。已放散的区域藻片呈白色,未放散区域藻片呈绿色,可通过肉眼及镜下观察有效区分。经过预实验的观察,选择在DP暴露后10 d,利用体视显微镜(Motic SMZ-168)对藻片进行观察和拍照。利用Image J软件对图像进行处理和分析。通过颜色差异对已放散和未放散区域进行识别和面积计算。已放散面积记为S3,观察区域总面积记为S4。繁殖细胞放散率(reproductive cells release rate, RCR)可表示为:
RCR% =S3/S4×100%
(2)
1.6 孔石莼繁殖细胞的附着与相对附着率的测定
孔石莼繁殖细胞放散后会很快附着。在培养皿底部放置载玻片,选择DP暴露后14 d将载玻片取出置于显微镜下观察计数。每个载玻片上随机选取30个视野拍照,计数附着的细胞数量。将空白对照组的附着率记为100%,计算其他各组的相对附着率(relative adhesion rate, RA)。
1.7 孔石莼幼体早期生长发育的观察及幼体生长率的测定
附着在载玻片上的孔石莼繁殖细胞萌发后,会进行纵向分裂形成早期丝状幼体。将幼体(外植体培养约30 d)暴露于不同浓度的DP测试液中(组别设置同1.3),每周更换一次测试液。于暴露后15 d将载玻片取出置于体视显微镜下观察孔石莼幼体生长情况并拍照。利用Motic Images Advanced 3.2软件测量孔石莼幼体的长度。测量记录指定区域内30个孔石莼幼体的长度,计算每组长度的平均值。
1.8 数据统计与分析
数据以平均值±标准差的形式表示。采用EXCEL软件对实验数据进行方差分析。采用ANOVA方法分析空白对照组与丙酮对照组及各DP暴露组之间的差异,P < 0.05表示差异显著。
2 结果(Results)
2.1 孔石莼繁殖细胞的诱导及早期发育过程观察
野外采集的孔石莼成体(图1,a)进行室内驯化,选取健康的藻体切割成边长5 mm以下的外植体片段,在(22±1) ℃,3 000 Lux的条件下培养5~7 d。外植体由边缘细胞开始,逐渐出现原生质浓缩、质壁分离的现象。随后,这些浓缩的原生质开始分裂,营养细胞转化为繁殖细胞(图1,b)。当繁殖细胞成熟后,放散到水中,具有2根鞭毛,可以游动(图1,c)。放散后的繁殖细胞很快附着变圆并失去鞭毛(图1,d),细胞体积增大并开始萌发,进行第一次分裂(图1,e)。第一次分裂后的细胞出现了藻体的极性分化(图1,f),其中一个细胞形成假根,另外一个细胞经过多次横分裂形成十几个细胞组成的单列丝状体(图1,g)。以上为孔石莼外植体的早期发育过程。再经过几十天的培养,单列丝状体通过纵分裂形成膜状体,进一步发育形成肉眼可见的孔石莼幼苗(图1,h)。
通过以上连续培养,确定在孔石莼外植体片段培养的第7、10及14天进行观察,分别测定繁殖细胞的形成率、放散率和附着率,选择孔石莼早期发育的单列丝状体阶段(外植体培养45 d)测定幼体体长。

图1 孔石莼繁殖细胞的诱导及早期发育过程注:a,h中标尺为1 cm;b~g中标尺为=10 μm。a,野外采集的孔石莼成体;b,营养细胞由边缘向内,逐渐转化成繁殖细胞; c,带两根鞭毛的繁殖细胞;d,游动细胞附着后,鞭毛消失,细胞变圆;e,细胞萌发,进行第一次分裂;f,第二次分裂,底部细胞形成假根; g,上层细胞多次分裂形成十几个细胞的单列丝状体;h,孔石莼幼苗。Fig. 1 The formation of reproductive cells and early development of U. pertusaNote: a and h, Scale = 1 cm; b-g, Scale = 10 μm. a. Adult U. pertusa; b. The formation of reproductive cells; c. Reproductive cell with 2 flagella; d. Adhesion of reproductive cell; e. The first cell division; f. The second cell division; g. The filament of U. Pertusa; h. The germling of U. pertusa.

图2 得克隆(DP)暴露对孔石莼繁殖细胞形成的影响Fig. 2 The effect of Dechlorane Plus (DP) on the formation of reproductive cells in U. pertusa
2.2 DP暴露对孔石莼繁殖细胞形成的影响
图2为不同浓度DP暴露下孔石莼繁殖细胞的形成率。与空白对照组相比,助溶剂对照组的形成率略低,但二者没有显著性差异(P = 0.13)。说明0.1%丙酮对孔石莼繁殖细胞形成没有显著影响。与空白对照组相比,不同浓度DP处理使形成率均有降低,随着暴露浓度的增加,形成率降低得更为明显,在试验浓度范围内呈现剂量效应关系。但只有10-6mol·L-1的DP处理组呈显著下降(P < 0.05),比空白对照组降低了76.76%。
2.3 DP暴露对孔石莼繁殖细胞放散的影响
图3为不同浓度DP暴露下孔石莼繁殖细胞的放散率。空白对照组与助溶剂对照组之间无显著性差异(P = 0.22),因此以空白对照作为参照。与空白对照相比,10-8mol·L-1的DP处理组的放散率略有下降,但差异不显著,而10-7和10-6mol·L-1的DP处理均使放散率显著低于空白对照(P< 0.05),分别下降了41.85%和46.26%。

图3 DP暴露对孔石莼繁殖细胞放散的影响Fig. 3 The effect of DP on the release of reproductive cells in U. pertusa
2.4 DP暴露对孔石莼繁殖细胞附着的影响
图4为不同浓度DP暴露下孔石莼的繁殖细胞的相对附着率。空白对照组与助溶剂对照组之间无显著性差异(P = 0.42)。与空白对照相比,DP处理组中附着的繁殖细胞数量均有所下降,并且在本试验暴露浓度范围内存在明显的剂量效应关系。在10-7和10-8mol·L-1处理组中,相对附着率呈现显著性降低(P < 0.05),分别仅为对照组的36.30%和14.36%。

图4 DP暴露对孔石莼繁殖细胞附着的影响Fig. 4 The effect of DP on the adhesion of reproductive cells in U. pertusa
2.5 DP暴露对孔石莼丝状幼体生长的影响
图5是不同浓度DP暴露下孔石莼丝状幼体的体长。空白对照组与助溶剂对照组之间无显著性差异(P = 0.18)。与空白对照组相比,DP暴露抑制了孔石莼丝状体的生长。在本实验中,10-8和10-7mol·L-1处理组中的丝状幼体体长分别减少了32.74%和38.98%,并呈现显著性差异(P< 0.05)。
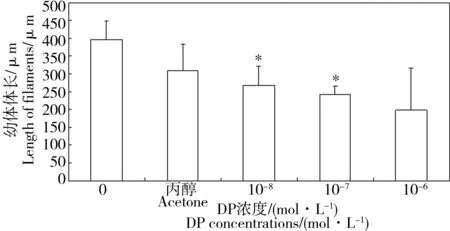
图5 DP暴露对孔石莼丝状幼体生长的影响Fig. 5 The effect of DP on the length of filaments in U. pertusa
3 讨论(Discussion)
3.1 DP对藻类的毒理学效应及其生态影响
DP作为一种广泛使用的氯代阻燃剂已在多种环境介质中被检出。在污染源(DP生产厂)附近的沉积物中,含量甚至可高达13 400 ng·g-1[13]。说明DP已成为环境中广泛存在的有机污染物。
2010年,Möller等[32]首次报道了DP在海洋环境中的含量,证明DP易于通过大气被远程传输。近年来,多篇报道结果显示,DP在我国黄海和东海海域的海水(1.8 ng·L-1)[17, 19]、沉积物(2.9~69.9 pg·g-1dw)[17]、以及海洋生物中均有分布(如牡蛎中为4.1 ng·g-1ww,孔石莼中为4.84 ng·g-1ww)[17-18],并且DP的水平分布从近岸海域向深海逐渐减少。因此,位于海陆过渡区域的潮间带以及潮下带很可能成为DP的一个重要汇聚区[19],在这一区域生存的海洋生物具有很大的DP暴露风险。但目前关于潮间带生物对DP污染的生物学响应的报道还十分缺乏。
研究表明,在水生生物中,DP暴露可影响鱼类肝脏的蛋白质表达,引起氧化损伤和细胞凋亡[26-27],并对海洋贝类产生繁殖毒性[29]。但对海洋初级生产者藻类的生物学影响还未见报道。
与陆地上的孢子植物一样,底栖海藻也表现出r-生态策略生物所普遍具备的特征:繁殖力强但早期死亡率高[33]。在底栖海藻的生活史进程中,从繁殖细胞释放到早期幼体形成是最脆弱的环境筛选期。面对高强度的环境压力(如波浪海流的冲击、对附着基质的竞争、捕食压力和环境污染等),底栖海藻需要通过提高繁殖细胞的产量和成活率来实现种群的增长,即繁殖细胞的数量决定其存活的几率[34]。因此,繁殖细胞的形成及放散率可用来考量底栖海藻的繁殖能力。但如果放散后的繁殖细胞不能在短时间内附着并形成牢固的假根(表现为附着率下降),则可能被敌害生物捕食或者死亡,从而影响种群的扩张。因此,繁殖细胞的形成、放散、附着以及早期幼体的生长是反映环境压力强度的关键指标,对成体形成至关重要[35]。
基于以上的认识及本文的研究结果,我们发现,随着DP浓度升高,孔石莼繁殖细胞的附着率和幼体生长速度均表现出明显的抑制效应。说明DP暴露对孔石莼的早期发育过程存在不利影响,并通过抑制其附着能力,造成繁殖细胞流失,影响种群数量的补充。而DP对早期幼体生长速度的抑制,可能使孔石莼在与生态位相似物种的竞争中处于下风,影响种群的扩张。在自然环境中,这种状况如果长期存在,可能引起孔石莼种群的衰退及空间生态位的释放,导致海藻群落结构的改变,甚至可能通过食物链传递改变捕食者的营养结构,引起海藻生态系统的结构和功能发生改变。因此,有关DP对海洋生物的毒理学效应及其生态影响,需要引起重视,有必要开展更深入的研究,如对DP抑制生殖细胞附着的生物学机制的探讨以及竞争物种对DP污染不同响应能力的研究等。
3.2 孔石莼繁殖特性在水生毒性测试中的应用潜力
孔石莼广泛分布,易于获得,常被用作环境指示生物。近些年来,陆续有学者以孔石莼成体作为测试对象,从生理学变化、氧化应激效应和分子水平开展了石油烃、三苯基氯化锡(TPTC)、重金属Cu和Cd的毒理学研究[31, 36-37]。与成体相比,海藻的幼体结构简单,对污染物的响应更为敏感。因此,Han等[38-40]建立了基于孔石莼繁殖细胞形成抑制的毒性测试方法,通过藻体颜色的变化确定细胞的转化程度。Girling等[41]建立了绿藻(Ulva intestinalis)和褐藻(Fucus spiralis)早期幼体生长的毒性测试方法,开展了防污涂料的毒理学测试,证明海藻幼体可以作为模式材料在化学品的毒性测试中加以应用。
如上文所述,孔石莼的繁殖历程包括繁殖细胞形成、放散、附着和早期幼体生长4个连续的关键阶段,而上述研究大多只是选择了该过程中的某一阶段而忽略了发育的连续性,尤其是忽视了“附着”这个关键的时期,本实验的结果表明经过前面几个发育进程,DP的毒性效应得到了积累,表现在“附着”阶段剂量效应关系更为明显。将“附着率”作为毒理学测试指标,更能反映DP的生态毒理效应。
与成体不同,利用早期发育阶段的孔石莼开展毒理学测试,快速大量地获得繁殖细胞是关键。在以往研究中,大多采用处于繁殖期的成熟藻体来获得繁殖细胞[42]。这种方法主要有2点不足:一是受季节限制,不能随时获得实验材料;二是获得的繁殖细胞同步性差,不适于进行毒理学测试。邵魁双等[43]曾通过调整外植体大小的方法诱导孔石莼营养细胞向繁殖细胞转化,但所采用的实验材料为孔石莼不育株,获得的繁殖细胞比率较低,难以满足大规模毒性测试需要。在此基础上,本文经过反复试验,确定了以处于营养生长期的野生孔石莼成体作为受试材料,通过外植体培养的方法,诱导藻体边缘细胞向繁殖细胞转化,可在较短时间内获得大量游动繁殖细胞,用于后期实验。该方法不受季节限制,材料易于获得和诱导,测试过程不需要复杂的仪器设备,便于推广应用。
综上所述,可知:1)低浓度DP暴露对孔石莼繁殖细胞的形成、放散和附着产生影响;2)DP暴露显著抑制了孔石莼早期幼体的生长;3)DP对孔石莼繁殖及早期发育的抑制作用在试验暴露浓度范围内具有剂量效应;4)DP对孔石莼繁殖及早期发育的干扰可能会影响其在潮间带的种群密度;5)基于孔石莼早期发育的毒性测试方法可用于DP的海洋生态风险评估。
[1] Hoh E A, Zhu L Y, Hites R A. Dechlorane Plus, a chlorinated flame retardant, in the Great Lakes [J]. Environmental Science & Technology, 2006, 40(4): 1184-1189
[2] Luo X, Wu J, Chen S, et al. Species-specific bioaccumulation of polybrominated diphenyl ethers, hexabromocyclododecan and Dechlorane Plus in biota: A review[J]. Scientia Sinica Chimica, 2013, 43(3): 291-304
[3] Wang D G, Qi H, Yang M, et al. An Asia-specific source of Dechlorane Plus: Concentration, isomer profiles, and other related compounds [J]. Environmental Science & Technology, 2010, 44(17): 6608-6613
[4] Sverko E, Tomy G T, Reiner E J, et al. Dechlorane Plus and related compounds in the environment: A review [J]. Environmental Science &Technology, 2011, 45(12): 5088-5098

[6] Qiu X, Hites R A. Dechlorane Plus and other flame retardants in tree bark from the Northeastern United States [J]. Environmental Science & Technology, 2008, 42(1): 31-36
[7] Von E A, Pijuan L, Marti R, et al. Determination of Dechlorane Plus and related compounds (Dechlorane 602, 603 and 604) in fish and vegetable oils [J]. Chemosphere, 2016, 144: 1256-1263
[8] Vorkamp K, Bossi R, Riget F F, et al. Novel brominated flame retardants and Dechlorane Plus in Greenland air and biota [J]. Environmental Pollution, 2014, 196: 284-291
[9] Fang M, Kim J C, Chang Y S, et al. Investigating Dechlorane Plus (DP) distribution and isomer specific adsorption behavior in size fractionated marine sediments [J]. Science of the Total Environment, 2014, 481(1): 114-120
[10] Zheng J, Wang J, Luo X J, et al. Dechlorane Plus in human hair from an e-waste recycling area in South China: Comparison with dust [J]. Environmental Science & Technology, 2010, 44(24): 9298-9303
[11] Wang B, Lino F, Huang J, et al. Dechlorane Plus pollution and inventory in soil of Huai'an City, China [J]. Chemosphere, 2010, 80(11): 1285-1290
[12] Yu Z, Lu S, Gao S, et al. Levels and isomer profiles of Dechlorane Plus in the surface soils from e-waste recycling areas and industrial areas in South China [J]. Environmental Pollution, 2010, 158(9): 2920-2925
[13] Tao W, Zhou Z, Shen L, et al. Determination of Dechlorane flame retardants in soil and fish at Guiyu, an electronic waste recycling site in South China [J]. Environmental Pollution, 2015, 206(1): 361-368
[14] Sun H, Li Y,Wang P, et al. Atmospheric levels and distribution of Dechlorane Plus in an e-waste dismantling region of East China [J]. Science China-Chemistry, 2016(1): 1-6
[15] 张鸿雁, 李硕, 陈胜文. 得克隆生物累积及毒性效应[J]. 上海第二工业大学学报, 2015, 32(4): 290-297
Zhang H Y, Li S, Chen S W. Accumulation in biota and toxicological effect of Dechlorane Plus[J]. Journal of Shanghai Second Polytechnic University, 2015, 32(4): 290-297 (in Chinese)
[16] Zhao Z, Zhong G, Möller A, et al. Levels and distribution of Dechlorane Plus in coastal sediments of the Yellow Sea, North China [J]. Chemosphere, 2011, 83(7): 984-990
[17] Jia H L, Sun Y Q, Liu X J, et al. Concentration and bioaccumulation of Dechlorane compounds in coastal environment of northern China [J]. Environmental Science & Technology, 2011, 45(7): 2613-2618
[18] 巩宁, 邵魁双, 贾宏亮, 等. 氯代阻燃剂得克隆在大连黄海海域潮间带不同环境介质中的含量及生物富集[J].海洋环境科学, 2013, 32(5): 674-678
Gong N, Shao K S, Jia H L, et al. Concentration and bioaccumulation of chlorinated flame retardant Dechlorane Plus in intertidal zone of Yellow Sea,Dalian [J]. Marine Environmental Science, 2013, 32(5): 674-678 (in Chinese)
[19] Wang G, Peng J, Hao T, et al. Distribution and region-specific sources of Dechlorane Plus in marine sediments from the coastal East China Sea [J]. Science of the Total Environment, 2016, 573: 389-396
[20] Brock W J, Schroeder R E, McKnight C A, et al. Oral repeat dose and reproductive toxicity of the chlorinated flame retardant Dechlorane Plus [J]. International Journal of Toxicology, 2010, 29(6): 582-593
[21] Crump D,Chiu S,Gauthier L T, et al. The effects of Dechlorane Plus on toxicity and mRNA expression in chicken embryos: A comparison of in vitro and in ovo approaches [J]. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 2011, 154(2): 129-134
[22] Wu B, Liu S,Guo X, et al. Responses of mouse liver to Dechlorane Plus exposure by integrative transcriptomic and metabonomic studies [J]. Environmental Science & Technology, 2012, 46(19): 10758-10764
[23] Yang Y, Ji F, Cui Y, et al. Ecotoxicological effects of earthworm following long-term Dechlorane Plus exposure [J]. Chemosphere, 2015, 144: 2476-2481
[24] Zhang L, Ji F, Li M, et al. Short-term effects of Dechlorane Plus on the earthworm Eisenia fetida determined by a systems biology approach [J]. Journal of Hazardous Materials, 2014, 273C(6): 239-246
[25] Dou J, Jin Y, Li Y, et al. Potential genotoxicity and risk assessment of a chlorinated flame retardant, Dechlorane Plus [J]. Chemosphere, 2015, 135: 462-466
[26] Kang H, Moon H B, Choi K. Toxicological responses following short-term exposure through gavage feeding or water-borne exposure to Dechlorane Plus in zebrafish (Danio rerio) [J]. Chemosphere, 2015, 146: 226-232
[27] Liang X, Li W, Martyniuk C J, et al. Effects of Dechlorane Plus on the hepatic proteome of juvenile Chinese sturgeon (Acipenser sinensis) [J]. Aquatic Toxicology, 2014, 148(3): 83-91
[28] Occidental Chemical Corporation (OxyChem). OxyChem expands fire retardant plant [J].Additives for Polymers, 1996(3): 8
[29] Barón E, Dissanayake A,Vilà-Cano J, et al. Evaluation of the genotoxic and physiological effects of decabromodiphenyl ether (BDE-209) and Dechlorane Plus (DP) flame retardants in marine mussels (Mytilus galloprovincialis) [J]. Environmental Science & Technology, 2016, 50(5):2700-2708
[30] 曾呈奎, 张德瑞, 等. 中国经济海藻志[M]. 北京: 科学出版社, 1962: 55-56
[31] 王珊, 刘瑀, 张松. 石油烃对孔石莼生长及光合作用的影响[J]. 大连海洋大学学报, 2011, 26(5): 432-436
Wang S , Liu Y, Zhang S. Effects of petroleum hydrocarbon on growth and photosynthesis in sea weed macroalga Ulva pertusa [J]. Journal of Dalian Ocean University, 2011, 26(5): 432-436 (in Chinese)
[32] Möller A, Xie Z, Sturm R, et al. Large-scale distribution of Dechlorane Plus in air and seawater from the Arctic to Antarctica [J]. Environmental Science & Technology, 2010, 44(23): 8977-8982
[33] MacArthur R H, Wilson E O. The Theory of Island Biogeography [M]. Princeton, N.J.: Princeton University Press, 1967: 152-153
[34] Janzen D H. Why do bamboos wait so long to flower? [J]. Annual Review of Ecology & Systematics, 1976, 7(7): 347-391
[35] Vadas Sr R L, Johnson S, Norton T A. Recruitment and mortality of early post-settlement stages of benthic algae [J]. European Journal of Phycology, 1992, 27(3): 331-351
[36] 李钧, 于仁诚, 李正炎, 等. 三苯基氯化锡(TPTC)对孔石莼光合作用及生长的影响[J]. 海洋与湖沼, 2000, 31(4): 404-407
Li J, Yu R C, Li Z Y, et al. Effects of TPTC on photosynthesis and growth of macroalgae, Ulva pertusa [J]. Oceanologia et Limnologia Sinica, 2000, 31(4): 404-407 (in Chinese)
[37] Babu M Y, Palanikumar L, Nagarani N, et al. Cadmium and copper toxicity in three marine macroalgae: Evaluation of the biochemical responses and DNA damage [J]. Environmental Science and Pollution Research, 2014, 21(16): 9604-9616
[38] Han Y S, Brown M T, Park G S. Evaluating aquatic toxicity by visual inspection of thallus color in the green macroalga Ulva: Testing a novel bioassay [J]. Environmental Science & Technology, 2007, 41(10): 3667-3671
[39] Han Tand Choi G W. A novel marine algal toxicity bioassay based on sporulation inhibition in the green macroalga Ulva pertusa (Chlorophyta) [J]. Aquatic Toxicology, 2005, 75(3): 202-212
[40] Han T, Han Y S, Chin Y P, et al. Spore release by the green alga Ulva: A quantitative assay to evaluate aquatic toxicants [J]. Environmental Pollution, 2008, 153(3): 699-705
[41] Girling J A, Thomas K V, Brooks S J, et al. A macroalgal germling bioassay to assess biocide concentrations in marine waters [J]. Marine Pollution Bulletin, 2014, 91(1): 82-86
[42] 嵇嘉民, 马家海, 李宇航, 等. 孔石莼的同形世代交替[J]. 渔业现代化, 2008, 35(2): 32-35
Ji J M, Ma J H, Li Y H, et al. Isomorphic alternation of generations of Ulva pertusa [J]. Fishery Modernization, 2008, 35(2): 32-35 (in Chinese)
[43] 邵魁双, 王金霞, 周百成. 孔石莼外植体再生及发育途径的研究[J]. 海洋科学, 2004, 28(6): 46-50
Shao K S, Wang J X, Zhou B C. Study on the regeneration and development pattern of explants of Ulva pertusa Kjellm (Ulvales,Chlorophyta)[J]. Marine Sciences, 2004, 28(6): 46-50 (in Chinese)
◆
EffectsofDechloranePlusonReproductionandEarlyDevelopmentofUlvapertusa
Gong Ning1,2,*, Shao Kuishuang3, Zhang Yukun1,2, Jing Deqing1,2, Sun Yeqing1,2,#
1. School of Environmental Science and Engineering, Dalian Maritime University, Dalian 116026, China2. Institute of Environmental Systems Biology, Dalian Maritime University, Dalian 116026, China3. National Marine Environmental Monitoring Center, Dalian 116023, China
10.7524/AJE.1673-5897.20170114013
2017-01-14录用日期2017-03-21
1673-5897(2017)3-556-08
X171.5
A
巩宁(1975-),女,海洋生物学博士,副教授,主要研究方向为水生生态毒理学。
通讯作者简介:孙野青(1959-),女,教授,主要研究方向为有害环境的系统生物学。
国家重点研发计划资助项目“浒苔着生机理与防控技术”(2016YFC1402104);国家自然科学基金(No. 41301560)
巩宁(1975-),女,海洋生物学博士,副教授,研究方向为水生生态毒理学,E-mail: cospar06@dlmu.edu.cn
*通讯作者(Corresponding author), E-mail: cospar06@dlmu.edu.cn
#共同通讯作者(Co-corresponding author), E-mail: yqsun@dlmu.edu.cn
巩宁, 邵魁双, 张钰昆, 等. 氯代阻燃剂得克隆对孔石莼(Ulva pertusa)繁殖及早期发育的影响[J]. 生态毒理学报,2017, 12(3): 556-563
Gong N, Shao K S, Zhang Y K, et al. Effects of Dechlorane Plus on reproduction and early development of Ulva pertusa [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 556-563 (in Chinese)
