人诱导多能干细胞用于亨廷顿病大鼠模型的移植治疗
2017-10-13刘智明杜谢琴余小祥
陈 波 刘智明 杜谢琴 余小祥
(武汉市第三医院,湖北 武汉 430000)
人诱导多能干细胞用于亨廷顿病大鼠模型的移植治疗
陈 波 刘智明1杜谢琴 余小祥
(武汉市第三医院,湖北 武汉 430000)
目的探讨用于亨廷顿病(HD)治疗提供的药物筛选模型。方法SD大鼠45只,分为正常对照组、毁损组、移植组三组,每组15只。正常组不予以处理,其余两组均用奎宁酸(QA)脑内注射,移植组在QA毁损模型建立后进行人诱导多能干细胞(hiPSC)移植。hiPSC在大鼠脑内存活了7 w,通过阿扑吗啡诱导旋转实验等行为学实验,观察各组大鼠运动功能情况;通过高十字迷宫、新环境抑制进食实验,观察各组焦虑类似的行为变化。结果与QA组相对比,观察到hiPSC移植组大鼠运动功能得到改善,大鼠焦虑类似的行为明显减少。hiPSC移植组大鼠的活动减少。结论hiPSC移植可以有效的改善HD大鼠的行为缺陷,hiPSC在治疗神经退行性疾病特别是HD,是一种理想的多潜能干细胞来源。
诱导多能干细胞;亨廷顿病;细胞移植;运动和非运动功能检测
亨廷顿病(HD)是一种以纹状体和大脑皮质中型棘状神经元大量丢失为特点的疾病,皮层神经元的丢失、变性会导致HD大鼠模型出现认知和情绪方面的改变〔1〕。尽管HD的致病基因和相关蛋白都已清楚,但确切的致病机制仍不清楚。研究表明,将兴奋性毒性物质奎宁酸(QA)注射至纹状体内可以模拟HD病理改变,进行移植治疗的研究〔2,3〕。随着细胞治疗技术的发展,细胞移植被认为是HD治疗最有前景的方法,尤其是人诱导多能干细胞(hiPSC),通过将外源性转录因子(Oct4,Sox2,Klf4和c-Myc)〔4〕导入人或动物体细胞诱导其逆分化而形成多能干细胞(iPSC),具有多能分化潜能及自我更新能力。有研究〔5〕利用帕金森病(PD)患者自体来源的iPSC分化为多巴胺能神经元后移植至PD大鼠模型中,发现了明显的行为学改善。Jeon等〔6〕使用HD患者自体来源的iPSC分化而成的神经前体细胞移植治疗HD大鼠,获得了明显的行为学改善,并在宿主靶区探测到分化形成的γ-氨基丁酸(GABA)能神经元。本研究移植iPSC至QA毁损的HD模型大鼠,观察其对大鼠运动和非运动功能的改善作用。
1 材料和方法
1.1实验动物 所有的动物测试和训练过程符合医学伦理委员会批准,随机分笼,每笼5只大鼠,21℃、65%的湿度饲养,昼夜节律为12 h,不限食水。分为三组,对照组15只不予以任何处理,QA毁损组:QA毁损的HD大鼠模型,hiPSC移植组:在建模成功后移植hiPSC。
1.2方法
1.2.1hiPSC用含标记基因病毒的转导 用重组慢病毒转导hiPSC,将第3代hiPSC以3×106个接种至T75培养瓶中,2 d后开始转导,转导的效率通过荧光显微镜检测GFP和JRed基因的表达,转导72 h后用含有嘌呤霉素的培养基培养。
1.2.2QA注射毁损纹状体、诱导iPSC移植 大鼠腹腔麻醉后,除对照组外单次注射QA至单侧纹状体,7 d后将大鼠随机分为两组,一组移植hiPSC至纹状体毁损侧,另一组在毁损侧纹状体注射碱性磷酸盐。
1.2.3运动功能测试
1.2.3.1阿扑吗啡诱导的旋转实验 所有的大鼠按照1.0 mg/kg注射阿扑吗啡,放置在有机玻璃圆筒中,每60 min记录一次动物的旋转运动,在移植后2、4、6 w分别测试一次。计算损毁侧同侧和对侧身体旋转次数:毁损同侧的净旋转百分比=同侧旋转次数-对侧旋转次数/总旋转次数×100%。
1.2.3.2悬挂实验 大鼠咬住粗0.5 cm线,线距离地面高度为30 cm,记录在60 s内跌落次数。每周测试3 d,每次3个实验,取平均成绩。在移植后1~6 w进行最后的运动测试结果。
1.2.4非运动测试
1.2.4.1高架十字迷宫实验 测试前将每只大鼠放置在迷宫中适应5 min,实验观察员在距装置2 m处观察大鼠的行为。在预实验完成后,将大鼠置于装置的中间面对开放的臂,测试焦虑相关的行为,包括在开放和封闭的臂中所用总时间,在开放臂中花费更长时间预示焦虑程度低,测量总运动距离评价自发活动水平。
1.2.4.2新环境进食抑制实验 将糖丸放置在新环境的中央,记录每只大鼠离开角落的等待时间和达到并开始进食糖丸的时间,记录喂食的情况,再将大鼠放回至原笼子中,记录在5、15、30 min时大鼠摄入食物量,作为衡量摄食的动力。
1.2.5组织学分析 向腹腔内注射胺碘酮(100 mg/kg)和盐酸赛拉嗪(5 mg/kg),然后固定脑组织并称重,用10%甲醛固定7 d后切除后脑,将前脑石蜡包埋后在显微镜下薄片切片机下连续切片,采用苏木素-曙红和0.5%紫罗兰进行染色,盖上玻片,在10倍的普通显微镜和荧光显微镜下观察。
1.3统计学分析 采用多重测量方差分析,所有的多重比较均采用图基(tukey)事后比较法进行分析。
2 结 果
2.1阿扑吗啡诱导旋转实验行为学分析 hiPSC移植组移植后2 w旋转运动减少。只有QA毁损组随着时间表现出旋转运动次数不断增加,hiPSC移植组表现出减少的趋势,在所有的移植后阶段均有统计学意义。见图1。
2.2悬挂测试 在移植后6 w,QA毁损组和hiPSC移植组从线上跌落的潜伏期时间表现出预期的效果。与hiPSC移植组相比,QA毁损组在线上悬挂的时间更短(P<0.001)。见图2。
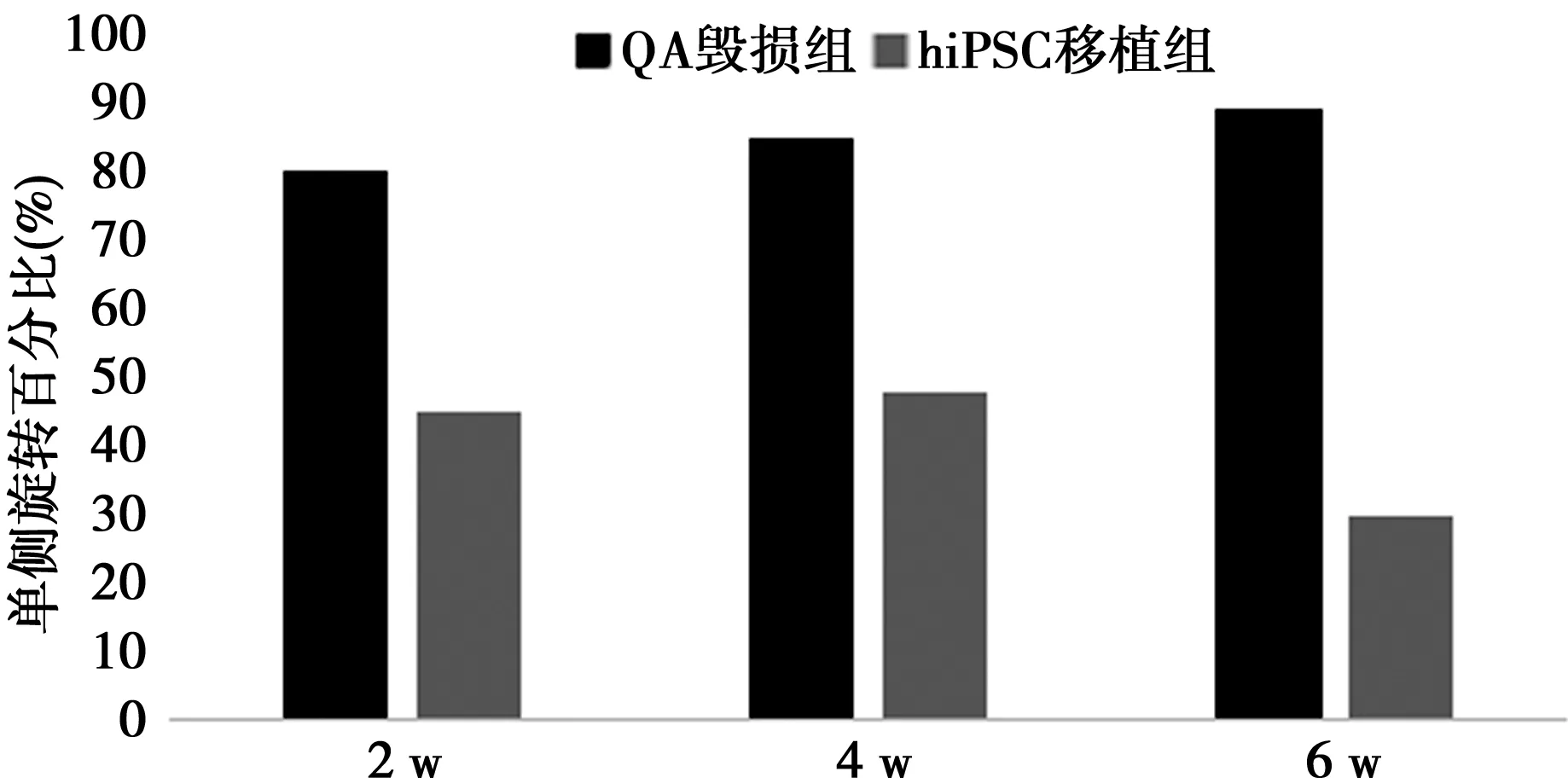
图1 阿扑吗啡诱导旋转实验行为学分析

图2 悬挂测试
2.3高架十字迷宫检测大鼠的焦虑水平 在移植后3 w和QA毁损组相比,hiPSC移植组在封闭臂中花的时间更短。hiPSC移植组和对照组在焦虑程度上没有区别。见图3。
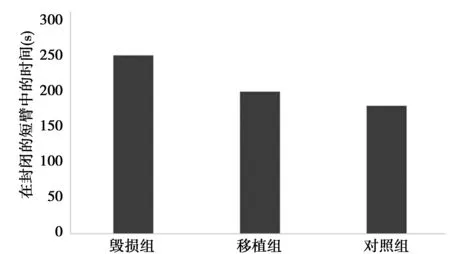
图3 三组大鼠在封闭的短臂中的时间比较
2.4新环境进食抑制实验中的焦虑类似的表现 QA毁损组表现出明显的焦虑类似的表现。和QA毁损组大鼠相比,在新环境进食移植实验中,hiPSC移植组大鼠在旷场实验的仪器中进食等待时间〔(310.8±23.7)s〕明显短于QA毁损组〔(438.7±25.8)s〕(P<0.01)。
3 讨 论
HD可导致运动功能和精神方面的异常,目前研究主要通过动物模型探索改善行为的神经学方面机制,这些机制包括神经元的分化和替代治疗、生长因子的释放等,且都可能与损伤修复的过程有关。根据之前的研究发现,hiPSC移植至HD大鼠模型中可能缓解运动功能和认知功能的缺陷〔6〕,且hiPSC相对其他细胞移植手段,可以通过采用患者自体来源的细胞,重编程为hiPSC,避免移植后的免疫排斥反应,是一种极好的细胞来源〔7〕。本研究结果表明,在QA毁损组中,大鼠的功能缺失会随着时间越来越严重,而将hiPSC移植至QA毁损的HD模型中没有出现免疫排斥反应,由纹状体退化导致的运动和探索功能得到了显著的改善,运动功能的损害和情绪的缺陷很少。尽管可以观察到探索的形式如站立、排泄的次数、恐惧的次数较少等改变,QA毁损的大鼠运动基线水平没有限制大鼠的行为学改变,且相对于hiPSC移植组大鼠来说运动更加频繁。在探索新环境中,大鼠通过测试站立和排泄次数提示情绪觉醒增多了,随着过程的不断熟练而情绪状态觉醒减少。在移植hiPSC至QA毁损的大鼠后6 w,重建了情绪状态的水平。
尽管hiPSC的移植治疗呈现出极有前景的发展趋势,但是在临床上利用细胞替代治疗HD正处于审查的阶段,虽然理论上可行,细胞替代治疗的局限性仍备受关注〔8〕,目前面临的难题还有移植细胞的存活、理论的可行性和异体移植后的排斥反应等〔9〕。总之,向HD大鼠模型纹状体内移植hiPSC可能缓解HD的运动和非运动缺陷,作为理想的药物筛选模型及移植治疗干预手段的运用和推广有待更深层次的研究。
1Picconi B,Passino E,Sgobio C,etal.Plastic and behavioral abnormalities in experimental Huntington′s disease:a crucial role for cholinergic interneurons〔J〕.Neurobiol Dis,2006;22(1):143-52.
2Freeman TB,Hauser RA,Sanberg PR,etal.Neural transplantation for the treatment of Huntington′s disease〔J〕.Prog Brain Res,2000;127(3):405-11.
3Leavitt BR,van Raamsdonk JM,Shehadeh J,etal.Wild-type Huntingtin protects neurons from excitotoxicity〔J〕.J Neurochem,2006;96(4):1121-9.
4Takahashi K,Tanabe K,Ohnuki M,etal.Induction of pluripotent stem cells from adult human fibroblasts by defined factors〔J〕.Cell,2007;131(5):861-72.
5Novais A,Ferreira AC,Marques F,etal.Neudesin is involved in anxiety behavior:structural and neurochemical correlates〔J〕.Front Behav Neurosci,2013;7(1):119.
6Jeon I,Choi C,Lee N,etal.In vivo roles of a patient-derived induced pluripotent stem cell line(HD72-iPSC)in the YAC128 model of huntington′s diseaseInt〔J〕.J Stem Cells,2014;7(1):43-7.
7Haddad-Mashadrizeh A,Bahrami AR,Matin MM,etal.Evidence for crossing the blood barrier of adult rat brain by human adipose-derived mesenchymal stromal cells during a 6-month period of post-transplantation〔J〕.Cytotherapy,2013;15(8):951-60.
8Li Y,Nguyen HV,Tsang SH.Skin biopsy and patient-specific stem cell lines〔J〕.Methods Mol Biol,2016;1353(1):77-88.
9Edalatmanesh MA,Bahrami AR,Hosseini E,etal.Bone marrow derived mesenchymal stem cell transplantation in cerebellar degeneration:a behavioral study〔J〕.Behav Brain Res,2011;225(1):63-70.
〔2016-12-03修回〕
(编辑 郭 菁)
R39
A
1005-9202(2017)19-4758-03;
10.3969/j.issn.1005-9202.2017.19.029
湖北省自然科学基金资助项目(面上基金)(No.2014CFB450);武汉市卫生计生委临床医学科研资助项目(No.wx15D21)
1 武汉市武昌医院
刘智明(1968-),男,主任医师,博士,主要从事神经外科方面研究。
陈 波(1979-),男,主治医师,主要从事神经外科方面研究。
