小鼠主动脉缩窄术后心肌水肿与水通道蛋白表达的相关性
2017-10-13吕洪臻黄素琴韩扣兰
黄 诚 吕洪臻 黄素琴 刘 颖 高 敏 韩扣兰
(盐城卫生职业技术学院,江苏 盐城 224005)
小鼠主动脉缩窄术后心肌水肿与水通道蛋白表达的相关性
黄 诚 吕洪臻 黄素琴 刘 颖 高 敏 韩扣兰
(盐城卫生职业技术学院,江苏 盐城 224005)
目的观察小鼠心肌组织水通道蛋白(AQP)1的表达对心肌水肿的影响。方法采用主动脉缩窄法(TAC)建立小鼠心肌肥厚和水肿模型。实验分为四组:①假手术组(Sham组);②Sham+氯化汞(HgCl2)组,假手术后心肌注射0.3 mmol/L HgCl250 μl ;③手术组(TAC组);④TAC+ HgCl2组,TAC术后心肌注射0.3 mmol/L HgCl250 μl。每组10只。术后2 w心脏超声检测各组小鼠心功能。计算各组小鼠心脏重量/体重比和心肌组织含水量。采用RT-PCR法检测各组小鼠心肌组织中AQP1 mRNA表达。采用Western印迹法检测各组小鼠心肌组织AQP1蛋白表达。结果TAC术后2 w,小鼠心肌组织发生明显肥厚和水肿。同时,TAC小鼠心肌组织中AQP1 mRNA和蛋白的表达比Sham组显著升高。心肌注射AQP1功能阻滞剂HgCl2可以降低TAC小鼠心脏重量/体重比和心肌组织含水量,改善TAC小鼠心功能。结论心肌组织中AQP1表达增加与TAC术后心肌水肿密切相关,阻滞AQP1功能可减轻心肌水肿,并改善心功能。
心肌肥厚;心肌水肿;水通道蛋白1;氯化汞
病理性心肌肥厚被公认为心血管疾病的独立危险因素〔1〕。心肌细胞水肿是心肌肥厚发展过程中最常见的病理生理改变,长期慢性水肿会进一步加重心脏功能紊乱〔2〕。因此,减轻心肌水肿对抑制心肌肥厚的进一步发生发展及改善心脏功能具有重要的临床意义。水通道蛋白(AQP)1广泛表达于多种细胞类型,包括内皮细胞和心肌细胞〔3,4〕。在心肌组织中,AQP1主要表达于毛细血管内皮细胞膜及心肌细胞膜〔4,5〕。研究表明AQP1的表达与体外循环后心肌水肿发生密切相关〔6〕。但是,主动脉缩窄(TAC)导致的心肌水肿与AQP1的关联尚未证实,另外,抑制AQP1的功能是否可以抑制心肌水肿和改善心脏功能也需要进一步的研究。本研究探讨TAC术后AQP1的表达与心肌水肿的相关性。
1 材料与方法
1.1实验材料 氯化汞(HgCl2,Sigma公司),AQP1(Santa Cruz Biotechnology)。
1.2动物模型建立和分组 雄性C57BL/6小鼠40只,清洁级,体重20~25 g,8~10周龄,由南京医科大学动物实验中心提供〔合格证号:SCXK(苏) 2002-0031〕。采用TAC法制备动物模型。4%戊巴比妥钠溶液腹腔注射麻醉,仰卧位固定小鼠,胸骨正中切口,分层打开纵隔腔,拨开胸腺,在心底部钝性分离主动脉弓部,将钝性27-G注射针头(外径0.4 mm)平行置于主动脉外壁,在头臂干和左颈总动脉之间,用7-0手术丝线将针头和主动脉弓一齐扎紧后将针头移去,心肌注射0.3 mmol/L HgCl250 μl,关胸,术毕。假手术组(Sham组)采用相同处理,将7-0丝线置于主动脉弓相同位置不做结扎。术后小鼠常规喂养,于术后2 w心脏超声检测心功能后处死小鼠,取出心脏,计算心脏重量/体重比(HW/BW),心脏标本置于液氮速冻,然后保存于-80℃冰箱待用。实验分为四组:①Sham组;②Sham+HgCl2组,假手术后心肌注射HgCl2;③手术组(TAC组);④TAC+HgCl2组,TAC术后心肌注射HgCl2。每组10只。
1.3心脏超声检测 术后2 w,小鼠经气体麻醉后连接小动物超声检测设备,检测心功能,取左室短轴观、胸骨旁左室长轴观,在二维影像指导下以M型超声模式测量室间隔厚度(IVS),左室后壁厚度(LVPW),左室舒张末期内径(LVEDD)和左室收缩末期内径(LVESD),计算左室射血分数(LVEF)和左室缩短分数(LVFS)。
1.4心肌组织含水量测定(干湿法测定) 每组取4只小鼠,分别称心脏湿重,置80℃烤箱内48 h后称干重,按以下公式计算心肌组织含水量:心肌组织含水量(%)=(湿重-干重)/湿重×100%。
1.5RNA提取和real-time RT-PCR 心肌组织中的总RNA用Trizol试剂提取。cDNA合成采用Takara公司PrimeScriptTM RT reagent 试剂盒说明书步骤进行,根据Takara公司SYBR®Premix Ex TaqTMⅡ试剂盒说明书步骤建立real-time PCR反应体系,在Eppendorf 公司Mastercycler ep realplex荧光定量PCR仪上检测特异底物扩增情况。引物序列如下:AQP1正义链5′-TGCGTTCTGGCCACCACTGAC-3′,反义链5′-GATGTCGTCAGCATCCAGGTC-3′。 GAPDH正义链5′-CTGGAGAAACCTGCCAAGTA-3′,反义链5′-TGTTGCTGTAGCCGTATTCA-3′。相对基因表达采用2-△△CT法计算。
1.6Western印迹检测 提取各组心肌组织总蛋白,进行蛋白定量后,样品按比例加入5×SDS凝胶上样缓冲液溶解,煮沸5 min。以20 μg蛋白进行上样,电泳。300 mA恒流90 min将蛋白转至PVDF膜;封闭液(1 g脱脂奶粉溶于20 ml PBST溶液)封闭1 h;一抗孵育(抗AQP1抗体1∶200;抗GAPDH抗体1∶5 000)4℃过夜。TBST清洗3次,每次10 min;二抗孵育(1∶2 000),室温1 h;TBST清洗3次,每次10 min;ECL发光液发光,Bio-Rad公司凝胶成像系统曝光、摄影、分析。
1.7统计学方法 采用SPSS18.0统计软件进行t检验。
2 结 果
2.1各组心功能比较 TAC术后2 w IVSD和LVPWD较Sham组明显增厚,LVEDD明显下降(P<0.01),表明TAC术后2 w心脏出现向心性肥厚,同时LVEF和LVFS较Sham组明显下降(P<0.01),但未降低到心力衰竭水平(LVEF<50%),表明TAC术后2 w心功能处于代偿期。Sham组小鼠心肌注射HgCl2对心功能无明显影响。另外,TAC组小鼠心肌注射HgCl2对TAC诱导的心肌肥厚无明显影响,但能提高TAC小鼠LVEF和LVFS(P<0.05),改善TAC小鼠心功能。见图1,表1。
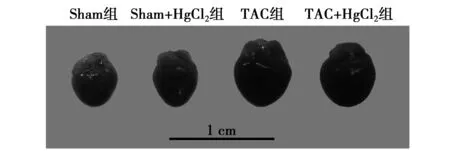
图1 各组心脏大体观察
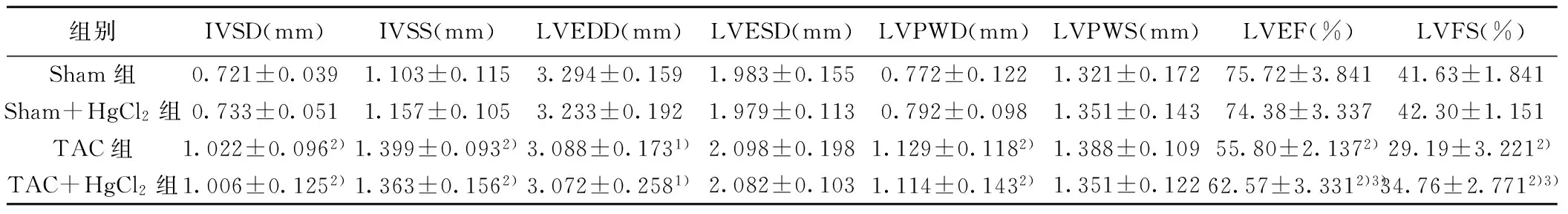
组别IVSD(mm)IVSS(mm)LVEDD(mm)LVESD(mm)LVPWD(mm)LVPWS(mm)LVEF(%)LVFS(%)Sham组0.721±0.0391.103±0.1153.294±0.1591.983±0.1550.772±0.1221.321±0.17275.72±3.84141.63±1.841Sham+HgCl2组0.733±0.0511.157±0.1053.233±0.1921.979±0.1130.792±0.0981.351±0.14374.38±3.33742.30±1.151TAC组1.022±0.0962)1.399±0.0932)3.088±0.1731)2.098±0.1981.129±0.1182)1.388±0.10955.80±2.1372)29.19±3.2212)TAC+HgCl2组1.006±0.1252)1.363±0.1562)3.072±0.2581)2.082±0.1031.114±0.1432)1.351±0.12262.57±3.3312)3)34.76±2.7712)3)
与Sham组比较1)P<0.05,2)P<0.01;与TAC组比较:3)P<0.05,下表同
2.2各组HW/BW及心肌含水量比较 TAC组术后2 w HW/BW较Sham组显著上升(P<0.01),TAC小鼠心肌注射HgCl2能在一定程度上降低HW/BW。但是,Sham组小鼠心肌注射HgCl2后HW/BW无明显差异(P>0.05)。同时,TAC术后2 w小鼠心肌含水量比Sham组显著增加,心肌注射HgCl2能在一定程度上降低TAC小鼠心肌含水量。但是,Sham组小鼠心肌注射HgCl2后心肌含水量并无明显差异。见表2。
2.3各组心肌AQP1 mRNA和蛋白表达比较 见图2,表3。
表2 各组小鼠HB/BW和心肌组织含水量

图2 各组心肌AQP1蛋白表达比较

组别AQP1mRNAAQP1蛋白Sham组1.000±0.0000.219±0.027Sham+HgCl2组1.027±0.0650.228±0.024TAC组1.700±0.2001)0.424±0.0141)TAC+HgCl2组1.667±0.1151)0.425±0.0131)
TAC术后2 w小鼠心肌AQP1 mRNA和蛋白表达均比Sham组显著增加(P<0.05),但是,心肌注射HgCl2对TAC诱导的AQP1 mRNA和蛋白表达增加无明显影响。另外,心肌注射HgCl2对Sham组小鼠心肌AQP1 mRNA和蛋白表达也无明显影响(P>0.05)。
3 讨 论
研究表明与心肌肥厚相关的信号转导通路主要集中在丝裂原活化蛋白激酶(MAPK)信号通路,Ca2+及其依赖的信号通路和磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/AKT)信号通路,并且相互关联〔7~9〕。然而,心肌细胞水肿是心肌肥厚发展过程中最常见的病理生理改变,长期慢性水肿会进一步加重心脏功能失调〔2〕。AQPs是一种跨膜通道蛋白,可以促进水分子的快速跨膜转运,维持细胞内外渗透压力的平衡。在人类和小鼠的心肌组织中可以检测到AQP-1,-4,-7和-11 mRNA表达,而相应的蛋白水平只检测到AQP1和AQP4的表达,Western印迹结果显示在人类、大鼠及小鼠心肌组织中均有AQP1蛋白的表达〔10〕。在心肌组织中,AQP1主要表达于毛细血管内皮细胞膜以及心肌细胞膜〔4,5〕。应用AQPs基因敲除小鼠模型研究AQPs在心肌细胞水通透性中的作用,结果显示AQP1敲除小鼠的心肌细胞水通透性下降,而不是AQP4敲除,说明在心肌细胞水通透性中起主要作用的是AQP1〔7〕。本研究说明小鼠TAC术后心肌水肿的发生与AQP1表达增高密切相关。虽然已有研究证实AQP1的高表达与心肌水肿的发生发展密切相关〔11〕,但是,AQP1是否可以作为心肌水肿的治疗靶点尚待研究。综上所述,心肌组织中AQP1表达增加与TAC后心肌水肿密切相关,阻滞AQP1功能可减轻心肌水肿,并改善心功能。因此,针对AQP1的靶向治疗也许可以成为临床上治疗心肌水肿,抑制心肌肥厚进一步发展的新措施。
1Morgan HE,Baker KM.Cardiac hypertrophy mechanical neural and endocrine dependence〔J〕.Circulation,1991;83(1):13-25.
2Laine GA,Allen SJ.Left ventricular myocardial edema.Lymph flow,interstitial fibrosis and cardiac function〔J〕.Circ Res,1991;68(6):1713-21.
3Shanahan CM,Connolly DL,Tyson KL,etal.Aquaporin-1 is expressed by vascular smooth muscle cells and mediates rapid water transport across vascular cell membranes〔J〕.J Vasc Res,1999;36(5):353-62.
4Au CG,Cooper ST,Lo HP,etal.Expression of aquaporin 1 in human cardiac and skeletal muscle〔J〕.J Mol Cell Cardiol,2004;36(5):655-62.
5Bondy C,Chin E,Smith BL,etal.Developmental gene expression and tissue distribution of the CHIP28 water-channel protein〔J〕.Proc Natl Acad Sci U S A,1993;90(10):4500-4.
6Ding FB,Yan YM,Huang JB,etal.The involvement of AQP1 in heart oedema induced by global myocardial ischemia〔J〕.Cell Biochem Funct,2013;31(1):60-4.
7Pellieux C,Sautllier T,Anbert JF,etal.Angiotensin Ⅱ induced cardiac hypertrophy in associated with different mitogen-activated protein kinase activation normotensive and hypertension mice〔J〕.J Hypertens,2000;18(9):1307-17.
8Fiedler B,Lohmann SM,Smolenski A,etal.Inhibition of calcineurin-NFAT hypertrophy signaling by cGMP-dependent protein kinase type I in cardiomyocytes〔J〕.Proc Natl Acad Sci USA,2002;99(17):11363-8.
9Brazil DP,Yang ZZ,Hemmings BA.Advances in protein kinase B signaling:AKT on multiple fronts〔J〕.Trends Biochem Sci,2004;29:233-42.
10Butler TL,Au CG,Yang B,etal.Cardiac aquaporin expression in humans,rats and mice〔J〕.Am J Physiol Heart Circ Physiol,2006;291:705-13.
11Egan JR,Butler TL,Au CG,etal.Myocardial water handling and the role of aquaporins〔J〕.Biochim Biophys Acta,2006;1758(8):1043-52.
〔2016-07-27修回〕
(编辑 苑云杰/曹梦园)
R542.2
A
1005-9202(2017)19-4754-03;
10.3969/j.issn.1005-9202.2017.19.027
盐城市卫生局科技计划项目(No.YK2012040)
韩扣兰(1968-),女,硕士,教授,主要从事心力衰竭、呼吸衰竭机制研究。
黄 诚(1983-),男,讲师,主治医师,主要从事心力衰竭机制研究。
