高效液相色谱法测定血清卵磷脂胆固醇酰基转移酶活性的建立*
2017-10-12王玉王思明曾洁杨睿悦李红霞董军陈文祥
王玉,王思明,曾洁,3,杨睿悦,李红霞,董军,,陈文祥,3
(1.北京大学第五临床医学院(北京医院),北京 100730;2.北京医院 国家老年医学中心,北京 100730;3.卫生部临床检验中心,北京 100730)
·临床检验技术研究·
高效液相色谱法测定血清卵磷脂胆固醇酰基转移酶活性的建立*
王玉1,王思明2,曾洁2,3,杨睿悦2,李红霞2,董军1,2,陈文祥2,3
(1.北京大学第五临床医学院(北京医院),北京 100730;2.北京医院 国家老年医学中心,北京 100730;3.卫生部临床检验中心,北京 100730)
目的建立高效液相色谱法(HPLC)测定血清卵磷脂胆固醇酰基转移酶(LCAT)活性的方法,观察LCAT活性与动脉粥样硬化性心血管病(CVD)传统危险因素的关系。方法选用7-脱氢胆固醇和1,2-二癸酰基甘油-3-磷酸(10∶0 PC)作为LCAT的反应底物,加入LCAT激活肽(LAP642),制备脂质体;在冰水浴中将500 μL脂质体与10 μL血清混合,37 ℃温育1 h;提取脂质,HPLC测定反应后7-脱氢胆固醇及其酯之比,计算LCAT活性。用所建方法测定120例健康志愿者血清的LCAT活性,分析其与CVD危险因素的关系。结果7-脱氢胆固醇、10∶0 PC(物质的量的比为1∶8.5)与LAP642组成的脂质体制备简单、性质稳定。当温育时间0~8 h、血清量0~20 μL时,LCAT活性与变量线性相关;平均批内不精密度(CV)和总CV分别小于1.76%、3.11%。方法比对结果显示,所建方法与ELISA测定的LCAT质量和内源底物法测定的LCAT活性显著正相关(P<0.01)。120例样本LCAT活性与体质量指数(BMI)、三酰甘油(TG)等呈正相关(P<0.05);与载脂蛋白AⅠ(apoAⅠ)(P<0.05)、高密度脂蛋白胆固醇(HDL-C)(P<0.01)等呈负相关。结论建立了HPLC测定LCAT活性的外源底物法,所建方法简便、精密、可靠,结果不受反应底物影响,为脂代谢机制研究和CVD危险分析提供了新的方法学基础。
卵磷脂胆固醇酰基转移酶;心血管病;高效液相色谱;7-脱氢胆固醇
Abstract:ObjectiveTo develop a high-performance liquid chromatography(HPLC)method for the measurement of lecithin-cholesterol acyltransferase(LCAT)activity and analyze the relationships between LCAT activity and the traditional risk factors of atherosclerotic cardiovascular disease(CVD).MethodsThe liposome which contained 7-dehydrocholesterol and 1,2-didecanoyl-sn-glycero-3-phosphocholine(10∶0 PC)as the substrate of LCAT and LCAT activating peptide(LAP642)as LCAT activator was mixed with 10 microliters of serum sample(50∶1, V/V)in ice-water bath and subsequently incubated at 37 ℃ for 1 h. After extracting with hexane, the lipid was analyzed by HPLC and the LCAT activity was calculated as the ratio of 7-dehydrocholesterol ester to free 7-dehydrocholesterol. LCAT activities of 120 health volunteers were measured and its relationship with traditional risk factors of CVD was analyzed.ResultsThe liposome composed of substrates(7-dehydrocholesterol and 10∶0 PC with ratio of amount 1∶8.5)and LAP642 was stable, efficient and easy for preparation. LCAT activity was a linear correction during 8 hours of incubation and was independent of the volume of serum added in the range from 0 to 20 microliters. The averages of intra- and total coefficients of variation(CV)were less than 1.76% and 3.11% respectively. The comparison of two methods showed that the results of the HPLC method were highly correlated with LCAT mass measured by commercial ELISA method and LCAT activity measured by endogenous substrate fractional esterification of high density lipoprotein cholesterol(FERHDL)(P<0.01). LCAT activity positively correlated with body mass index(BMI), triglyceride(TG)(P<0.05)and negatively correlated with apolipoprotein AΙ(apoAΙ)(P<0.05)and high density lipoprotein cholesterol(HDL-C)(P<0.01)in the volunteers.ConclusionA simple, precise and reliable HPLC method for determination of LCAT activity using artificial substrate has been established, and the results were not influenced by endogenous cholesterol levels in serum. The newly developed method could be a useful tool in the study of lipid metabolism and the assessment for risk factors of CVD.
Keywords: lecithin-cholesterol acyltransferase; cardiovascular disease; high-performance liquid chromatography; 7-dehydrocholesterol
高密度脂蛋白胆固醇(HDL-C)降低是动脉粥样硬化(atherosclerosis,As)性心血管病(cardiovascular diseases,CVD)的重要危险因素[1],这与HDL在胆固醇逆转运(reverse cholesterol transport,RCT)中发挥的作用密不可分。RCT指外周组织过量的游离胆固醇酯化后被运回肝脏进而排出体外的过程;卵磷脂胆固醇酰基转移酶(lecithin-cholesterol acyltransferase,LCAT)作为胆固醇酯化的唯一催化酶且主要作用于HDL,理论上与CVD密切相关[2-3]。但LCAT与CVD的关系一直存在争议,简便、可靠的LCAT测定方法对LCAT功能研究及CVD风险预测具有重要意义。目前,LCAT测定主要有质量测定和活性测定两类方法,后者反映LCAT功能,与CVD相关性更高,可分为内源底物法[4-7]和外源底物法[8-11]。代表性的内源底物法为Dobiasova建立的全血清酯化速率法(cholesterol esterification rate, CER)[4]和高密度脂蛋白胆固醇分数酯化速率法(fractional esterification rate of HDL cholesterol,FERHDL)[5],3H标记全血清或HDL上的胆固醇,37 ℃温育,薄层层析分离游离胆固醇及其酯,通过液闪计数定量计算CER或FERHDL。此外,我们课题组也建立了准确测定FERHDL的HPLC内标法[6]。内源法与CVD多种危险因素密切相关[6-7],但测定结果依赖底物浓度,不能反映LCAT的真正活性。经典外源底物法[8]选用胆固醇(或类似物)和卵磷脂作为底物制备脂质体,加入少量血清,37 ℃温育,测定单位时间内同位素标记胆固醇的酯化率,计算LCAT活性。外源底物法理论上为真正意义的酶活性测定方法,但由于脂质体制备中加入各类外源物质,影响酶促反应程度不同,测定结果可能无法反映LCAT真实活性。本研究在探讨酶促反应条件和酯化反应检测方法的基础上建立了HPLC测定LCAT活性的方法,并用其测定了120例健康志愿者的LCAT活性,分析LCAT与CVD传统危险因素的关系。
1 材料和方法
1.1仪器与试剂 Agilent 1200高效液相色谱仪(美国Agilent公司);Nova-Pak C18色谱柱(5 μm,3.9 mm×150 mm,美国Waters公司);十万分之一天平(德国Sartorious公司);减压干燥箱(美国Fisher Scientific 公司);LAURD p18水浴锅(德国LAURD公司);氮吹仪(北京八方世纪公司);旋涡混合器等。脂质体制备所用7-脱氢胆固醇购自美国Sigma公司,10∶0 PC购自美国Avanti Polar Lipids公司,LAP642由中国SBS公司合成,LCAT质量测定试剂盒购自捷克BioVendor公司。有机溶剂乙腈、异丙醇、正己烷、无水乙醇等为HPLC级,购自美国Fisher Scientific公司。其他化学试剂如甲醇、氯仿、磷酸盐等均为国产分析纯试剂,购自北京化学试剂公司。
1.2LCAT活性测定底物和反应条件的选择 选择具有共轭双键的7-脱氢胆固醇作为胆固醇类似物。为选择合适磷脂,固定7-脱氢胆固醇浓度及其与不同碳链磷脂的物质的量比,分别制备脂质体(一定比例的磷脂和胆固醇在水中形成的稳定微型泡囊体),与血清温育后,HPLC测定酯化速率;为考察LCAT酶催化反应的动力学,向脂质体(每份500 μL)中加入3种不同个体血清,37 ℃分别温育1、2、4、6、8 h,HPLC测定酯化速率;为考察样本用量,向脂质体(每份500 μL)中加入2.5、5、10、15及20 μL血清,37 ℃温育,HPLC测定酯化速率。
1.3LCAT活性测定
1.3.1脂质体制备 精密称取7-脱氢胆固醇6 mg(0.015 6 mmoL)和10∶0 PC 75 mg(0.132 mmoL),溶于1 mL氯仿,与1 mL含25 mg LAP642(0.009 mmoL)的甲醇溶液混合,N2吹干至有机溶剂完全挥发,加入100 mL三羟甲基氨基甲烷(Tris)(50 mmol/L,pH=7.45),涡旋振荡约0.5 min,混匀、分装并保存于-80 ℃。
1.3.2LCAT活性测定 自-80 ℃取出脂质体、血清和质控血清,室温融化。取500 μL脂质体于冰水浴中预冷的试管中,加入各待测血清和质控血清10 μL,37 ℃温育1 h,温育结束后置于冰水浴中并加入500 μL乙醇终止反应,加入正己烷1 mL,涡旋震荡20 min抽提脂质,转移正己烷500 μL至进样瓶,减压干燥,加入0.3 mL流动相重组,HPLC分析。
1.3.3HPLC分析 取重组后的溶液30 μL进行HPLC分析。流动相为乙腈、异丙醇(1∶1);流速1 mL/min;检测波长280 nm。HPLC同时分离测定反应后底物(7-脱氢胆固醇)和产物(7-脱氢胆固醇酯)水平,酯化峰所占的面积比即酯化率,将酯化率转化为酶活性国际单位Kat,1 Kat=(C×L1×R)/(L2×T),其中C为7-脱氢胆固醇浓度(mol/L),L1为每份脂质体的体积(L),R为酯化率(%),L2为每份脂质体加入血清的体积(L),T为酯化时间(h)。
1.4不精密度考察和方法学比对 为考察LCAT测定的不精密度,取LCAT活性高、中、低的不同个体血清3份,分别测定LCAT活性5次,每次每种血清重复分析3份;质控血清两份,分别测定10次,每次两个平行管;计算批内CV和总CV。分别用本方法、市售LCAT质量测定法和FERHDL法测定80例个体血清样品,每样品测定2次,考察各方法测定结果的相关性。
1.5健康志愿者样品测定 2015年3月招募北京医院120名健康志愿者(年龄19~72岁,男51例,女69例),测量身高、体质量、血压等体征指数;采集晨起空腹血液,室温放置1 h后离心取上清,-80 ℃保存。用所建方法测定样品LCAT活性,每次13~18个样品和2个质控血清,8次完成全部测定。血清总胆固醇(TC)、TG和肌酐采用酶法测定;血清葡萄糖采用己糖激酶法;HDL-C、低密度脂蛋白胆固醇(LDL-C)采用匀相法;apoAⅠ、apoB采用免疫比浊法。所有试剂均为Roche 公司产品,按试剂盒说明书在日立7180自动生化分析仪上进行测定。FERHDL和各种氨基酸、肉毒碱和溶血卵磷脂等测定使用我室建立的HPLC[6]和液相色谱串联质谱法(LC-MS/MS)[12]。本研究通过北京医院医学伦理学委员会批准,志愿者均签署了知情同意书。
1.6统计学分析 用Microsoft Office Excel 2010软件分析所建方法的线性、不精密度等。用SPSS17.0统计学软件分析120个数据,Levene检验示数据呈正态分布;Pearson相关分析LCAT活性与其他指标的关系,P<0.05为有统计学意义。
2 实验与结果
2.1LCAT活性测定底物的选择 7-脱氢胆固醇最大紫外光吸收波长为280 nm,HPLC可直接测定7-脱氢胆固醇及其酯的水平。7-脱氢胆固醇与不同碳链长度的磷脂(14∶0、12∶0、10∶0、8∶0 PC)制备脂质体,与血清温育后用HPLC检测。结果显示,随着脂肪酸链缩短,酯化峰的保留时间缩短,8∶0 PC的保留时间最短,但酯化率低,综合酯化率与保留时间选择10∶0 PC。HPLC分离7-脱氢胆固醇及其癸酸酯的色谱图见图1,分离于6 min完成。7-脱氢胆固醇浓度0.156 mmol/L,与10∶0 PC物质的量比为1∶8.5,LAP642浓度0.09 mmol/L时,脂质体反应活性最高。
2.2LCAT反应动力学和样本量的选择 脂质体与不同个体血清反应的动力学见图2,结果显示温育时间0~8 h,酯化速率与温育时间呈线性关系。LCAT酯化反应与血清量的关系见图3,结果显示血清量0~20 μL,酯化速率与血清量线性相关。本研究选用温育时间1 h,每份脂质体加入10 μL血清(脂质体与血清的体积比5∶1)的实验条件。
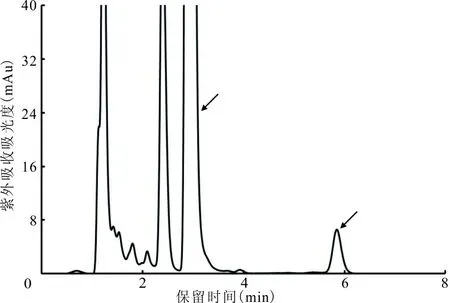
注:峰1,7-脱氢胆固醇;峰2,7-脱氢胆固醇癸酸酯。
图1 HPLC分离7-脱氢胆固醇及其酯化产物的色谱图

图2 3名不同个体血清LCAT酯化7-脱氢胆固醇的动力学曲线
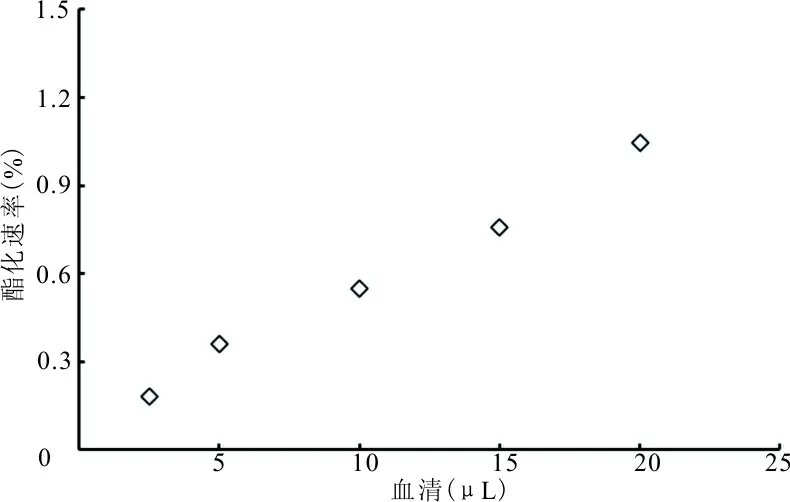
图3 LCAT酯化反应与血清量的关系
2.3LCAT活性测定的不精密度和方法学比对 高、中、低3个样品和质控样品LCAT活性测定的平均批内CV和总CV见表1。平均批内CV和总CV分别小于1.76%和3.11%,精密度良好。方法比对结果显示, 80例样品LCAT活性与ELISA测定的LCAT质量(r=0.50,P<0.01)和内源底物法测定的LCAT活性(FERHDL)(r=0.52,P<0.01)均呈正相关。
2.4健康志愿者LCAT活性测定 健康志愿者血清LCAT活性测定结果与其他CVD危险因素的关系见表2。120例样本LCAT活性为(45.33±7.44)μKat/L,其中女性为(45.46±7.55)μKat/L,男性为(45.15±7.35)μKat/L,差异无统计学意义(P>0.05)。将LCAT活性与其他CVD危险因素进行相关分析,LCAT活性与BMI(r=0.284,P<0.05)、TG(r=0.259,P<0.05)、谷氨酸(r=0.299,P<0.05)、亮氨酸(r=0.212,P<0.05)、苯丙氨酸(r=0.248,P<0.05)呈正相关(P<0.05);与apoAⅠ(r=-0.225,P<0.05)、HDL-C(r=-0.320,P<0.001)、尿总酚/肌酐(r=-0.221,P<0.05)、谷氨酸/谷氨酰胺(r=-0.291,P<0.05)、溶血卵磷脂18∶1(r=-0.219,P<0.05)呈负相关;与肉毒碱10∶1、18∶1无相关关系(P>0.05)。
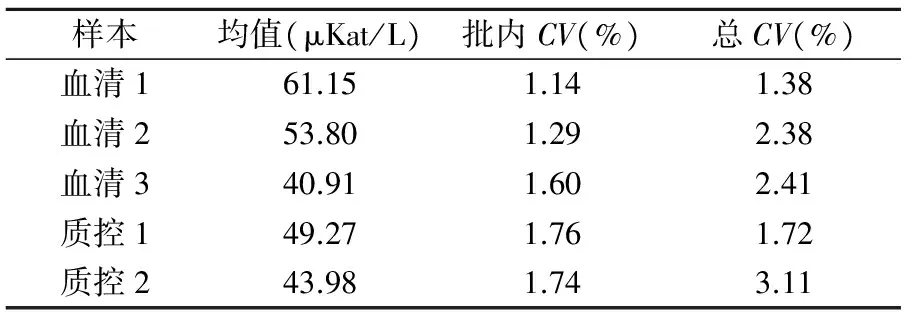
表1 HPLC测定血清LCAT活性的精密度
表2 120例健康志愿者LCAT活性及其与CVD危险因素的相关性
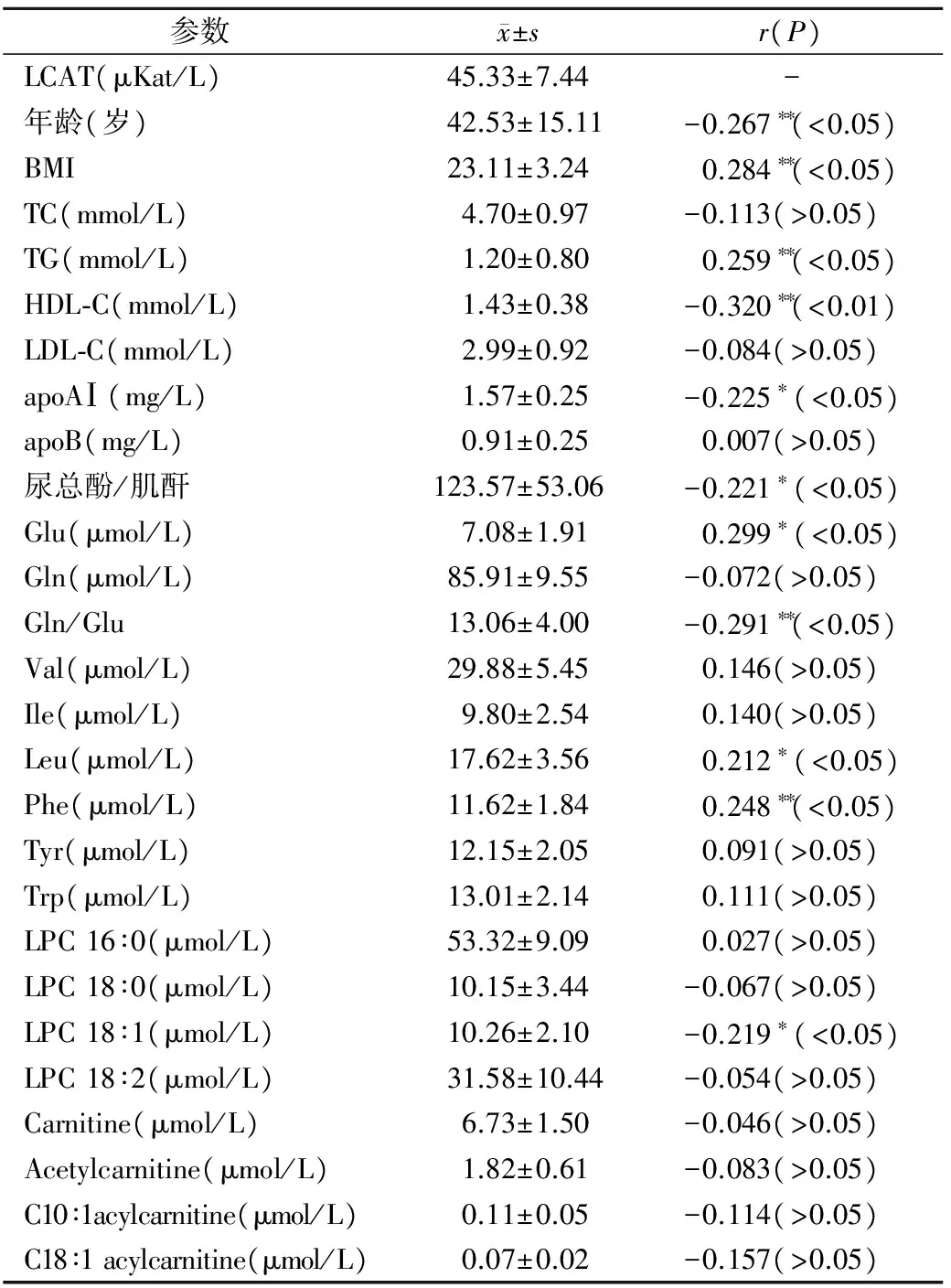
参数x±sr(P)LCAT(μKat/L)45.33±7.44-年龄(岁)42.53±15.11-0.267∗∗(<0.05)BMI23.11±3.240.284∗∗(<0.05)TC(mmol/L)4.70±0.97-0.113(>0.05)TG(mmol/L)1.20±0.800.259∗∗(<0.05)HDL⁃C(mmol/L)1.43±0.38-0.320∗∗(<0.01)LDL⁃C(mmol/L)2.99±0.92-0.084(>0.05)apoAⅠ(mg/L)1.57±0.25-0.225∗(<0.05)apoB(mg/L)0.91±0.250.007(>0.05)尿总酚/肌酐123.57±53.06-0.221∗(<0.05)Glu(μmol/L)7.08±1.910.299∗(<0.05)Gln(μmol/L)85.91±9.55-0.072(>0.05)Gln/Glu13.06±4.00-0.291∗∗(<0.05)Val(μmol/L)29.88±5.450.146(>0.05)Ile(μmol/L)9.80±2.540.140(>0.05)Leu(μmol/L)17.62±3.560.212∗(<0.05)Phe(μmol/L)11.62±1.840.248∗∗(<0.05)Tyr(μmol/L)12.15±2.050.091(>0.05)Trp(μmol/L)13.01±2.140.111(>0.05)LPC16∶0(μmol/L)53.32±9.090.027(>0.05)LPC18∶0(μmol/L)10.15±3.44-0.067(>0.05)LPC18∶1(μmol/L)10.26±2.10-0.219∗(<0.05)LPC18∶2(μmol/L)31.58±10.44-0.054(>0.05)Carnitine(μmol/L)6.73±1.50-0.046(>0.05)Acetylcarnitine(μmol/L)1.82±0.61-0.083(>0.05)C10∶1acylcarnitine(μmol/L)0.11±0.05-0.114(>0.05)C18∶1acylcarnitine(μmol/L)0.07±0.02-0.157(>0.05)
注:Glu,谷氨酸;Gln谷氨酰胺;Val缬氨酸;Ile,异亮氨酸;Leu,亮氨酸;Phe,苯丙氨酸;Tyr,酪氨酸;Trp,色氨酸;LPC,溶血卵磷脂; Carnitine,肉毒碱; Acetylcarnitine,乙酰肉毒碱。
3 讨论
LCAT活性测定是酶反应测定,测定结果依赖于反应体系和过程,因此反应体系的选择和反应过程的定义至关重要。一直以来,LCAT活性测定的外源底物法在脂质体的组成、制备和反应检测等方面设计多样,结果缺乏可比性。首先, LCAT的底物不溶于水,几乎无法在不添加任何外源性物质的情况下制备稳定性高、活性强的反应底物脂质体。外源物质主要有apoAⅠ、清蛋白[8]、巯基乙醇、溶血卵磷脂等,不同方法加入的种类和含量均不同,对LCAT活性的影响程度不一。其次,底物类型选择不同,检测方法也随之不同,同位素标记法采用液闪计数测定,安全性差,不适合临床使用;具有荧光基团的甾醇(DHE)[10]采用荧光光度法测定,灵敏度高;标准曲线内标法用HPLC法测定,需二次测定,处理过程复杂,结果变异大[11]。第三,脂质体制备常采用超声破碎、胆酸钠透析法等,操作复杂、费时,稳定性差[8,11]。
本研究选择7-脱氢胆固醇和10∶0 PC作为底物,加入LAP642作为LCAT的激活剂和底物助溶剂。之前文献选用apoAⅠ,其纯化困难,价格昂贵,性质不稳定,本实验用LAP642代替apoAⅠ,价格低、具有较好助溶性,只需涡旋混合即可制备性质稳定的脂质体。HPLC可同时分析反应后的7-脱氢胆固醇及其酯,不需要校准物和内标,通过峰面积计算7-脱氢胆固醇酯所占的百分比,即酯化速率,很大程度上简化了实验步骤,减少实验误差。温育时间0~8 h、血清量0~20 μL范围内,LCAT活性与变量线性相关,说明在一定血清量和时间段内,单位时间LCAT转化底物的物质的量相同,酯化率不受内源性底物(血清胆固醇)的影响,符合零级反应。精密度评价结果显示,平均批内CV和总CV分别小于1.76%和3.11%,与之前报道的方法相比,精密度更好[8,11]。方法比对结果显示,本法测定的LCAT活性与LCAT质量和FERHDL检测结果显著正相关,但因为不同方法测定的LCAT的生物学意义不同,测定结果并不完全一致。
用所建方法测定了120例健康志愿者血清的LCAT活性,结果发现LCAT活性与CVD危险因素指标如BMI、TG、FERHDL检测结果等正相关,与CVD保护因素apoAⅠ、HDL等负相关,具有统计学意义,提示本研究所测定的LCAT活性越高,CVD风险越高。这一结论与Dullaart、Holleboom和Tani等[13-15]的研究一致,与Sethi等[16]不同。另外,LCAT活性与多种CVD新生物学标志物[12](支链和芳香族氨基酸、溶血卵磷脂等)密切相关。综上所述,本研究所建方法脂质体制备简便、快速;脂质体稳定,反应活性高;HPLC同时检测7-脱氢胆固醇及其酯,不需要校准品和内标,精密度高;基本不受内源性底物的影响,结果反映血清LCAT活性,所建方法用于LCAT功能研究和CVD危险分析。本研究仍存在不足之处,由于人体血清中本身含有apoAⅠ,实验中加入其类似物LAP642,对血清中LCAT活性的影响可能不均一,导致测定结果有所偏差。故仍需进一步深入研究不加任何外源物质的脂质体制备。
[1]Brunham LR. HDL as a causal factor in atherosclerosis: insights from human genetics[J]. Curr Atheroscler Rep, 2016, 18(12): 71.
[2]Romanow WG, Piper DE, Fordstrom P,etal.BacMam production of active recombinant lecithin-cholesterol acyltransferase: expression, purification and characterization[J]. Protein Expr Purif, 2016, 125:1-6.
[3]Saeedi R, Li M, Frohlich J. A review on lecithin:cholesterol acyltransferase deficiency[J]. Clin Biochem, 2015, 48(7-8):472-475.
[4]Channon KM, Clegg RJ, Bhatnagar D,etal. Investigation of lipid transfer in human serum leading to the development of an isotopic method for the determination of endogenous cholesterol esterification and transfer[J]. Atherosclerosis, 1990, 80(3): 217-226.
[5]Dobiásová M, Frohlich J, Sedová M,etal. Cholesterol esterification and atherogenic index of plasma correlate with lipoprotein size and findings on coronary angiography[J]. J Lipid Res, 2011, 52(3): 566-571.
[6]Dong J, Yu S, Chen W,etal. A simple and precise method for direct measurement of fractional esterification rate of high density lipoprotein cholesterol by high performance liquid chromatography[J]. Clin Chem Lab Med, 2014,4(52):557-564
[7]Tanaka S1, Yasuda T, Ishida T,etal. Increased serum cholesterol esterification rates predict coronary heart disease and suddendeath in a general population[J]. Arterioscler Thromb Vasc Biol, 2013, 33(5):1098-104.
[8]Chen CH, Albers JJ. Characterization of proteoliposomes containing apoprotein A-I: a new substrate for the measurement of lecithin: cholesterol acyltransferase activity[J]. J Lipid Res,1982, 23(5):680-691.
[9]Vaisman BL, Remaley AT. Measurement of lecithin-cholesterol acyltransferase activity with the use of a Peptide-proteoliposome substrate[J]. Methods Mol Biol, 2013, 1027:343-352.
[10]Homan R, Esmaeil N, Mendelsohn L,etal. A fluorescence method to detect and quantitate sterol esterification by lecithin:cholesterolacyltransferase[J]. Anal Biochem, 2013, 441(1):80-86.
[11]Manabe M, Abe T, Nozawa M. New substrate for determination of serum lecithin:cholesterolacyltransferase[J]. J Lipid Res, 1987, 28(10):1206-1215.
[12]Wang M, Dong J, Chen WX,etal.Simultaneous quantification of cardiovascular disease related metabolic risk factors using liquid chromatography tandem mass spectrometry in human serum[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1009-1010 : 144-151.
[13]Dullaart RP, Perton F, Hillege HL,etal. High plasma lecithin:cholesterolacyltransferase activity does not predict low incidence of cardiovascular events: possible attenuation of cardioprotection associated with high HDL cholesterol.[J]. Atherosclerosis, 2010, 208(2):537-542.
[14]Holleboom AG, Kuivenhoven JA, Vergeer M,etal.Plasma levels of lecithin:cholesterol acyltransferase and risk of future coronary artery disease in apparently healthy men and women: a prospective case-control analysis nested in the EPIC-Norfolk population study[J]. J Lipid Res, 2010, 51(2): 416-421.
[15]Tani S, Takahashi A, Nagao K,etal.Association of lecithin-cholesterol acyltransferase activity measured as a serum cholesterol esterification rate and low-density lipoprotein heterogeneity with cardiovascular risk: a cross-sectional study[J]. Heart Vessels, 2016, 31(6):831-840.
[16]Sethi AA, Sampson M, Warnick R,etal. High pre-beta1 HDL concentrations and low lecithin: cholesterol acyltransferase activities are strong positive risk markers for ischemic heart disease and independent of HDL-cholesterol[J]. Clin Chem, 2010, 56(7):1128-1137.
Measurementoflecithin-cholesterolacyltransferaseactivityusinghigh-performanceliquidchromatography
WANGYu1,WANGSi-ming2,ZENGJie2,3,YANGRui-yue2,LIHong-xia2,DONGJun1,2,CHENWen-xiang2,3
(1.PekingUniversityFifthSchoolofClinicalMedicine,BejingHospital,Beijing100730;2.BeijingHospital,NationalCenterofGerontology,Beijing100730; 3.NationalCenterforClinicalLaboratories,Beijing100730,China)
R446;R541.4
A
2017-04-17)
(本文编辑王海燕)
国家自然科学基金(81472035,81171647)。
王玉,1991年生,女,硕士研究生,研究方向为血脂代谢。
董军,研究员,博士研究生导师,E-mail:jun_dong@263.net。
10.13602/j.cnki.jcls.2017.09.02
