血清白介素-27水平与视神经脊髓炎患者疾病严重程度的关系☆
2017-10-12贾昆刘小姣周冰洁张大启杨丽
贾昆 刘小姣 周冰洁 张大启 杨丽
血清白介素-27水平与视神经脊髓炎患者疾病严重程度的关系☆
贾昆△刘小姣*周冰洁*张大启*杨丽○☆
目的检测视神经脊髓炎(neuromyelitis optica,NMO)患者与健康人血清中白介素27(interleukin-27,IL-27)水平,探讨其在NMO发病中的意义及其与疾病严重程度的相关性。方法采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测39例NMO急性期患者与39例健康志愿者血清中IL-27水平,比较组间差异及分析NMO组血清IL-27水平与扩展残疾状况评分(expanded disability status scale,EDSS)、脊髓受累节段数、年复发率及水通道蛋白4(aquaporin-4,AQP-4)抗体滴度等临床指标的相关性。结果NMO组血清IL-27水平较健康对照组(healthy controls,HCs)明显降低,差异具有统计学意义(P<0.001),且NMO组患者血清IL-27水平与EDSS评分、脊髓受累节段数、随访2年平均复发率呈负相关(r=-0.439,P=0.010;r=-0.434,P=0.006;r=-0.451,P=0.031),而与AQP-4抗体滴度不存在相关性(r=-0.027,P=0.871)。多元回归分析显示血清IL-27水平与EDSS评分存在负相关性(B=-0.025,P=0.023)。结论IL-27可能参与了NMO的发病过程,且与疾病严重程度负相关,同时对于疾病的预后具有一定影响。
视神经脊髓炎 白介素-27酶联免疫吸附法 水通道蛋白-4抗体
视神经脊髓炎(neuromyelitis optica,NMO)是一种罕见的、易发于中青年女性的中枢神经系统(central nervous system,CNS)自身免疫性星形胶质细胞病,目前认为,包括B、T细胞在内的多种炎性细胞和细胞因子在其发病过程中扮演着重要角色[1]。IL-27是于2002年发现的IL-12家族的新型异源二聚体细胞因子,在多种自身免疫性疾病中发挥不同作用[2-3]。本课题组既往对于IL-27在视神经脊髓炎谱系疾病 (neuromyelitis optica spectrum disorder,NMOSD)中的作用进行了回顾性研究,发现IL-27可能参与了NMOSD的病理过程[4]。本研究以经典NMO患者为研究对象,探讨IL-27在NMO患者外周血清中的表达水平及其与临床指标间的关系,随访患者,观察IL-27是否可作为疾病复发的预后参考指标。
1 对象与方法
1.1 研究对象收集天津医科大学总医院神经内科2010年7月~2015年7月住院治疗的39例NMO患者。入组标准:符合WINGERCHUCK等[5]于2006年修订的视神经脊髓炎诊断标准:两项必要标准:①视神经炎;②脊髓炎;至少具备以下3项支持标准中的2项:①MRI脊髓病变范围至少3个或3个以上;②MRI表现不符合MS表现;③AQP-4抗体血清学阳性。排除标准:①无CNS完整影像学资料;②存在结节病、血管炎、白塞氏病、系统性红斑狼疮等其他可造成非特发性CNS炎性脱髓鞘的系统免疫性疾病;③存在眼底动脉闭塞、脊髓动静脉畸形、脊髓肿瘤等其他可能导致NMO类似症状的疾病;④存在身体其他系统严重的器质性疾病或依从性较差。对照组血标本来自我院体检中心39名健康人。所有血标本采集前6个月患者未接受过大剂量激素冲击及其他免疫抑制剂治疗。本研究得到天津医科大学总医院伦理委员会批准,取得了全体受试对象知情同意。
1.2 研究方法
1.2.1 临床资料收集 记录所有研究对象性别、年龄、服药史及留取标本时NMO患者EDSS评分、新发脊髓受累节段数,随访患者,记录标本留取后2年疾病复发情况,其中EDSS评分由两位具备资格的神经科医生独立完成并校对,所有临床信息均获自我院临床数据库。
1.2.2 标本采集及血清IL-27水平检测 清晨抽取空腹静脉血约3 mL,离心分离血清并于-80℃低温保存,所有标本同一时间检测。采用人IL-27 ELISA(eBioscience,San Diego,CA,USA)试剂盒检测血清IL-27水平,应用酶标仪在450 nm波长下测定各底物吸光度值,制作标准曲线,计算各样本IL-27浓度,最低检测标准为9.5 pg/mL,低于此标准视为血清中IL-27水平为0 pg/mL。
1.2.3 血清AQP-4抗体水平检测 利用转染人AQP4质粒的HEK293细胞通过荧光免疫沉淀法(fluoroimmunpprecipitation assay,FIPA)测定血清AQP-4抗体水平,以FU值在健康对照组均值+3倍标准差以上为阳性判断标准[6]。
1.3 统计学方法统计分析及作图采用SPSS 20.0软件(SPSS Inc.,Chicago,IL,USA)和 GraphPad PRISM 5.0软件 (Graph Pad Software Inc.,San Diego,CA,USA)完成。计量资料采用±s表示,Mann-Whitney秩和检验用于比较两组间IL-27水平的差异,Spearman等级相关分析用于分析IL-27水平与临床指标间的相关性,多元回归分析用于检验各因素对患者EDSS评分的影响。检验水准 α=0.05。
2 结果
2.1 基本资料39例急性期NMO患者包括男6例,女 33 例,年龄 21~77 岁,平均(49.26±12.86)岁,其中9例为首次发作,其余均为2次以上发作,平均EDSS评分为4.94±2.01,AQP-4抗体阳性率为82.05%(32/39)。39例患者中有23例在标本采集后进行了至少2年的随访。HCs组中男8例,女 31 例,年龄 21~67 岁,平均(45.13±10.97)岁,且所有人均无感染、过敏及其他自身免疫性疾病。NMO组与HCs组年龄与性别差异无统计学意义。
2.2 NMO患者血清IL-27水平NMO组及HCs组血清IL-27水平分别为 (41.78±30.49)pg/mL、(71.08±31.53)pg/mL,二者差异具有统计学意义(P<0.001)(图 1)。
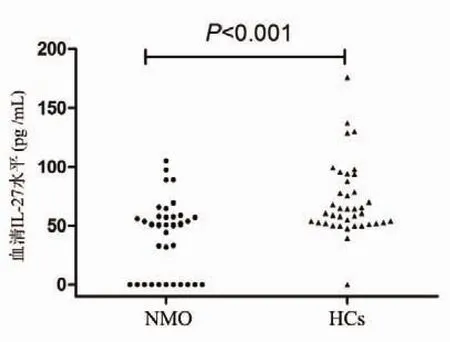
图1 NMO患者与HCs血清IL-27水平
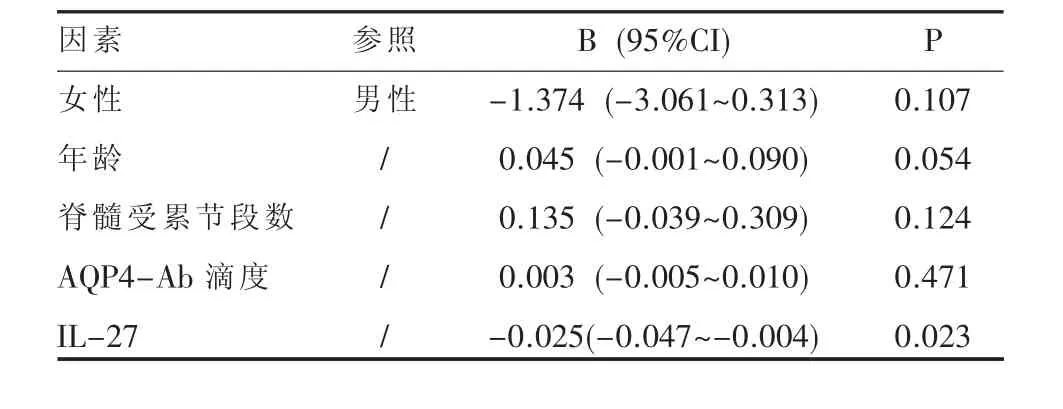
表1 NMO患者EDSS评分多因素回归分析
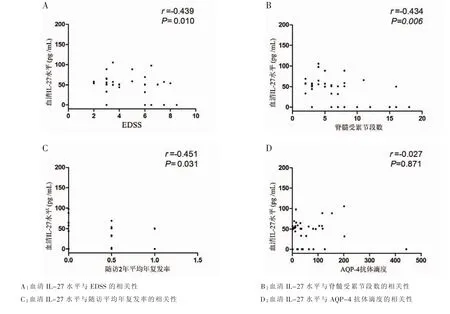
图2 NMO患者血清IL-27水平与临床特征的相关性
2.3 血清IL-27水平与疾病严重程度的关系
通过比较NMO患者血清IL-27水平与临床资料及AQP-4抗体滴度的相关性发现,NMO患者血清IL-27水平与EDSS评分及脊髓受累节段数呈负相关 (r=-0.439,P=0.010;r=-0.434,P=0.006)(图 2A、B),同时与标本采集后 2年的平均年复发率呈负相关(r=-0.451,P=0.031)(图 2C),而与NMO患者与AQP-4抗体滴度无明显相关性(r=-0.027,P=0.871)(图 2D)多元回归分析显示血清IL-27水平与患者EDSS评分存在负相关性(B=-0.025,P=0.023),而患者年龄、性别、脊髓受累节段数及抗体滴度等未发现与EDSS评分存在相关性(表 1)。
3 讨论
NMO是T细胞依赖的、抗体介导的、多种免疫因子参与的自身免疫性炎性疾病,典型病灶表现为星形胶质细胞AQP4的缺失,同时伴有大量的补体激活,从而引起免疫损伤,其发病机制复杂,至今尚不明确。IL-27是IL-12家族成员之一,在多种自身免疫性疾病中发挥着促进和抑制炎症反应的双重作用,而其在NMO中的作用目前鲜有报道。
我们研究发现,NMO患者血清中IL-27水平显著低于HCs组,血清IL-27水平与EDSS评分、脊髓受累节段数存在负相关性,提示其可能在NMO病理过程中发挥抑制炎症反应的保护性作用。这与我们既往关于IL-27与NMOSD关系的研究结果相一致[4]。YOSHIMOTO等[7]曾用不同水平的IL-27刺激小鼠脾脏B淋巴细胞并采用PCR分析结果,发现B细胞在IL-27的刺激下可表达T-bet mRNA,且表达水平与IL-27刺激浓度呈正相关,而T-bet又可反作用于B细胞,对其抗体类别转换具有十分重要的作用[8-9]。除此之外,IL-27还可能通过诱导Tr1细胞的分化,促进IL-10的分泌,进而起到抑制免疫炎症反应的作用[10]。也有研究发现,相比于MS患者和健康人,急性期NMO患者外周血中Th17细胞的比例及其分泌产物IL-17的水平显著升高[11]。高水平的Th17及记忆性Th17细胞与NMO患者疾病残疾程度即EDSS评分相关[12]。而IL-27可通过降低视黄酸相关孤儿受体 (retinoic acid-related orphan receptor,ROR)的表达进而抑制初始Th细胞分化为Th17细胞[13]。此外,IL-27还可抑制Th17细胞分泌IL-17,从而减轻炎症反应[14]。
除此之外,在对于患者进行随访后发现,患者血清IL-27水平与标本留取后2年的平均年复发率存在负相关性,提示IL-27可能可以作为预估NMO疾病复发的参考指标,而IL-27在疾病缓解期的滴度变化及与NMO炎症反应的关系需要进一步观察。本研究发现IL-27与AQP-4抗体水平存在相关性趋势,但无统计学意义,作为NMO疾病重要生物标记物的AQP-4抗体发挥着主要免疫损伤作用,其与IL-27的关系仍需进一步大样本研究。
总之,本文研究结果提示NMO作为抗体介导的自身免疫性疾病,细胞因子也在很大程度上影响着疾病的发展及转归。因此,探讨IL-27与NMO之间的关系,有助于进一步认识NMO的发病机制及判断疾病的严重程度,同时对疾病的预后具有一定的指导意义。此外,利用其免疫调节功能使之有可能成为治疗的潜在靶点。本研究是在小样本的基础上的研究,虽然得到一些有意义的结果,但仍需进一步扩大样本量进行实验验证。
[1]JASIAK-ZATONSKA M,KALINOWSKA-LYSZCZARZ A,MICHALAK S,et al.The Immunology of Neuromyelitis Optica-Current Knowledge,Clinical Implications,Controversies and Future Perspectives[J].Int J Mol Sci,2016,17(3):273.
[2]吴萱,林艾羽,王华燕,等.维持性泼尼松治疗视神经脊髓炎的疗效观察[J].中国神经精神疾病杂志,2015,41(3):145-149.
[3]NADERI S,HEJAZI Z,SHAJARIAN M,et al.IL-27 plasma level in relapsing remitting multiple sclerosis subjects:The double-faced cytokine[J].J Immunoassay Immunochem,2016,37(6):659-670.
[4]ZHANG DQ,JIA K,WANG R,et al.Decreased serum IL-27 and IL-35 levels are associated with disease severity in neuromyelitis optica spectrum disorders [J].J Neuroimmunol,2016,293:100-104.
[5]WINGERCHUK DM,LENNON VA,PITTOCK SJ,et al.Revised diagnostic criteria for neuromyelitis optica[J].Neurology,2006,66(10):1485-1489.
[6]WANG J,LI X,ZHANG DQ,et al.Quantitative analysis of aquaporin-4 antibody in longitudinally extensive transverse myelitis[J].J Neuroimmunol,2015,278:26-29.
[7]YOSHIMOTO T,OKADA K,MORISHIMA N,et al.Induction of IgG2a class switching in B cells by IL-27[J].J Immunol,2004,173(4):2479-2485.
[8]PENG SL,SZABO SJ,GLIMCHER L H.T-bet regulates IgG class switching and pathogenic autoantibody production[J].Proc Natl Acad Sci U S A,2002,99(8):5545-5550.
[9]GERTH AJ,LIN L,PENG SL.T-bet regulates T-independent IgG2a class switching[J].Int Immunol,2003,15(8):937-944.
[10]FITZGERALD DC,ZHANG GX,EL-BEHI M,et al.Suppression of autoimmune inflammation of the central nervous system by interleukin 10 secreted by interleukin 27-stimulated T cells[J].Nat Immunol,2007,8(12):1372-1379.
[11]WANG HH,DAI YQ,QIU W,et al.Interleukin-17-secreting T cells in neuromyelitis optica and multiple sclerosis during relapse[J].J Clin Neurosci,2011,18(10):1313-1317.
[12]YING L,HONG HW,et al.Increased memory Th17 cells in patients with neuromyelitis optica and multiple sclerosis.[J].J Neuroimmunol,2011,234:155-160.
[13]DIVEU C,MCGEACHY MJ,BONIFACE K,et al.IL-27 blocks RORc expression to inhibit lineage commitment of Th17 cells[J].J Immunol,2009,182(9):5748-5756.
[14]STUMHOFER JS,LAURENCEA,WILSON EH,etal.Interleukin 27 negatively regulates the development of interleukin 17-producing T helpercellsduring chronic inflammation of the central nervous system [J].Nat Immunol,2006,7(9):937-945.
(责任编辑:李立)
《中国神经精神疾病杂志》联系方式
网址:http://www.zgsjjs.com/;http://www.zgsjjs.cn/联系电话:020-8733 2686 E-mail:zgsjjs@126.com
联系地址:广州市中山二路58号门诊楼13楼西侧 邮编510080收件人:《中国神经精神疾病杂志》编辑部
汇款地址:广州中山二路58号 邮编510080收款人:中山大学附属第一医院期刊中心请附言:中国神经精神疾病杂志,稿件编号。
微信公众号:中国神经精神疾病杂志(微信号:nervousmental)
The study on the association of serum interleukin-27 levels with disease severity in neuromyelitis optica.
JIA Kun,LIU Xiaojiao,ZHOU Bingjie,ZHANG Daqi,YANG Li.Department of Neurology and Tianjin Neurological Institute,Tianjin Medical University General Hospital,Tianjin 300052,China.Tel:022-60814536
ObjectiveTo examine the interleukin-27 (IL-27)levels in the serum of the patients with neuromyelitis optica(NMO)and healthy controls(HCs)and explore the correlation of the serum IL-27 level with disease severity.MethodsSerum concentrations of IL-27 from 39 patients with NMO and 39 HCs were measured by using enzyme-linked immunosorbent assay (ELISA).Mann-Whitney U test was performed to analyze the difference in the IL-27 levels between the NMO group and the HCs.Spearman's rank correlation analysis was used to analyze the correlations of serum IL-27 levels with clinical parameters(EDSS,spinal cord lesion length,annual relapse rate and antibody titers of AQP-4)of NMO.ResultsThe serum IL-27 levels were significantly lower in NMO group than in HCs(P<0.001).Serum IL-27 levels were negatively correlated with EDSS,total length of spinal cord lesion identified by MRI at the sampling,and the average relapse rate during two-year follow-up (r=-0.439,P=0.010;r=-0.434,P=0.006;r=-0.451,P=0.031).There was no significant correlation between IL-27 levels and antibody titers of AQP-4(r=-0.027,P=0.871).Multivariate regression analysis showed that serum IL-27 levels were negatively correlated with EDSS (B=-0.025,P=0.023).ConclusionIL-27 may participate in the pathogenic process of NMO and might be a prognosis marker of the disease.
Neuromyelitis optica Interleukin-27 Enzyme-linked immunosorbentassay (ELISA)Aquaporine 4 antibody
R744.5+2
A
2016-06-03)
10.3969/j.issn.1002-0152.2017.08.007
☆国家自然科学基金面上项目(编号:81471221);天津市应用基础与前沿技术研究计划(重点项目)(编号:15JCZDJC35700)
* 天津市环湖医院(天津300350)
△天津医科大学总医院,天津市神经病学研究所
○☆通信作者(E-mail:yangli2001@tmu.edu.cn)
