代谢工程合成5-氨基乙酰丙酸的研究进展
2017-09-30张双虹邹亚兰冯丽丽王智文
张双虹,邹亚兰,宋 鑫,冯丽丽,陈 涛,王智文
(1.天津大学 化工学院,天津 300350;2.天津大学 系统生物工程教育部重点实验室,天津 300350;3.天津大学 化工协同创新中心,天津 300350;4.山东农业大学 林学院,山东泰安 271018)
代谢工程合成5-氨基乙酰丙酸的研究进展
张双虹1,2,3,邹亚兰1,2,3,宋 鑫4,冯丽丽1,2,3,陈 涛1,2,3,王智文1,2,3
(1.天津大学 化工学院,天津 300350;2.天津大学 系统生物工程教育部重点实验室,天津 300350;3.天津大学 化工协同创新中心,天津 300350;4.山东农业大学 林学院,山东泰安 271018)
5-氨基乙酰丙酸(5-ALA)是生物体内吡咯类物质生物合成的前体物质,在医药和农业领域显示出广阔的市场潜力。随着代谢工程的发展以及对5-ALA生物合成途径的研究,利用微生物合成5-ALA成为研究的新方向。与传统的化学法合成相比,利用微生物合成5-ALA具有低污染、高产率和低成本等优势。本文中,笔者介绍了5-ALA生物合成的最新研究进展,分析了5-ALA代谢途径的关键影响因素,并对未来的研究方向进行了展望。
5-氨基乙酰丙酸;C4途径;C5途径;生物合成
5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)是一种非蛋白类氨基酸,广泛存在于动物、植物和微生物细胞中,是生物体内合成卟啉、叶绿素和维生素B12(VB12)等吡咯类化合物的前体物质。5-ALA在环境中易降解无残留,作为除草剂[1]和杀虫剂[2]可以选择性地杀死双子叶植物的杂草,引起害虫体内生化代谢失衡。此外,5-ALA具有类似于植物激素的生理活性,在植物生长过程中起调节作用,可作为植物生长调节剂[3]使用。在医学领域,作为光动力治疗药物,5-ALA在恶性肿瘤治疗、皮肤癌治疗方面已经显示出广阔的市场前景[4],在膀胱癌[5]、直肠癌[6]和黑色素瘤[7]治疗方面有良好的效果。现阶段,5-ALA的生产方法包括化学法合成和生物法合成。传统的5-ALA生产主要以乙酰丙酸、糠醛、嘧啶等为原料化学合成,然而化学合成法存在副产物多、产物分离困难和原料价格昂贵等问题,造成5-ALA得率低、生产成本较高[8],这也是5-ALA市场价格高的原因。随着生物技术的发展,以微生物为底盘细胞,通过代谢工程改造来进行生物法合成成为新的研究方向。本文中,笔者重点介绍5-ALA的生物合成途径,并对近年来微生物合成5-ALA的研究进展进行综述和展望。

图1 5-ALA的生物合成途径Fig.1 Biosynthetic pathways of 5-ALA
1 5-ALA的合成途径
在自然界中,动物、植物和微生物等均可以生产5-ALA,其主要的合成途径有两条[8]:C4途径(C4 pathway)和C5途径(C5 pathway)。C4途径主要存在于动物、真菌、原生动物和一些光合细菌中,如沼泽红假单胞菌。C5途径主要存在于高等植物、藻类和细菌中,如大肠杆菌和谷氨酸棒状杆菌[9]。但是,也有少数微生物同时具有C4途径和C5途径,例如 Euglena gracilis[10]。1.1 C4途径
C4途径如图1所示,由5-氨基乙酰丙酸合成酶(5-aminolevulinate synthase,ALAS)催化甘氨酸和琥珀酰CoA生成5-ALA,该反应的辅因子是磷酸吡哆醛。ALAS是C4途径中的关键酶,由于光合细菌的ALAS具有较高的酶活,所以研究者主要针对光合细菌的ALAS进行研究,这些光合细菌主要包括类球红细菌[11]和沼泽红假单胞菌等[12]。
目前,利用C4途径代谢工程合成5-ALA的研究主要集中在大肠杆菌。研究者们尝试将不同来源的ALAS在大肠杆菌中表达以提高5-ALA的产量。早在1999年,Bolt等[11]在大肠杆菌中成功克隆了来源于类球红细菌(Rhodobacter sphaeroides)的ALAS,测得其比酶活为0.22 U/mg,其对底物琥珀酰CoA和甘氨酸的Km值分别为17 μmol/L与1.9 mmol/L。Choi等[13]在大肠杆菌中克隆了来源于沼泽红假单胞菌(Rhodopseudomonaspalustris)KUGB306 的 ALAS,比酶活为 0.92 U/mg,对琥珀酰CoA与甘氨酸的 Km值分别为 50 μmol/L与 2 mmol/L。Lin等[14]在大肠杆菌表达了来源于放射形土壤杆菌(Agrobacterium radiobacter)zju-0121的ALAS,比酶活为0.12 U/mg,对琥珀酰 CoA 与甘氨酸的 Km值分别为257 μmol/L与9.7 mmol/L。2013年,Zhang等[15]克隆了来源于沼泽红假单胞菌的ALAS,ALAS的比酶活为 3.6 U/mg,这是目前报道的最高酶活ALAS,对琥珀酰CoA与甘氨酸的Km值分别为 11 μmol/L 与 3.8 mmol/L。2014 年,Lou等[16]将来源于类球红细菌、放射形土壤杆菌和慢生型大豆根瘤菌的ALAS在大肠杆菌中成功表达,发现这几个ALAS的最适pH均为7.5,最适温度为37℃,在最适条件下,它们的比酶活分别为0.12、0.15和 0.2 U/mg。
1.2 C5途径
在利用C5途径合成5-ALA中,谷氨酸是5-ALA合成的前体物,由于该物质含有五个碳,因此,该合成途径被称为C5途径,具体途径见图1。C5途径需要经过三步反应:谷氨酰tRNA合成酶(GluRS,由gltx基因编码)催化谷氨酸与相应的tRNA相连,生成谷氨酰tRNA;随后,谷氨酰tRNA在谷氨酰tRNA还原酶(GluTR,由hemA基因编码)的作用下还原为谷氨酰-1-半醛(GSA)[17];最后,谷氨酰-1-半醛在谷氨酰-1-半醛氨基转移酶(GSA-AM,由hemL基因编码)的催化下,生成5-ALA[8]。
C5途径合成5-ALA中,GluTR和GSA-AM(谷氨酰-1-半醛氨基转移酶)是关键酶。GluTR是5-ALA生物合成的第一个关键酶,但是由于该酶蛋白对水解酶敏感,关于该酶蛋白分子结构的报道不多。GluTR受到终产物血红素的调节,当血红素的浓度足够的时候,GluTR的水平会降低,而当限制血红素浓度的时候,GluTR的蛋白量和活力会明显的提高[18]。由 GluTR催化生成的谷氨酰-1-半醛(GSA)是一个不稳定的中间产物,会被迅速催化生成5-ALA,为了减少中间产物GSA的损失,并且加快反应速度,GluTR蛋白和GSA-AM蛋白会形成酶复合体[19]。因此,研究人员认为GSA-AM也是C5途径中参与5-ALA生物合成的一个重要的酶。
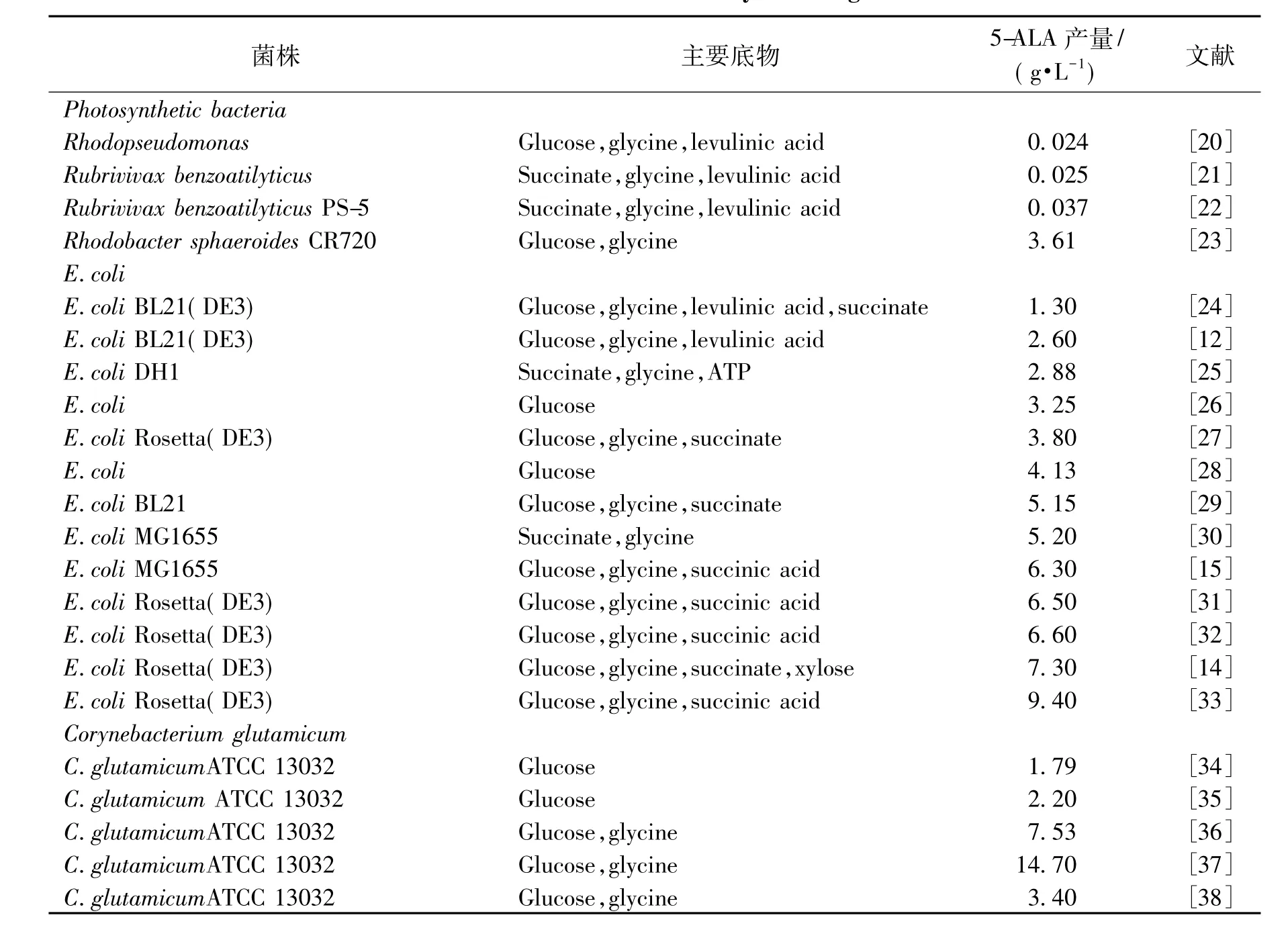
表1 微生物生产5-ALA的研究Table 1 Production of 5-ALA by microorganism
2 代谢工程改造微生物合成5-ALA
表1列举了不同微生物菌株合成5-ALA的情况。产生5-ALA的微生物包括光合细菌、大肠杆菌和谷氨酸棒状杆菌等。近几年,通过代谢工程改造微生物合成5-ALA成为了研究的热点,其工程策略主要包括:不同来源ALAS酶基因的异源表达优化,提高前体物甘氨酸和琥珀酰CoA的供给,限速酶GluTR的稳定性改进,降低副产物的溢流代谢和强化5-ALA的胞外运输等。
2.1 大肠杆菌代谢工程改造合成5-ALA
2.1.1 C4途径代谢工程改造合成5-ALA
通过代谢工程方法合成5-ALA的研究主要集中在大肠杆菌中进行,提高ALAS的酶活是改造的关键。早在1996年,Vander Werf等[25]将来源于类球红细菌(R.sphaeroides)的hemA基因克隆至大肠杆菌中,实现了hemA基因的活性表达,通过对发酵培养基以及发酵条件等进行优化,使得5-ALA的最终产量达到了2.88 g/L。为了提高ALAS的酶活,Fu等[27]分析了 ALAS 在 E.coli BL21(DE3)和E.coli Rosetta(DE3)(稀有密码子优化菌株)中的表达差异,发现:来源于类球红细菌(R.sphaeroides)的hemA基因在密码子优化的菌株 E.coli Rosetta(DE3)中可以更好地表达,使5-ALA的产量提高至3.80 g/L。Jeong等[39]发现5-ALA 的生物合成可能与细胞内的氧化还原电势有着密切的关系,当同时过表达依赖于NADPH的苹果酸酶基因maeB和5-氨基乙酰丙酸合酶编码基因hemA,能够明显提高ALAS的活力。琥珀酰CoA是5-ALA合成的前体物,为了解决前体物供应的问题,Kang等[40]将5-氨基乙酰丙酸合酶编码基因导入到一株琥珀酸生产菌株中,5-ALA的产量较之前提高了4倍。Yang[33]等发现发酵过程中的溶氧水平对ALAS的活力有影响,菌体对数生长期中一定时间的厌氧控制对ALA产量的提高有促进作用,最终在15 L发酵罐中5-ALA 产量达 9.4 g/L。Ding[9]等在大肠杆菌中过表达优化来自光合细菌(Rhodobacter capsulatus)的hemA基因,将5-ALA的产量从20 mg/L提高到689 mg/L,进一步过表达辅酶A合成路径相关基因,下调hemB基因的表达,最终ALA产量达2.81 g/L。
2.1.2 C5途径代谢工程改造合成5-ALA
鉴于大肠杆菌自身能够利用C5途径进行5-ALA的合成,近几年来,人们也开展了利用C5途径进行5-ALA代谢工程合成的研究。Kang等[28]首先在大肠杆菌中分析了C5途径中涉及的3个酶GluRS、GluTR和GSA-AM对5-ALA合成的影响,结果发现,GluTR是5-ALA生物合成过程中的限速酶。由于该酶的稳定性很差,将来自于鼠伤寒沙门氏菌(Salmonella Arizona)的hemA基因的N端编码Thr-2和Leu-3氨基酸的密码子之间插入了两个编码赖氨酸的密码子:AAGAAG。进一步在大肠杆菌中过表达突变型hemAM基因,5-ALA的产量提高到0.18 g/L。此外,他们还发现GSA-AM和HemAM酶具有协同作用,在此基础上过表达rhtA基因,5-ALA的产量提高到 4.13 g/L。2015 年,Zhang等[26]研究发现hemB、hemD、hemG和hemH是5-ALA下游代谢合成血红素的关键基因,上调hemD和hemF基因的表达有利于5-ALA的积累,而过表达hemB、hemG和hemH基因并不利于5-ALA的积累。最终通过在大肠肝菌中组合过表达hemA、hemL、hemD和hemF基因,5-ALA 产量达到 3.25 g/L。Zhang 等[41]通过酶工程手段对GluTR进行改造,在GluTR的N末端插入赖氨酸或精氨酸残基以提高GluTR的稳定性,5-ALA的产量较之前提高了1.76倍。研究人员还发现了离子平衡对于5-ALA的积累有影响,Li等[42]基于RyhB调节离子平衡的作用,通过表达ryhB基因,使5-ALA的产量提高16%,该研究对于利用非编码RNA(Small RNA)调节5-ALA积累有指导意义。Zhang等[43]同样发现了离子浓度对于5-ALA积累的影响,在优化离子添加浓度基础上,过表达hemA、hemL、hemD和 hemF基因,分批发酵产量达4.05 g/L。
2.2 谷氨酸棒状杆菌代谢工程改造合成5-ALA
谷氨酸棒状杆菌是从土壤中分离得到的革兰氏阳性菌,在工业上广泛应用于生产氨基酸、胺类以及生物能源等,是一株食品安全菌株。5-ALA的C5合成途径前体是谷氨酸,谷氨酸棒状杆菌能天然分泌谷氨酸,无需外源添加其他前体物质,从而降低了生产成本。而且谷氨酸棒状杆菌本身没有甘氨酸裂解系统,可以有效避免甘氨酸在胞内的降解[36]。因此谷氨酸棒状杆菌被认为是合成5-ALA的重要潜力菌株。
2.2.1 C4途径代谢工程改造合成5-ALA
笔者所在的课题组在利用谷氨酸棒状杆菌通过C4途径代谢工程改造合成5-ALA方面进行了系列研究。2015年,Feng等[36]在谷氨酸棒杆菌ATCC 13032中引入类球红细菌(R.sphaeroides)的hemA基因,敲除生成乙酸、乳酸的合成途径基因,敲除编码青霉素结合蛋白的pbp1b基因,过表达源自大肠杆菌的rhtA基因,5-ALA在5 L发酵罐中流加发酵时,产量达到了7.53 g/L。在此基础上,Zou等[38]研究了丝氨酸及甘氨酸合成途径对5-ALA合成的影响,结果表明,甘氨酸合成途径是5-ALA合成的关键途径。2016年,Yang等[37]比较了不同来源的 ALAS对5-ALA合成的影响,将来自Rhodobacter capsulatus SB1003的ALAS进行密码子优化,两阶段发酵5-ALA产量达12.4 g/L,进一步过表达来自大肠杆菌的RhtA运输蛋白,使得5-ALA产量达到14.7 g/L,为目前谷氨酸棒杆菌代谢工程合成5-ALA的最高产量。
2.2.2 C5途径代谢工程改造合成5-ALA
通过C4途径的代谢工程改造合成5-ALA,甘氨酸的供给是重要的限制因素,发酵过程中往往需要添加甘氨酸,从而造成成本提高。此外,一定浓度的甘氨酸对菌体的生长有抑制作用,也影响了发酵过程。而谷氨酸棒状杆菌C5途径合成5-ALA的过程中,谷氨酸棒状杆菌的天然产物谷氨酸是5-ALA的前体物,显示了可以直接利用葡萄糖进行代谢合成5-ALA的天然优势。
最近,Yu等[34]鉴定了谷氨酸棒杆菌中利用C5途径合成5-ALA的关键基因hemA和hemL,而且他们发现溶氧水平和Fe2+对5-ALA的发酵具有重要的影响,通过在谷氨酸棒杆菌中表达不同来源的hemA和hemL基因,5-ALA的最终产量达到了 1.79 g/L。2015年,Ramzi等[35]将 来 自 鼠 伤 寒 沙 门 氏 菌(Salmonella typhimurium)的hemA基因定点突变后在谷氨酸棒状杆菌中表达,同时表达hemL基因,经过发酵优化,5-ALA的最终产量达到了2.2 g/L。
3 展望
近年来,5-ALA的微生物合成已经取得了较大进步,显示了微生物法工业化生产5-ALA的良好前景。在C4途径中,ALAS的酶活是关键因素,前期研究多集中在不同宿主的hemA基因在模式菌株大肠杆菌中异源表达与选择。随着酶工程的发展,通过半理性/理性方法构建稳定的调控解除的ALAS酶,是代谢工程改造合成5-ALA的重要研究方面。到目前为止,通过C5途径可以实现以葡萄糖为底物的5-ALA合成,然而C5途径及其5-ALA下游代谢合成血红素途径,多为必需基因及其相关途径,基因调控复杂,这对进一步理性代谢工程改造造成了阻碍,需要进一步加强相关途径的酶及其基因表达调控的研究,为理性代谢工程改造合成5-ALA提供理论基础。
[1] XU L,ZHANG W,ALI B,et al.Synergism of herbicide toxicity by 5-aminolevulinic acid is related to physiological and ultrastructural disorders in crickweed(Malachium aquaticum L.)[J].Pestic Biochem Physiol,2015,125:53-61.
[2] MASCAL M,DUTTA S.Synthesis of the natural herbicide deltaaminolevulinic acid from cellulose-derived 5-(chloromethyl)furfural[J].Green Chem,2011,13(1):40-41.
[3] AKRAM N A,ASHRAF M.Regulation in plant stress tolerance by a potential plant growth regulator,5-aminolevulinic acid[J].J Plant Growth Regul,2013,32(3):663-679.
[4] CORNELIUS J F,SLOTTY P J,EL KHATIB M,et al.Enhancing the effect of 5-aminolevulinic acid based photodynamic therapy in human meningioma cells[J].Photodiagnosis Photodyn Ther,2014,11(1):1-6.
[5] FUKUHARA H,KUREISHI M,KHODA T,et al.The utility of a flexible fluorescence-cystoscope with a twin mode monitor for the 5-aminolevulinic acid-mediated photodynamic diagnosis of bladder cancer[J].PLoS ONE,2015,10(9):e0136416.
[6] WOZNIAKM,DUS-SZACHNIEWICZK,ZIOLKOWSKIP.Insulin-like growth factor-2 is induced following 5-aminolevulinic acid-mediated photodynamic therapy in SW620 human colon cancer cell line[J].Int J Mol Sci,2015,16(10):23615-23629.
[7] HU Z,FAN H,LV G,et al.5-aminolevulinic acid-mediated sonodynamic therapy induces anti-tumor effects in malignant melanoma via p53-miR-34a-Sirt1 axis[J].J Dermatol Sci,2015,79(2):155-162.
[8] KANG Z,ZHANG J,ZHOU J,et al.Recent advances in microbial production of delta-aminolevulinic acid and vitamin B12[J].Biotechnol Adv,2012,30(6):1533-1542.
[9] DING W,WENG H,DU G,et al.5-aminolevulinic acid production from inexpensive glucose by engineering the C4 pathway in Escherichia coli[J].J Ind Microbiol Biotechnol,2017,44(8):1127-1135.
[10] WEINSTEIN J D,BEALE S I.Separate physiological roles and subcellular compartments for two tetrapyrrole biosynthetic pathways in Euglena gracilis[J].J Biol Chem,1983,258(11):6799-6807.
[11] BOLT E L,KRYSZAK L,JILL Z,et al.Characterization of the Rhodobacter sphaeroides 5-aminolaevulinic acid synthase isoenzymes,HemA and HemT,isolated from recombinant Escherichia coli[J].Eur J Biochem,1999,265(1):290-299.
[12] CHOI C,HONG B S,SUNG H C.Optimization of extracellular 5-aminolevulinic acid production from Escherichia coli transformed with ALA synthase gene of Bradyrhizobium japonicum[J].Biotechnol Lett,1999,21(6):551-554.
[13] CHOI H P,HONG J W,RHEE K H.Cloning,expression,and characterization of 5-aminolevulinic acid synthase from Rhodopseudomonas palustris KUGB306[J].FEMS Microbiol Lett,2004,236(2):175-181.
[14] LIN J,FU W,CEN P.Characterization of 5-aminolevulinate synthase from Agrobacterium radiobacter,screening new inhibitors for 5-aminolevulinate dehydratase from Escherichia coli and their potential use for high 5-aminolevulinate production[J].Bioresour Technol,2009,100(7):2293-2297.
[15] ZHANG L,CHEN J,CHEN N,et al.Cloning of two 5-aminolevulinic acid synthase isozymes HemA and HemO from Rhodopseudomonas palustris with favorable characteristics for 5-aminolevulinic acid production[J].Biotechnol Lett,2013,35(5):763-768.
[16] LOU J W,ZHU L,WU M B,et al.High-level soluble expression ofthe hemA gene from Rhodobacter capsulatus and comparative study of its enzymatic properties[J].J Zhejiang Univ Sci B,2014,15(5):491-499.
[17] SCHAUER S,CHATURVEDI S,RANDAU L,et al.Escherichia coli glutamyl-tRNA reductase[J].J Biol Chem,2002,277(50):48657-48663.
[18] DE ARMAS-RICARD M,LEVICAN G,KATZ A,et al.Cellular levels of heme affect the activity of dimeric glutamyl-tRNA reductase[J].Biochem Biophys Res Commun,2011,405(1):134-139.
[19] MOSER J,SCHUBERT W D,BEIER V,et al.V-shaped structure of glutamyl-tRNA reductase,the first enzyme of tRNA-dependent tetrapyrrole biosynthesis[J].EMBO J,2001,20(23):6583-6590.
[20] SAIKEUR A,CHOORIT W,PRASERTSAN P.Influence of precursors and inhibitor on the production of extracelluar 5-aminolevulinic acid and biomass by Rhodopseudomonas palustris KG31[J].Biosci Biotechnol Biochem,2009,73(73):987-992.
[21] SUPALAK S,POONSUK P.Characterization of a newly isolated Rubrivivax benzoatilyticus PS-5 with self-flocculation property and optimization pathway for 5-aminolevulinic acid production[J].Afr J Biotechnol,2013,12(16):2069-2081.
[22] SATTAYASAMITSATHIT S,PRASERTSAN P.Improvement of 5-aminolevulinic acid production by Rubrivivax benzoatilyticus PS-5 with self-flocculation by co-fermentation of precursors and volatile fatty acids under pH-controlled conditions[J].Ann Microbiol,2013,64(1):385-389.
[23] KAMIYAMA H,HOTTA Y,TANAKA T,et al.Production of 5-aminolevulinic acid by a mutant strain of a photosynthetic bacterium[J].Seibutsu-kogaku Kaishi,2000,78(2):48-55.
[24] CHUNG S Y,SEO K H,RHEE J I.Influence of culture conditions on the production of extra-cellular 5-aminolevulinic acid(ALA)by recombinant E.coli[J].Process Biochem,2005,40(1):385-394.
[25] VANDER WERF M J,ZEIKUS J G.5-aminolevulinate production by Escherichia coli containing the Rhodobacter sphaeroides hemA gene[J].Appl Environ Microbiol,1996,62(10):3560-3566.
[26] ZHANG J,KANG Z,CHEN J,et al.Optimization of the heme biosynthesis pathway for the production of 5-aminolevulinic acid in Escherichia coli[J].Sci Rep,2015,5(17):8584.
[27] FU W,LIN J,CEN P.5-Aminolevulinateproductionwith recombinant Escherichia coli using a rare codon optimizer host strain[J].Appl Microbiol Biotechnol,2007,75(4):777-782.
[28] KANG Z,WANG Y,GU P.Engineering Escherichia coli for efficient production of 5-aminolevulinic acid from glucose[J].Metab Eng,2011,13(5):492-498.
[29] HANPIL C,LEE Y M,YUN C W.Extracelluar 5-aminolevulinic acid production by Escherichia coli containing the Rhodopseudomonas palustris KUGB306 hemA gene[J].J Microbiol Biotechnol,2008,18(6):1136-1340.
[30] XIE L,HALL D,EITEMAN M A,et al.Optimizationof recombinant aminolevulinate synthase production in Escherichia coli using factorial design[J].Appl Microbiol Biotechnol,2003,63(3):267-273.
[31] FU W,LIN J,CEN P.Expression of a hemA gene from Agrobacterium radiobacter in a rare codon optimizing Escherichia coli for improving 5-aminolevulinate production[J].Appl Biochem Biotechnol,2010,160(2):456-466.
[32] FU W,LIN J,CEN P.Enhancementof 5-aminolevulinate production with recombinant Escherichia coli using batch and fedbatch culture system[J].Bioresour Technol,2008,99(11):4864-4870.
[33] YANG J,ZHU L,FU W Q,et al.Improved 5-aminolevulinic acid production with recombinant Escherichia coli by a short-term dissolved oxygen shock in fed-batch fermentation[J].Chin J Chem Eng,2013,21(11):1291-1295.
[34] YU X,JIN H,LIU W,et al.Engineering Corynebacterium glutamicum to produce 5-aminolevulinic acid from glucose[J].Microb Cell Fact,2015,14:183.
[35] RAMZI A B,HYEON J E,KIM S W,et al.5-aminolevulinic acid production in engineered Corynebacterium glutamicum via C5 biosynthesis pathway[J].Enzyme Microb Technol,2015,81:1-7.
[36] FENG L,ZHANG Y,FU J,et al.Metabolic engineering of Corynebacterium glutamicum forefficientproduction of5-aminolevulinic acid[J].Biotechnol Bioeng,2016,113(6):1284-1293.
[37] YANG P,LIU W,CHENG X,et al.A new strategy for production of5-aminolevulinic acid in recombinant Corynebacterium glutamicum with high yield[J].Appl Environ Microbiol,2016,82(9):2709-2717.
[38] ZOU Y,CHEN T,FENG L,etal.Enhancementof5-aminolevulinic acid production by metabolic engineering of the glycine biosynthesis pathway in Corynebacterium glutamicum[J].Biotechnol Lett,2017,39(9):1369-1374.
[39] JEONG A H S,DEOK KWON Y,OH HEE K.5-aminolevulinic acid biosynthesis in Escherichia colicoexpressing NADP-dependent malic enzyme and 5-aminolevulinate synthase[J].J Microbiol Biotechnol,2007,17(9):1579-1584.
[40] KANG Z,WANG Y,WANG Q,et al.Metabolic engineering to improve 5-aminolevulinic acid production[J].Bioeng Bugs,2011,2(6):342-345.
[41] ZHANG J,WENG H,DING W,et al.N-terminal engineering of glutamyl-tRNA reductase with positive charge arginine to increase 5-aminolevulinic acid biosynthesis[J].Bioengineered,2017,8(4):424-427.
[42] LI F,WANG Y,GONG K,et al.Constitutive expression of ryhB regulates the heme biosynthesis pathway and increases the 5-aminolevulinic acid accumulation in Escherichia coli[J].FEMS Microbiol Lett,2014,350(2):209-215.
[43] ZHANG J,KANG Z,DING W,et al.Integrated optimization of the in vivo heme biosynthesispathway and the in vitro iron concentration for 5-aminolevulinate production[J].Appl Biochem Biotechnol,2016,178(6):1252-1262.
(责任编辑 荀志金)
Advances in 5-aminolevulinic acid microbial production
ZHANG Shuanghong1,2,3,ZOU Yalan1,2,3,SONG Xin4,FENG Lili1,2,3,CHEN Tao1,2,3,WANG Zhiwen1,2,3
(1.School of Chemical Engineering and Technology,Tianjin University,Tianjin 300350,China;2.Key Laboratory of Systems Bioengineering of the Ministry of Education,Tianjin University,Tianjin 300350,China;3.Collaborative Innovation Center of Chemical Science and Engineering,Tianjin University,Tianjin 300350,China;4.College of Forestry,Shandong Agricultural University,Tai'an 271018,China)
5-Aminolevulinic acid(5-ALA)is a common precursor of the tetrapyrrole biosynthesis pathway in organisms and has broad application potentials in medicine and agriculture.With the rapid development of metabolic engineering and biosynthetic pathway of 5-ALA microbial production,scientists have tried to produce 5-ALA by biosynthesis.Compared to its chemical synthesis,microbial production of 5-ALA has many advantages,including low pollution and high productivity.This review summarizes the recent progress in microbial production of 5-aminolevulinic acid,and analyzed the key factors in 5-ALA production,and discusses future directions of 5-ALA research.
5-aminolevulinic acid;C4 pathway;C5 pathway;biosynthesis
Q812
A
1672-3678(2017)05-0065-06
10.3969/j.issn.1672-3678.2017.05.008
2017-07-06
天津市自然科学基金(15JCQNJC06000);国家自然科学基金(21576200、21621004、21390201)
张双虹(1993—),女,河北邢台人,研究方向:发酵工程;王智文(联系人),副教授,E-mail:zww@tju.edu.cn
