微生物代谢路径的优化与调控
2017-09-30陈修来罗秋玲刘立明
陈修来,高 聪,刘 佳,罗秋玲,刘立明
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 食品微生物制造工程实验室,江苏 无锡 214122)
微生物代谢路径的优化与调控
陈修来1,2,3,高 聪1,2,3,刘 佳1,2,3,罗秋玲1,2,3,刘立明1,2,3
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 食品微生物制造工程实验室,江苏 无锡 214122)
代谢路径平衡对化学品、药品和生物燃料的生产具有重要的作用。为了满足工业化生产的需求,维持代谢路径最优平衡是实现代谢流高效化导向目标代谢产物的必要手段。从DNA、RNA、蛋白质和代谢物四个水平,分析归纳了微生物代谢路径的优化与调控策略,并展望了代谢路径平衡进一步精深调控的发展方向。
代谢路径;路径优化;代谢工程;合成生物学
随着石油资源的日益枯竭,以石油为基础的化工产业面临严重的挑战。微生物发酵法能够以廉价可再生碳源为底物生产多种化学品,具有可持续、绿色环保等优点。因此,微生物发酵法成为替代传统石油化工方法的重要技术手段[1-2]。目前,微生物发酵法已经用于多种同源及异源代谢产物的生产[3],包括:生物柴油、大宗化学品、精细化学品、药物和营养品等,有效地实现了高产量、高得率和高生产强度的目标。
代谢工程通过对底盘微生物进行遗传改造,重新配置细胞的生化代谢网络,构建高效的细胞工厂,将可再生原料转化为高附加值化合物。目前,代谢工程已经成功应用于多种生物基产品的工业化生产,如:青蒿素[4]和 1,4-丁二醇[5]等。然而,通过操纵内源基因和引入异源途径改造微生物固有代谢网络,通常会导致代谢途径通量不平衡,引起中间代谢物过量积累,从而抑制胞内代谢活动,降低菌体生理活性和发酵性能[6]。Wu等[7]在代谢工程改造大肠杆菌(Escherichia coli)BL21(DE3)生产白藜芦醇的过程中,通过胞内表达源于黏红酵母(Rhodotorul glutinis)的酪氨酸解氨酶(TAL)、香芹(Petroselinum crispum)的4-香豆酰辅酶 A连接酶(Pc4CL)、车轴草根瘤菌(Rhizobium trifolii)的丙二酸酯合成酶(MatB)/丙二酸载体蛋白(MatC)和葡萄(Vitis vinifera)的芪合酶(STS),白藜芦醇的产量仅仅达到3.03 mg/L,主要原因在于中间代谢物香豆酰辅酶A的过量积累对菌株具有毒性[8]。为了有效降低香豆酰辅酶A的毒性,进一步提高白藜芦醇的产量,可以将白藜芦醇合成途径分成3个模块,并精细化调控3个模块中基因表达水平,有效地实现了代谢途径平衡,最终使得白藜芦醇产量达到35.02 mg/L[7]。
因此,解决代谢失衡问题,可以有效改善微生物细胞生长状况、代谢物产量及产率。其中,找到最佳途径平衡点是微生物代谢工程改造过程中的最重要一步。基于此,本综述中,笔者从 DNA、RNA、蛋白质和代谢物四个水平 (图1)详细论述代谢路径优化与调控相关的现代生物技术,并展望代谢路径平衡进一步精深调控的发展方向。
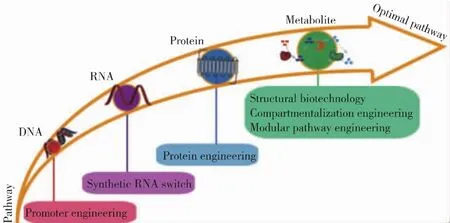
图1 微生物代谢路径的优化策略Fig.1 Strategies for optimization of microbial metabolic pathways
1 基于DNA水平的代谢路径优化
启动子工程,借助基因表达元件,调节路径酶的差异表达,实现代谢流平衡,从而提高细胞工厂的生产效率。启动子工程常用的路径优化控制策略:1)构建启动子文库[9]。借助iGEM、PlantCARE等在线分析工具,设计不同强度的合成启动子,优化代谢路径关键基因转录起始效率。该方法已经成功用于双乙酰(图 2)的生产[10]。2) 替换启动子[11]。利用iGEM、CellML等软件,选择合适强度的启动子替换合成路径中限速酶的自身启动子,提高代谢路径限速酶的表达效率。该方法已经成功用于L-精氨酸[11]和2,3-丁二醇(图2)[12]的生产。3)调控核糖体结合位点(RBS) 强 度[13]。 利 用 RBS Calculator[14]、RBS Designer[15]等预测软件,设计具有不同翻译起始速率的RBS,精确控制代谢路径基因的翻译效率。该方法已经成功用于虾青素[13]和脂肪酸[16]的生产。4) 合成间隔区[17]。通过构建mRNA二级结构突变库,借助GeneSplicer和SplicePort等在线工具,预测和改变RNA酶切割位点,实现多基因路径间隔区的组合优化。该方法已经成功用于甲羟戊酸的生产[17]。
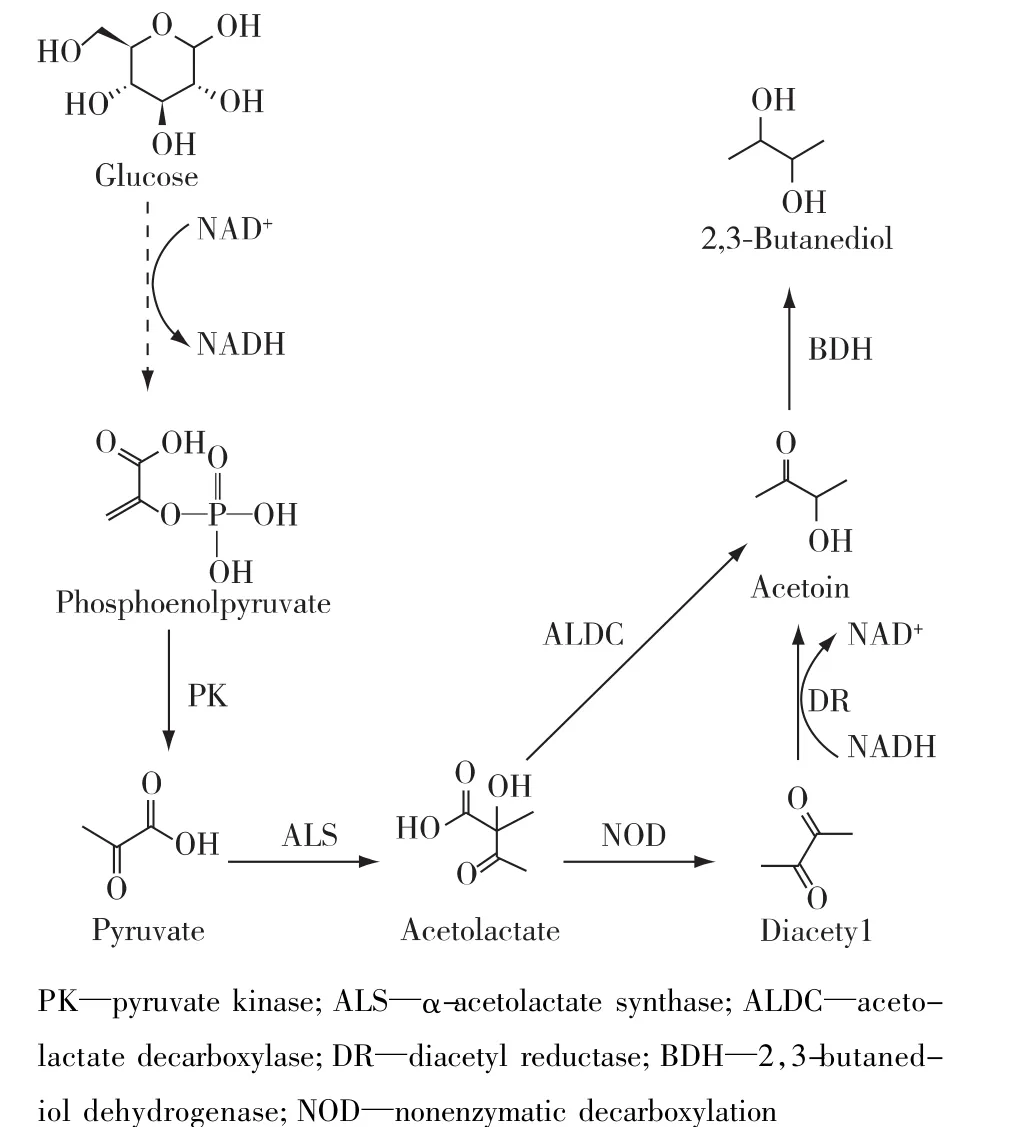
图2 微生物双乙酰和2,3-丁二醇的代谢途径Fig.2 Metabolic pathways for diacetyl and 2,3-butanediol production
2 基于RNA水平的代谢路径优化
在正常条件下,RNA分子可以自组装成具有不同生理功能的多种二级结构,因此,RNA分子结构被广泛应用于合成生物学的研究领域。其中,典型应用是利用合成RNA开关调控微生物碳代谢流,实现目标代谢物过量积累。合成RNA开关常用的路径优化控制策略:1)核酶开关[18]。通过适配子序列构成细胞敏感器(感应区),并借助核酶序列控制胞内代谢物的时空波动(执行区),实现目标基因理性控制和代谢物积累量的提高。该方法已经成功用于黄嘌呤的生产[18]。2) 核糖开关[19]。由一类顺式编码调控 RNA组成,如:腺苷钴胺素(AdoCbl)、黄素单核苷酸(FMN)、S-腺苷甲硫氨酸和甘氨酸核糖开关等,通过诱导目的基因转录终止或者抑制转录起始来实现对基因表达的调控。该方法已经成功用于维生素B12的生产[20]。3)反义RNA开关[21]。主要由两部分组成,包括:识别特定mRNA的结合区域和招募辅助蛋白的支架区域,通过控制mRNA降解速率,反义RNA开关可以针对多个基因的表达进行多尺度调控。该方法已经成功用于尸胺(图 3)的生产[21]。
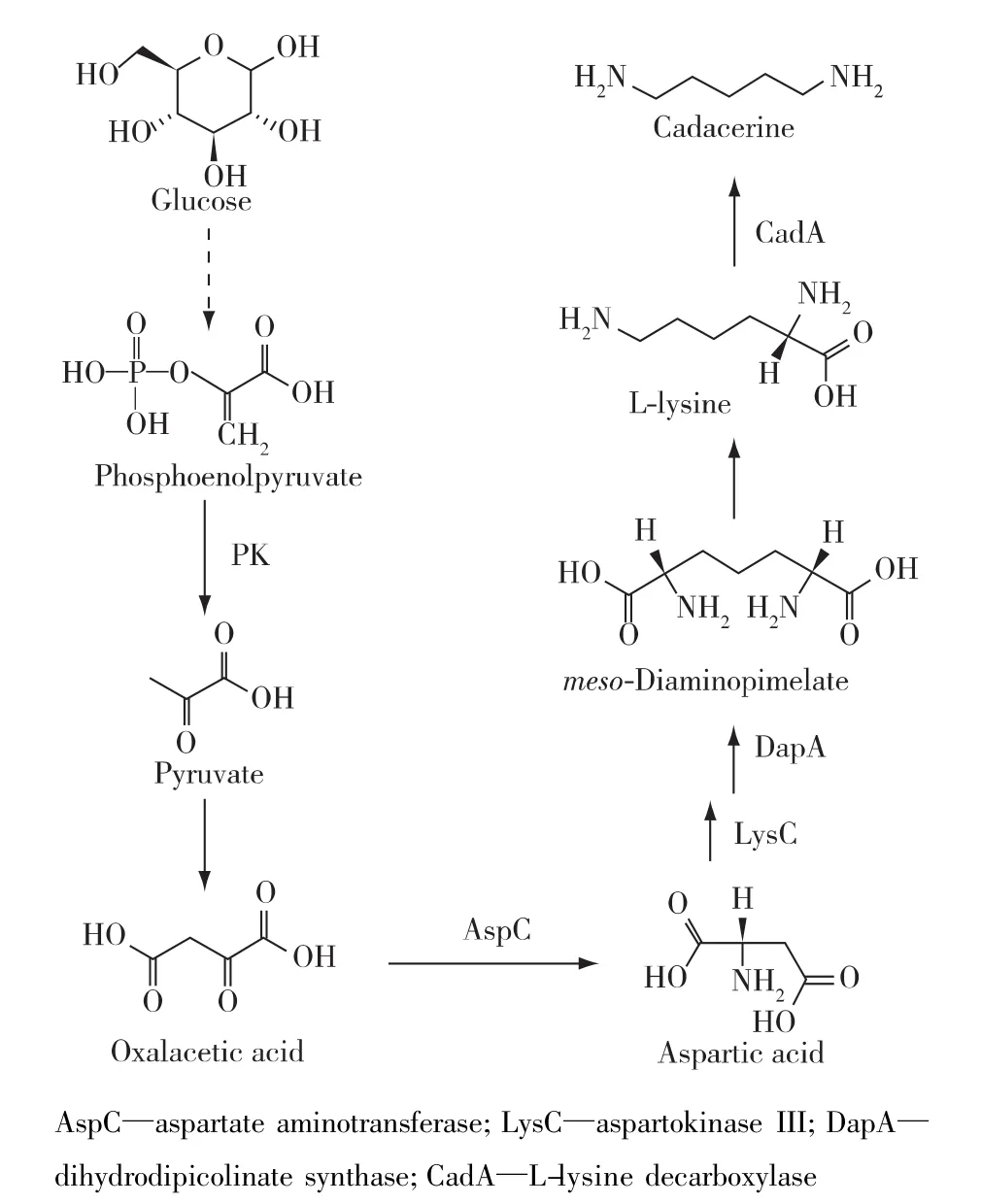
图3 微生物尸胺的代谢途径Fig.3 Metabolic pathways for cadaverine production
3 基于蛋白质水平的代谢路径优化
蛋白质工程是合成生物学的重要组成部分,通过对酶的性质和酶的组件进行重新设计,可以获得人们所需要的代谢物高效合成路径[22]。蛋白质工程常用的路径优化控制策略:1)提高酶的活性。传统蛋白质表达量的改善方法,易形成包涵体,且容易增加菌体代谢负荷。现代的方法,通过采用易错PCR、点突变和交叉延伸技术,改变底物结合口袋和修饰蛋白质编码序列,从而实现酶活力的提高[23-24]。该方法已经成功用于聚羟基脂肪酸酯[25]和左旋海松二烯[23]等化合物的生产。2)改变底物和产物的特异性。由于天然酶催化底物谱较窄,难以合成许多非天然化合物[24]。另外,某些底物特异性不高的天然酶在催化反应中容易催化底物类似物生成副产物,降低产品纯度。因此,为了解决这些问题,针对酶的活性位点和结合口袋采取易错PCR、定点突变和DNA改组等方式,可以有效地调整酶底物特异性,实现路径催化效率的提高[26]。该方法已经成功用于L-高丙氨酸[22]和3-脱氢莽草酸(图4)[27]等化合物的生产。3)修饰调控元件。在代谢物生产过程中,当代谢物浓度达到一定阈值时,代谢路径就会启动负反馈调控。因此,为了解决反馈抑制,通过对转录调控蛋白采取化学突变、DNA改组及定点饱和突变等方式,可以降低负反馈调节,提高路径催化效率[28]。该方法已经成功用于氨基葡萄糖[29]和 L-苯丙氨酸(图 4)[30]等化合物的生产。
4 基于代谢物水平的代谢路径优化
在正常状态下,微生物体内的代谢路径能够为细胞生长提供适量的构架化合物。然而,合成生物学是将异源代谢路径引入到微生物中,该路径超出了微生物自我调控的范围,容易引起代谢负荷和代谢不平衡[31]。为了解决此问题,可以通过合成生物学的相关技术策略,系统性地优化代谢路径,从而为实现细胞代谢网络与代谢物合成的平衡奠定基础[32]。常用的路径优化控制策略包括:结构生物学、区间工程和模块路径工程等。
4.1 结构生物学
在代谢工程改造的过程中,一方面,代谢中间产物的过量积累会对宿主细胞产生毒性;另一方面,中间代谢物会被竞争途径消耗,从而降低产物合成效率。为解决这些问题,支架技术作为一种新兴的路径优化策略,能够在空间上缩短路径酶的底物传输距离,构建多酶复合结构。支架技术常用的路径优化控制策略:1)DNA支架技术[33]。借助锌指DNA结合域,特定的DNA序列能够与特异性的蛋白质结构相结合。基于此,通过设定特定的DNA序列,能够将路径酶按照不同的顺序、比例及空间位置排布在DNA链上,以此增加路径酶的催化底物浓度,提高路径催化效率。该方法已经成功用于1,2-丙二醇等化合物的生产[33]。2)RNA 支架技术[34]。利用RNA元件的适配体区域与路径酶的结合作用,将路径酶组装成多维的空间结构,从而提高路径催化效率。该方法已经成功用于氢气(H2)的生产[34]。3) 蛋白质支架技术[35]。借助蛋白质的相互作用原理,蛋白质的互作区域能够与特异性蛋白质相结合。通过将该相互作用区域定位于支架蛋白上,以此招募并结合特定的路径酶,从而缩短路径酶的实际催化距离,提高路径催化效率。该方法已经成功用于丁酸(图 5)[36]和 D-葡萄糖二酸[37]等化合物的生产。
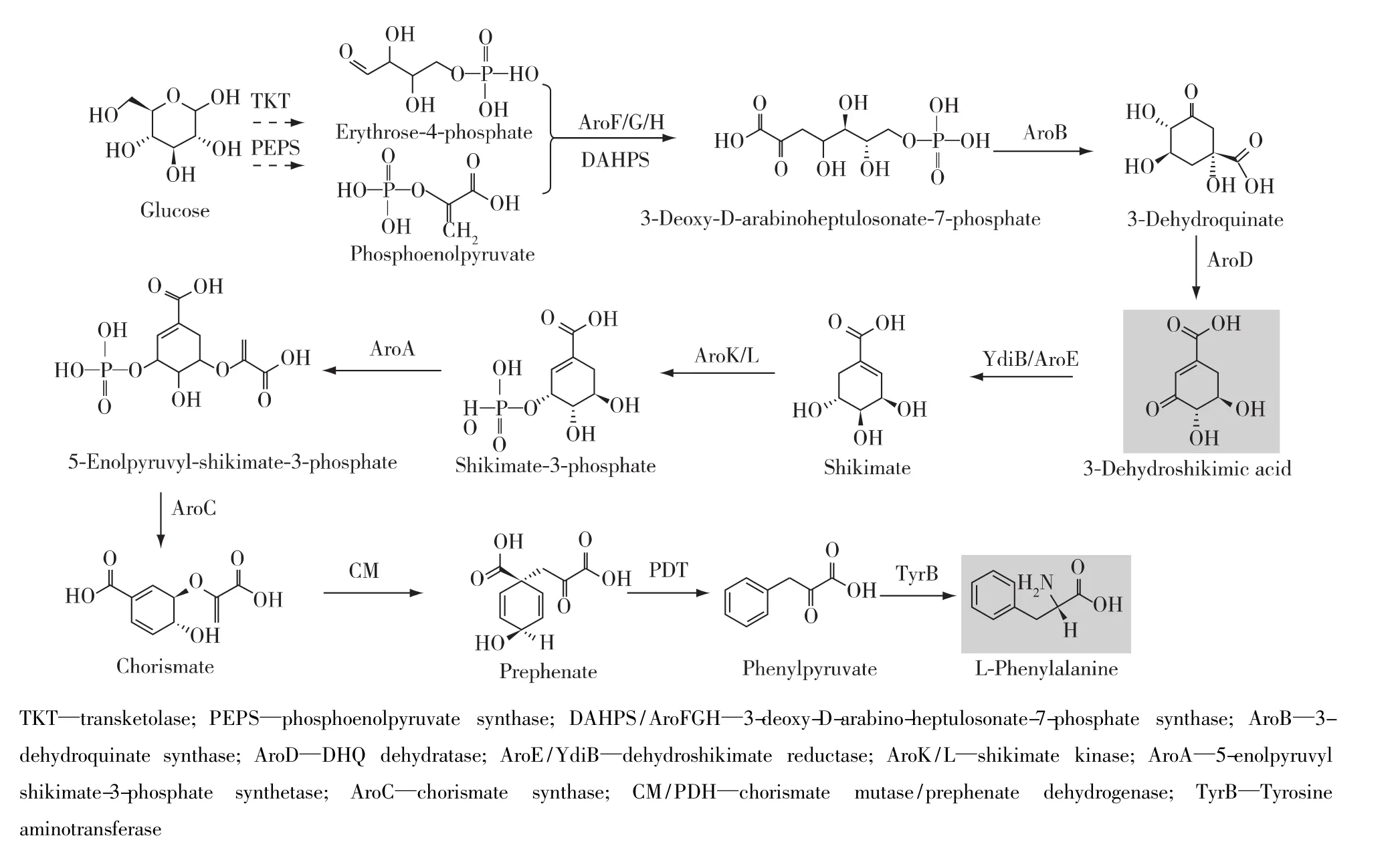
图4 微生物3-脱氢莽草酸和L-苯丙氨酸的代谢途径Fig.4 Metabolic pathways for 3-dehydroshikimic acid and L-phenylalanine production
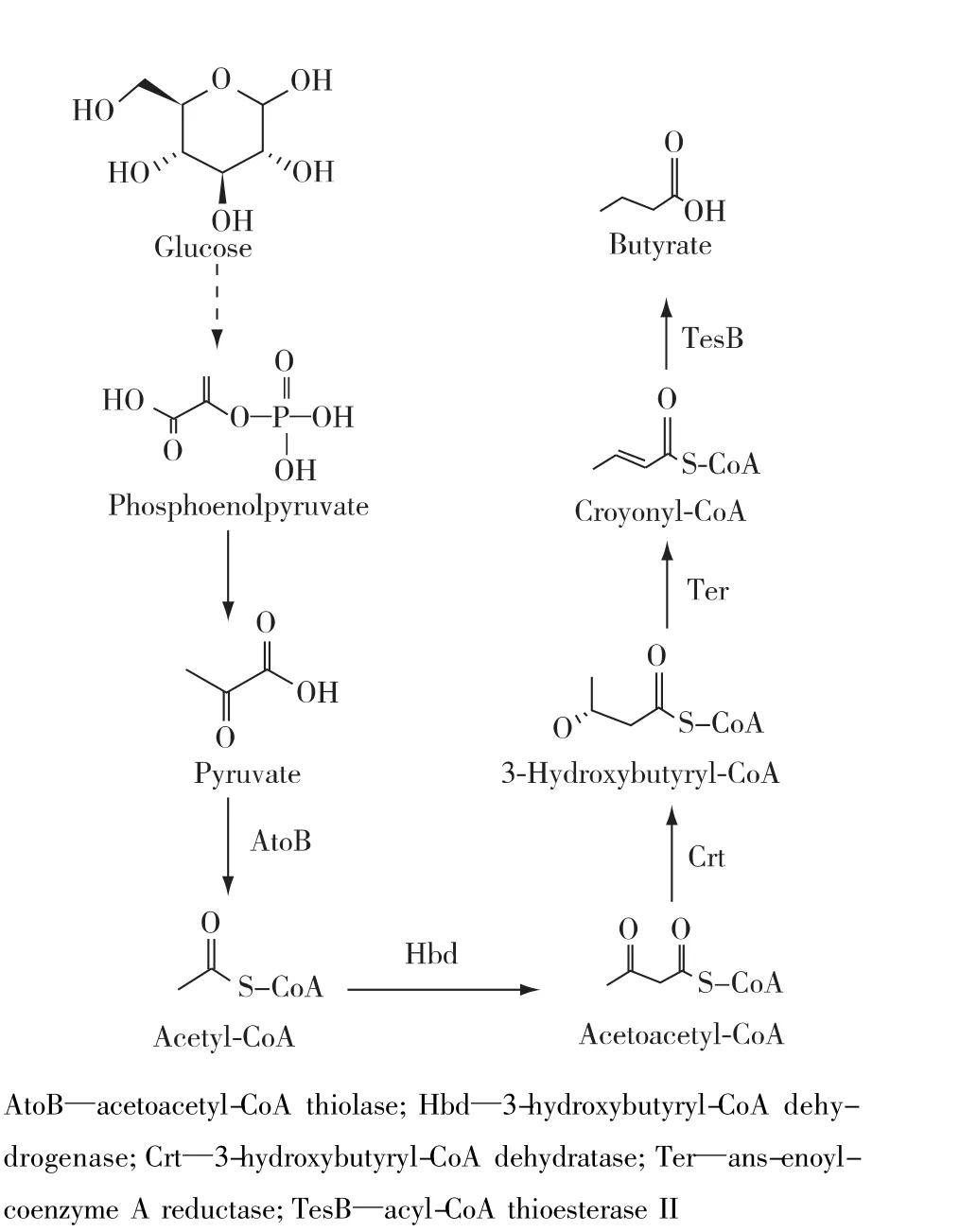
图5 微生物丁酸的代谢途径Fig.5 Metabolic pathways forbutyrate production
4.2 区间工程
区间工程通过区域化产物合成路径与胞内自身代谢路径,从而使二者彼此间的交互影响达到最小化。区间工程将路径酶反应从无限制的胞质环境转换到具有膜结构的细胞器中,有效地降低了底物扩散效应和酶催化的空间距离,提升了细胞工厂合成目标化学品的能力[38]。区间工程常用的路径优化控制策略:1)线粒体工程[39-41]。线粒体中载有许多中心代谢途径,如:柠檬酸循环、氨基酸合成和脂肪酸代谢等,而这些代谢路径能够为化学品的生物合成提供广泛的前体谱。在狭小封闭的线粒体中进行催化反应合成化学品,将会进一步提高底物浓度,改善催化反应的速率和产品的生产强度。该方法已经成功用于异丁醇(图6)[39]和富马酸[42]等化合物的生产。2) 过氧化物酶体工程[43]。过氧化物酶体是由一层单位膜包裹的囊泡,内含丰富的酶类,如:氧化酶、过氧化氢酶和过氧化物酶,不属于内膜系统的膜结合细胞器。另外,过氧化物酶体区别于其他细胞器的特点在于清空这些膜内蛋白,不会影响菌体自身代谢,而这种密闭的微环境也为合成路径的区间化提供了可能。该方法已经成功用于紫色杆菌素[43]和烷烃[44]等化合物的生产。3)羧酶体工程[45]。羧酶体由以蛋白质为主的单层膜包围,内含固定CO2所需的1,5-二磷酸核酮糖羧化酶/加氧酶和碳酸酐酶,是蓝藻细菌和硫杆菌等自养微生物固定CO2的主要场所。因此,羧酶体适合进行涉及CO2固定的生物合成路径。该方法已经成功用于异丁醛(图6)[46]等化合物的生产。
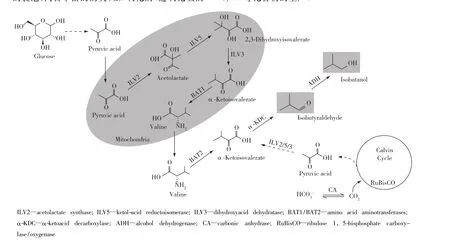
图6 微生物异丁醇和异丁醛的代谢途径Fig.6 Metabolic pathways forisobutanol and isobutyraldehyde production
4.3 模块路径工程
针对涉及多条路径的代谢优化,通常采用单条路径逐一代谢工程优化的方式实现代谢流的平衡。但是,该方法往往需要经历多轮的菌株构建、筛选和优化过程,时间和经济成本较高,不利于进行大规模的优化操作。为了解决上述问题,路径模块化这一概念应运而生,即采用人为划分的方式,将多条路径划分为几个小的路径模块,并在转录(如启动子、基因拷贝数)、翻译(如RBS强度)或蛋白(如蛋白质工程)等水平上,调整途径模块催化特性,在不需要高通量筛选的条件下,实现多条代谢途径的综合优化[47-48]。根据实际的操作方式,模块路径工程常用的路径优化控制策略:1)基于生化反应代谢物特点的模块化[49]。以路径中间代谢物浓度、特性等生化指标作为模块划分依据,通过优化不同模块的表达强度,降低中间代谢物的积累,避免对菌体产生毒害作用和负反馈调节。该方法已经成功用于紫杉醇等化合物的生产[49]。2)基于代谢路径分支节点的模块化[6]。以分支代谢路径和中心代谢路径的代谢物交叉节点作为模块划分依据,通过优化不同模块的碳流输送强度,调控代谢流在路径的实际分布情况,实现菌体生长和产品合成的最优协同。该方法已经成功用于(2S)-生松素(图7)等化合物的生产[50]。3) 基于酶转换数的模块化[51]。针对路径中酶催化效率的不同,以酶转换数作为参考指标,将代谢路径中的不同酶促反应划分成不同模块,通过优化不同模块的催化效率,构建最适的底物传输通道,实现底物转运效率和催化效率的提高。该方法已经成功用于黄酮类化合物(图7)的生产[52]。
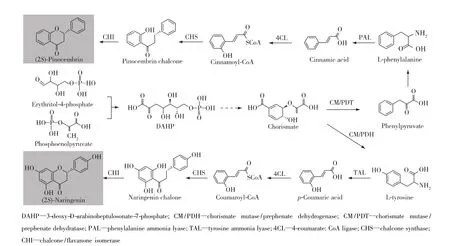
图7 微生物(2S)-生松素和(2S)-柚皮素的代谢途径Fig.7 Metabolic pathways for(2S)-pinocembrin and(2S)-naringenin production
5 结论与展望
针对微生物代谢路径的优化与调控,国内外研究人员从四个方面开展了卓有成效的研究:在DNA水平(如,启动子工程等);在 RNA水平(如,合成RNA开关);在蛋白质水平(如,蛋白质工程);在代谢物水平(如,结构生物学、区间工程、模块路径工程)。上述代谢工程新技术的应用,能够从不同层次水平上对菌株及其代谢路径进行系统的调节和优化,实现系统、简约、高效调控代谢通路中通量平衡的目标。然而,路径代谢反应速率同时受到多种因素扰动的影响,包括:路径基因的表达水平、路径酶的催化能力和中间代谢物的浓度等。现有的代谢路径优化策略,缺乏实时俘获与控制细胞代谢状态的能力,不能有效地维持代谢路径稳态,从而影响目标代谢物的积累。因此,一方面,借助系统生物学的相关技术手段,如:基因组规模代谢网络模型、基因组规模转录调控网络模型、基因组规模蛋白质互作网络模型以及全细胞模型等,从细胞整体水平上理解和把握微生物的生理、代谢和功能状态,有助于实时识别代谢路径优化过程中的关键因素。另一方面,利用精确代谢工程[53]与动态代谢工程[54]的相关策略,如:RNA敏感器(包括天然RNA敏感控制元件、合成的RNA敏感部件等)和蛋白质敏感器(包括转录激活敏感器、蛋白激活敏感器、荧光敏感器、细胞敏感器等),设计可实时调控的微生物代谢系统,动态改造与调控基因的整体表达水平,实现代谢路径的稳态调控。第三方面,基于高通量筛选技术,优化代谢路径 DBTL循环[55]的速率,强化DBTL循环的操作效率,提高单轮DBTL循环所能构建菌株的通量。综上所述,新技术的进一步发展与应用,必将进一步推进微生物细胞工厂的构建效率,提高目标化学品的生产能力,降低生物制造化学品的成本,为各种化合物的绿色生产奠定基础。
[1] PADDON C J,WESTFALL P J,PITERA D J,et al.High-level semi-synthetic production of the potent antimalarial artemisinin[J].Nature,2013,496:528-532.
[2] SAXENA R K,ANAND P,SARAN S,et al.Microbial production of 1, 3-propanediol: recent developments and emerging opportunities[J].Biotechnol Adv,2009,27(6):895-913.
[3] JULLESSON D,DAVID F,PFLEGER B,et al.Impact of synthetic biology and metabolic engineering on industrial production of fine chemicals[J].Biotechnol Adv,2015,33(7):1395-1402.
[4] PADDON C J,KEASLING J D.Semi-synthetic artemisinin:a model forthe use ofsyntheticbiology in pharmaceutical development[J].Nat Rev Microbiol,2014,12(5):355-367.
[5] BARTON N R,BURGARD A P,BURK M J,et al.An integrated biotechnology platform fordeveloping sustainable chemical processes[J].J Ind Microbiol Biotechnol,2015,42(3):349-360.
[6] LO T M,TEO W S,LING H,et al.Microbial engineering strategies to improve cell viability for biochemical production[J].Biotechnol Adv,2013,31(6):903-914.
[7] WU J,LIU P,FAN Y,et al.Multivariate modular metabolic engineering of Escherichia coli to produce resveratrol from L-tyrosine[J].J Biotechnol,2013,167(4):404-411.
[8] SANTOS C N,KOFFAS M,STEPHANOPOULOS G.Optimization of a heterologous pathway for the production of flavonoids from glucose[J].Metab Eng,2011,13(4):392-400.
[9] ALPER H,FISCHER C,NEVOIHT E,et al.Tuning genetic control through promoter engineering[J].Proc Natl Acad Sci USA,2005,102(36):12678-12683.
[10] GUO T,KONG J,ZHANG L,et al.Fine tuning of the lactate and diacetyl production through promoter engineering in Lactococcus lactis[J].PLoS ONE,2012,7(4):e36296.
[11] PARK S H,KIM H U,KIM T Y,et al.Metabolic engineering of Corynebacterium glutamicum for L-arginine production[J].Nat Commun,2014,5:4618.
[12] XU Y,CHU H,GAO C,et al.Systematic metabolic engineering of Escherichia coli for high-yield production of fuel bio-chemical 2,3-butanediol[J].Metab Eng,2014,23:22-33.
[13] ZELCBUCH L,ANTONOVSKY N,BAR-EVEN A,et al.Spanning high-dimensional expression space using ribosome-binding site combinatorics[J].Nucleic Acids Res,2013,41(9):e98.
[14] SALIS H M,MIRSKY E A,VOIGT C A.Automated design of synthetic ribosome binding sites to control protein expression[J].Nat Biotechnol,2009,27(10):946-950.
[15] NA D,LEE D.RBS Designer:software for designing synthetic ribosome binding sites that yields a desired level of protein expression[J].Bioinformatics,2010,26(20):2633-2634.
[16] XU P,GU Q,WANG W,et al.Modular optimization of multi-gene pathways for fatty acids production in E.coli[J].Nat Commun,2013,4:1409.
[17] PFLEGER B F,PITERA D J,SMOLKE C D,et al.Combinatorial engineering of intergenic regions in operons tunes expression of multiple genes[J].Nat Biotechnol,2006,24(8):1027-1032.
[18] WIN M N,SMOLKE C D.A modular and extensible RNA-based gene-regulatory platform for engineering cellular function[J].Proc Natl Acad Sci USA,2007,104(36):14283-14288.
[19] MELLIN J R,COSSART P.Unexpected versatility in bacterial riboswitches[J].Trends Genet,2015,31(3):150-156.
[20] MOORE S J,MAYER M J,BIEDENDIECK R,et al.Towards a cell factory for vitamin B12 production in Bacillus megaterium:bypassing of the cobalamin riboswitch control elements[J].New Biotechnol,2014,31(6):553-561.
[21] NA D,YOO S M,CHUNG H,et al.Metabolic engineering of Escherichia coli using synthetic small regulatory RNAs[J].Nat Biotechnol,2013,31(2):170-174.
[22] FOO J L,CHING C B,CHANG M W,et al.The imminent role of protein engineering in synthetic biology[J].Biotechnol Adv,2012,30(3):541-549.
[23] LEONARD E,AJIKUMAR P K,THAYER K,et al.Combining metabolic and protein engineering of a terpenoid biosynthetic pathway for overproduction and selectivity control[J].Proc Natl Acad Sci USA,2010,107(31):13654-13659.
[24] WANG C,OH M K,LIAO J C.Directed evolution of metabolically engineered Escherichia coli for carotenoid production[J].Biotechnol Prog,2000,16(6):922-926.
[25] AMARA A A,STEINBUCHEL A,REHM B H.In vivo evolution ofthe Aeromonas punctata polyhydroxyalkanoate (PHA)synthase:isolation and characterization of modified PHA synthases with enhanced activity[J].Appl Microbiol Biotechnol,2002,59(4/5):477-482.
[26] ZHANG K,SAWAYA M R,EISENBERG D S,et al.Expanding metabolism for biosynthesis of nonnatural alcohols[J].Proc Natl Acad Sci USA,2008,105(52):20653-20658.
[27] RAN N,FROST J W.Directed evolution of 2-keto-3-deoxy-6-phosphogalactonate aldolase to replace 3-deoxy-D-arabinoheptulosonic acid 7-phosphate synthase[J].J Am Chem Soc,2007,129(19):6130-6139.
[28] TANG S Y,FAZELINIA H,CIRINO P C.AraC regulatory protein mutants with altered effector specificity[J].J Am Chem Soc,2008,130(15):5267-5271.
[29] DENG M D,GRUND A D,WASSINK S L,et al.Directed evolution and characterization of Escherichia coli glucosamine synthase[J].Biochimie,2006,88(5):419-429.
[30] LIU S P,LIU R X,XIAO M R,et al.A systems level engineeredE.coli capable of efficiently producing L-phenylalanine[J].Process Biochem,2014,49(5):751-757.
[31] LEE J W,NA D,PARK J M,et al.Systems metabolic engineering of microorganisms for natural and non-natural chemicals[J].Nat Chem Biol,2012,8(6):536-546.
[32] LEE S Y,KIM H U.Systems strategies for developing industrial microbial strains[J].Nat Biotechnol,2015,33(10):1061-1072.
[33] CONRADO R J,WU G C,BOOCK J T,et al.DNA-guided assembly of biosynthetic pathways promotes improved catalytic efficiency[J].Nucleic Acids Res,2012,40(4):1879-1889.
[34] DELEBECQUE C J,LINDNER A B,SILVER P A,et al.Organization of intracellular reactions with rationally designed RNA assemblies[J].Science,2011,333(6041):470-474.
[35] DUEBER J E,WU G C,MALMIRCHEGINI G R,et al.Synthetic protein scaffolds provide modular control over metabolic flux[J].Nat Biotechnol,2009,27(8):753-759.
[36] BAEK J M,MAZUMDAR S,LEE S W,et al.Butyrate production in engineered Escherichia coliwith synthetic scaffolds[J].Biotechnol Bioeng,2013,110(10):2790-2794.
[37] MOON T S,DUEBER J E,SHIUE E,et al.Use of modular,synthetic scaffolds for improved production of glucaric acid in engineered E.coli[J].Metab Eng,2010,12(3):298-305.
[38] CONRADO R J,VARNER J D,DELISA M P.Engineering the spatial organization of metabolic enzymes:mimicking nature's synergy[J].Curr Opin Biotechnol,2008,19(5):492-499.
[39] AVALOS J L, FINK G R, STEPHANOPOULOS G.Compartmentalization of metabolic pathways in yeast mitochondria improves the production of branched-chain alcohols[J].Nat Biotechnol,2013,31(4):335-341.
[40] SACZEBARA F M,CHANDELIER C,VILLERET C,et al.Total biosynthesis of hydrocortisone from a simple carbon source in yeast[J].Nat Biotechnol,2003,21(2):143-149.
[41] FARHI M,MARHEVKA E,MASCI T,et al.Harnessing yeast subcellular compartments for the production of plant terpenoids[J].Metab Eng,2011,13(5):474-481.
[42] CHEN X,DONG X,WANG Y,et al.Mitochondrial engineering of the TCA cycle for fumarate production[J].Metab Eng,2015,31:62-73.
[43] DELOACHE W C,RUSS Z N,DUEBER J E.Towards repurposing the yeast peroxisome for compartmentalizing heterologous metabolic pathways[J].Nat Commun,2016,7:11152.
[44] ZHOU Y J,BUIJS N A,ZHU Z,et al.Harnessing yeast peroxisomes for biosynthesis of fatty-acid-derived biofuels and chemicals with relieved side-pathway competition[J].J Am Chem Soc,2016,138(47):15368-15377.
[45] CAMERON J C,WILSON S C,BERNSTEIN S L,et al.Biogenesis of a bacterial organelle:the carboxysome assembly pathway[J].Cell,2013,155(5):1131-1140.
[46] ATSUMI S,HIGASHIDE W,LIAO J C.Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde[J].Nat Biotechnol,2009,27(12):1177-1180.
[47] JUMINAGA D,BAIDOO E E,REDDING-JOHANSON A M,et al.Modular engineering of L-tyrosine production in Escherichia coli[J].Appl Environ Microbiol,2012,78(1):89-98.
[48] ZHOU Y J,GAO W,RONG Q,et al.Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production[J].J Am Chem Soc,2012,134(6):3234-3241.
[49] AJIKUMAR P K,XIAO W H,TYO K E,et al.Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli[J].Science,2010,330:70-74.
[50] WU J,DU G,ZHOU J,et al.Metabolic engineering of Escherichia coli for(2S)-pinocembrin production from glucose by a modular metabolic strategy[J].Metab Eng,2013,16:48-55.
[51] YADAV V G,DE M M,LIM C G,et al.The future of metabolic engineering and synthetic biology:towards a systematic practice[J].Metab Eng,2012,14(3):233-241.
[52] PIRIE C M,DE M M,JONES P K L,et al.Integrating the protein and metabolic engineering toolkits for next-generation chemical biosynthesis[J].ACS Chem Biol,2013,8(4):662-672.
[53] MCNERNEY M P,WATSTEIN D M,STYCZYNSKI M P.Precision metabolic engineering:the design ofresponsive,selective,and controllable metabolic systems[J].Metab Eng,2015,31:123-131.
[54] BROCKMAN IM,PRATHER K L.Dynamicmetabolic engineering:new strategies for developing responsive cell factories[J].Biotechnol J,2015,10(9):1360-1369.
[55] NIELSEN J,KEASLING J D.Engineering cellular metabolism[J].Cell,2016,164(6):1185-1197.
(责任编辑 荀志金)
Optimization and regulation of microbial metabolic pathways
CHEN Xiulai1,2,3,GAO Cong1,2,3,LIU Jia1,2,3,LUO Qiuling1,2,3,LIU Liming1,2,3
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China;3.Laboratory of Food Microbial-Manufacturing Engineering,Jiangnan University,Wuxi 214122,China)
Metabolic pathway balance plays an important role in producing chemicals,pharmaceuticals andbiofuels.To meet thedemand of industrial production,microbes should maintain a maximal carbon flux towards target metabolites withoutfluctuations in metabolic pathway.We reviewed the detailed strategies to optimize and regulate metabolic pathwaybalance at four levels,i.e.,DNA,RNA,protein and metabolite level.Furthermore,we indicated future research directions to further optimize and regulate metabolic pathway balance.
metabolic pathway;pathway optimization;metabolic engineering;synthetic biology
Q815
A
1672-3678(2017)05-0001-08
10.3969/j.issn.1672-3678.2017.05.001
2017-06-07
江苏省自然科学基金(BK20160163);中国博士后科学基金(2016M600362);江南大学自主科研计划重点项目(JUSRP51611A);江南大学自主科研计划青年基金(JUSRP116022)
陈修来(1985—),男,山东莒县人,副教授,研究方向:系统代谢工程与合成生物学;刘立明(联系人),教授,E-mail:mingll@jiangnan.edu.cn
