代谢工程改造大肠杆菌生产乳酸的研究进展
2017-09-30张利华陈献忠
张利华,陈献忠,沈 微,樊 游
(江南大学 生物工程学院,江苏 无锡 214122)
代谢工程改造大肠杆菌生产乳酸的研究进展
张利华,陈献忠,沈 微,樊 游
(江南大学 生物工程学院,江苏 无锡 214122)
乳酸是自然界中最小的手性分子,广泛应用于食品、医药和化工等领域,同时也是合成生物可降解塑料——聚乳酸的前体。目前,化学合成法和微生物发酵法是生产乳酸的两种主要方法,而后者在底物的可再生性、产物光学纯度和环境友好等方面均具有潜在优势。自然界中许多微生物细胞都能合成和积累乳酸,如大肠杆菌、酿酒酵母和乳酸菌等。与乳酸菌、芽胞乳杆菌和谷氨酸棒状杆菌等乳酸生产菌株相比,大肠杆菌具有生长速度快、营养要求简单、易于高密度发酵、代谢网络清楚、遗传操作方法成熟和产物乳酸光学纯度高等优势。本文中,笔者介绍了乳酸的研究现状及其在工业生产领域中的作用,系统综述了国内外通过代谢工程改造大肠杆菌生产乳酸的研究进展,在此基础上展望了乳酸生产研究的发展方向,以期为其工业应用提供参考。
大肠杆菌;乳酸;代谢工程;细胞工厂
乳酸(lactic acid,LA)是世界三大有机酸(乳酸、乙酸和柠檬酸)之一,且已被美国食品和药品管理局认定为“公认安全物质(GRAS)”,广泛应用于食品、医药和化妆品等领域[1]。近年来,随着人们环保意识的不断提升,以聚乳酸为代表的生物可降解塑料的需求急剧增加,而高光学纯乳酸单体是合成聚乳酸的前体物质[2-3]。近年来,全球乳酸和聚乳酸需求量增长迅速,预计到2020年将分别达到196 和 120.5 万 t[4]。乳酸分子中含有一个手性碳原子,因此具有旋光性,可以形成 D(-)-乳酸和L(+)-乳酸,一般通过化学合成法获得的乳酸为二者的混合物,称为外消旋型乳酸(DL-乳酸),应用价值远不及高光学纯度的乳酸[5]。目前,微生物发酵法是生产高光学纯度乳酸的唯一方法[4],常见的产乳酸微生物主要有细菌、酵母等,表1总结了一些常见的乳酸生产菌种及其发酵性能。与其他产乳酸的微生物相比,大肠杆菌具有生长迅速、营养需求简单和发酵周期短等优势。更重要的是,大肠杆菌的遗传背景清楚、易于进行遗传操作,在代谢工程育种中具有显著优势。因此,很多学者致力于通过代谢工程手段改造大肠杆菌生产乳酸的研究。本文中,笔者将在介绍乳酸的性质和应用的基础上,对代谢工程改造E.coli生产乳酸的最新研究进展进行系统综述。
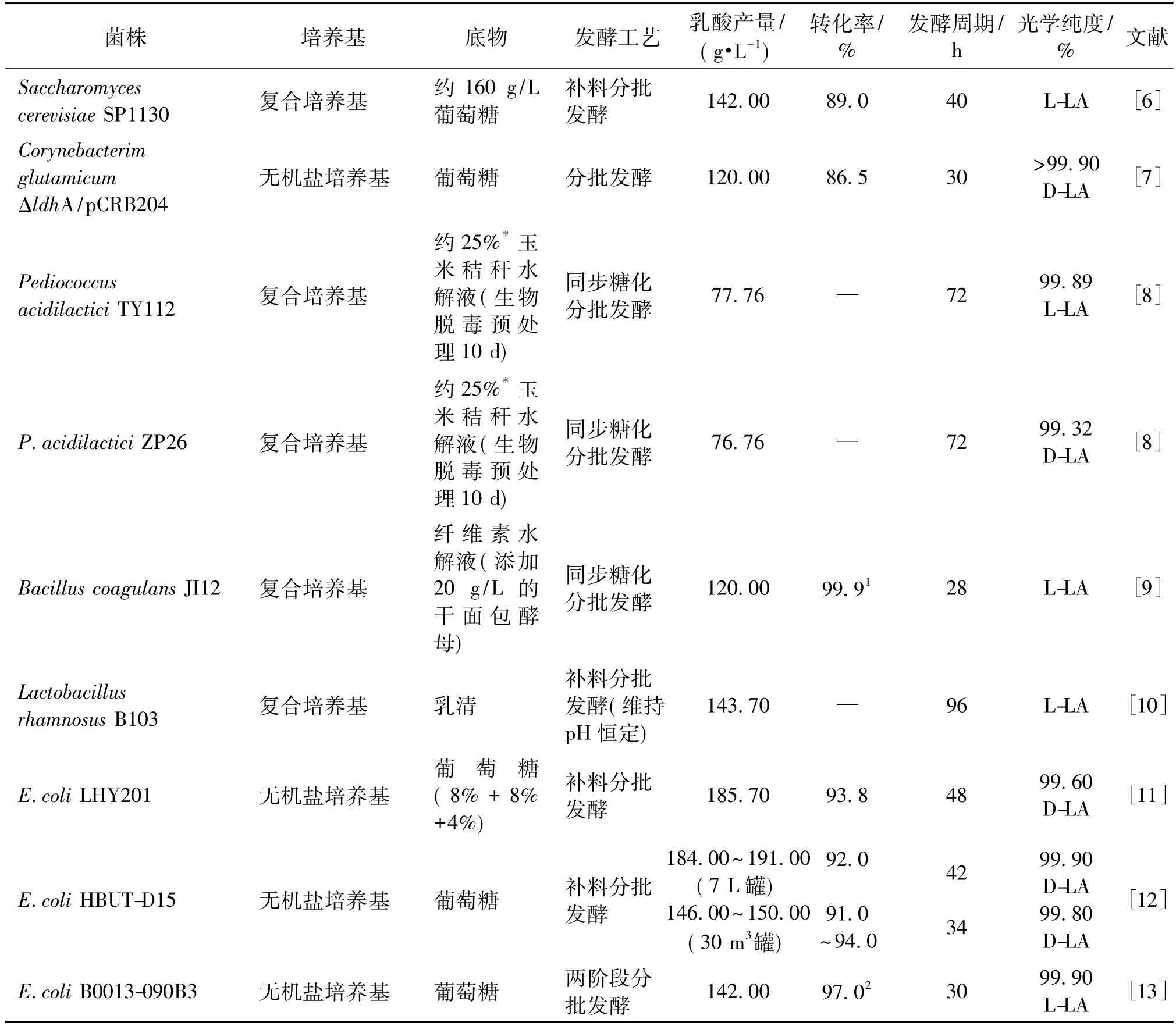
表1 产乳酸菌株的生产性能的比较Table 1 Comparison of fermentation performances of lactate-producing microorganisms
1 乳酸的应用
乳酸学名α-羟基丙酸,分子具有旋光性,是多种手性物质合成的前体,广泛地应用于食品、医药、化妆品和农药等众多领域[1,4]。D-乳酸不仅可以用于氨基酸的不对称合成[14],也可以应用于芳香丙酸类除草剂的手性合成。例如,日本的伊赛尔化学工业公司以高光学纯度的D-乳酸作为原料,研发并生产了性能优良的针对禾本科杂草的“绿色”除草剂骠马(Puma Super)[15],并且以高光学纯度的D-乳酸为原料合成的芳香丙酸类除草剂的药效较L-乳酸高6~12倍[16]。与 D-乳酸相比,高光学纯度的 L-乳酸在医药和食品领域中具有明显优势,这主要是因为人体内只有L-乳酸脱氢酶,无D-乳酸脱氢酶,当人体D-乳酸含量过高时会出现不良反应[17]。在啤酒行业中,常用高光学纯度的L-乳酸替代磷酸等添加剂,不仅可以调节 pH,还使得饮料的口感更佳[18]。鉴于L-乳酸在食品行业中的独特优势,目前食品安全级的高纯度L-乳酸需求量逐年增加。
乳酸的另一个重要应用是生产环保生物材料聚乳酸。聚乳酸是一种聚酯类材料,具有良好的生物相容性和生物可降解性,并且安全无毒。根据合成聚乳酸单体的不同,可以将聚乳酸分为聚D-乳酸(PDLA)、聚 L-乳 酸 (PLLA) 和 聚 DL-乳 酸(PDLLA)。尽管D-乳酸与L-乳酸单体的物理性质基本相同,但是PDLA、PLLA和PDLLA的物理性质却相差较大。例如,PDLA和PLLA的力学强度低、韧性差且熔点较低(170~180℃),而以不同比例混合的PDLLA不仅熔点(220~230℃)提高,而且力学性能和水解能力都有所改善[2-3]。近年来,随着人们环保意识的不断提高和化石资源的耗竭,以乳酸为原料的高分子聚合物的研究已经成为当今社会普遍关注的研究热点与重点。美国和日本等一些国家已经开始用聚乳酸生产绿色包装材料(如垃圾袋、包装纸和饮料罐等),并投入市场使用。此外,还有一些地区用聚乳酸材料代替传统的聚乙烯农用地膜,不仅解决了传统地膜易破、透明度差的问题,还避免了白色污染对土壤的破坏[19]。
预计到2020年,全球乳酸和聚乳酸的需求量将分别达到 196.0 和 120.5 万 t[4],但是目前全球乳酸的产能不足且价格较高,进而导致聚乳酸的生产成本居高不下,很难在价格上与传统的聚乙烯、聚丙烯和聚苯乙烯材料相竞争[3,8]。因此,必须系统研究乳酸生产菌株的代谢机理,进而选育出能够利用廉价原料高效生产高光学纯度和化学纯度乳酸的生产菌种,以降低发酵法生产乳酸的成本,这对于扩大乳酸的应用范围和聚乳酸材料的推广以及环境保护都具有非常重要的意义。
2 大肠杆菌产乳酸代谢途径的研究
大肠杆菌利用几种常见底物生产乳酸的主要代谢网络如图1所示。野生型E.coli细胞可以利用自身的D-乳酸脱氢酶(LdhA)将糖酵解途径(EMP)中间产物丙酮酸转化为D-乳酸。由于野生型大肠杆菌不具有L-乳酸脱氢酶,通常情况下,L-乳酸很难在发酵液中积累,当胞内有毒中间产物丙酮醛积累量增加时,菌体会通过醛脱氢酶A(AldA)将丙酮醛转化为少量的 L-乳酸[5,20],但是L-乳酸的含量极低,几乎无法检测。由图1可知,乳酸仅仅是大肠杆菌众多代谢产物中的一种,在丙酮酸代谢节点上,存在许多代谢支流与乳酸合成途径竞争前体底物。因此,野生型大肠杆菌发酵糖类不仅产生乳酸,还会伴随着甲酸、乙酸、琥珀酸和丁二酸等多种有机酸和乙醇的产生,进而导致底物转化率低,乳酸分离纯化难度大等问题。此外,副产物代谢途径还与乳酸合成过程竞争还原力(主要是NADH)[21],且副产物的积累也导致发酵液pH下降,不利于细胞的生长和乳酸的生产。因此,利用大肠杆菌生产乳酸的研究重点之一是通过基因工程手段,理性地删除竞争代谢途径,并在平衡细胞物质代谢和能量代谢的基础上增强乳酸合成途径,从而快速获得生产性能优良的工程菌株。
为了促进乳酸的积累,有研究人员尝试在E.coli中过表达自身的D-乳酸脱氢酶基因(ldhA),虽然乳酸脱氢酶的活性大幅度提高(10倍以上),但是仍然有较多的丙酮酸流向其他代谢支路,并且菌体的生长也受到了一定程度的抑制[22-23]。后来,很多研究工作都尝试通过代谢改造来阻断竞争代谢途径[24-26],进而促进乳酸合成途径的前体物质的供给。研究表明,通过删除单拷贝的乙酸激酶基因(ackA)或磷酸转乙酰酶基因(pta),分配到乳酸合成途径的代谢流增强,乳酸的产量也明显提高[25,27];删除丙酮酸甲酸裂解酶基因(pflA或pflB)或磷酸烯醇式丙酮羧化酶基因(ppc)也可以大幅度提高乳酸的产量[24,26]。虽然代谢改造可以提高乳酸的积累量,但是某些基因的删除却不利于工程菌株在工业生产中的应用。例如,删除ppc基因可以提高乳酸产量,却导致菌体无法利用无机盐培养基进行生长和乳酸发酵[26]。
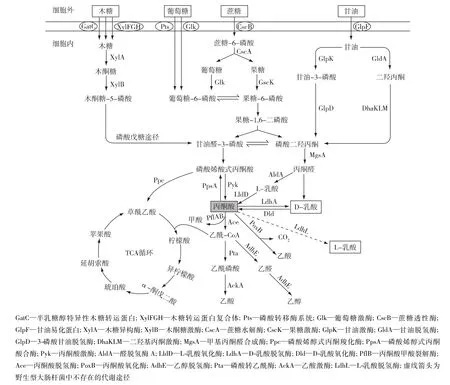
图1 大肠杆菌的乳酸代谢网络Fig.1 Metabolic pathway of lactic acid in E.coli
相对于简单的单基因删除,涉及多条代谢途径的多个基因的叠加删除可能更有利于目标产物的积累。Zhao等[28]在产乙醇的大肠杆菌重组菌株SZ470( ΔfrdBC,ΔldhA,ΔackA,ΔpflB,ΔmgsA,ΔpdhR::pflBp6-acEF-lpd)的基础上删除乙醇脱氢酶基因(adhE),然后整合表达来源于乳酸片球菌的L-乳酸脱氢酶基因(ldhL),并对工程菌株进行驯化,所得菌株WL204的L-乳酸产量可达62 g/L;在此基础上,将L-乳酸脱氢酶直接替换为D-乳酸脱氢酶,并通过删除pstG基因来解除宿主菌株中的葡萄糖阻遏效应,所得工程菌株JH15可以同时发酵木糖和葡萄糖生产高光学纯度的 D-乳酸[29]。Grabar等[5]研究发现,同时删除pflB、富马酸还原酶基因(frd)、adhE和ackA后,工程菌株可以在无机盐发酵培养基中积累110 g/L的D-乳酸(光学纯度95%),进一步删除甲基丙酮醛合成酶基因(mgsA),不仅乳酸的产量有所提高(118 g/L),而且光学纯度可以达到99.9%以上。周丽[30]在系统地研究单基因删除和多基因组合删除对大肠杆菌乳酸代谢影响的基础上,选择性地组合删除野生型大肠杆菌中的8个基因:ackA、pta、磷酸烯醇式丙酮酸合酶基因(pps)、pflB、FAD依赖型D-乳酸脱氢酶基因(dld)、丙酮酸氧化酶基因(poxB)、adhE和富马酸还原酶基因(frdA),重组菌株B0013-070的发酵液中多种副产物的含量都得到了很好的控制,并且D-乳酸产量可达125 g/L,光学纯度大于99.9%。值得指出的是,目前已经有利用经过代谢工程改造的大肠杆菌进行半工业化生产乳酸的研究[12],在30 m3发酵罐中发酵160 g/L的葡萄糖,乳酸产量可达146.00~150.00 g/L,生产强度为 3.95~4.29 g/(L·h),光学纯度也达到99.80%(表1)。

表2 代谢工程改造大肠杆菌产乳酸的性能比较Table 2 Comparison of fermentation performances of metabolically engineered E.coli for lactic acid production
3 大肠杆菌利用不同底物产乳酸的研究
随着全球聚乳酸产业的不断发展壮大,乳酸的价格成了限制聚乳酸材料大规模投入市场应用的一个重要难题[31]。目前,工业化生产乳酸主要以葡萄糖和淀粉为原料,这不仅与食品和饲料等行业竞争原料,而且导致乳酸生产成本较高(原材料占生产成本的40%~70%)[4]。因此,寻找价格低廉的底物作为乳酸生产的原料,成为降低乳酸生产成本、促进乳酸产业发展的重要途径之一。作为基因工程的模式菌株,大肠杆菌发酵法生产乳酸不仅具有原料转化率高和产物光学纯度高等众多优势,而且大肠杆菌可以利用己糖和戊糖等多种碳源,为其在工业化生产乳酸中的应用奠定基础。一些经过代谢工程改造的E.coli菌株利用不同底物进行乳酸发酵的生产性能总结于表2中。
3.1 利用葡萄糖生产乳酸
葡萄糖是目前发酵产业中最重要的原料之一,广泛地应用于氨基酸发酵和乳酸发酵等行业。葡萄糖在E.coli中的代谢流程如图1所示。由图1可知,乳酸只是众多代谢中间产物中的一种。野生型大肠杆菌代谢葡萄糖只能产生D-乳酸,几乎不能积累L-乳酸,而经过代谢改造的大肠杆菌不仅可以发酵葡萄糖高效地生产D-乳酸,还可以大量积累L-乳酸,同时葡萄糖的转化率通常超过 90%[13,32]。Grabar等[5]在删除乳酸代谢的部分竞争途径后,通过向无机盐发酵培养基中添加甜菜碱(渗透压保护剂),工程菌株可以高效地转化葡萄糖,积累118 g/L的D-乳酸,葡萄糖转化率高达98%。利用类似的策略,Zhou等[33]构建了工程菌株B0013-070(表2),通过好氧-限氧两阶段发酵法,D-乳酸产量达到114.0 g/L,产酸阶段乳酸的生产强度可达10.1 g/(L·h),在此基础上尝试通过温控开关(PR-PL调控ldhA基因表达)设计来协调菌株的生长和乳酸发酵之间的矛盾,进一步提高了乳酸的产量[34]。此外,也有一些研究尝试利用高浓度的乳酸盐来对代谢工程菌株进行驯化,不仅可以提高菌株对乳酸的耐受性,还有利于协调菌体生长与乳酸发酵之间的物质和能量平衡[11-12],这些经过驯化培养后的菌株发酵葡萄糖生产乳酸的能力都有不同程度的提高,并且一些菌株已经可以实现半工业化乳酸生产[12]。
葡萄糖是目前利用大肠杆菌发酵生产乳酸的最优碳源,其作为乳酸发酵的底物具有很多优点,如发酵周期短、底物转化率高和乳酸产量高等,但是葡萄糖作为发酵底物增加了乳酸的生产成本,并且葡萄糖是一种速效碳源,浓度过高时会产生阻遏效应。因此,从乳酸产业的发展角度来看,葡萄糖并不是未来乳酸工业生产的最合适原料。
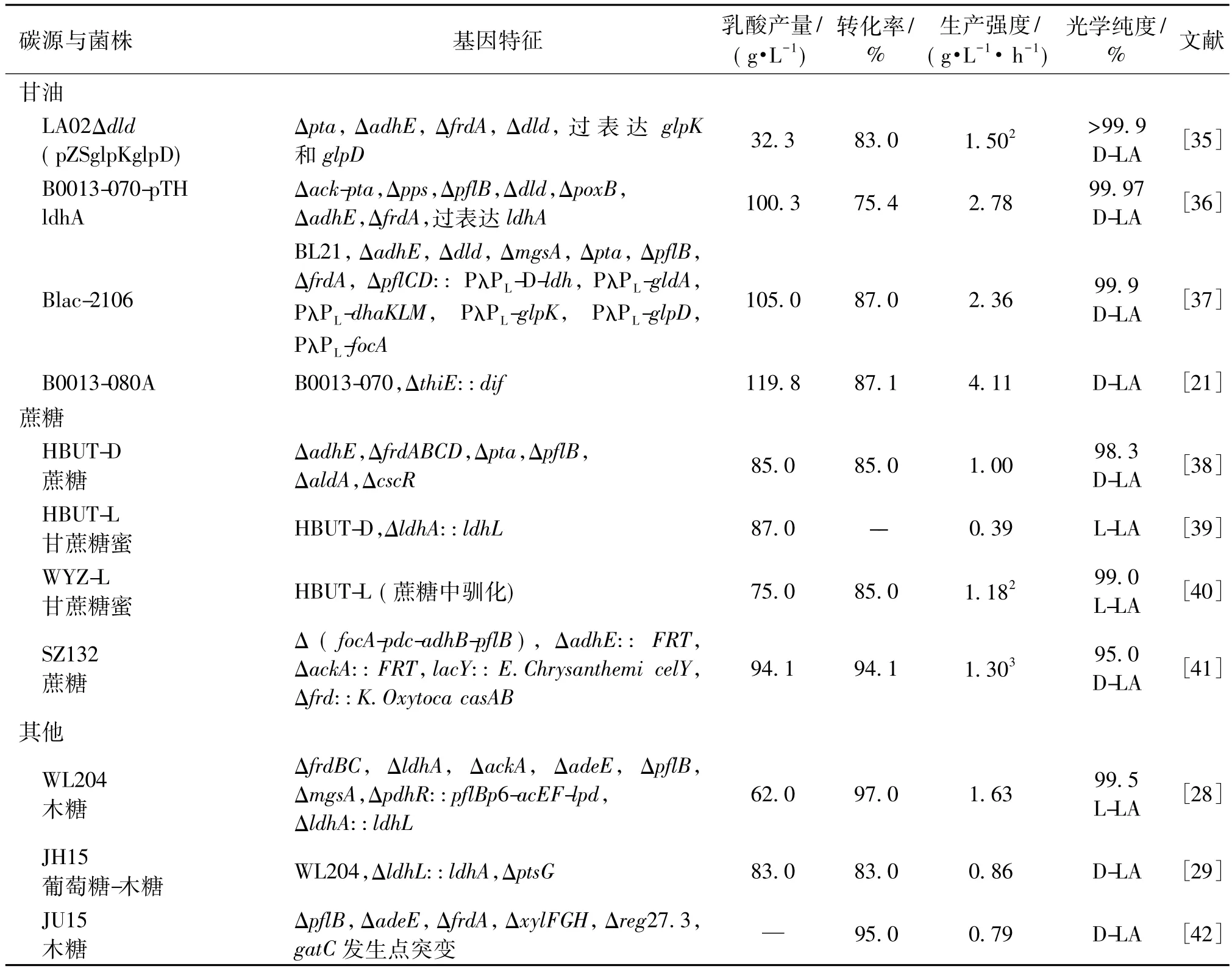
续表2
3.2 利用甘油生产乳酸
近年来,随着生物柴油制造业和脂肪酸工业的迅速发展,大量的水解副产物甘油(俗称粗甘油)伴随而生。目前,粗甘油已经成为来源丰富且价格低廉的含碳资源[43]。其中,以粗甘油作为原材料,通过大肠杆菌工程菌株发酵生产乳酸的成本较低,与粗甘油的精制相比较,更加具有经济效益[44]。
甘油在大肠杆菌细胞内的代谢流程如图1所示。当发酵液中的溶氧不足时,E.coli发酵甘油每产生1分子的乳酸,细胞内就会积累 1分子的NADH[43],这不仅破坏了菌体内氧化还原力的平衡,还抑制了乳酸的进一步积累。另一方面,在溶氧充足的情况下,大肠杆菌可以利用甘油快速生长,但是乳酸的合成却受到抑制,而在溶氧受到限制时,细胞内供能不足,不利于菌体的生长,却可以促进乳酸的发酵[35,43]。因此,在利用大肠杆菌发酵甘油生产乳酸的过程中,协调菌体内的氧化还原力平衡和菌体生长与乳酸合成之间的平衡,是保证乳酸高效生产的关键所在。Mazumdar等[35]研究发现,删除大肠杆菌中乳酸合成代谢途径的部分竞争支流后,通过过表达glpK和glpD基因可以提高甘油的代谢效率,工程菌株通过乳酸合成路径生产1 mol乳酸的同时产生1~2 mol的ATP,并且可以维持细胞内的氧化还原力平衡。笔者所在课题组的Chen等[36]也利用类似的策略来阻断竞争代谢支流,并通过温控开关设计来调控菌体的生长与乳酸的合成之间的平衡,所构建的工程菌株具有良好的发酵工业粗甘油生产乳酸的性能,发酵36 h可积累100.3 g/L的 D-乳酸,产酸强度为 2.78 g/(L·h)。而Tian等[21]则通过删除硫胺素焦磷酸合酶基因(thiE),构建营养缺陷型菌株,然后通过控制外源添加硫胺素的用量来控制细胞生长,从而协调菌体生长与乳酸发酵之间的平衡,也取得了很好的效果。Wang等[37]则在删除乳酸合成代谢途径的竞争支流后,删除mgsA基因来进一步提高乳酸的光学纯度,并通过表达focA基因来促进乳酸的分泌,工程菌株发酵甘油产D-乳酸高达105.0 g/L。
目前,大肠杆菌发酵粗甘油生产乳酸的研究已经取得了很好的结果,但是乳酸的产量仍然较以葡萄糖为底物时低。分析其原因,可能是因为甘油的还原性比葡萄糖等糖类物质高,所以在对大肠杆菌宿主进行代谢改造时需要全面地协调细胞内各代谢通路之间的矛盾,不仅要阻断乳酸合成途径的竞争代谢途径和乳酸分解途径,提高底物的转化率,还要平衡细胞内的氧化还原力供给,以提高乳酸的生产强度,这会增加代谢调控的复杂性,对代谢调控精确度的要求也更高。3.3 利用蔗糖生产乳酸
蔗糖是一种广泛存在于甘蔗和甜菜等植物体内的二糖,被认定为目前发酵行业中最廉价的碳源[45]。Wang 等[38]利用一株可以代谢蔗糖的 E.coli W作为出发菌株,经过代谢改造获得工程菌株HBUT-D(表2),该菌株可以在无机盐培养基中发酵蔗糖生产D-乳酸,并且蔗糖的转化率可达85%。随后他们将HBUT-D菌株的ldhA基因删除,并引入Pediococcus acidilactici菌株的ldhL基因,经过连续的蔗糖适应性驯化以后,工程菌株的蔗糖操纵子(cscA和cscB)的表达水平得到加强,所得菌株可以发酵蔗糖或甘蔗糖蜜,积累较高浓度的 L-乳酸[39-40]。Zhou 等[46]则以 E.coli W 作为出发菌株,经代谢途径改造后的工程菌株可以在复合培养基中发酵100 g/L的蔗糖,并且蔗糖的转化率高达95%,通过添加甜菜碱来提高菌株在无机盐培养基中对高浓度底物的耐受性,菌株可以在无机盐培养基中发酵蔗糖,产生94 g/L的D-乳酸[41]。然而,自然界中超过50%的大肠杆菌不能直接利用蔗糖[47]。因此,一些研究者尝试通过基因工程手段在不能代谢蔗糖的E.coli菌株中表达蔗糖代谢相关的基因,所得工程菌株可以利用蔗糖和糖蜜作为唯一碳源进行乳酸发酵[48],这也拓展了工程菌株的底物利用范围。
3.4 利用其他糖类生产乳酸
木质纤维素原料在自然界中广泛存在,是世界上产量和储存量最丰富的碳源,具有可再生、含糖量高和价格低廉等优点,以此为原料,不与人畜竞争粮食资源[49]。随着传统资源的消耗和人们环保意识的提高,近年来以木质纤维素作为发酵原料的研究引起了人们的广泛关注。目前,已经有多种纤维素原料被应用于乳酸的生产研究,如甜高粱[50]和玉米秸秆[51]等,但是通过大肠杆菌直接利用纤维素原料进行乳酸发酵的研究报道较少。这是因为:一方面在于木质纤维素原料结构稳定,彻底水解的工艺复杂;另一方面木质纤维素水解液中糖分组成复杂,而大肠杆菌中存在碳代谢阻遏效应(如在葡萄糖和木糖同时存在时,优先利用葡萄糖),不利于乳酸的生产和原料的充分利用。
一些经过代谢工程改造的大肠杆菌可以很好地利用木糖作为唯一碳源进行乳酸生产[28,52],但是当葡萄糖同时存在时却优先利用葡萄糖,并且在葡萄糖消耗完后木糖仍然不能被完全利用。研究表明,通过删除E.coli菌株中的葡萄糖跨膜转运基因ptsG,可以显著降低葡萄糖的抑制效应,工程菌株可以同时高效地利用葡萄糖和木糖[42,53],并且菌株还可以发酵稻草水解液,积累25.15 g/L的D-乳酸。为了提高木质纤维素水解液中不同糖类的利用率,有研究者尝试利用多菌共同发酵的方法进行乳酸生产。Eiteman等[54]构建了两株D-乳酸生产菌株,其 中 大 肠 杆 菌 ALS1073(ΔpflB,ΔptsG763,ΔmanZ743,Δglk-726)不能利用葡萄糖,而 ALS1074(ΔpflB,ΔxylA748)菌株不能利用木糖,通过控制两株菌的生物量,就可以很好地同时发酵葡萄糖和木糖生产乳酸,这两种策略都为利用大肠杆菌发酵木质纤维素生产乳酸奠定了理论基础。
4 总结与展望
利用大肠杆菌发酵生产乳酸的最终目标在于把廉价的原料高转化率、高生产强度和高产量地转化为目标产物。为了达到这一目的,众多科研工作者尝试从各个方面来改造大肠杆菌宿主,删除副产物代谢途径,增强目标产物的代谢通路,协调乳酸发酵过程中的能量平衡、氧化还原力平衡等,已经取得了一定的成果,但是离完全工业化生产乳酸仍有一定的距离。
微生物是一个精密的细胞工厂,目标产物的合成必须在整个代谢网络中多种酶的协同作用下才能完成。因此,今后还可以从以下几个方面对利用大肠杆菌生产乳酸展开研究。首先,在现有研究基础上结合代谢网络分析、转录组学分析和代谢通量分析等技术对细胞的乳酸代谢网络进行全局分析,找出不同代谢通路之间的联系,进而理性地设计细胞代谢通路,从而协调乳酸积累与中间产物生成、乳酸积累与菌体生长之间的关系,进一步提高菌体的乳酸生产性能。其次,大肠杆菌对酸的耐受性不如芽孢杆菌和乳杆菌等菌株,发酵过程中常常需要添加碱液来稳定发酵液的pH,这不仅增加了发酵生产的难度,也不利于产物乳酸的分离纯化,因此可以通过分子手段提高菌体对乳酸的耐受性,并促进产物的分泌。如,研究乳酸盐驯化提高大肠杆菌乳酸耐受性的分子机制,进而定向改造宿主细胞,提高其对高浓度产物的耐受性;也可以在大肠杆菌宿主中表达外源的与乳酸分泌相关的基因(如focA),促进菌体将乳酸分泌到发酵液中。最后,在深入研究糖类的代谢机理的基础上,通过代谢工程手段改造大肠杆菌细胞,使其可以同时发酵多种糖类,进而利用纤维素原料进行乳酸发酵,以降低乳酸生产成本。
[1] JU S Y,KIM J H,LEE P C.Long-term adaptive evolution of Leuconostoc mesenteroides for enhancement of lactic acid tolerance and production[J].Biotechnol Biofuels,2016,9:240.
[2] TSUJI H,FUKUI I.Enhanced thermal stability of poly(lactide)s in the melt by enantiomeric polymer blending[J].Polymer,2003,44(10):2891-2896.
[3] KLOTZ S,KAUFMANN N,KUENZ A,et al.Biotechnological production of enantiomerically pure D-lactic acid[J].Appl Microbiol Biotechnol,2016,100(22):9423-9437.
[4] ABDEL-RAHMANM A,SONOMOTO K.Opportunitiesto overcome the current limitations and challenges for efficient microbial production ofoptically pure lactic acid[J].J Biotechnol,2016,236:176-192.
[5] GRABAR T B,ZHOU S,SHANMUGAM K T,et al.Methylglyoxal bypass identified as source of chiral contamination in L(+)and D(-)-lactate fermentations by recombinant Escherichia coli[J].Biotechnol Lett,2006,28(19):1527-1535.
[6] SONG J Y,PARK J S,KANG C D,et al.Introduction of a bacterial acetyl-CoA synthesis pathway improves lactic acid production in Saccharomyces cerevisiae[J].Metab Eng,2016,35:38-45.
[7] OKINO S,SUDA M,FUJIKURA K,et al.Production of D-lactic acid by Corynebacterium glutamicum under oxygen deprivation[J].Appl Microbiol Biotech,2008,78(3):449-454.
[8] YI X,ZHANG P,SUN J,et al.Engineering wild-type robust Pediococcus acidilactici strain for high titer L-and D-lactic acid production from corn stover feedstock[J].J Biotechnol,2016,217:112-121.
[9] JUTURU V,WU J C.Production of high concentration of L-lactic acid from oil palm empty fruit bunch by thermophilic B.coagulans JI12[J].BiotechnolApplBiochem,2017,doi:10.1002/bab.1567.
[10] BERNARDO M P,COELHO L F,SASS D C,et al.L-(+)-lactic acid production by Lactobacillus rhamnosus B103 from dairy industry waste[J].Braz J Microbiol,2016,47(3):640-646.
[11] 文瑶,周玮,付相敏,等.D-乳酸大肠杆菌工程菌的驯化及其补料发酵研究[J].湖北农业科学,2016,55(18):4771-4775.
[12] FU X M,WANG Y X,WANG J H,et al.Semi-industrial scale(30 m3)fed-batch fermentation for the production of D-lactate by Escherichia coli strain HBUT-D15[J].J Ind Microbiol Biotechnol,2017,44(2):221-228.
[13] NIU D D,TIAN K M,PRIOR B A,et al.Highly efficientL-lactate production using engineered Escherichia coli with dissimilar temperature optima for L-lactate formation and cell growth[J].Microb Cell Fact,2014,13:78.
[14] RAJGARHIA V,DUNDON C A,OLSON S,et al.Methods and materials for the production of D-lactic acid in yeast:WO,2003102201[P].2003-12-11.
[15] 张高华,吴晓芳.用手性液谱柱法拆分及骠马农药旋光对映体含量的测定[J].现代商检科技,1998,8(1):22-25.
[16] 蒋木庚,杨红,陈如东,等.芳氧丙酸类除草剂光学异构的研究[J].南京农业大学学报,2000,23(2):97-100.
[17] 鲁泓鹰.一株高效利用木糖产D-乳酸大肠杆菌工程菌株的构建及其发酵研究[D].武汉:湖北工业大学,2015.
[18] DATTA R,TSAI S P,BONSIGNORE P,et al.Technological and economic-potential of poly(lactic acid)and lactic acid derivatives[J].FEMS Microbiol Rev,1995,16(2/3):221-231.
[19] 王竹林,金立国.环保型聚乳酸纤维的开发和应用[J].针织工业,2003(5):62-64.
[20] BOOTH I R,FERGUSON G P,MILLER S,et al.Bacterial production of methylglyoxal:a survival strategy or death by misadventure? [J].Biochem Soc Trans,2003,31(6):1406-1408.
[21] TIAN K M,NIU D D,LIU X G,et al.Limitation of thiamine pyrophosphate supply to growing Escherichia coliswitches metabolism to efficientD-lactate formation[J].Biotechnol Bioeng,2016,113(1):182-188.
[22] BUNCH P K,MAT-JAN F,LEE N,et al.The ldhA gene encoding the fermentative lactate dehydrogenase of Escherichia coli[J].Microbiology,1997,143(1):187-195.
[23] YANG Y T,SAN K Y,BENNETT G N.Redistribution of metabolic fluxes in Escherichia coli with fermentative lactate dehydrogenase overexpression and deletion[J].Metab Eng,1999,1(2):141-152.
[24] ZHU J,SHIMIZU K.The effect of pfl gene knockout on the metabolism for optically pure D-lactate production by Escherichia coli[J].Appl Microbiol Biotechnol,2004,64(3):367-375.
[25] ZHOU L,ZUO Z R,CHEN X Z,et al.Evaluation of genetic manipulation strategies on D-lactate production by Escherichia coli[J].Curr Microbiol,2011,62(3):981-989.
[26] ZHU J,SHIMIZU K.Effect of a single-gene knockout on the metabolic regulation in Escherichia coli for D-lactate production under microaerobic condition[J].Metab Eng,2005,7(2):104-115.
[27] CHANG D E,JUNG H C,RHEE J S,et al.Homofermentative production ofD-orL-lactate in metabolically engineered Escherichia coli RR1[J].Appl Environ Microbiol,1999,65(4):1384-1389.
[28] ZHAO J F,XU L Y,WANG Y Z,et al.Homofermentative production ofopticallypureL-lacticacid from xyloseby genetically engineered Escherichia coli B[J].Microb Cell Fact,2013,12:57.
[29] LU H Y,ZHAO X,WANG Y Z,et al.Enhancement of D-lactic acid production from a mixed glucose and xylose substrate by the Escherichia coli strain JH15 devoid of the glucose effect[J].BMC Biotechnol,2016,16:19.
[30] 周丽.高产高纯 D-乳酸的 E.coli代谢工程菌的构建[D].无锡:江南大学,2012.
[31] JUTURU V,WU J C.Microbial production of lactic acid:the latest development[J].Crit Rev Biotechnol,2016,36(6):967-977.
[32] ZHU Y,EITEMAN M A,DEWITTK,etal.Homolactate fermentation by metabolically engineered Escherichia coli strains[J].Appl Environ Microbiol,2007,73(2):456-464.
[33] ZHOU L,TIAN K M,NIU D D,et al.Improvement of D-lactate productivity in recombinant Escherichia coli by coupling production with growth[J].Biotechnol Lett,2012,34(6):1123-1130.
[34] ZHOU L,NIU D D,TIAN K M,et al.Genetically switched D-lactate production in Escherichia coli[J].Metab Eng,2012,14(5):560-568.
[35] MAZUMDAR S,CLOMBURG J M,GONZALEZ R.Escherichia coli strains engineered for homofermentative production of D-lactic acid from glycerol[J].Appl Environ Microbiol,2010,76(13):4327-4336.
[36] CHEN X Z,TIAN K M,NIU D D,et al.Efficient bioconversion of crude glycerol from biodiesel to optically pure D-lactate by metabolically engineered Escherichia coli[J].Green Chem,2014,16(1):342-350.
[37] WANG Z W,SAINI M,LIN L J,et al.Systematic engineering of Escherichia coli for D-lactate production from crude glycerol[J].J Agric Food Chem,2015,63(43):9583-9589.
[38] WANG Y,TIAN T,ZHAO J,et al.Homofermentative production of D-lactic acid from sucrose by a metabolically engineered Escherichia coli[J].Biotechnol Lett,2012,34(11):2069-2075.
[39] 赵锦芳,薛葳蕤,张晓敏,等.大肠杆菌工程菌利用甘蔗糖蜜发酵产 L-乳酸研究[J].湖北农业科学,2016,55(24):6541-6545.
[40] WANG Y Z,LI K P,HUANG F,et al.Engineering and adaptive evolution of Escherichia coli W for L-lactic acid fermentation from molasses and corn steep liquor without additional nutrients[J].Bioresour Technol,2013,148:394-400.
[41] ZHOU S,GRABAR T B,SHANMUGAM K T,et al.Betaine tripled the volumetric productivity of D(-)-lactate by Escherichia coli strain SZ132 in mineral salts medium[J].Biotechnol Lett,2006,28(9):671-676.
[42] UTRILLA J,LICONA-CASSANI C,MARCELLIN E,et al.Engineering and adaptive evolution of Escherichia coli for D-lactate fermentation reveals GatC as a xylose transporter[J].Metab Eng,2012,14(5):469-476.
[43] DURNIN G,CLOMBURG J,YEATES Z,et al.Understanding and harnessing the microaerobic metabolism of glycerol in Escherichia coli[J].Biotechnol Bioeng,2009,103(1):148-161.
[44] POSADA J A,CARDONA C A,GONZALEZ R.Analysis of the production process of optically pure D-lactic acid from raw glycerol using engineered Escherichia coli strains[J].Appl Biochem Biotechnol,2012,166(3):680-699.
[45] VICKERS C E,KLEIN-MARCUSCHAMER D,KROMER J O.Examining the feasibility of bulk commodity production in Escherichia coli[J].Biotechnol Lett,2012,34(4):585-596.
[46] ZHOU S,YOMANO L P,SHANMUGAM K T,et al.Fermentation of 10%(w/v)sugar to D(-)-lactate by engineered Escherichia coli B[J].Biotechnol Lett,2005,27(23/24):1891-1896.
[47] ZHOU L,CUI W J,LIU Z M,et al.Metabolic engineering strategies for D-lactate over production in Escherichia coli[J].J Chem Tech Biotechnol,2016,91(3):576-584.
[48] SHUKLA V B,ZHOU S,YOMANO L P,et al.Production of D(-)-lactate from sucrose and molasses[J].Biotechnol Lett,2004,26(9):689-693.
[49] ABDEL-RAHMAN M A,TASHIRO Y,SONOMOTO K.Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria:overview and limits[J].J Biotechnol,2011,156(4):286-301.
[50] WANG Y,MENG H Y,CAI D,et al.Improvement of L-lactic acid productivity from sweetsorghum juice by repeated batch fermentation coupled with membrane separation[J].Bioresour Technol,2016,211:291-297.
[51] HU J L,LIN Y X,ZHANG Z T,et al.High-titer lactic acid production by Lactobacillus pentosus FL0421 from corn stover using fed-batch simultaneous saccharification and fermentation[J].Bioresour Technol,2016,214:74-80.
[52] 许丽媛,赵锦芳,王永泽,等.重组大肠杆菌利用木糖发酵产高纯度 L-乳酸[J].生物加工过程,2013,11(3):24-28.
[53] 丁小云,顾健健,王永泽,等.产D-乳酸重组大肠杆菌ptsG基因的敲除及其混合糖同步发酵[J].生物技术通报,2015,31(12):221-226.
[54] EITEMAN M A,LEE S A,ALTMAN R,et al.A substrateselective co-fermentation strategy with Escherichia coli produces lactate by simultaneously consuming xylose and glucose[J].Biotechnol Bioeng,2009,102(3):822-827.
(责任编辑 荀志金)
As the simplest hydroxyl acid,lactic acid is one of the most important organic acids in food,pharmaceutical,cosmetic and chemical industries.More importantly,it is used to produce polylactic acid(PLA),a biodegradable polymer of great interest because it can be produced from renewable means and biodegradable in nature.Presently,lactic acid can be synthesized either chemically or by microbial fermentation.However,microbial fermentation has some potential advantages in using renewable substrates,high optical purity and environmentally friendly process.There are many strains capable of producing lactic acid such as Escherichia coli,Lactobacillus,Bacillus coagulans and Corynebacterium glutamicum.Owing to a rapid doubling time and growth rate,and the availability of excellent genetic tools for strain improvement,E.coli strains have been developed for effective production of D-and L-lactic acid using a metabolic engineering approach.This review describes the physicochemical properties of lactic acid as well as the state of its research and application.Furthermore,we focus on recent efforts devoted to metabolic engineering of E.coli for the production of lactic acid.Also,this review presents the guidelines for further developments in lactic acid production using E.coli.
Escherichia coli;lactic acid;metabolic engineering;cell factory
Progresses in the metabolic engineering of Escherichia coli for lactic acid production
ZHANG Lihua,CHEN Xianzhong,SHEN Wei,FAN You
(School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Q819
A
1672-3678(2017)05-0048-09
10.3969/j.issn.1672-3678.2017.05.006
2017-06-10
中央高校基本科研业务费专项资金(JUSRP51611A)
张利华(1989—),男,河南信阳人,研究方向:微生物代谢工程育种;陈献忠(联系人),副教授,E-mail:xzchen@jiangnan.edu.cn
