一次高强度间歇运动对青年男性外周血T淋巴细胞分布与免疫应答的调节
2017-09-29陈华伟杨军英
陈华伟,杨军英,汤 静
CHEN Hua-wei1,YANG Jun-ying1,TANG Jing2
一次高强度间歇运动对青年男性外周血T淋巴细胞分布与免疫应答的调节
陈华伟1,杨军英1,汤 静2
CHEN Hua-wei1,YANG Jun-ying1,TANG Jing2
目的:观察一次急性高强度间歇运动(HIIT)对外周血T淋巴细胞分布与免疫应答的影响。方法:20名健康青年男性进行一次HIIT,分别于运动前、运动后即刻以及运动后60 min取静脉血,用流式细胞术测定淋巴细胞亚群分布以及体外T淋巴细胞刺激实验(佛波醇乙酯/离子霉素)诱导的免疫应答标志物(CD69、CD40L、CD122、GARP、LAP、GITR、CTLA-4和CD39)相对表达量[用平均荧光强度(MFI)和阳性细胞率表示],免疫分析法检测血浆应激激素(皮质醇、肾上腺素和去甲肾上腺素等)的变化。结果:17名受试者完成全部实验。1)运动后即刻淋巴细胞及其各亚群计数均显著性升高(P<0.05),运动后60 min下降(P<0.05)。2)运动后即刻,淋巴细胞计数与血浆肾上腺素(r=0.84,P<0.05)及去甲肾上腺素(r=0.62,P<0.05)含量显著正相关。3)运动后即刻,CD40L(CD3+CD4+和CD4+CD45RO+Th)、CD122(CD3+CD8+和CD3+CD8highTc)和LAP(CD4+CD25highCD127lowTreg)表达上调(P<0.05),运动后60 min时CD40L和CD122恢复(P>0.05),T淋巴细胞各亚群CD69以及Treg细胞LAP/GARP和CD39表达显著性升高(P<0.05)。结论:一次急性HIIT能够:1)造成内分泌-免疫系统暂时性扰动,儿茶酚胺升高诱导淋巴细胞各亚群在循环中重新分布并呈现双相反应特征;2)选择性动员Th细胞和CD8highT细胞并增强外源性刺激诱导免疫应答的能力,运动后恢复期具有免疫抑制作用的Treg被动员,从而调节并重建T细胞稳态。
高强度间歇运动;淋巴细胞亚群;分布;免疫应答;流式细胞术
淋巴细胞是一个复杂不均一的细胞群,包括T、B和自然杀伤(natural killer,NK)细胞,其中T淋巴细胞(简称T细胞,下同)按照抗原分化簇(cluster of differentiation,CD)可分为细胞毒性T(cytotoxic T,Tc)(CD8+)和辅助性T(T helper,Th)(CD4+)两个亚群,介导细胞免疫[41]。Th细胞受刺激后可分化为多个亚群,其中调节性T(regulatory T,Treg)具有免疫调节作用,能够抑制其他免疫细胞并维持免疫稳态和免疫耐受。
剧烈运动诱导应激激素(儿茶酚胺、皮质醇等)分泌增多,进而对免疫系统功能稳态产生影响[37]。Nieman等[29]和Nieman等[30]分别提出,运动负荷与免疫机能的“J型”曲线和“开窗期”理论模型,即中等强度运动能够提高免疫功能,而长时间高强度运动则造成暂时性免疫抑制。前人[2,20,28]以及课题组[4]的研究证实,高强度剧烈运动,甚至力竭运动诱导淋巴细胞凋亡,是运动性免疫抑制的重要机制。多数以传统持续训练为模型的研究显示,运动能够扰乱内分泌-免疫系统[1,6,9],动员白细胞并可造成T细胞稳态失衡[3,5,7,10,32,43],影响效果依赖于运动强度和持续时间。近年来的研究表明,高强度间歇运动(high-intensity interval training,HIIT)作为一种新颖的训练模式能够有效提升有氧、无氧运动能力,并显著改善健康体适能,与传统持续有氧运动相比,具有省时、有效等突出特点,因此,成为时下流行的运动方式[12]。然而,HIIT对内分泌-免疫系统的影响鲜有关注。因此,本研究利用流式细胞术观察一次急性HIIT对外周血T细胞分布与免疫应答的影响,并探讨其可能调控机制。
1 研究对象与方法
1.1 研究对象
招募新乡市某社区健康青年男性(年龄<40岁),通过问卷调查了解病史与运动史。受试者身体健康,无烟酒嗜好,无服药史,无呼吸系统、心血管系统、免疫系统、骨骼肌肉系统疾病,无过敏反应史。实验前告知实验目的、实验流程和潜在风险,并签署知情同意书。选取20名符合研究要求的受试者(均自愿参加本实验)。
1.2 实验设计
本研究包括3次实验。第1次:受试者签署知情同意书、熟悉实验流程,并进行身体形态学参数测定;第2次:1周后利用递增负荷运动实验测定最大摄氧量(maximal oxygen intake,VO2max)和峰值功率输出(peak power output,PPO);第3次:1周后进行一次急性HIIT,于运动前、运动后即刻和运动后60 min静脉取血进行指标测定。整体实验设计见图1。
图1 实验整体流程Figure 1 Flowsheet of the Experiment
1.3 递增负荷运动实验
利用自行车测功仪(Monark 839E,瑞典)测定VO2max和PPO。受试者佩戴便携式运动心肺测试系统(VO2000,美国)以及遥测心率仪(Polar S810,芬兰)以监控运动过程中摄氧量(oxygen uptake,O2)、心率(heart rate,HR)等生理参数。方案为:先以50 W负荷热身2 min,然后每分递增25 W,直至力竭。O2峰值持续超过15 s即为VO2max,蹬车功率峰值持续超过60 s即为PPO[24]。
1.4 HIIT方案
递增负荷运动实验1周后,受试者完成一次急性HIIT,参照Little等[24]制定的方案并稍作修改:先以50 W负荷热身3 min,然后,反复以100%O2max对应的功率蹬车1 min,间歇期以50 W负荷蹬车75 s,共完成8组,最后以50 W负荷进行3 min整理运动。实验过程中始终保持60 rpm的蹬车频率。
1.5 血样提取与血常规测定
分别于HIIT运动前(pre)、运动后即刻(post0)以及运动后60 min(post 60)肘正中静脉取血10 ml,肝素抗凝。白细胞及其分类计数、血细胞比容(hematocrit,HCT)和血红蛋白(hemoglobin,HGB)浓度利用血液分析仪(MICROS60,美国)测定。运动前后血浆容量(plasma volume,PV)的变化用Dill等[14]建立的公式估算:
血 容 量(blood volume,BV):BVa=BVb×(HGBb/HGBa);
红细胞容量(red cell volume,RV):RVa=BVa×HCTa;RVb=BVb×HCTb;
血浆容量(plasma volume,PV):PVa=BVa-RVa;PVb=BVb-RVb;
PV变化率(percentage change of PV,%△PV):%△PV=(PVa-PVb)/ PVb×100=(PVa/PVb-1)×100,其中PVa/PVb=(HGBb/HGBa-HGBb/HGBa×HCTa)/(1-HCTb)。
运动后所测指标的校正值=测量值×(100+%△PV)/ 100
注:b表示运动前,a表示运动后。
1.6 淋巴细胞亚群免疫表型分型
取100 μl抗凝血,按照试剂盒说明与以下单克隆荧光抗体避光孵育:CD8-V500、CD56-FITC、CD19-PE、CD16-APC、CD3-PerCPeFluor710和CD4-APCeFluor780。 加入2 ml红细胞裂解液,避光孵育20 min,300 g离心5 min。PBS缓冲液2 ml洗涤,离心5 min。流式细胞仪(FACSCantoTMII,美国)上机检测淋巴细胞亚群免疫表型分型。
1.7 体外T细胞刺激实验
利用佛波醇乙酯(phorbol myristate acetate,PMA)和离子霉素(ionomycin)刺激诱导T细胞活化以检测免疫应答功能,包括细胞活化、增殖、分化。取2 ml抗凝血,以40.5 μM PMA和670 μM离子霉素(2 μl)联合刺激,于二氧化碳培养箱(37˚C、5% CO2)中孵育2 h。用流式细胞仪检测HIIT诱导的T细胞活化标志物(即表面受体)表达,包括基础状态(未经刺激)和应激状态(经PMA/离子霉素刺激)。100 μl刺激后的外周血加入CD3-Horizon V450、CD8-Horizon V500和CD4-APC-H7抗体避光孵育,上机检测T细胞早期活化标志物(CD69-FITC和CD40L-PE)、增殖标志物(CD122-FITC、)、记忆性T细胞标志物(CD45RO-APC)(括号内为相应抗体)表达情况。100 μl刺激后的外周血加入CD25-PerCP-Cy5.5和CD127-PECy7(Treg细胞表型)抗体避光孵育,上机检测Treg细胞活化标志物(GITR-FITC、CTLA-4-PE、CD39-APC、LAP-PE和GARPAPC)表达量(GITR:glucocorticoid-induced TNFR-related protein,糖皮质激素诱导TNFR相关蛋白;CTLA-4:cytotoxic T lymphocyte antigen-4,细胞毒性T淋巴细胞抗原4;LAP:latency-associated peptides,潜在相关多肽;GARP:glycoprotein A repetitions predominant,以糖蛋白A重复序列为主的蛋白)。用流式细胞仪测定相关标志物及细胞因子的平均荧光强度(median fluorescence intensity,MFI)及阳性细胞率(阳性率,即阳性细胞数占总体细胞或门内细胞的百分数)代表其相对表达量。用未经刺激组作为平行对照。
1.8 激素水平检测
血浆皮质醇含量用电化学发光免疫分析法测定,测试仪器为自动电化学发光免疫分析仪(ROCHE Elecsys 2010,瑞士)。儿茶酚胺(肾上腺素和去甲肾上腺素)用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定,测试仪器为酶标仪(Bio-Rad 550,美国)。
1.9 统计学处理
所有数据以“均数±标准差”表示。各指标时程变化(pre、post 0、post 60)比较使用重复测量的方差分析,多重比较使用LSD检验;激素含量与白细胞计数的关系,使用简单相关分析,并计算pearson相关系数(r)。P<0.05为差异具有统计学意义,统计软件为SPSS 20.0 for Windows。
2 结果
2.1 样本量及受试者一般特征
由于意外受伤、疲劳、拒绝取血、无故失联以及其他个人原因,共3名受试者未完成运动方案和测试,在统计时予以剔除,因此,最终样本量n=17。受试者一般情况见表1。

表1 受试者一般特征Table 1 General Characteristics of the Subjects
2.2 一次HIIT对白细胞动员的影响
运动后即刻%△PV较运动前显著性下降(P<0.05),提示,运动后血液浓缩。运动后即刻白细胞计数升高(P<0.05),淋巴细胞和单核细胞计数以及比例升高(P<0.05),粒细胞计数升高而比例下降(P<0.05);运动后60 min白细胞计数、单核细胞计数和比例恢复(P>0.05),粒细胞计数和比例仍高于运动前(P<0.05),淋巴细胞计数和比例则低于运动前(P<0.05,表2)。
2.3 一次HIIT对淋巴细胞亚群的影响
一次HIIT后,淋巴细胞亚群在循环中重新分布,并呈现双相反应特征。与运动前比较,B细胞(CD19+)、NK细胞(CD56+)、总T细胞(CD3+)在运动后即刻显著性升高(P<0.05),而在运动后60 min显著性下降(P<0.05)。将T细胞进行亚群分类后发现,CD4+Th、CD4+CD25highCD127lowTreg、CD4+CD25highFoxp3+Treg、CD8+Tc、CD8highTc和CD8lowTc细胞对一次HIIT的反应,同样呈现双相反应模式(P<0.05,表3)。

表2 一次HIIT前后%△PV及白细胞分类的变化Table 2 Changes of %△PV and Leukocyte Differential Count before and after a Bout of HIIT

表3 一次HIIT前后淋巴细胞亚群计数的变化 (×109/l)Table 3 Changes of Lymphocyte Subsets Count before and after a Bout of HIIT (×109/L)
2.4 血浆激素水平的变化
血浆皮质醇在运动后即刻,无显著性变化(P>0.05),但在运动后60 min显著低于运动前和运动后即刻(P<0.05)。肾上腺素和去甲肾上腺素在运动后即刻升高(P<0.05),运动后60 min显著下降(P<0.05)并恢复至运动前水平(P>0.05,表4)。

表4 一次HIIT前后激素水平的变化Table 4 Changes of Hormonal Concentration before and after a Bout of HIIT
2.5 血浆激素水平与白细胞分类计数相关分析
运动后即刻,淋巴细胞计数与血浆肾上腺素(r=0.84,P<0.05)及去甲肾上腺素(r=0.62,P<0.05)含量显著正相关,(图2)。皮质醇与各白细胞分类计数间均无显著性关联(P>0.05)。

图2 运动后即刻血浆肾上腺素含量 (a)、去甲肾上腺素含量 (b)与淋巴细胞计数的相关分析Figure 2 Correlation Analysis of Plasma Epinephrine (a),Norepinephrine (b) and Lymphocyte Count Immediate after Completion of Exercise
2.6 一次HIIT对T细胞免疫应答的影响
2.6.1 CD40配体(CD40 ligand,CD40L)表达
平行对照实验(未经刺激)时,HIIT各时间点T细胞CD40L MFI和阳性率(均<1%)均无显著性变化(P>0.05)。T细胞刺激实验显示,运动后即刻,CD3+CD4+T细胞CD40L MFI和阳性率,CD4+CD45RO+T细胞CD40L阳性率升高(P<0.05),运动后60 min恢复(P>0.05),其他亚群(CD8high、CD8low、CD8highCD45RO+和CD8lowCD45RO+)在各时间点均无显著性变化(P>0.05,图3)

图3 T细胞刺激实验时CD3+CD4+T细胞(a)和CD4+CD45RO+T细胞 (b) CD40L表达Figure 3 CD40L Expression in CD3+CD4+T (a) and CD4+CD45RO+T Cells (b) during T Lymphocytes Stimulation Test
2.6.2 CD69表达
平行对照实验(未经刺激)时,HIIT各时间点T细胞CD69 MFI和阳性率均无显著性变化(P>0.05)。T细胞刺激实验显示,运动后即刻T细胞CD69 MFI和阳性率均无显著性变化,运动后60 min时T细胞各亚群CD69阳性率以及多数T细胞亚群CD69 MFI显著性升高(P<0.05),只有CD8low和CD8lowCD45RO+T细胞CD69 MFI在各时间点均无显著性变化(P>0.05,图4)。
2.6.3 CD122表达
平行对照实验(未经刺激)时,HIIT各时间点T细胞CD122 MFI和阳性率均无显著性变化(P>0.05)。T细胞刺激实验显示,运动后即刻,CD3+CD8+和CD3+CD8highT细胞CD122阳性率升高(P<0.05),运动后60 min时恢复(P>0.05),此时,CD3+CD8lowT细胞CD122 MFI和阳性率较运动后即刻显著性下降(P<0.05,图5)
2.6.4 Treg活化标志物表达
平行对照实验(未经刺激)时,运动后即刻各Treg活化标志物MFI和阳性率均无显著性变化;运动后60 min时Treg细胞GARP阳性率显著低于运动后即刻(P<0.05),GARP MFI显著低于运动前以及运动后即刻(P<0.05),其它活化标志物LAP、GITR和CTLA-4则均无显著性变化(P>0.05,图60)。
T细胞刺激实验显示,运动后即刻Treg细胞LAP阳性率升高(P<0.05),运动后60 min时LAP阳性率高于运动前和运动后即刻(P<0.05),LAP MFI高于运动前水平(P<0.05);运动后60 min时LAP/GARP共表达以及CD39阳性率高于运动前(P<0.05);GITR和CTLA-4在各时间点均无显著性变化(P>0.05,图7~图9)。
3 讨论
本研究旨在探讨一次急性HIIT对健康青年男性外周血T细胞分布与免疫应答的影响,结果发现,一次急性HIIT可造成内分泌-免疫系统暂时性扰动,儿茶酚胺释放增多,动员T细胞进入外周循环并提高免疫功能,然而,这一调节作用呈现一过性特征,运动后60 min具有免疫抑制作用的Treg被动员,免疫稳态基本恢复。
3.1 一次HIIT对免疫细胞分布的影响
研究发现,一次急性运动能够对内分泌-免疫系统产生显著影响,造成免疫细胞一过性重新分布。据报道,亚极量[19]和极量[8,9,34]持续运动以及间歇运动[25]时白细胞及其分类均呈现双相变化,表现为运动中以及运动后即刻粒细胞和淋巴细胞增多,恢复期粒细胞继续增加,而淋巴细胞减少,这与本研究(以HIIT为运动方式)结果基本一致。
本研究还发现,淋巴细胞各亚群对一次HIIT的反应同样呈现双相反应特征,运动后即刻,NK细胞数量变化最显著,其次是Tc、Th和B细胞;相关分析显示,淋巴细胞计数与儿茶酚胺(肾上腺素和去甲肾上腺素)含量显著正相关。前人的研究证实,运动中以及运动后儿茶酚胺含量升高以及血流量增加,是淋巴细胞及其亚群动员的重要原因[37],然而机制未明。有学者认为,除中枢和周围免疫器官外,其他非免疫系统,如内皮组织可能也是淋巴细胞定居以及发生免疫应答的部位[22]。研究提示,肾上腺素通过β-肾上腺素能受体(β-adrenergic receptor,β-AR)途径,降低淋巴细胞与内皮细胞的黏附能力,继之动员淋巴细胞从边缘池进入血循环[35]。肾上腺素灌注或使用β-肾上腺素能激动剂能够选择性上调Tc细胞β-AR表达,进而与血管内皮分离并释放入血[15]。

图4 T细胞刺激实验时CD3+CD4+T细胞 (a)、CD4+CD45RO+T细胞 (b)、CD3+CD8+T细胞 (c)、CD8+CD45RO+T细胞 (d)、CD3+CD8highT细胞(e)、CD3+CD8lowT细胞(f)、CD8highCD45RO+T细胞(g)和CD8lowCD45RO+T细胞(h)CD69表达Figure 4 CD69 Expression in CD3+CD4+T (a),CD4+CD45RO+T (b),CD3+CD8+T (c),CD8+CD45RO+T (d),CD3+CD8highT (e),CD3+CD8lowT (f),CD8highCD45RO+T (g) and CD8lowCD45RO+T Cells (h) during T Lymphocytes Stimulation Test
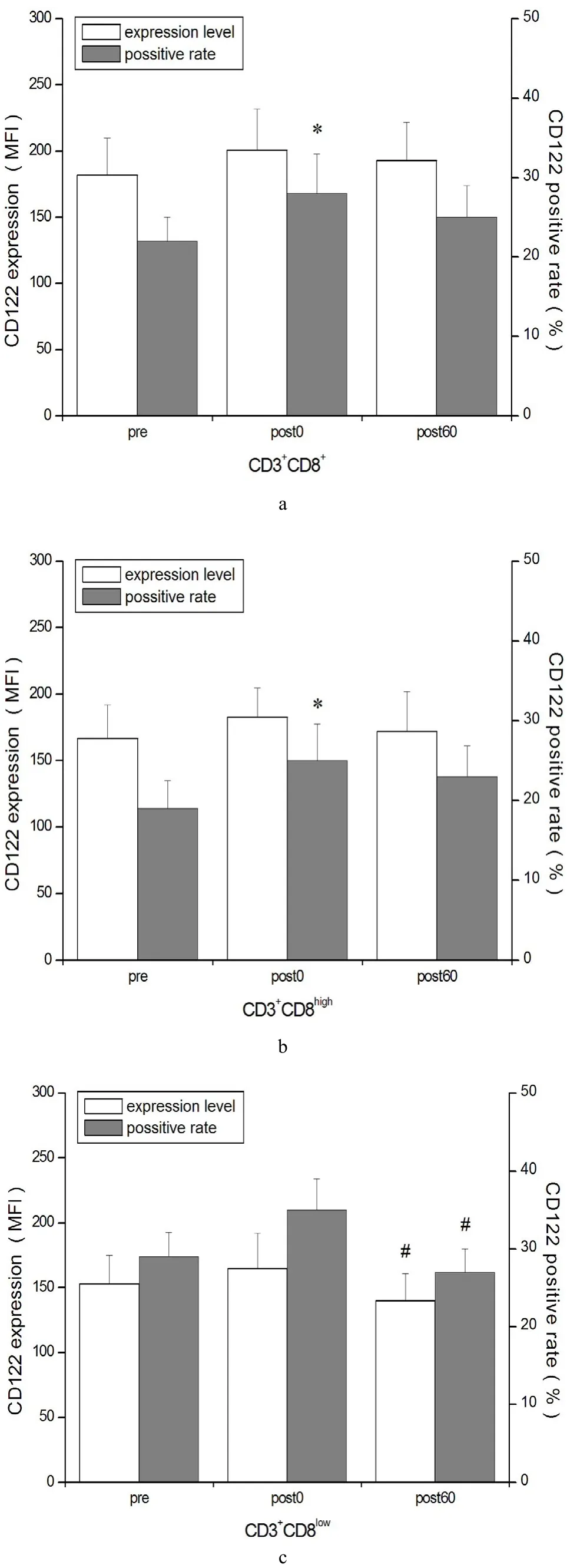
图5 T细胞刺激实验时CD3+CD8+T细胞(a)、CD3+CD8highT细胞(b)和CD3+CD8lowT细胞(c)CD122表达Figure 5 CD122 Expression in CD3+CD8+T (a),CD3+CD8highT (b)and CD3+CD8lowT Cells (c) during T Lymphocytes Stimulation Test

图6 平行对照实验时Treg细胞GARP MFI和阳性率Figure 6 MFI and positive rate of GARP in Tregcells during parallel control test

图7 T细胞刺激实验时Treg细胞LAP MFI和阳性率Figure 7 MFI and positive rate of LAP in Tregcells during T lymphocytes stimulation test
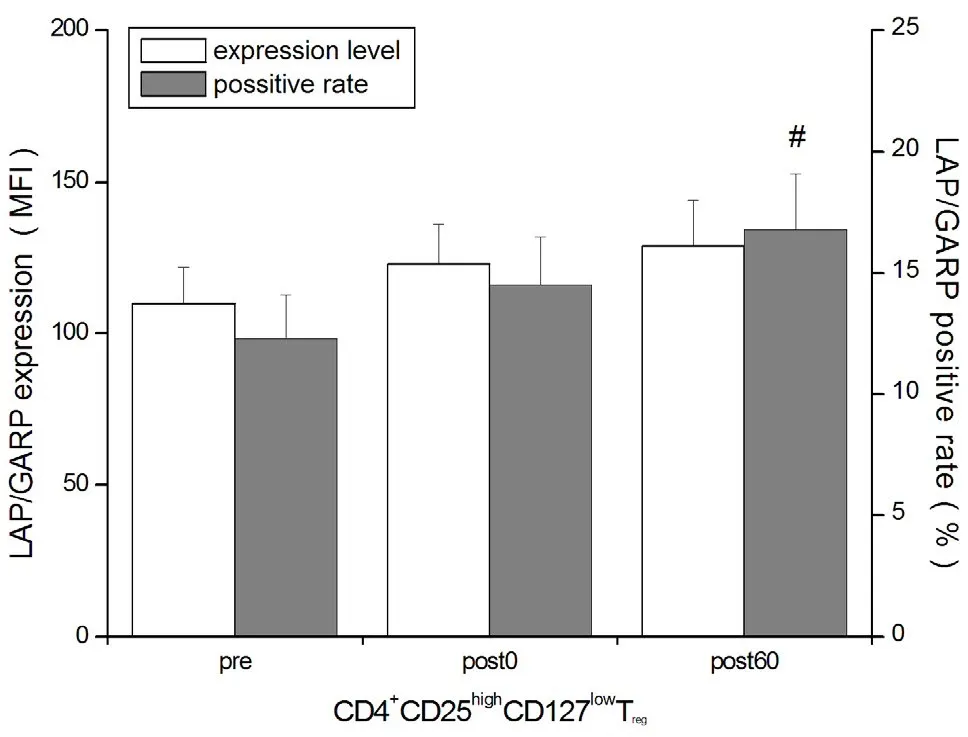
图8 T细胞刺激实验时Treg细胞LAP/GARP MFI和阳性率Figure 8 MFI and Positive Rate of LAP/GARP in TregCells during T Lymphocytes Stimulation Test
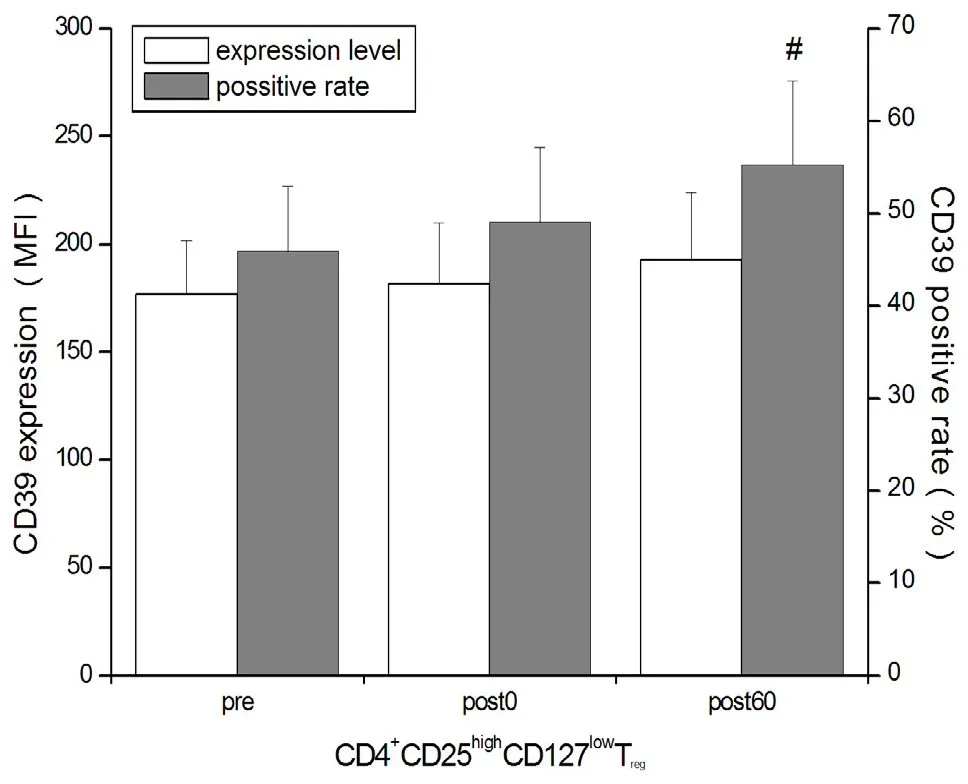
图9 T细胞刺激实验时Treg细胞CD39 MFI和阳性率Figure 9 MFI and Positive Rate of CD39 in TregCells during T Lymphocytes Stimulation Test
高强度运动能够上调皮质醇分泌,然而,HIIT对皮质醇的影响少有关注。Engel等[17]报道,男性运动员HIIT后30 min唾液皮质醇明显升高;Peake等[31]的研究显示,HIIT后即刻ACTH和皮质醇含量明显升高。但在本研究中,HIIT后即刻,ACTH和DHEAS含量升高,而皮质醇无显著性变化。高强度长时间运动时,血浆皮质醇含量在恢复期持续升高[37],而本研究中HIIT后1 h皮质醇却显著低于运动前水平。研究结果存在差异可能与运动方案、取血时间点以及生物节律变异等因素有关。
3.2 一次HIIT对T细胞介导免疫应答的影响
初始T细胞激活不仅需要T细胞受体相关的主要组织相容性复合体,还需要协同刺激信号(如协同刺激分子CD40/CD40L)参与,两者同时存在才能完全活化,若缺少后者,T细胞则凋亡或无反应(免疫无能)[33]。在本研究中,与运动前比较,HIIT后即刻CD4+T(Th)细胞CD40L表达上调。此外,CD40L在CD45RO+Th细胞高表达,提示,HIIT优先动员记忆性T细胞释放入血。与初始T细胞相比,记忆性T细胞通过免疫记忆功能在接触低剂量抗原即可迅速产生应答。本研究中,Tc细胞CD40L表达并无显著性变化。研究证实[38],协同刺激分子CD40L主要在活化的Th细胞表达,而活化的Tc细胞则极少表达。Tc细胞表面表达CD40,Th细胞通过CD40L与Tc细胞CD40结合,继之激活Tc细胞毒性反应[42]。
CD69(II型跨膜糖蛋白)是T细胞活化的另一早期标志物。先前的研究发现,一次高强度运动后T细胞CD69表达量无显著性变化[13,18],而低中强度运动后则升高[26]。在本研究中,运动后1 h体外刺激实验时,T细胞各亚群CD69表达均增加;将Tc细胞分为CD8high和CD8low亚群后发现,CD8highT细胞CD69表达上调,而CD8low则无显著性变化。然而,有研究得到相反的结论,即60 min递增负荷力竭运动实验后,PHA刺激外周血单核细胞(peripheral blood monouclear cell,PBMC)CD69表达下调,提示,可能发生免疫抑制[16];一次急性HIIT后,超抗原诱导的T细胞CD69表达降低,而PHA刺激时则无显著性变化[39]。研究结果不一致可能与采用的体外刺激方法、运动方案、运动时间以及细胞类型等因素有关。
细胞增殖标志物CD122(IL-2受体β链)在Tc细胞呈组成性表达,而在Th细胞则少量表达甚至无表达[23]。本研究发现,HIIT后即刻,T细胞刺激实验时CD8highT细胞CD122表达暂时性上调,表明HIIT诱导T细胞增殖并分化为效应性T;运动后1 h,CD8lowT细胞CD122表达低于运动后即刻(但与运动前无显著性差异),提示,经由IL-2信号途径的增殖能力下降,以及CD8lowT细胞毒性效应减弱,并恢复至运动前安静水平。
Treg的主要功能在于调控多种生理和病理性免疫应答(包括自身免疫),通过抑制效应性T在维持免疫耐受以及免疫稳态中起重要作用[33],因此,Treg对运动的反应和适应可能与免疫功能的反馈性调节有关。Moyna等[27]证实,短时间游泳比赛后循环中Treg计数增加;Perry等[32]的研究显示,长时间高强度运动后Treg含量下降。在本研究中,HIIT后即刻,儿茶酚胺升高并动员Treg(CD4+CD25highCD127low和CD4+CD25highFoxp3+)进入外周血。运动后恢复期,由于儿茶酚胺逐渐清除,Treg计数下降。HIIT除诱导Treg重新分布和数量改变外,对Treg功能的影响具有滞后效应。本研究中,HIIT后1 h,未经刺激(平行对照实验)的Treg细胞GARP表达下调。GARP是活化Treg特异性早期标志物之一,作为锚定蛋白GARP能够介导转化生长因子β(transforming growth factor β,TGF-β)释放入细胞外基质,对Treg介导的免疫抑制活性具有重要调节作用[36]。因此,GARP表达下降与Treg功能状态有关,提示,大量未活化的Treg动员入血。本研究结果似乎说明,HIIT减弱了Treg的免疫抑制功能,然而,进行T细胞刺激实验时,CD39和LAP表达却显著上调,说明Treg对于抗原刺激的敏感性增强,Treg通过腺苷[11]和TGF-β[21]途径介导免疫抑制。TGF-β是具有多种生物学效应的调节因子,Treg以无活性膜结合态合成TGF-β[即潜在TGF-β(latent TGF-β)]并与LAP形成复合体[21,36],因此,活化Treg细胞LAP的表达量可间接反映潜在TGF-β含量。HIIT诱导T细胞稳态失衡、促进T细胞增殖与分化,由于潜在TGF-β能够抑制Tc增殖以及Th1分化[40],因此推测,运动后恢复期Treg合成潜在TGF-β的作用在于,通过抑制T细胞分化以维持并重建T细胞稳态,这在运动后即刻和运动后1 h LAP持续表达上调以及运动后1 h Treg细胞LAP/GARP共表达增加,得到进一步印证。
4 结论与展望
一次急性HIIT可造成内分泌-免疫系统暂时性扰动,儿茶酚胺释放增多选择性动员Th细胞和CD8highT细胞并增强外源性刺激诱导免疫应答的能力(即反应性或敏感性增强),运动后恢复期具有免疫抑制作用的Treg被动员,从而调节并重建T细胞稳态。
本研究为HIIT在健身中的应用价值提供了理论依据。一次长时间高强度剧烈运动或力竭运动可诱导机体发生运动性免疫抑制,是造成参训者免疫机能下降以及感染性疾病发病率增加的重要原因。本研究则证实,虽然HIIT属于大强度运动,但一次HIIT后免疫机能能够迅速恢复,并未造成一过性免疫抑制,因此,具有较高安全性,同时作为省时有效的运动方式,值得在大众健身中推广应用。然而,改善免疫机能的最佳HIIT处方(运动强度、运动时间和运动频率)仍需进一步探索。
本研究针对一次急性HIIT诱导T细胞分布与免疫应答的变化进行了初探,然而,纳入样本量较少、恢复期60 min后未取观测点是本研究的主要不足。此外,长期HIIT的影响以及相关结论是否适用于其他人群(运动员、中老年、慢性病患者)尚不得而知,需要研究证实。
HIIT对于内分泌-免疫系统的影响鲜有关注。鉴于HIIT风靡运动健康领域并有替代传统耐力训练的趋势,因此,今后的研究应深入探讨急慢性HIIT对神经、免疫、内分泌的影响及机制。同时本研究也提出了新的课题,即长期HIIT对T细胞动力学(动员、活化、增殖、分化、效应)影响如何;长期HIIT对免疫功能产生何种效应(增强抑或损害),若发生运动性免疫抑制,可否用“开窗期”理论模型和“J型”曲线模型来解释;既可提高运动能力又能改善免疫机能的最佳HIIT方案如何。此外,本研究对HIIT诱导Treg细胞功能性标志物表达进行了初探,但Treg介导免疫调节在运动中的作用机制尚未明晰。今后的研究应进一步了解Treg标志物的作用与功能,并揭示其与运动性免疫抑制的关系。总之,研究视角聚焦淋巴细胞对HIIT的反应与适应规律及机制,尤其是Treg维持T细胞稳态的细胞与分子机理,对于更好地推广、宣传和实施全民健身计划,科学合理地安排训练和比赛,使机体在承受大负荷同时,保持身体健康以及防治过度训练综合征和运动性免疫抑制,具有重要的理论意义与实践价值。
[1] 陈佩杰. 急性运动对机体免疫系统的影响[J]. 上海体育学院学报,2000,24(1):41-46.
[2] 陈佩杰,董静梅. 过度运动激活中性粒细胞产生的活性氧对淋巴细胞DNA损伤及干预研究[J]. 体育科学. 2011,31(1):29-38.
[3] 罗贝贝,王茹,陈佩杰. 太极拳运动对中老年女性Th1/Th2平衡影响的机制研究[J]. 中国运动医学杂志,2012,31(5):396-401.
[4] 汤静. 大强度运动对青年男子淋巴细胞凋亡的影响[J]. 河南大学学报(自然科学版),2014,44(2):208-212.
[5] 陶占泉,陈佩杰,王茹,等. 5周递增负荷运动训练过程中T-helper1和T-helper2相关细胞因子基因表达的变化[J]. 中国运动医学杂志,2006,25(3):271-275.
[6] 王沛. 不同负荷的运动训练对大鼠T淋巴细胞亚群的影响[J].体育学刊,2001,8(5):79-80.
[7] 王茹,陈佩杰. 运动诱导的TH1/TH2淋巴细胞亚群失衡机制研究进展[J]. 中国运动医学杂志,2009,28(1):112-117.
[8] 吴丽君,郭新明. 番茄红素及运动对人体T淋巴细胞亚群的影响[J]. 成都体育学院学报,2010,36(8):73-76.
[9] 叶绍凡. 黄精多糖对力竭运动小鼠胸腺胸腺指数、脾脏指数、T淋巴细胞亚群、巨噬细胞吞噬功能的影响[J]. 基因组学与应用生物学,2015,34(1):60-65.
[10] 朱政,杨银田,陈佩杰. 半程马拉松比赛后4 h针灸干预的Th1与Th2特征自发性细胞因子基因表达的变化[J]. 广州体育学院学报,2007,27(2):108-110.
[11] BAO R,SHUI X,HOU J,et al. Adenosine and the adenosine A2A receptor agonist,CGS21680,upregulate CD39 and CD73 expression through E2F-1 and CREB in regulatory T cells isolated from septic mice[J]. Int J Mol Med,2016,38(3):969-975.
[12] BATACAN R B,DUNCAN M J,DALBO V J,et al. Effects of high-intensity interval training on cardiometabolic health:a systematic review and meta-analysis of intervention studies[J]. Br J Sports Med,2017,51(6):494-503.
[13] BISHOP N C,FITZGERALD C,PORTER P J,et al. Effect of caffeine ingestion on lymphocyte counts and subset activation in vivo following strenuous cycling[J]. Eur J Appl Physiol,2005,93(5-6):606-613.
[14] DILL D B,COSTILL D L. Calculation of percentage changes in volumes of blood,plasma,and red cells in dehydration[J]. J Appl Physiol,1974,37(2):247-248.
[15] DIMITROV S,LANGE T,BORN J. Selective mobilization of cytotoxic leukocytes by epinephrine[J]. J Immunol,2010,184(1):503-511.
[16] DUBOSE D A,WENGER C B,FLINN S D,et al. Distribution and mitogen response of peripheral blood lymphocytes after exertional heat injury[J]. J Appl Physiol (1985),2003,95(6):2381-2389.
[17] ENGEL F,HÄRTEL S,WAGNER M O,et al. Hormonal,metabolic,and cardiorespiratory responses of young and adult athletes to a single session of high-intensity cycle exercise[J]. Pediatr Exe Sci,2014,26(4):485-494.
[18] GREEN K J,ROWBOTTOM D G,MACKINNON L T. Acute exercise and T-lymphocyte expression of the early activation marker CD69[J]. Med Sci Sports Exe,2003,35(4):582-588.
[19] KIM K,SUZUKI K,PEAKE J,et al. Physiological and leukocyte subset responses to exercise and cold exposure in cold-acclimatized skaters[J]. Biol Sport,2014,31(1):39-48.
[20] KRÜGER K,MOOREN F C. Exercise-induced leukocyte apoptosis[J]. Exerc Immunol Rev,2014,20:117-134.
[21] LAURENT M A,BONNIER D,THÉRET N,et al. In silico characterization of the interaction between LSKL peptide,a LAPTGF-beta derived peptide,and ADAMTS1[J]. Comput Biol Chem,2016,61:155-161.
[22] LEE M,KIEFEL H,LAJEVIC M D,et al. Transcriptional programs of lymphoid tissue capillary and high endothelium reveal control mechanisms for lymphocyte homing[J]. Nat Immunol,2014,15(10):982-995.
[23] LI S,XIE Q,ZENG Y,et al. A naturally occurring CD8(+)CD122(+) T-cell subset as a memory-like Treg family[J]. Cell Mol Immunol,2014,11(4):326-331.
[24] LITTLE J P,SAFDAR A,WILKIN G P,et al. A practical model of low-volume high-intensity interval training induces mitochondrial biogenesis in human skeletal muscle:potential mechanisms[J].J Physiol,2010,588(Pt 6):1011-1022.
[25] MATHES S,MESTER J,BLOCH W,et al. Impact of high-intensity and high-volume exercise on short-term perturbations in the circulating fraction of different cell types[J]. J Sports Med Phys Fitn,2017,57(1-2):130-137.
[26] MORABITO C,LANUTI P,CAPRARA G A,et al. Responses of peripheral blood mononuclear cells to moderate exercise and hypoxia[J]. Scand J Med Sci Sports,2016,26(10):1188-1199.
[27] MOYNA N M,ACKER G R,FULTON J R,et al. Lymphocyte function and cytokine production during incremental exercise in active and sedentary males and females[J]. Int J Sports Med,1996,17(8):585-591.
[28] NAVALTA J W,LYONS S,PRESTES J,et al. Exercise intensity and lymphocyte subset apoptosis[J]. Int J Sports Med,2013,34(3):268-273.
[29] NIEMAN D C. Exercise,infection,and immunity[J]. Int J Sports Med,1994,15(Suppl 3):S131-141.
[30] NIEMAN D C,BERK L S,SIMPSON-WESTERBERG M,et al.Effects of long-endurance running on immune system parameters and lymphocyte function in experienced marathoners[J]. Int J Sports Med,1989,10(5):317-323.
[31] PEAKE J M,TAN S J,MARKWORTH J F,et al. Metabolic and hormonal responses to isoenergetic high-intensity interval exercise and continuous moderate-intensity exercise[J]. Am J Physiol Endocrinol Metab,2014,307(7):E539-552.
[32] PERRY C,PICK M,BDOLACH N,et al. Endurance exercise diverts the balance between Th17 cells and regulatory T cells[J].PLoS One,2013,8(10):e74722.
[33] REEVES E,JAMES E. Antigen processing and immune regulation in the response to tumours[J]. Immunol,2017,150(1):16-24.
[34] SAND K L,FLATEBO T,ANDERSEN M B,et al. Effects of exercise on leukocytosis and blood hemostasis in 800 healthy young females and males[J]. World J Exp Med,2013,3(1):11-20.
[35] SANDERS V M. The beta2-adrenergic receptor on T and B lymphocytes:do we understand it yet?[J]. Brain Behav Immun,2012,26(2):195-200.
[36] SHEVACH E M. Garp as a therapeutic target for modulation of T regulatory cell function[J]. Expert Opin Ther Targets,2017,21(2):191-200.
[37] SIMPSON R J,KUNZ H,AGHA N,et al. Exercise and the regulation of immune functions[J]. Prog Mol Biol Transl Sci,2015,135:355-380.
[38] TRELLA E,RAAFAT N,MENGUS C,et al. CD40 ligand-expressing recombinant vaccinia virus promotes the generation of CD8(+) central memory T cells[J]. Eur J Immunol,2016,46(2):420-431.
[39] TOSSIGE-GOMES R,COSTA K B,OTTONE V O,et al. Lymphocyte redox imbalance and reduced proliferation after a single session of high intensity interval exercise[J]. PLoS One,2016,11(4):e0153647.
[40] TRAVIS M A,SHEPPARD D. TGF-β activation and function in immunity[J]. Annu Rev Immunol,2014,32:51-82.
[41] YANES R E,GUSTAFSON C E,WEYAND C M,et al. Lymphocyte generation and population homeostasis throughout life[J].Semin Hematol,2017,54(1):33-38.
[42] ZHANG B,WU T,CHEN M,et al. The CD40/CD40L system:a new therapeutic target for disease[J]. Immunol Lett,2013,153(1-2):58-61.
[43] ZHAO G,ZHOU S,DAVIE A,et al. Effects of moderate and high intensity exercise on T1/T2 balance[J]. Exerc Immunol Rev,2012,18:98-114.
Regulation of a Bout of High-intensity Interval Training on Peripheral T Lymphocyte Cell Distribution and Immune Response in Male Juveniles
Objective:To observe the effects of acute high-intensity interval training (HIIT) on peripheral T lymphocyte cell distribution and immune response in male jnveniles. Methods:Twenty healthy male juveniles performed a bout of HIIT. Leucocyte subset distribution,in vitro T lymphocytes stimulation test (phorbol myristate acetate/ionomycin) induced immune response related markers (CD69,CD40L,CD122,GARP,LAP,GITR,CTLA-4 and CD39) relative expression level(by median fluorescence intensity (MFI) and positive cell rate) by flow cytometry,plasma stress hormone (cortisol,epinephrine and norepinephrine) by immune analytic method were determined before,immediate after and 60 minutes after completion of exercise. Results:17 of 20 subjects completed all tests. 1) lymphocytes and the attendant subsets increased immediately after HIIT (P<0.05),while decreased 60 min after HIIT (P<0.05). 2) The lymphocyte count immediate after exercise were positively correlated with plasma epinephrine (r=0.84,P<0.05) and norepinephrine(r=0.62,P<0.05). 3) Immediately after exercise,CD40L (CD3+CD4+and CD4+CD45RO+Th),CD122 (CD3+CD8+and CD3+CD8highTc) and LAP (CD4+CD25highCD127lowTreg) expression upregulated (P<0.05);60 min after exercise,CD40L and CD122 restored (P>0.05) while CD69 of lymphocyte subsets as well as LAP/GARP and CD39 of Tregcell expression elevated (P<0.05).Conclusion:An acute of HIIT could 1) lead to transitory perturbation of endocrine-immune system and elevation of catecholamine induce lymphocyte subset redistribution by biphasic response;2)selectively mobilize Thand CD8highT cells and enhance sensitivity to in vitro stimulation-induced immune response,subsequently immunosuppressive Treg were mobilized during recovery to regulate and restore T cell homeostasis.
high-intensity interval training;lymphocyte subsets;distribution;immune response;flow cytometry
G804.7
A
1000-677X(2017)09-0055-10
10. 16469/j. css. 201709006
2017-05-23;
2017-09-05
河南省高等学校青年骨干教师资助计划项目(2015GGJS-034)。
陈华伟,男,讲师,博士, 研究方向为运动训练与运动生理,E-mail:chenhuawei198305@126.com;杨军英,女,副教授,博士, 研究方向为运动生物化学,E-mail:yangjunying@htu.cn; 汤静,女,回族,副教授,硕士,研究方向为运动训练与健康促进。E-mail:tangjing0522@126.com。
1. 河南师范大学 体育学院,河南 新乡 453007;2. 河南工程学院 体育部,河南 郑州 451191
1. He’nan Normal University,Xinxiang 453007,China;2. He’nan Institute of Engineering,Zhengzhou 451191,China.
