运动结合饮食控制通过降低RAAS系统活性改善男性肥胖青少年血管内皮功能
2017-09-29唐东辉侯玉洁杨东升刘润芝李旭龙弓宇婧
唐东辉,侯玉洁,白 爽,李 娟,杨东升,刘润芝,姚 梦,李旭龙,弓宇婧
TANG Dong-hui1,HOU Yu-jie1,BAI Shuang1,LI Juan2,YANG Dong-sheng3,LIU Run-zhi4,YAO Meng1,LI Xu-long1,GONG Yu-jing1
运动结合饮食控制通过降低RAAS系统活性改善男性肥胖青少年血管内皮功能
唐东辉1,侯玉洁1,白 爽1,李 娟2,杨东升3,刘润芝4,姚 梦1,李旭龙1,弓宇婧1
TANG Dong-hui1,HOU Yu-jie1,BAI Shuang1,LI Juan2,YANG Dong-sheng3,LIU Run-zhi4,YAO Meng1,LI Xu-long1,GONG Yu-jing1
目的:通过检测封闭式运动减肥训练营中肥胖青少年血管内皮功能及RAAS系统主要成分的变化,揭示运动结合饮食控制改善肥胖青少年血管内皮功能的生物学机制。方法:32名男性单纯性肥胖青少年,年龄:15.38 ± 2.82岁,BMI:33.21 ± 4.23 kg/m2。接受为期6周的运动结合饮食控制,采用EndoPAT-2000系统测试受试者实验前后的指端反应性充血指数(RHI),并对血清NO、内皮素(ET-1)、肾素(PRA)、血管紧张素Ⅱ(AngⅡ)、血管紧张素原(AGT)、血管紧张素转换酶(ACE)、醛固酮(ALD)水平、身体形态、糖脂代谢、血压进行检测。结果:经过6周运动结合饮食控制干预,肥胖青少年身体成分、围度和糖脂代谢指标明显改善。RHI(P<0.01)和血清中NO/ ET-1(P<0.01)显著上升,血清PRA 、AngⅡ和ALD(P<0.05、P<0.01和P<0.01)显著下降。运动结合饮食控制干预前后血清PRA 、AngⅡ和ALD的变化程度呈显著正相关,而AngⅡ与RHI变化程度呈显著负相关(r=-0.562,P=0.003)。结论:肥胖青少年RAAS系统活性显著提高。6周的运动结合饮食控制,能够有效改善肥胖青少年的血管内皮功能,其机制可能与运动结合饮食控制降低了RAAS系统活性有关。
运动;肥胖青少年;内皮功能;EndoPAT;RAAS
1 前言
全球肥胖和超重人群在2014年已达到21亿[33],肥胖已经成为继心血管疾病和恶性肿瘤之后,对人类健康最具威胁的第3大因素。肥胖不仅影响青少年的健康,还与成年后的糖尿病、高血压、高脂血症、动脉粥样硬化等多种疾病的发生密切相关,被认为是诱发成年后心血管疾病(cardiovascular diseases,CVDs)的高危因素[13]。研究显示,肥胖青少年存在不同程度血管内皮功能障碍,其内皮细胞依赖性血管舒张功能较正常青少年下降[11,45,47],在肥胖青少年早期的动脉粥样硬化形成中起关键作用[7],因此,内皮功能可以作为心血管疾病风险的早期预测指标之一。近年来的研究发现,血管内皮功能障碍与肾素-血管紧张素-醛固酮系统(reninangiotensin-aldosterone system,RAAS)存在一定关系。
RAAS是体内重要的体液调节系统,在体液及组织器官中参与了对靶器官功能的调节[27]。RAAS激素级联反应开始于肾素的生产。肾素是由肾小球入球动脉的球旁细胞合成和分泌的一种天冬氨酰蛋白酶,通过将血管紧张素原转换成AngⅠ调节RAAS 激素级联反应的初始和作为反应初始的限速步骤。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)是RAS系统的主要效应肽,借由血管紧张素I型受体(angiotensin type 1 receptor,AT1)发挥收缩血管、升高血压、促炎症、促增殖等生物学作用[44],并诱发内皮功能的异常[5]。近年来的研究发现,血管紧张素酶与AngⅡ受体抑制剂可通过减弱AngⅡ的作用降低2型糖尿病发生率[42]。这使得AngⅡ在调节能量代谢和胰岛素抵抗方面的作用受到关注。AngⅡ是RAAS的中心环节,它具有很高的生物活性,是一种强烈的缩血管物质,而醛固酮(ALD)是RAAS的最终效应因素,和AngⅡ协同引起脂肪细胞肥大和内皮功能紊乱的发生[11]。另有研究发现,肥胖人群循环系统和脂肪组织中血管紧张素原(angiotensinogen,AGT)、血管紧张素转换酶(angiotensin-converting enzyme,ACE)和AngⅡ等RAAS系统主要成分较正常人群表达均增强,提示,随着脂肪含量的增加,RAAS系统活化程度的增加可能是导致肥胖青少年血管内皮功能障碍的重要原因[9,22,34]。
规律运动结合饮食控制,作为成人及青少年肥胖防治的重要措施,其健康效应已经被众多研究所证实[19,23,26]。前期研究发现,有氧运动结合抗阻训练的综合运动形式可以通过多种途径有效改善肥胖青少年的血管内皮功能[10,20,42]。前期研究已证实,运动训练结合饮食控制能够改善肥胖青少年血管内皮功能[30,35],然而,其相关机制是否与运动调节RAAS系统有关,尚未取得一致认同。因此,本研究通过检测运动结合饮食控制,对肥胖青少年血管内皮功能及RAAS系统主要成分的影响,从运动调节RAAS系统活性的角度,探讨运动结合饮食控制,改善肥胖青少年血管内皮功能障碍的相关生物学机制。
2 研究对象与方法
2.1 研究对象
本研究选取封闭式减肥夏令营的32名男性单纯性肥胖青少年为实验对象(EC)。纳入标准中肥胖标准按照“中国学龄儿童青少年超重、肥胖筛查体质量指数值分类标准”确定。其它纳入标准包括无心血管疾病、无肾脏疾病、无吸烟史、近6个月未服用过任何的激素类药物、平时无规律运动习惯等。同时,选择10名体重正常的健康男性青少年作为对照组(CG)。
2.2 伦理支持
实验流程均遵从相关规定,相关的生化检查均由三级甲等医院专业医务人员负责,并且登记在案。所有受试者及其法律监护人,均要求预先了解整个实验流程及目的,整个实验过程中可随时自由退出实验。由监护人填写知情同意书。
2.3 研究设计
2.3.1 运动方案
所有肥胖青少年在封闭运动减肥夏令营接受为期6周的运动干预,运动方案包括有氧运动与抗阻训练两部分内容,有氧运动在上午进行,主要包括篮球、游泳、有氧操、慢跑及体育游戏,运动强度控制在最大心率的60%~70%,每周5次,每次80 min(热身运动15 min,正式训练50 min,放松训练15 min),个体最大心率取公式“最大心率=220-年龄”估算,运动过程中心率的监控采用心率表,结合受试者自测脉搏进行;抗阻训练在下午进行,且每2次抗阻训练至少间隔1天,主要内容包括肩关节、肘关节、髋关节、膝关节与躯干肌群的屈伸练习,运动强度约为65%~70%一次最大重复负荷(One Repetition Maximum,1RM),每周训练3次,每次进行3组,每组包括6个运动环节,每个环节重复6~8次。
2.3.2 饮食控制方案
运动干预期间的膳食以满足肥胖青少年生长发育的基本生理需要为标准,由营养师统一配餐,个体一日总热量摄入根据“个体体重×极轻体力劳动单位体重热能供应量(20~25kal/kg)”计算;早、中及晚餐提供的热量比例约为30%、40%、30%。其中,糖、脂肪及蛋白质的供能量约占总热量的60%、25%及15%。方案实施期间,严格统一作息制度,严禁受试者额外的能量摄入。
2.4 身体基本情况测试
对所有受试者的身高、体重、BMI、腰围、臀围、颈围、血压等指标在实验前后进行测试。为尽量减小操作误差,前后检测均由同一测试人员完成。
2.5 血液生化指标测试
分别在实验前后采集受试者空腹状态下的肘静脉血,分离血清置-80 ℃环境保存待测。为避免生物节律对实验结果的影响,血液采集时间均选择在上午8∶00~10∶00点进行。脂代谢指标采用酶比色法测定:包括甘油三酯(total triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C),并计算动脉粥样硬化指数:AI=(TC-HDL-C)/HDL-C;血糖(FBG)采用氧化酶法测定;NO、ET-1、AGT、ACE、AngⅡ、ALD及胰岛素水平采用酶联免疫吸附法测定,血清PRA水平采用放射免疫分析法测定,并计算胰岛素抵抗指数:HOMA-IR=FBG×FINS / 22.5。
2.6 血管内皮功能检测
基于外周动脉张力测定技术(PAT ,Peripheral Arterial Tonometry)的EndoPAT-2000系统,能够通过置于指尖上独特的生物传感器,测量内皮介导的血管张力变化[22],通过反应性充血指数(Reactive Hyperemia Index,RHI)间接反映血管内皮功能,在评价肥胖青少年血管内皮功能方面,已经取得了较多的研究成果[17,23,25]。
本研究使用EndoPAT-2000系统(以色列,Itamar Medical Ldt)对受试者食指指尖动脉搏动容积变化进行检测,记录对照组和实验组受试者的RHI变化情况。测试时先进行5 min基线值的测定。然后,在肱动脉处对血流进行阻断,再进行5 min的测定。接着将阻断放开,最后进行5 min的阻断后测定。随后,系统会自动生成RHI值。

图1 EndoPAT-2000系统评价受试者RHI图示Figure 1. The Evaluation of RHI Using by EndoPAT-2000
2.7 统计方法
采用SPSS 18.0进行统计学分析。数据均以( ±SD)表示,实验组前后测的数据采用配对样本 t 检验。实验组和对照组间的数据采用独立样本 t 检验。相关性分析使用Pearson相关分析方法,显著性水平为P=0.05。
3 研究结果
3.1 运动结合饮食控制前后受试者身体形态指标变化
如表1所示,运动结合饮食控制干预前,肥胖青少年的体重、BMI、颈围、腰围、臀围等指标均高于对照组,具有非常显著性差异(P<0.01)。经过6周运动结合饮食控制,肥胖青少年体重(93.30 ± 20.04 vs 82.69 ± 17.66,P<0.01)、BMI(33.21 ± 4.23 vs 29.31±3.80,P<0.01)、颈围(40.17 ±3.84 vs 37.49 ± 3.68,P<0.01)、腰 围(101.90 ± 11.46 vs 90.70 ± 10.73,P<0.01)、臀围(110.24 ± 11.24 vs 104.66 ±10.22,P<0.01)等指标均下降,均具有非常显著性差异。
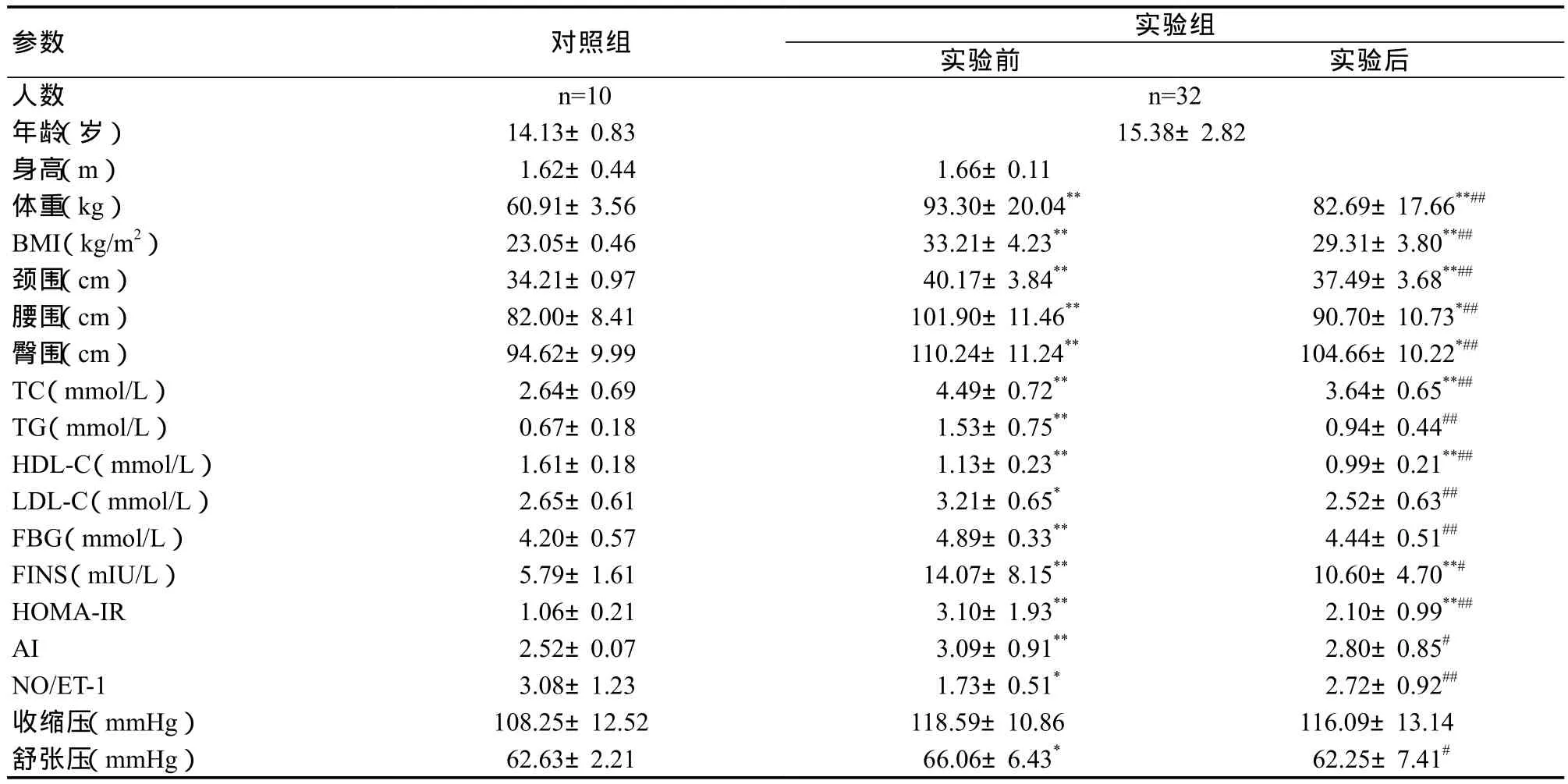
表1 受试者实验前后身体形态、血液、血压指标变化Table 1 Change of Body Shape,Blood and Blood Pressure in before and after Exercise Intervention
3.2 运动结合饮食控制前后受试者常规生理指标变化
如表1所示,运动结合饮食控制前,肥胖青少年的总胆固醇、甘油三酯、低密度脂蛋白胆固醇、血糖、胰岛素、胰岛素抵抗指数、动脉粥样硬化指数、舒张压等指标均不同程度的显著高于对照组(P<0.01,P<0.01,P<0.05,P<0.01,P<0.01,P<0.01,P<0.01,P<0.05),高密度脂蛋白和NO/ET-1显著低于对照组(P<0.01,P<0.05)。经过6周运动结合饮食控制干预,肥胖青少年总胆固醇(4.49± 0.72 vs 3.64 ± 0.65,P<0.01)、甘油三酯(1.53 ± 0.75 vs 0.94 ± 0.44,P<0.01)、低密度脂蛋白胆固醇(3.21 ±0.65 vs 2.52 ± 0.63,P<0.01)、高密度脂蛋白胆固醇(1.13± 0.23 vs 0.99 ± 0.21,P<0.01)、血糖(4.89 ± 0.33 vs 4.44± 0.51,P<0.01)、胰岛素(14.07 ± 8.15 vs 10.60 ± 4.70,P<0.05)、胰岛素抵抗指数(3.10 ± 1.93 vs 2.10 ± 0.99,P<0.01)、动脉粥样硬化指数(3.09 ± 0.91 vs 2.80 ± 0.85,P<0.05)、舒张压(66.06 ± 6.43 vs 62.25 ± 7.41,P<0.05)等指标均出现不同程度的显著下降。NO/ET-1(1.73 ± 0.51 vs 2.72 ± 0.92,P<0.01)显著上升。其中,甘油三酯、低密度脂蛋白胆固醇、血糖、动脉粥样硬化指数、NO/ET-1、舒张压等指标同对照组相比,已经不具有显著的差异。

图2 受试者实验前后RAAS系统主要成分及血管内皮功能变化情况Figure 2. Change of RAAS System and Endothelial Function in before and after Exercise Intervention
3.3 运动结合饮食控制前后受试者血管内皮功能变化
如图2F所示,运动结合饮食控制干预前,肥胖青少年RHI水平显著低于对照组(P<0.01)。经过6周运动结合饮食控制干预,肥胖青少年RHI(1.43 ± 0.35 vs 1.67 ±0.36,P<0.01)水平出现非常显著的上升,但仍显著低于对照组(P<0.05)。
3.4 运动结合饮食控制前后受试者RAAS系统主要成分变化
如图2A-E所示,运动结合饮食控制干预前,肥胖青少年的血清PRA、AGT、ACE、AngⅡ和ALD水平显著高于对照组(P<0.01)。经过6周运动结合饮食控制,肥胖青少年血清PRA(3.58±0.63 vs 2.51±0.55,P<0.05)、AngⅡ水 平(207.35 ± 51.53 vs 160.25 ± 36.70,P<0.01)、ALD(100.10±16.5 vs 68.13±10.1,P<0.01)显著下降,且同对照组相比,不存在显著差异。而肥胖青少年血清ACE、AGT水平在实验前后并未出现显著变化,仍然显著高于对照组(P<0.01)。
3.5 运动结合饮食控制前后受试者AngⅡ与RHI变化的相关性
对肥胖青少年运动结合饮食控制前后的血清PRA、AngⅡ、ALD水平以及RHI分别进行Pearson相关分析,结果如图3A-C所示。此外,运动结合饮食控制干预前后血清PRA与AngⅡ(r=0.68,P<0.01),AngⅡ与ALD(r=0.58,P<0.01)以及PRA与ALD(r=0.61,P<0.01)水平的变化程度均呈正相关关系。此外,如图3D所示,肥胖青少年运动结合饮食控制前后,AngⅡ的变化量与RHI的变化量呈显著的负相关关系(r=-0.562,P<0.01)。

图3 运动结合饮食控制干预前后肥胖青少年RAAS指标与RHI相关性分析Figure 3. Correlation of the RAAS Index and RHI of Obese Adolescents in before and after Exercise Intervention
4 讨论
肥胖作为一种慢性疾病,使2型糖尿病、高血压、动脉粥样硬化等心血管疾病的风险加大[17,21],是心血管疾病的独立危险因素[32]。近年来,青少年肥胖的发病日益严重,已成为严重威胁青少年健康的社会问题。血管内皮功能障碍是肥胖相关心血管疾病的始动环节,通过合理的干预措施,肥胖青少年血管内皮功能障碍可以得到有效逆转,从而有效降低肥胖青少年心血管疾病的风险。因此,探索肥胖青少年血管内皮功能障碍的有效干预措施,已经成为当前预防医学领域的重要课题。
规律运动结合饮食干预作为健康生活方式的重要内容,已被证实可作为降低肥胖、预防心血管疾病的重要非药物策略。科学的运动锻炼与饮食控制能够有效降低人群的心血管风险事件发生率和死亡率[4,38],并对肥胖者血管内皮功能有着积极的影响。高强度有氧间歇训练(AIT)和持续中等强度训练(CME)都可以有效提高心血管疾病人群的运动能力,并降低代谢风险因素,其中AIT的时效性要优于CME[38]。在降低血压和改善心血管风险因素方面,AIT和CME也表现出较好的效果[16]。动物研究也发现,跑台训练与游泳训练能够减缓动脉粥样硬化的进程并延缓血管斑块的产生,特别是载脂蛋白E和低密度脂蛋白胆固醇受体缺乏的大鼠[28,37]。通过有氧运动能够缓解肥胖造成的轻度高血压并预防自发性高血压的发病[3,39]。此外,同有氧运动一样,抗阻运动也被证实能够改善肥胖人群的身体成分并降低代谢综合征的风险[18,36]。已有研究发现,抗阻运动对高血压大鼠的心血管系统能够产生积极影响[41],减缓肥胖和轻度高血压的发展并改善肥胖大鼠的新陈代谢[24,43]。同时,还能预防由高脂饮食引起的心血管系统结构与功能的改变[14]。
本实验室在前期研究发现,6周有氧运动结合抗阻运动的形式能够有效降低肥胖青少年体重、改善体成分、降低胰岛素抵抗、氧化应激及炎症水平,并显著提高了血流介导的血管舒张功能(FMD),推测运动干预改善肥胖青少年血管内皮功能的机制与运动降低了氧化应激及炎症有关[1]。本研究考虑安全因素,选择以持续中等强度有氧运动结合抗阻训练作为运动干预的主要形式,同时,结合饮食控制,以使运动干预的健康效益最大化。本研究结果证实,通过6周的运动结合饮食控制干预,肥胖青少年的身体成分、形态指标及低密度脂蛋白胆固醇、总胆固醇、甘油三酯、血糖、胰岛素抵抗指数、舒张压等生理指标均有明显改善,进一步证明了本研究所采用的运动结合饮食控制干预方案的有效性。
既往研究中,血管内皮功能的评价方式更多地采用血管血流介导舒张功能(flow-mediated dilation,FMD),即以肱动脉血流阻断前后血管内径变化能力,间接反映血管内皮功能。众多研究表明,运动训练能够对患有代谢综合征人群的FMD产生良好的改善作用[12,40]。但是,FMD在可操作性上具有一定的局限性。EndoPAT设备作为评价血管内皮功能的一项无创的新技术,是以佩戴于指端的生物传感器PAT 探头,检测肱动脉血流阻断前后,指端动脉血管的反应性充血指数(RHI)来评价血管内皮功能。有研究发现,RHI与冠状动脉疾病(CAD)患者的心血管危险因素和未来心血管疾病事件负相关[15]。经过低能量饮食(LED)和中等强度有氧运动干预后,伴随着体重减轻,RHI显著改善[29]。因此,本研究采用EndoPAT评价肥胖青少年血管内皮功能的变化。结果发现,6周运动结合饮食控制后,肥胖青少年的RHI显著上升,进一步证明了运动干预结合饮食控制能够改善肥胖青少年的血管内皮功能,也进一步支持了EndoPAT技术评价血管内皮功能的有效性。
在RAAS系统中,血管紧张素原(AGT)在肾素(PRA)作用下水解成血管紧张素I(Ang I),后者在血清和组织中,通过血管紧张素转换酶(ACE)的作用生成血管紧张素Ⅱ(AngⅡ),AngⅡ可通过作用于肾上腺皮质球状带,促进醛固酮的合成。同时,AngⅡ可通过AT1型受体选择性地干扰血管内皮细胞PI3K/Akt/eNOS信号转导,抑制NO生成。同时,激活RAS/Raf/ERK/AP-1通路促进ET-1生成,进而导致血清NO/ET-1比例失衡,影响血管的正常舒缩功能[48]。AngⅡ可发挥强烈的缩血管效应,而ALD 是RAAS 的最终效应因素,和AngⅡ协同作用可引起脂肪细胞肥大与血管收缩[2]。本研究也发现,在运动结合饮食控制干预前,肥胖青少年的PRA、AGT、ACE、AngⅡ和ALD水平都显著高于对照组,而NO/ET-1显著低于对照组。提示,肥胖青少年RAAS系统活化水平显著增加。而通过6周的运动结合饮食控制干预后,虽然肥胖青少年血清AGT和ACE水平并没有出现显著变化,但是,PRA、AngⅡ和ALD水平却显著降低,同时NO/ET-1水平显著升高。提示,运动结合饮食控制干预有效降低了肥胖青少年RAAS系统活性,并显著改善了其血管内皮细胞的内分泌功能。RAAS异常是心血管疾病的主要发病机制,PRA、AngⅡ及ALD对血压的调节起着重要作用,三者之间的任一因素异常都有导致血压异常的可能。研究证实,中等强度的体力活动可缓解肥胖成年人所带来的RAAS系统的激活状态[47],而本研究表明,这种规律在肥胖儿童中同样适用[17]。
本研究中,6周运动结合饮食控制干预前后,肥胖青少年血清AGT和ACE水平未出现显著变化,这可能是因为本研究干预时间较短,运动引起的RAAS系统活性成分变化可能具有时序性特征。此外,本研究由于采样量及实验条件的限制,没有分析RAAS系统中ACE2/Ang-(1-7)/Mas这一保护轴的变化情况,后续研究应当将RAAS系统成分进行综合分析,以更加精确地阐明运动干预对肥胖青少年RAAS系统的影响。
本研究结果还显示,6周运动结合饮食控制干预前后肥胖青少年的血清PRA、AngⅡ、ALD三者之间的变化程度均呈显著正相关,这提示,运动结合饮食控制可以有效降低肥胖青少年RAAS系统活性,因此,降低了AngⅡ与ALD水平。此外,AngⅡ水平与RHI变化程度存在显著负相关,其原因可能是经过6周的运动结合饮食控制干预后,随着RAAS系统活性降低,肥胖青少年AngⅡ水平也随之降低,进而减少了其对血管内皮细胞PI3K/Akt/eNOS信号的抑制,促进血管内皮细胞NO释放,增加了RHI。这提示,6周运动结合饮食控制干预改善肥胖青少年血管内皮功能的机制与RAAS系统活性降低有关。
5 小结
肥胖青少年RAAS系统活化水平增加,通过6周的运动结合饮食控制干预,能够有效改善肥胖青少年的身体形态、糖脂代谢、RAAS系统活性以及血管内皮功能,运动结合饮食控制干预,提高肥胖青少年血管内皮功能的相关机制,可能与RAAS系统活性降低有关。
[1] 李娟,唐东辉,陈巍. 有氧运动结合抗阻训练对男性肥胖青少年心血管功能的改善及可能机制[J]. 体育科学,2013,33(8):37-42.
[2] 唐东辉,李娟. 肥胖儿童血管内皮细胞胰岛素抵抗及运动干预的研究现状[J]. 沈阳体育学院学报,2014,33(1):82-85.
[3] AGARWAL D,WELSCH M A,KELLER J N,et al. Chronic exercise modulates RAS components and improves balance between pro- and anti-inflammatory cytokines in the brain of SHR [J].Basic Res Cardiol,2011,106(6):1069-1085.
[4] ANDERSON J L,ADAMS C D,ANTMAN E M,et al. 2012 ACCF/AHA focused update incorporated into the ACCF/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction [J]. Circulation,2013,127(23):e663-e828.
[5] BURACZYNSKA M,PIJANOWSKI Z,SPASIEWICZ D,et al.Renin-angiotensin system gene polymorphisms:assessment of the risk of coronary heart disease [J]. Kardiol Pol,2003,58(1):1-9.
[6] BRUYNDONCKX L,HOYMANS V Y,DE G A,et al. Diet,exercise,and endothelial function in obese adolescents [J]. Pediatrics,2015,135(3):653-661.
[7] CELERMAJER D S,SORENSEN K E,GOOCH V M,et al.Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis [J]. Lancet,1992,340(8828):1111-1115.
[8] CHUEH L H,YING T W,CHOU C H,et al. Effect of aerobic interval training on exercise capacity and metabolic risk factors in people with cardiometabolic disorders [J]. J Cardiopulm Rehabil Prev,2011,(31):378-385.
[9] DELBIN M A,DAVEL AP,COUTO G K,et al. Interaction between advanced glycation end products formation and vascular responses in femoral and coronary arteries from exercised diabetic rats [J]. Plos One,2012,7(12):e53318- e53319.
[10] DELP M D,LAUGHLIN M H. Regulation of skeletal muscle perfusion during exercise [J]. Acta Physiol Scand,1998,162(3):411-419.
[11] FARPOURLAMBERT N J,AGGOUN Y,MARCHAND L M,et al. Physical activity reduces systemic blood pressure and improves early markers of atherosclerosis in pre-pubertal obese children [J]. J Am Coll Cardiol,2009,54(25):2396-2397.
[12] FRANCOIS M E,DURRER C,PISTAWKA K J,et al. Resistance-based interval exercise acutely improves endothelial function in 2 type 2 diabetes [J]. Am J Physiol Heart Circ Physiol,2016,311(5):H258-H267.
[13] FRANKS P W,HANSON R L,KNOWLER W C,et al. Childhood obesity,other cardiovascular risk factors,and premature death [J]. N Engl J Med,2010,362(19):485-486.
[14] GUILHERME F,ANDRE A,VENDRAMINI R C,et al. Resistance training prevents the cardiovascular changes caused by high-fat diet [J]. Life Sci,2016,(146):154-162.
[15] HAMBURG N M,KEYES M J,LARSON M G,et al. Cross-sectional relations of digital vascular function to cardiovascular risk factors in The Framingham Heart Study [J]. Circulation,2008,117(19):2467-2471.
[16] HARALD E,TOMAS S,TJONNA A E,et al. Aerobic interval training reduces blood pressure and improves myocardial function in hypertensive patients [J]. Eur J Prev Cardiol,2011,19(2):151-160.
[17] HOWARD B V,RUOTOLO G,ROBBINS D C,et al. Obesity and dyslipidemia [J]. Endocrinol Metab Clin North Am,2003,32(4):855–867.
[18] INGA E,GJERTRUD A,TJONNA A E,et al. Both aerobic endurance and strength training programmes improve cardiovascular health in obese adults [J]. Clin Sci,2008,(115):283-293.
[19] JR M T,BAUGHMAN K L,THOMPSON P D. Exercise prescription and primary prevention of cardiovascular disease [J].Circulation,2010,121(23):2601-2602.
[20] KATZMARZYK P T,CRAIG C L. Musculoskeletal fitness and risk of mortality [J]. Med Sci Sport Exe,2002,34(5):740-744.
[21] KOPELMAN P G. Obesity as a medical problem [J]. Nature,2000,404(6778):635–643.
[22] KOSTIS J B,WILSON A C,HOOPER W C,et al. Association of angiotensin-converting enzyme DD genotype with blood pressure sensitivity to weight loss [J]. Am Heart J,2002,144(4):625-629.
[23] KUANGCHUNG S,JANCKILA A J,CHINGFAI K,et al. Effects of exercise on insulin sensitivity,inflammatory cytokines,and serum tartrate-resistant acid phosphatase 5a in obese Chinese male adolescents [J]. Metabolism,2010,59(1):144-151.
[24] LEITE R D,DURIGAN C,DE A D,et al. Resistance training may concomitantly benefit body composition,blood pressure and muscle MMP-2 activity on the left ventricle of high-fat fed diet rats [J]. Metabolism,2013,62(10):1477-1484.
[25] MAHMUD F H,HILL D J,CUERDEN M S,et al. Impaired vascular function in obese adolescents with insulin resistance [J]. J Pediatr,2009,155(5):678-682.
[26] MAIORANA A,ODRISCOLL G,CHEETHAM C,et al. The effect of combined aerobic and resistance exercise training on vascular function in type 2 diabetes [J]. J Am Coll Cardiol,2001,38(3):860-866.
[27] MCKINLEY M J,ALBISTON A L,ALLEN A M,et al. The brain rennin-angiotensin system:location and physiological roles [J].Int J Biochem Cell Biol,2003,35(6):901-918.
[28] MEISSNER M,LOMBARDO E,HAVINGA R,et al. Voluntary wheel running increases bile acid as well as cholesterol excretion and decreases atherosclerosis in hypercholesterolemic mice [J].Atherosclerosis,2011,218(2):323-329.
[29] MERINO J,MEGIAS R I,FERRE R,et al. Body weight loss by very-low-calorie diet program improves small artery reactive hyperemia in severely obese patients [J]. Obes Surg,2013,23(1):17-23.
[30] MIYAKI A,MAEDA S,YOSHIZAWA M,et al. Effect of habitual aerobic exercise on body weight and arterial function in overweight and obese men [J]. J Am Coll Cardiol,2009,104(6):823-828.
[31] MONTERO D,WALTHER G,PEREZMARTIN A,et al. Endothelial dysfunction,inflammation,and oxidative stress in obese children and adolescents:markers and effect of lifestyle intervention [J]. Obes Rev,2012,13(5):441-442.
[32] MURPHY N F,MACINTYRE K,et al. Long-term cardiovascular consequences of obesity:20-year follow-up of more than 15000 middle-aged men and women (the Renfrew-Paisley study) [J].Eur Heart J,2006,27(1):96–106.
[33] NG M,FLEMING T,ROBINSON M,et al. Global,regional and national prevalence of overweight and obesity in children and adults 1980-2013:A systematic analysis [J]. Lancet,2014,384(9945):766-781.
[34] NICOLAS K,NIINA M,HARRI S,et al. Effect of age on highfat diet-induced hypertension [J]. Am J Physiol Heart Circ Physiol,2011,301(1):H164-H166.
[35] OKAMOTO T,MASUHARA M,IKUTA K. Combined aerobic and resistance training and vascular function:effect of aerobic exercise before and after resistance training [J]. J App Phy,2007,103(5):1655-1661.
[36] OLSON T P,DENGEL D R,LEON A S,et al. Moderate resistance training and vascular health in overweight women [J]. Med Sci Sports Exe,2006,38(9):1558-1564.
[37] PELLEGRIN M,BERTHELOT A,HOUDAYER C,et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice [J]. Atherosclerosis,2007,190(1):35-42.
[38] PERK J,DE B G,GOHLKE H,et al. European guidelines on cardiovascular disease prevention in clinical practice [J]. Eur Heart J,2012,33(13):1635-1701.
[39] PINHEIRO A R,CUNHA A R,AGUILA M B,et al. Beneficial effects of physical exercise on hypertension and cardiovascular adverse remodeling of diet-induced obese rats [J]. Nutr Metab Cardiovasc Dis,2007,17(5):365-375.
[40] SAWYER B J,TUCKER W J. Effects of high-intensity interval training and moderate-intensity continuous training on endothelial function and cardiometabolic risk markers in obese Adults [J]. J Appl Physiol,2016,121(1):279-288.
[41] SHIMOJO G L,PALMA R K,BRITO J O,et al. Dynamic resis
tance training decreases sympathetic tone in hypertensive ovariectomized rats [J]. Braz J Med Biol Res,2015,48(6):523-527.
[42] TJONNA A E,SANG J L,OIVIND R,et al. Aerobic interval training versus continuous moderate exercise as a treatment for the metabolic syndrome a pilot study [J]. Yearbook Anesthesiol Pain Manage,2008,118(4):346-348.
[43] SPERETTA G F,ROSANTE M C,DUARTE F O,et al. The effects of exercise modalities on adiposity in obese rats [J]. Clin,2012,67(12):1469-1477.
[44] STRAZZULLO P,IACONE R,IACOVIELLO L,et al. Genetic variation in the renin-angiotensin system and abdominal adiposity in men:the olivetti prospective heart study [J]. Ann Intern Med,2003,138(1):17-23.
[45] TOUNIAN P,AGGOUN Y,DUBERN B,et al. Presence of increased stiffness of the common carotid artery and endothelial dysfunction in severely obese children:a prospective study [J].Child:Care,Heal Develop,2002,28(2):191-192.
[46] WATTS K,BEYE P,SIAFARIKAS A,et al. Exercise training normalizes vascular dysfunction and improves central adiposity in obese adolescents [J]. J Am Coll Cardiol,2004,43(10):1823-1827.
[47] ZHANG L,MIYAKI K,ARAKI J,et al. Interaction of angiotensin I-converting enzyme insertion-deletion polymorphism and daily salt intake influences hypertension in Japanese men [J].Hypertens Res,2006,29(10):751-758.
Exercise Combined with Diet Control Improving Male Obese Adolescents’ Vascular Endothelial Function through Reducing the Activity of RAAS System
Objective:To reveal biological mechanisms of exercise combined with diet control to improve obese adolescents’ endothelial function by detecting the change of endothelial function and the RAAS system main components in enclosed exercise weight loss camp. Method:32 male obese adolescents take a 6-weeks exercise combined with diet control intervention. The Reactive Hyperemia Index (RHI) was detected using EndoPAT-2000 system before and after intervention. Meanwhile the serum levels of NO,ET-1,PRA,AngⅡ,AGT,ACE,ALD,body morphology,glucolipid metabolism and BP were tested. There was a significant positive correlation between the changes of serum PRA,AngⅡ and ALD belong the intervention of diet and control,and a significant negative correlation between AngⅡ and RHI (r=-0.562,P=0.003). Result:After 6-weeks intervention,obese adolescents’ body morphology,girth and glucolipid metabolism are significantly improved. RHI(P<0.01) and serum levels of NO/ ET-1 (P<0.01) are significantly increased,while PRA、AngⅡand ALD significantly decreased(P<0.05、P<0.01 and P<0.01). ΔAngⅡ and ΔRHI has significant negative correlation (r=-0.562,P=0.003). Conclusion:The activity of RAAS system in obese adolescents is increased significantly. The 6-weeks exercise combined with diet control intervention can improve vascular endothelial function in obese adolescents effectively and its mechanisms may be related to the decreased activity of RAAS system after exercise combined with diet control.
exercise;obese adolescents;endothelial function;EndoPAT;RAAS
G80-05
A
1000-677X(2017)09-0048-07
10. 16469/j. css. 201709005
2017-04-28;
2017-09-05
国家自然科学基金面上项目 (81472992);波谱与原子分子物理国家重点实验室开放课题 (T151409)。
唐东辉,女, 教授,博士生导师,研究方向为体质与健康、青少年体重控制,Tel:(010)58805205,E-mail:tdh1964@bnu.edu.cn;侯玉洁,女,在读硕士研究生,研究方向为体质与健康、青少年体重控制,E-mail:1052519207@qq.com;白爽,女,在读博士研究生,研究方向为体质与健康、青少年体重控制,E-mail:baishuangvivi@163.com。
1. 北京师范大学 体育与运动学院,北京 100875;2. 河北师范大学 体育学院,河北 石家庄 050024;3. 卓尔运动减肥中心,浙江 杭州 310023;4. 泰山医学院 运动医学与康复学院,山东 泰安 271000
1.Beijing Normal University,Beijing 100875,China;2.Hebei Normal University,Shijiazhuang,050024,China;3.Zhuoer Exercise Weight-losing,Hangzhou,310023,China;4.Taishan Medical University,Taian,271000,China.
