一株新的多菌灵降解菌的筛选、鉴定及其降解特性
2017-09-26王亦然年浩瀚陈梦玲王光利
李 杰,王亦然,年浩瀚,陈梦玲,鲁 瑶,王光利
①
(淮北师范大学 生命科学学院,安徽 淮北 235000)
一株新的多菌灵降解菌的筛选、鉴定及其降解特性
李 杰,王亦然,年浩瀚,陈梦玲,鲁 瑶,王光利
①
(淮北师范大学 生命科学学院,安徽 淮北 235000)
从长期受多菌灵污染的土壤中,通过培养试验和紫外分光光度计法,筛选出一株能较好降解多菌灵的细菌,并将其命名为C4.根据菌落形态、生理生化特性及16S rDNA序列的同源性分析等,初步鉴定为细杆菌属.多菌灵降解菌C4能够适应较广的温度范围,且在30℃生长最好,降解效果最优.当初始pH为7.0,且通气量大的时候,该菌株生长最好,降解率最高.在一定的NaCl浓度范围内,降解菌C4都能生长,且当盐浓度为35 g·L-1时,降解率最高,结合实验所得数据,本次实验选择10 g·L-1.在最优降解条件下,降解菌C4在5~6 d内,几乎可以完全降解100 mg·L-1的多菌灵,平均降解能力为18.5 mg·L-1·d-1.
多菌灵;筛选;鉴定;生物降解
0 引言
多菌灵(N-(2-苯骈咪唑基)-氨基甲酸甲酯)是一种苯并咪唑类杀菌剂,具有广谱、高效、低毒的特点,在世界各国的工农业生产中有很长的应用历史.同时它也是苯菌灵和托布津类杀菌剂的主要代谢产物.多菌灵的作用机制是在细胞分裂期,通过打乱微管组装来阻止纺锤体的形成.由于长期大量且不规范地使用多菌灵,喷洒的农药大部分都进入土壤中.多菌灵及其残留物已在多种粮食、蔬菜、水果、草药及烟草中检测到.农药残留超标不仅使农民受到严重的损失,同时对环境也造成危害.多菌灵在土壤中较稳定,且在不同的土壤环境下,半衰期也有差别[1-2],残留在土壤中的多菌灵会通过植物的根系,叶脉进入整个植物[3],最后通过食物链传递给各级消费者[4],产生毒害影响.有关多菌灵的毒害作用已经有不少报道.Morinaga等[5]发现多菌灵有可能会干扰人类的内分泌.Singh等[6]通过对大麦根的分生细胞分析得出,多菌灵有可能会造成遗传毒害.现已有大量的报道证明,多菌灵对雄性生殖系统具有毒性作用,如Nakai等[7]研究结果显示,大剂量的口服多菌灵会明显损伤精子形成早期的顶体.我国每年多菌灵的生产量已超过10 000 T.大量的农药残留在土壤、河流中,对各种生物的生长繁殖造成潜在的危害.目前已经报道多种多菌灵降解菌,且降解途径已有报道[8-9],但有关细杆菌属对多菌灵的降解还尚未有报道.
1 材料与方法
1.1 材料
1.1.1 培养基与试剂
基础培养基:1.5 g K2HPO4,0.5 g KH2PO4,0.2 g MgSO4·7H2O,1.0 g NaCl,1.0 g NH4NO3,1 L水. LB培养基:5 g酵母提取物,10 g NaCl,10 g胰化蛋白胨,1 L水.
1.1.2 供试土样和药剂
从江苏省太仓市某农药厂多菌灵生产车间排污口处采集的活性污泥土样;多菌灵原药(有效成分98%),购自石家庄百纳化工助剂有限公司;三氯甲烷(色谱纯)、乙酸乙酯(色谱纯)、甲醇(色谱纯)、无水硫酸钠(分析纯).
1.1.3 仪器
TQHZ-2002A大容量全温度振荡培养箱;智能光照培养箱;德国Hettich ROTINA380R离心机;高效液相色谱仪.
1.2 方法
1.2.1 多菌灵降解菌的富集筛选
取采集的5份土样,每份2 g,共10 g,加入100 mL的基础培养基中,培养基中另加0.1%的酵母膏,和终浓度50 mg·L-1的多菌灵.在30℃,160 r·min-1的恒温震荡箱中培养5 d,取第一次富集液的上清5 mL,转接到100 mg·L-1的多菌灵富集培养基中继续培养5 d.同样的条件下连续转接,富集液浓度分别为200 mg·L-1,300 mg·L-1,400 mg·L-1,500 mg·L-1,600 mg·L-1.稀释涂布,培养3 d后根据菌落的颜色、大小、湿润度、透明度、菌落边缘的形态、菌落的形状等选择具有代表性的单菌落,在平板上进行编号后划线,在恒温培养箱中倒置培养24 h.得到纯培养物后接种到10 mL的液体LB中培养至OD600为1.0时,接2%的培养液到多菌灵浓度为50 mg/L的基础培养基中,通过紫外分光光度计和HPLC进行验证.对有明显降解效果的纯培养物进行甘油保存,方便后续实验使用.
1.2.2 HPLC检测
取培养7 d的多菌灵降解液,用等体积的三氯甲烷萃取,静置分层后收集下层,无水硫酸钠去除残留水分.室温下用氮气流挥发净三氯甲烷,再用2 mL甲醇重新溶解,0.22 μm有机相针头过滤去除杂质后收集,通过高效液相色谱仪检测.HPLC条件:流动相为甲醇和水(1:1),流速1 mL·min-1,检测波长为280 nm.
1.2.3 16S rRNA的PCR扩增和序列测定
按照1%的接菌量接种到液体LB中,恒温培养至生长对数期,采用高盐法提取基因组[10].PCR引物为通用引物(+)27F:5′-AGAGTTTGATCCTGGCTCAG-3′和(-)1492R:5′-GGTTACCTTGTTACGACT-3′.扩增体系为:基因组模板20 ng,10×buffer 5 μL,10 mmol·L-1的dNTPs 2 μL,10 μM的27F 1 μL,10 μM的1492R 1μL,5 U·μL-1的Tap Plus poiymerase 0.5 μL,剩下的用水补齐50 μL.PCR扩增程序:95℃5 min;94℃30 s,56℃30 s,72℃90 s,共30个循环;72℃10 min.扩增产物连接到pMD18-T载体中,然后转化到E.coli DH5α中,挑选阳性克隆子送到上海生物工程技术服务有限公司进行测序,将测序结果在NC⁃BI上,在线查询分析,利用Blast软件在GenBank中与其他的16S rDNA基因序列进行同源性比较,选择相近的序列和降解菌株的序列用MEGA 5.0计算遗传距离,通过邻结法[11]构建系统进化树,如图1所示.
1.2.4 纯培养条件下菌株的降解特性
1.2.4.1 pH对菌株生长及降解特性的影响
取5%处于对数期OD为1.0的新鲜菌液加入到灭过菌的100 mL无机盐培养基中,多菌灵的终浓度为100 mg·L-1,用HCl和NaOH来调节pH,分别为4.0,5.0,6.0,7.0,8.0,9.0,10.0时,30℃,160 r的恒温震荡培养箱中避光培养72 h,吸取2 mL培养液,测此时降解菌的OD600.同时,萃取出培养液中的多菌灵,用紫外分光光度计进行检测.以灭活菌做对照.
1.2.4.2 温度对降解菌株的生长及降解特性的影响
取处于生长对数期OD600为1.0的新鲜菌液5 mL,加入到100 mL无机盐培养基中,多菌灵的终浓度为100 mg·L-1,分别放置在10℃,15℃,20℃,25℃,30℃,35℃,40℃,160 r的恒温震荡培养箱中避光培养72 h.吸取2 mL培养液测菌的吸光值,剩余的培养液用三氯甲烷萃取,再用紫外分光光度计检测.
1.2.4.3 装液量对降解菌生长和降解特性的影响
取处于生长对数期OD600为1.0的新鲜菌液5 mL,加入到分别装有30 mL,50 mL,70 mL,90 mL,110 mL,130 mL的无机盐培养基中,多菌灵的终浓度为100 mg·L-1,放置在30℃,160 r的恒温震荡培养箱中避光培养72 h.吸取2 mL培养液测菌的吸光值,剩余的培养液用三氯甲烷萃取,再用紫外分光光度计检测.
1.2.4.4 NaCl浓度对降解菌降解特性的影响
取处于对数生长期OD600为1.0的新鲜菌液5 mL,加入到含有不同浓度NaCl的无机盐培养基中,多菌灵的终浓度为100 mg·L-1.置于30℃,160 r·min-1恒温振荡培养箱中培养72 h后,用紫外分光光度计检测.
1.2.4.5 最优培养条件下多菌灵的降解特性
取处于对数生长期OD600为1.0的新鲜菌液5 mL,加入到100 mL无机盐培养基中,30℃,160 r·min-1置于恒温震荡培养箱中培养5 d,分别于12 h,24 h,36 h,48 h,72 h,96 h,120 h取样,用HPLC检测.
2 结果与分析
2.1 多菌灵降解菌的筛选与鉴定
用无机盐培养基,经过40 d的富集筛选得到一株降解多菌灵的菌株,将其命名为C4.纯培养物的菌落表面光滑粘稠,凸起湿润,颜色呈黄绿色,边缘整齐,镜检结果呈革兰氏阳性.用SDS高盐法提取C4的基因组,以通用引物扩增出大小为1.5 kb的16S rDNA序列,扩增产物送至上海生工生物公司测序,测序结果在GenBank数据库中进行DNA序列 BLAST同源性比较,发现其与细杆菌属的相似度最高.结合菌株C4的形态特征,生理生化特性,初步鉴定菌株C4属于细杆菌属(Microbacterium),且尚不能确定种,还需与模式生物进行DNA杂交,根据同源性做进一步分析.
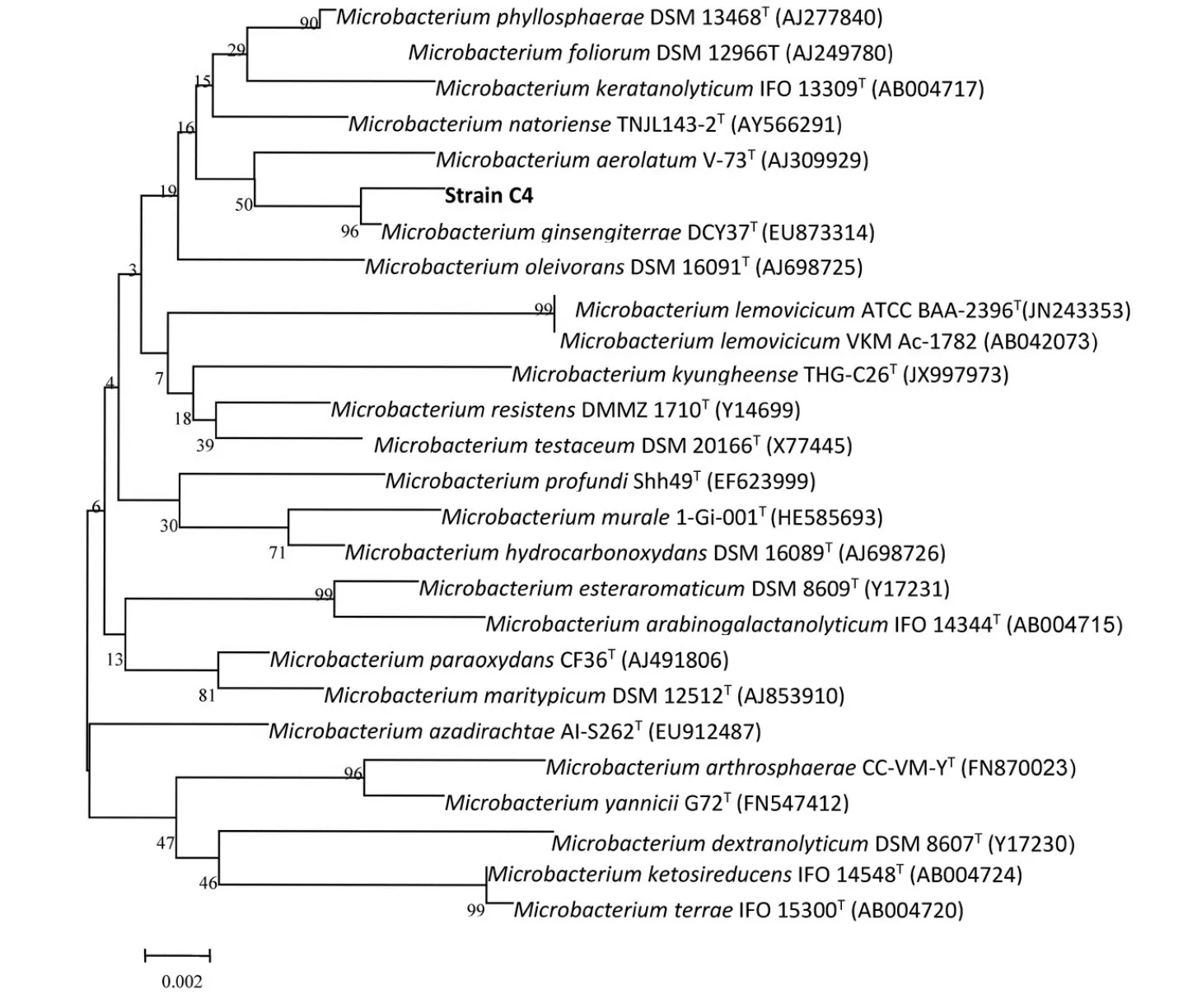
图1 根据16S rDNA部分基因序列构建的菌株C4与相关种属的系统发育树
2.2 纯培养条件下菌株的降解特性
2.2.1 pH对菌株生长及降解特性的影响
在不同的pH条件下,多菌灵的生长和降解情况如图2所示.降解菌C4在pH为7的时候,降解菌C4的生长量OD600最高为0.321,降解率也最高为82%.当培养基初期为酸性时,随着酸性的增强,降解菌的生长量和降解效果逐渐降低.当培养基初期为碱性时,随着碱性的增强,降解菌的生长量和降解效果逐渐降低.所以培养基的初始酸碱度对降解菌C4的生长量和降解率有较大的影响.由于多菌灵易溶于酸水不溶于碱水,所以在酸性条件下比在碱性条件时降解的更好.

图2 不同pH对菌株C4生长和降解的影响

图3 温度对菌株C4生长和降解的影响
2.2.2 温度对菌株生长和降解的影响
温度对降解菌C4的生长和降解效果如图3所示,降解菌C4的最适生长范围是25~35℃,此时的降解效果最佳.72 h时,降解率最高可达到68%.当温度范围在10~20℃时,降解菌生长较慢.超过35℃,该菌的生长量减少.说明高温不适合降解菌C4生长.所以本次实验最适温度选择在30℃.
2.2.3 装液量对降解菌生长和降解的影响
装液量分别为30 mL,50 mL,70 mL,90 mL,110 mL,130 mL,摇瓶培养72 h,检测结果如图4所示.当装液量为30~50 mL时,降解效果最好.此时通气量大,菌生长的也好.当通气量在70~130 mL时,降解菌株C4的降解效果逐渐下降,菌株的生长情况也逐渐下降,说明该降解菌株不是厌氧菌.考虑到瓶子的利用率,所以本次试验的装液量选定为100 mL.

图4 装液量对菌株C4生长和降解的影响

图5 NaCl浓度对菌株C4生长和降解的影响
2.2.4 NaCl浓度对降解菌生长和降解的影响
在无机盐培养基中加入不同浓度的NaCl,摇瓶培养72 h后检测菌株的生长和降解情况,如图5所示,当盐浓度为15~35 g·L-1时,菌生长状况最好,当高于35 g·L-1时,降解菌生长量迅速下降,直至浓度为100 g·L-1时,菌株几乎无法生长.盐浓度在25 g·L-1时,菌株的降解效果最好.根据实验结果,本次实验选择盐浓度为10 g·L-1.
2.2.5 最优条件下菌株的生长和降解情况
当降解条件为30℃,中性,NaCl浓度为10 g·L-1,装液量为100 mL的时候,摇瓶培养120 h后检测结果.如图6所示,从图6中可以看出,该菌在无机盐培养基中生长状况良好,且在刚开始的60 h之内降解较快,随后在120 h时,降解菌C4的降解量达到91%,能很好的降解多菌灵.且降解菌的降解曲线和生长曲线相吻合.降解菌没有明显的延滞期,生长量在逐步增加,直至72 h后处于平稳期.

图6 最优条件下菌株C4生长和降解情况
3 讨论
生物修复技术因具有经济、环保、高效的特点,作为一种治理环境农药污染的方法被国内外学者所重视.最关键性的一步就是要筛选出能够高效降解农药的菌株.张桂山等[12]报道的罗尔斯通菌属,当外加酵母提取物,多菌灵浓度为500 mg·L-1,避光培养24 d,降解率达到95.96%.Xu等[13]筛选出的红球菌属能以多菌灵为唯一碳、氮源生长.在2~3 d内,可以完全降解100 mg·L-1的多菌灵,降解率高达55.56 mg·L-1·d-1.王呈玉等[14]筛选出的拉乌尔菌属在25℃,pH 7.0,200 r·min-1,避光培养72 h,多菌灵初始浓度为50 mg·L-1的降解率达到100%.降解菌的生长特性对该菌是否能应用于生物修复具有重要的实际意义.本实验室筛选出的多菌灵降解菌Microbacterium sp.对环境具有良好的适应性.通过试验可知,该降解菌在温度范围为20~40℃时,降解率均高于30%.当pH为7左右时,降解率均高于50%,能适应稍大范围的酸碱度变化.且在NaCl浓度为10~35 g·L-1的范围内有较好的降解效果.C4能够在以多菌灵为唯一碳源的无机盐培养基中很好的生长,且降解效果较好,培养120 h后,降解率高达91%.
由于多菌灵本身对于生物安全具有危害性,且已经被大量生产并应用于农业生产过程中,所以研究多菌灵的生物降解具有重要的意义.筛选出能够高效降解多菌灵的菌株是生物修复的基础,探究降解菌的降解特性对日后把降解菌推向实际应用具有重要意义.另外,继续探索该菌株代谢途径,纯化出代谢产物验证其是否会造成二次污染,构建多功能高效稳定的工程菌等相关问题还尚待解决.
4 结论
从长期受到多菌灵污染的土壤中筛选出一株能够高效降解多菌灵的菌株,命名为C4.经生理生化实验和16S rDNA序列同源性测定,初步鉴定该降解菌为细杆菌属,其丰富了降解菌的菌种资源.该菌株能够在以多菌灵为唯一碳源的无机盐培养基中很好的生长,且降解效果较好,培养120 h后,降解率高达91%.通过试验可以看出,这株降解菌C4的最适生长条件为30℃,中性,有氧.该菌株有较宽泛的温度适应范围,且在偏酸性的条件下,降解率也高达50%以上,同时对盐浓度有一定的耐受范围.这为该菌株用于多菌灵污染土壤的微生物治理提供良好的依据,且为以后研究多菌灵代谢提供基础.
[1]李海飞,聂继云,徐国锋,等.多菌灵在柑橘,香蕉和芒果贮藏期的残留降解[J].江苏农业学报,2010,26(2):415-419.
[2]游子涵,陈智东,柳训才,等.油菜植株及其土壤中多菌灵残留检测及动态[J].农药,2006,45(8):552-553.
[3]HUEBRA M J G,HEMANDEZ P,NIETO O,et al.Determination of carbendazim in soil samples by anodic stripping voltammetry using a carbon fiber ultramicroelectrode[J].Fresenius Journal of Analytical Chemistry,2000,367(5):474-478.
[4]REISINGER K,SZIGETI J,VAMAGY L.Determination of carbendazim residues in the eggs,liver and pectoral muscle of Japanese quail(Coturnix coturnix japonica)[J].Acta Veterinaria Hungarica,2006,54(1):127-133.
[5]MORINAGA H,YANASE T,NOMURA M,et al.A benzimidazole fungicide,benomyl,and its metabolite,carbendazim,in⁃duce aromatase activity in a human ovarian granulose-like tumor cell line(KGN)[J].Endocrinology,2004,145(4):1860-1869.
[6]SINGH P,SRIVASTAVA A K,SINGH A K.Cell cycle stage specific application of cypermethrin and carbendazim to as⁃sess the genotoxicity in somatic cells of Hordeum vulgare L[J].Bulletin of Environmental Contamination and Toxicology,2008,81(3):258-261.
[7]NAKAI M,TOSHIMORI K,YOSHINAGA K,et al.Carbendazim-induced abnormal development of the acrosome during early phases of spermiogenesis in the rat testis[J].Cell and Tissue Research,1998,294(1):145-152.
[8]王玉军,马卉,李业东,等.一株高效降解菌对多菌灵的降解机理[J].农药,2014,53(1):49-51.
[9]FANG H,WANG Y,GAO C,et al.Isolation and characterization of Pseudomonas sp.CBW capable of degrading carbendaz⁃im[J].Biodegradation,2010,21(6):939-946.
[10]WANG G L,YUE W L,LIU Y,et al.Biodegradation of the neonicotinoid insecticide acetamiprid by bacterium pigmen⁃tiphaga sp.strain AAP-1 isolated from soil[J].Bioresource Technology,2013,138:359-368.
[11]赵卫,胡志君,杨敬,等.我国三株登革2型病毒基因组全序列的测定及系统发生树分析[J].军事医学科学院院刊,2000,24(3):166-169.
[12]张桂山,贾小明,马晓航,等.一株多菌灵降解细菌的分离、鉴定及系统发育分析[J].微生物学报,2004,44(4):417-421.
[13]XU J L,GU X Y,SHEN B,et al.Isolation and Characterization of a Carbendazim-Degrading Rhodococcus sp.djl-6[J]. Current Microbiology,2006,53(1):72-76.
[14]王呈玉,李明石,曲迪,等.一株新的多菌灵高效降解菌的筛选与降解特性分析[J].农业环境科学学报,2012,31(3):563-569.
The Isolation,Identification and Degradation Character of a Novel Carbendazim-degrading Bacterium
LI Jie,WANG Yiran,NIAN Haohan,CHEN Mengling,LU Yao,WANG Guangli
(School of Life Science,Huaibei Normal University,235000,Huaibei,Anhui,China)
The aim was to isolation a novel carbendazim-degrading bacterium and study the degradation char⁃acter.A carbendazim-degrading bacterium was isolated by continuous enrichment,screened from long carben⁃dazim-treated soils,then it was identified according to their morphological observation,physiological biochem⁃ical test,comparison sequences of 16S rDNA and phylogenetic analysis.The degrading rate was detected by UV spectrophotometer.The result shows that the optimum growth temperature on carbendazim is 25~30℃,the optimum pH is 7.0.The C4 can utilize carbendazim as the sole carbon or nitrogen source and after five to six days 100 mg·L-1of carbendazim could almost be degraded completely,the average degradation rate at 18.5 mg·L-1·d-1.
carbendazim;isolation;identification;biodegradation
X 173
A
2095-0691(2017)03-0037-06
2017-04-05
李 杰(1994- ),女,安徽淮北人,硕士生,研究方向:微生物学.通信作者:王光利(1978- ),男,安徽淮北人,博士,副教授,主要从事环境微生物学与环境微生物工程的研究工作.
