主动脉弓置换术后血小板功能改变及影响因素
2017-09-26姚婧鑫
陈 良,姚婧鑫,吕 琳,龙 村,楼 松
·临床研究·
主动脉弓置换术后血小板功能改变及影响因素
陈 良,姚婧鑫,吕 琳,龙 村,楼 松
目的了解深低温停循环下(DHCA)全主动脉弓置换患者术前及鱼精蛋白中和后的凝血功能和血小板功能,并探讨其影响因素。方法2014年6月至2015年3月主动脉夹层患者入组,排除标准为:发病时间超过30 d、二次手术、术前7天内服用抗血小板药物、血液系统慢性疾病。记录术前和转机一般临床资料;取麻醉诱导后(T1)、鱼精蛋白中和5 min后(T2)两个时间点的静脉血,用血栓弹力图(TEG)行凝血功能检测,常规实验室方法测定血常规、出凝血。所有数据进行统计分析。结果50名患者,与T1比较,T2血凝块强度最大振幅值(MA)和纤维蛋白含量(FIB)均明显下降,且差异均有显著性(P<0.001),但中位数均在正常范围内。相比于T1,T2 血小板计数和血红蛋白均明显下降且具有统计学意义(P<0.001)。T1 MA水平与T1 血小板呈直线相关(r=0.76,P=0.008);T1 MA与发病时间存在二次方曲线关系(R2=0.551、P<0.001),T2 MA与T1 血小板呈线性关系(r=0.60,P=0.002)。多因素logistics回归显示女性(OR=0.097,P=0.047)、体重指数(BMI)(OR=1.197,P=0.036)是停循环后输血小板的危险因素,而术前血小板功能(OR=0.852,P=0.026)为保护因素。术前MA对预测停循环后是否输血小板的ROC曲线下面积为(0.843±0.093)(95%CI:0.660-1.000,P=0.004),术前MA以59.95 mm为最佳界值点,其敏感性和特异性分别为93%和75%。结论DHCA全主动脉弓置换患者鱼精蛋白中和后血小板功能及FIB水平明显下降,但多数患者均在正常范围内。女性、BMI偏低和术前MA低于59.95 mm患者可能更需要输血小板。
深低温停循环;全主动脉弓置换术;血小板功能
心脏外科手术围术期输血较为常见,体外循环可增加患者的输血率。深低温停循环(deep hypothermic circulatory arrest,DHCA)主动脉弓置换术患者输血量更大[1],本院全主动脉弓术后患者常规输入2单位血小板,而输血小板时机多以经验为主,如根据血小板计数的多少和观察有无出血等,但单纯的Plt并不能反映有多大比例的血小板可参与正常凝血功能[2]。本研究探讨DHCA下主动脉弓置换术患者体外循环后对凝血功能和血小板功能的影响因素。
1 资料与方法
1.1研究对象 本研究经院所医学伦理委员会批准,所有纳入研究的患者均在实验前签署知情同意书。2014年6月至2015年3月期间,需DHCA下进行全主动脉弓置换术的主动脉夹层或主动脉瘤患者。排除标准:发病时间>30 d、二次手术、术前7天内服用抗血小板药物、血液系统慢性疾病。
1.2麻醉及体外循环方法 手术方式选择为在全身麻醉、DHCA和选择性脑灌注下应用四分支人工血管行主动脉弓置换术。患者常规麻醉诱导插管,诱导药物使用依托咪酯、芬太尼、维库溴铵。诱导后患者经口插入气管插管。体外循环预充液为6%羟乙基淀粉130/0.4 1 000 ml、乳酸林格液600 ml、肝素4 000 U。ACT>400 s进行体外循环,流量维持着2.2~2.4 L/(min·m2)。鼻咽温达到18~20℃时可开始全身停循环及选择性脑灌注。远端主动脉修复完成后恢复流量,5 min后开始复温。复温至鼻咽温30℃时给予甘露醇(0.5 g/kg)。直肠温达36℃后可以停机。
1.3监测指标 血栓弹力图(TEG)的血凝块强度最大振幅值(MA),纤维蛋白原(FIB)含量;次要指标为:血常规、凝血酶原时间(PT)、部分凝血活酶时间(APTT)、TEG的ACT值(反应时间)、K值(血凝块时间)和α角(凝固角)。同时记录患者身高、体重、体重指数(BMI)、发病时间(即症状出现时间至手术时间)、高血压病史、术前血清肌酐(Cr)、白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)。记录体外循环期间肝素总用量、体外循环时间、阻断时间、最低鼻温、最低肛温等数据。在以下时点采集患者静脉血监测上述指标:麻醉诱导后(T1)、鱼精蛋白中和5 min后(T2)。[美国Haemoscope公司生产的TEG5000型血栓弹力图仪,采用Rapid TEG(r-TEG)试剂盒;Sysmex XE-2100全自动血小板分析仪进行血常规检测;ACL TOP全自动血凝分析仪检测凝血三项]。

2 结 果
2.1一般临床资料 共纳入50例患者,其中男性35例(70.0%),平均年龄(47.1±11.4)岁,急诊手术25例(50.0%),大部分患者合并高血压(72.0%)(表1)。体外循环的转机时间、主动脉阻断时间、最低鼻温、最低肛温及肝素用量等指标见表2。
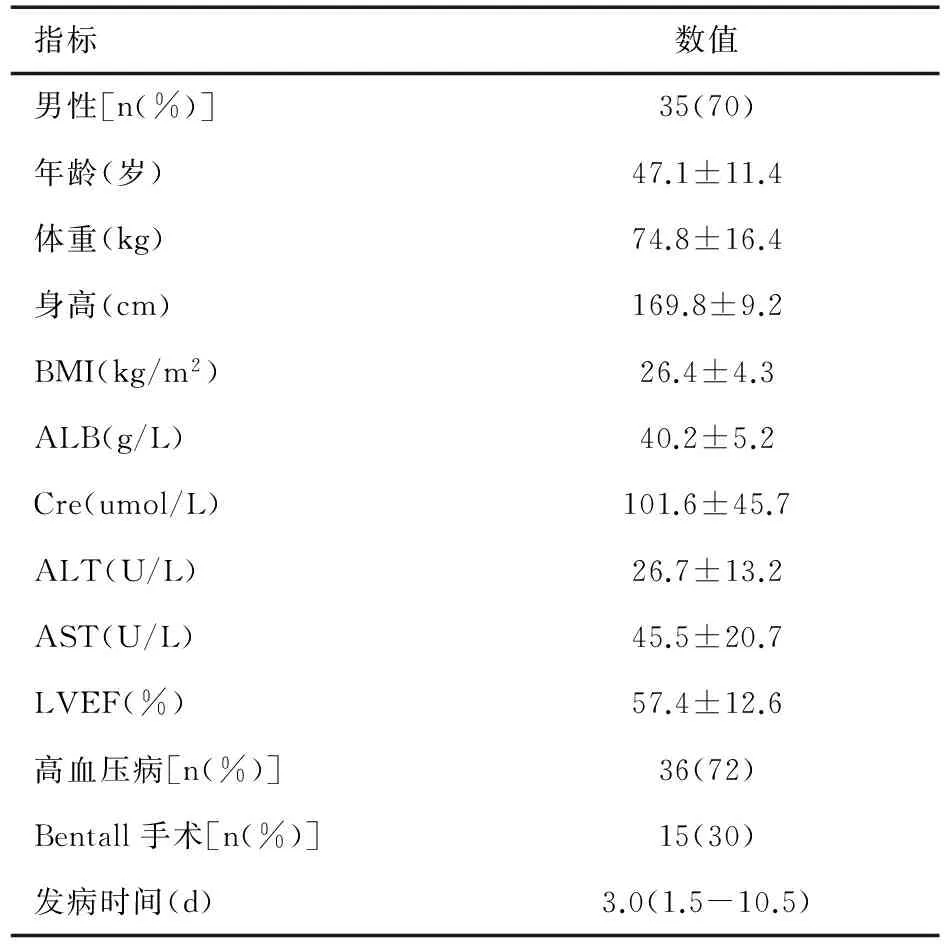
表1 患者术前一般临床资料(n=50)

表2 患者体外循环主要参数表(n=50)
2.2r-TEG检测结果 ①MA值:与T1比较,T2 MA明显下降(P<0.001),但中位数均在正常范围内,69.23%的患者T2时MA在正常范围。②TEG ACT:相对于T1,T2时ACT值都明显延长,具有显著统计学意义(P=0.009)。③K值:相对于T1,T2时K值显著延长,差异有显著性(P<0.001)。④α角:相对于T1,T2时α角缩小,差异有显著性(P<0.001)。见表3。
2.3常规化验结果 ①血小板计数(Plt)、血红蛋白(Hb):相比于T1,T2 Plt、Hb均明显下降,且具有统计学意义(P<0.001,P<0.001)。②白细胞计数(WBC):相对于T1,T2 WBC显著升高,且具有统计学意义(P<0.001)。③PT、APTT:T1时,两者均超出正常范围;与T1相比,T2的PT、APTT均显著延长,且具有统计学差异(P<0.001,P<0.001)。④FIB:T1时中位数高于正常值;与T1相比,T2的FIB明显减少,且具有统计学差异(P<0.001)。见表4。
2.4MA相关和回归分析 ①术前MA水平与年龄、性别、BMI、术前肝功、术前肌酐无明显关系,而与转机前Plt呈直线相关(r=0.76,P=0.008);利用曲线估计得出,发病30 d内转机前血小板功能与发病时间存在二次方曲线关系(R2=0.551),且该模型具有统计学意义(P<0.001),由此可知,发病14~15 d左右,患者MA值可达群体最高峰(图1)。②鱼精蛋白中和5 min后MA与转机前Plt呈线性关系(r=0.680,P=0.002);与发病时间同样成二次方曲线关系(R2=0.281,P=0.002)。与转机时间总体上无明显线相关性。然而采用非参数回归的曲线拟合方法,局部多项式估计(Loess)发现,血小板功能与转机时间存在多种变化趋势,大概在160 min以内,随着时间延长,血小板功能下降,160 min至210 min,血小板功能呈现略有增加趋势,当超过210 min后,血小板功能再次迅速下降(图2)。另外,鱼精蛋白中和后血小板功能与最低鼻温、最低肛温、肝素用量无明显相关性。
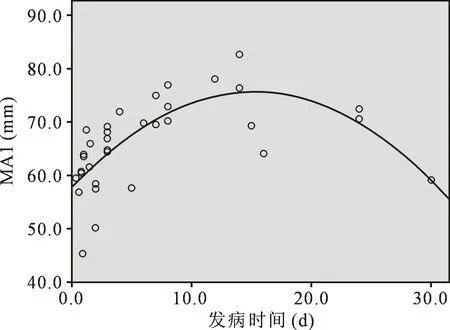
图1 转机前血小板功能与发病时间散点及相关图
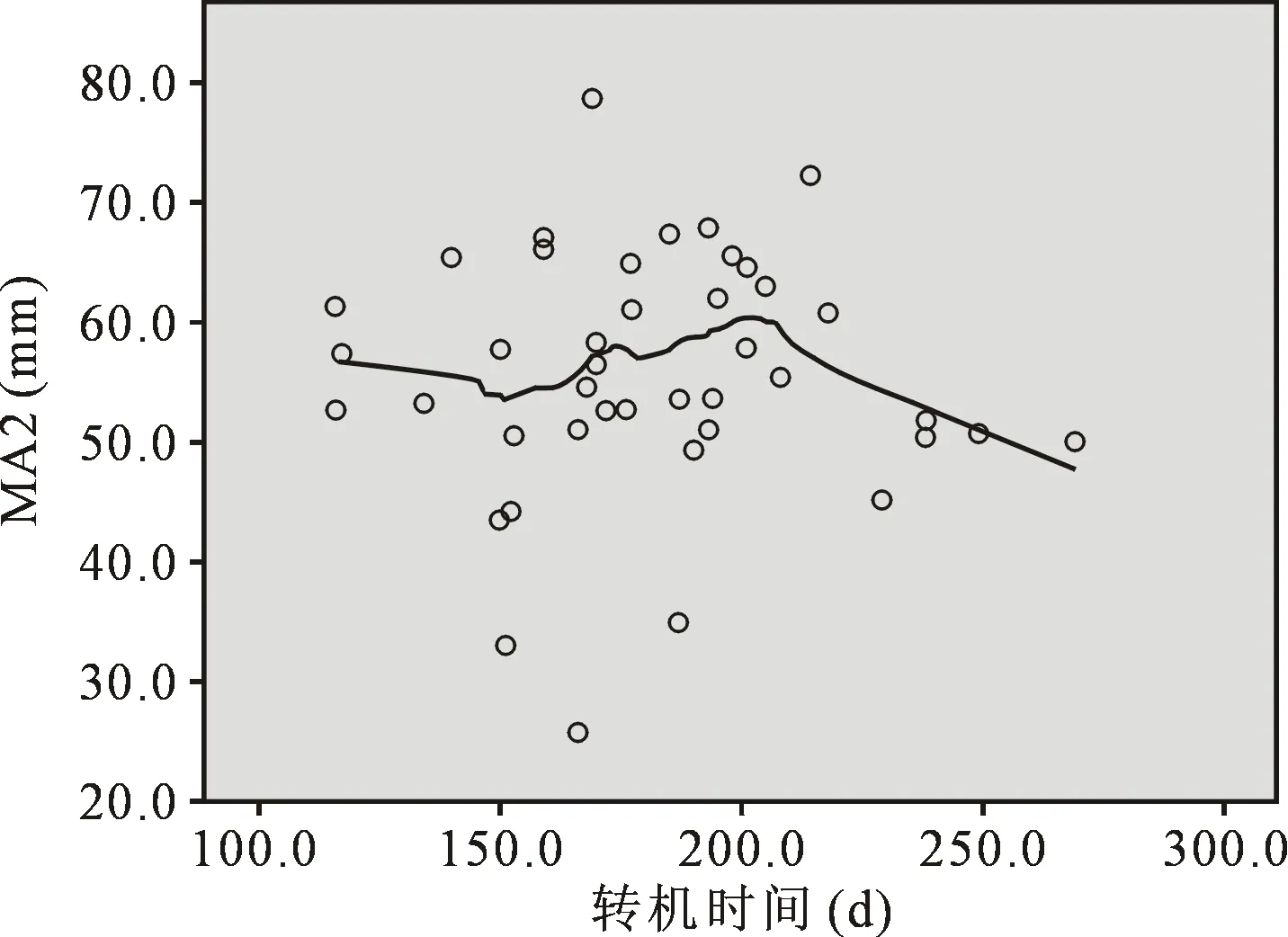
图2 T2后血小板功能与转机时散点图及曲线拟合

项目T1T2P值MA(mm)63.8(58.5~70.1)56.5(49.8~62.4)<0.001TEGACT(s)113.0(107.5~124.5)121.0(117.0~136.0)=0.009K(s)75.0(50.0~102.5)150.0(85.0~210.0)<0.001α(°)75.4(73.8~75.4)68.6(64.4~75.6)<0.001
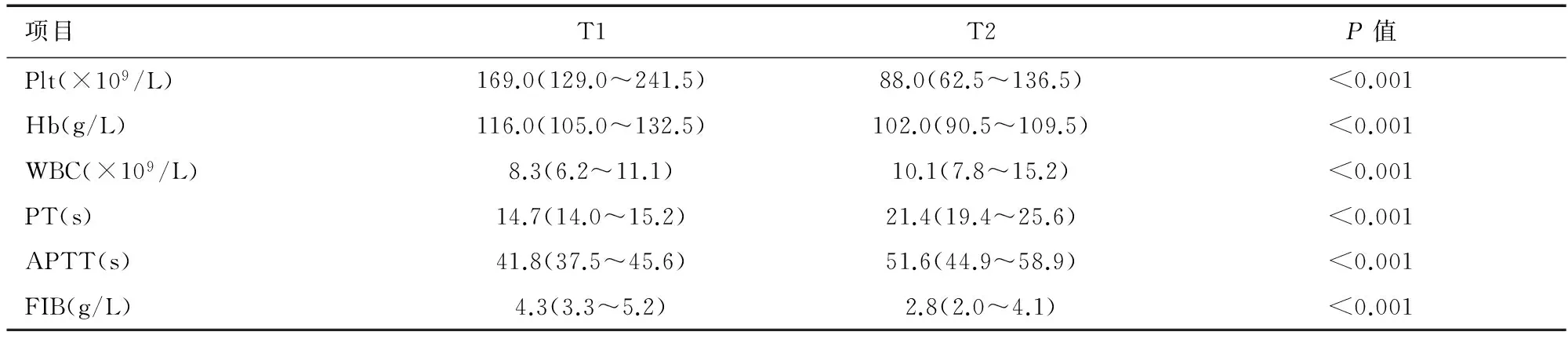
表4 常规检测指标数据对比(n=50)
2.5logistics回归和ROC曲线图 单因素分析结果显示,停循环后血小板功能低于正常值的危险因素包括:术前血小板功能、发病时间、性别、BMI。进一步多因素logistics回归显示女性(OR:0.097,95%CI:0.008~1.172,P=0.047)、BMI(OR:1.197,95% CI:0.873~1.638,P=0.036)是停循环后输血小板的独立危险因素,而术前血小板功能(OR:0.852,95%CI:0.728~0.997,P=0.026)为保护因素。术前MA对预测停循环后是否输血小板的ROC曲线下面积为(0.843±0.093)(95%CI:0.660~1.000,P=0.004),术前MA以59.95 mm为最佳界值点,其敏感性和特异性分别为93%和75%(YI指数:0.68)。
3 讨 论
DHCA体外循环下主动脉及主动脉弓置换术患者,因手术创面大、手术操作复杂、血管吻合多、体外循环时间长,患者血液破坏、术中失血较多,围术期的血制品用量大,除了凝血因子缺乏和纤溶亢进外,血小板下降是主要原因[3],但并不是所有血小板降低的患者需要输入血小板[2],血小板和其他血制品一样会增加患者发病率和死亡率[4-5],所以有必要了解DHCA体外循环下主动脉及主动脉弓置换术停循环后的血小板和凝血功能及其影响因素,以更好的科学用血。
本结果显示,DHCA体外循环下主动脉弓置换术患者停体外循环后血小板、FIB浓度明显下降,但MA值、FIB水平中位数均在正常范围内;停循环后血小板、Hb浓度均降低,而WBC水平显著升高,凝血指标PT、APTT明显延长;TEG ACT值、K值均延长,且超出正常范围,α角则减小,说明停体外循环后患者凝血因子活性降低。在相关因素分析中发现,转机前血小板与主动脉夹层或主动脉瘤的发病时间呈双向变化。鱼精蛋白中和后血小板随着转机时间的延长呈现多种不同变化趋势。停循环后输血小板的危险因素包括女性、低体重、术前MA值低于59.95 mm。
体外循环结束后血细胞计数的上述变化,与既往研究类似[6]。其原因是多方面的,其中血液与大量的外源性异物表面接触发生反应是导致血液系统发生变化的主要原因,如泵的机械转动对泵管的挤压,心内吸引等多种因素产生涡流和剪切力变化,红细胞表面张力发生改变均可导致溶血[7];血小板会吸附于管路及膜肺的表面产生聚集反应,甚至释放反应,同时低温也会影响血细胞的功能。不同血细胞的改变会诱发补体和激活凝血系统[8]。
根据病程长短,主动脉夹层分期有多种方法,传统分为两期:急性期(<14 d)和慢性期(>14 d);而目前最新是四分法:超急性期(<24 h),急性期(2~7 d),亚急性期(8~30 d)和慢性期(>30 d)[9]。本研究采用后者,入组时间选择为30 d以内。结果表明术前血小板和发病时间呈双向变化。原因考虑是在发病早期,血流夹层至动脉内膜下,启动凝血机制激活血小板,同时应激、疼痛引起的儿茶酚胺的释放也可激活大量血小板,结果机体内血小板功能代偿性增高,甚至有的会超出正常范围;急性期过后,随着症状改善、夹层内血栓相对稳定及应激状态的缓解,血小板逐渐下降。根据本结果二次方程计算,发病14~15 d 血小板可达群体最高峰,说明14 d以内整个机体凝血功能异常活跃,血小板持续增高,病情非常不稳定;早期研究就已经证实2周内死亡率非常高,2周后死亡率下降,这也正是传统主动脉夹层病程分期时间(14 d)的依据[10]。鱼精蛋白中和后血小板随着转机时间的延长呈现不同变化趋势,原因可能是,在转机开始的一段时间内,活化的血小板黏附于暴露的内皮下组织及体外循环管道系统,或者与循环中的单核细胞或中性粒细胞结合,导致血小板和功能明显下降,随着时间延长[8],部分与管壁结合的血小板脱落进入血液循环,同时体外循环中儿茶酚胺大量释放,通过与血小板表面的α-腺苷受体结合可使血小板对其他激活剂的反应能力大大增强,血小板代偿性增高;但转流时间进一步延长,循环中血小板的破坏数量不断增加,同时血小板表面α-腺苷受体逐渐丧失,其对儿茶酚胺的反应性也降低,血小板随之下降[11]。另外,这种现象可能还和深低温持续时间有关[12]。
目前认为鱼精蛋白中和后血小板会下降,在30 min至1 h内会逐渐恢复[11],所以鱼精蛋白中和后的血小板在一段时间内也会出现进行性下降,但多数患者仍可能在正常范围内,所以鱼精蛋白中和后,是不是可以考虑不用常规输入血小板;根据本实验结果,对于女性、BMI偏低、术前血小板偏低的患者是输血小板的高危人群,而发病时间10~15 d输血小板的可能性相对较小;即便需输入血小板时,最好从1单位血小板开始,密切监测术区凝血情况,小剂量逐渐加量。有条件的医院可以在TEG或ROTEM(血栓弹力描记法)检测的指导下制定最佳的输血方案[8,12]。但考虑到TEG测量MA需要20~30 min时间,所以等待测量鱼精蛋白中和后的MA结果决定是否输血小板具有一定局限性,可以考虑术前常规检测血小板,术前MA低于59.95 mm时候提示输血小板的可能性比较大,同时根据患者术区渗血等多方面综合考虑是否输入血小板。
术前PT、APTT中位数均超出正常值,说明发病后机体启动了内源性和外源性凝血通路;FIB具有双重生物活性,既是凝血酶作用的底物,又是高浓度纤溶酶的靶物质,甚至可预测术后的输血量[14]。与既往研究类似[15],停体外循环后FIB水平明显下降,原因包括体外循环时吸附、破坏,同时机体纤溶系统活性增强,FIB消耗增加,另外还可能与FIB和血小板聚集之间存在相互作用有关[16]。
本研究也有一定的局限性:首先,本实验样本量有限,会影响多因素logistic回归分析输血小板的危险因素,所以转机时间没有进入多因素回归方程并不完全意味着转机时间对血小板没有影响。另外,主动脉夹层病情危重,很多为急诊手术,发病时间长的患者数量相对较少,对分析发病时间和血小板的曲线回归可能产生一定的影响。
综上,随着医疗技术的不断发展,体外循环对全主动脉弓置换患者血小板和凝血功能的影响比想象的要小,鱼精蛋白中和后大部分患者,特别是发病10~15 d患者的血小板、FIB水平仍在正常范围。
4 结 论
DHCA全主动脉弓置换患者鱼精蛋白中和后血小板及FIB水平明显下降,但多数患者均在正常范围内。术前血小板、FIB水平和发病时间都呈现双向变化,停体外循环后血小板与转机时间呈多种变化趋势。而对于女性、BMI偏低、术前MA低于59.95 mm的患者可能更需要输血小板。该结果仍需更多观察和研究去证实。
[1] McKay C, Allen P, Jones PM,etal. Aortic arch replacement and elephant trunk procedure: an interdisciplinary approach to surgical reconstruction, perfusion strategies and blood management [J]. Perfusion, 2010,25 (6):369-379.
[2] Zaffar N, Joseph A, Mazer CD,etal. The rationale for platelet transfusion during cardiopulmonary bypass: an observational study[J]. Can J Anaesth, 2013, 60(4):345-354.
[3] Ramnarine IR, Higgins MJ, McGarrity A,etal. Autologous blood transfusion for cardiopulmonary bypass: effects of storage conditions on platelet function[J]. J Cardiothorac Vasc Anesth, 2006, 20(4): 541-547.
[4] O'Brien SF, Yi QL, Fan W,etal. Current incidence and residual risk of HIV, HBV and HCV at Canadian Blood Services[J]. Vox Sang, 2012, 103(1): 83-86.
[5] Vamvakas EC, Blajchman MA. Transfusion-related mortality: the ongoing risks of allogeneic blood transfusion and the availablestrategies for their prevention[J]. Blood, 2009,113(15): 3406-3417.
[6] Hornick P, George A. Blood contact activation: pathophysiological effects and therapeutic approaches[J].Perfusion, 1996, 11(1): 3-19.
[7] 周玉娇, 于坤. 体外循环红细胞损伤的原因、表现及危害[J]. 中国体外循环杂志, 2015, 13(1):61-64.
[8] Thiele RH, Raphael J. A 2014 update on coagulation management for cardiopulmonary bypass[J]. Semin Cardiothorac Vasc Anesth,2014, 18(2):177-189.
[9] Booher AM, Isselbacher EM, Nienaber CA,etal. The IRAD classification system for characterizing survival after aortic dissection[J]. Am J Med, 2013,126(8):730.e19-24.
[10] Clough RE, Nienaber CA. Management of acute aortic syndrome[J]. Nat Rev Cardiol, 2015, 12(2):103-114.
[11]龙村,黑飞龙,朱德明等.体外循环教程[M].北京:人民卫生出版社,2011.199-422.
[12] Mazzeffi M, Marotta M, Lin HM,etal. Fischer G. Duration of deep hypothermia during aortic surgery and the risk of perioperative blood transfusion[J]. Ann Card Anaesth, 2012,15(4):266-273.
[13] Whiting D, DiNardo JA.TEG and ROTEM: technology and clinical applications[J]. Am J Hematol, 2014,89(2):228-232.
[14] Pillai RC, Fraser JF, Ziegenfuss M,etal. Influence of circulating levels of fibrinogen and perioperative coagulation parameters on predicting postoperative blood loss in cardiac surgery: a prospective observational study[J]. J Card Surg, 2014, 29(2):189-195.
[15] Edmunds LH Jr. Managing fibrinolysis without aprotinin[J]. Ann Thorac Surg, 2010, 89(1):324-331.
[16] Lee SH, Lee SM, Kim CS,etal. Fibrinogen recovery and changes in fibrin-based clot firmness after cryoprecipitate administration in patients undergoing aortic surgery involving deep hypothermic circulatory arrest[J]. Transfusion, 2014, 54(5):1379-1387.
Changesinfunctionofplateletaftertotalaorticarchreplacementandtheirinfluencingfactors
Chen Liang, Yao Jing-xin, Lv Lin, Long Cun, Lou Song
DepartmentofExtracorporealCirculation,FuwaiHospital,NationalCenterforCardiovascularDiseases,Chinese
AcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing,100037,China
LouSong,Email:lousongfw@163.com
ObjectiveTo evaluate the platelet function and blood coagulation of patients
thoracic aortic procedures with deep hypothermic circulatory arrest (DHCA), and to investigate their influencing factors.MethodsThe study consisted of 50 patients scheduled for aorta replacement undergoing DHCA between June 2014 and March 2015. Patients with re-operation, prescription antiplatelet drugs within 7 days before operation, onset time over 30 days and hematological diseases were excluded. Function of platelet and coagulation were tested by thrombelastogram (TEG) at two intervals, namely after anesthesia induction (T1) and 5 mins after protamine neutralization (T2). Blood routine examination and coagulating time test were also included.ResultsCompared with before cardiopulmonary bypass (CPB), MA value and fibrinogen (FIB) significantly reduced on T2 (P<0.001,P<0.001). Platelet count and hemoglobin concentration were both statistically decreased after protamine neutralization(P<0.001,P<0.001).There was a liner relationship between platelet function and platelet count before CPB (r=0.76,P=0.008).The correlation between function of platelet before operation and onset time was quadratic curve relationship (R2=0.551,P<0.001). Multivariate logistic regression analysis revealed that female (OR=0.097,P=0.047) and body mass index (OR=1.197,P=0.036) were risk factors associated with platelet transfusion at the end of CPB, while the function of platelet (OR=0.852,P=0.026) before surgery was a protective factor. The area under the ROC curve of MA before surgery on platelet transfusion was 0.843 (95%CI: 0.660-1.000,P=0.004).The specificity of MA<59.95mm was 75%, the sensitivity was 93%.ConclusionThe levels of FIB and platelet function significantly decreased at the end of CPB, while most of patients' platelet functions were at normal range. Blood platelet transfusion might be more reasonable for patients of female, lower BMI and MA <59.95mm before surgery.
Deep hypothermic circulatory arrest; Total aortic arch replacement; Platelet function
2016-09-29)
2016-12-30)
10.13498/j.cnki.chin.j.ecc.2017.03.03
100037 北京,中国医学科学院,北京协和医学院,国家心血管病中心,阜外心血管病医院体外循环科[陈良(研究生)]
楼松,Email:lousongfw@163.com
