钙蛋白酶抑制剂在深低温停循环中肺保护机制的实验研究
2017-09-26董莉亚张韫佼黄雅筠许喜乐
董莉亚,张韫佼,黄雅筠,许喜乐
·基础研究·
钙蛋白酶抑制剂在深低温停循环中肺保护机制的实验研究
董莉亚,张韫佼,黄雅筠,许喜乐
目的评估钙蛋白酶(calpain)抑制剂对心脏手术深低温停循环(DHCA)中炎症反应性肺损伤的保护机制,并探讨其作用是否通过核转录因子kappa B(NF-κB)介导。方法16只幼猪建立体外循环(CPB)DHCA模型,随机分为对照组和实验组,实验组CPB前1 h静脉注射calpain抑制剂LLY-FMK(苄氧羧基-亮氨酸-亮氨酸-酪氨酸-荧光甲基酮)1 mg/kg,对照组则注射同剂量的生理盐水。检测两组CPB前和CPB/DHCA后肺静态顺应性、肺血管阻力指数、肺湿干质量比、支气管肺泡灌洗液肿瘤坏死因子-α(TNF-α)浓度以及肺组织NF-κB水平;CPB/DHCA结束取肺组织HE染色光镜观察肺组织水肿和炎细胞浸润情况。结果与CPB前相比, CPB后两组的肺静态顺应性下降,肺血管阻力、肺湿干重比和肺组织NF-κB表达增加(P<0.05),但两组相比,实验组的改变显著轻于对照组(P<0.05),实验组支气管肺泡灌注液中的TNF-α含量显著低于对照组(P<0.05),光镜下中性粒细胞渗出、肺水肿和肺泡损伤程度轻于对照组。结论calpain抑制剂LLY-FMK能减轻DHCA后肺部炎症反应,从而改善肺功能,这种保护作用可能与降低NF-κB活性有关。
体外循环;深低温停循环;calpain;肺缺血再灌注损伤
深低温停循环(deep hypothermic circulatory arrest,DHCA)是危重、复杂及低龄儿先天性心脏病手术常用的体外循环(cardiopulmonary bypass,CPB)方法。笔者前期研究证实CPB/DHCA结束初期肺部炎症反应加重[1-2]。钙激活中性蛋白酶( calcium-activated neutral protease,Calpain)抑制剂LLY-FMK(carbobenzoxy-leucinyl-leucinyl-tyrosine-fluoromethyl ketone,苄氧羧基-亮氨酸-亮氨酸-酪氨酸-荧光甲基酮)是一个穿透细胞膜能力强的不可逆抑制剂,竞争calpain I和II催化部位,有学者发现calpain抑制剂LLY-FMK有利于减轻与小儿心脏外科和体外循环相关的术后心肺功能障碍,这种功能改善是通过降低CPB/DHCA后血浆内皮素-1和维持肺内皮一氧化氮水平,从而降低肺血管阻力,改善肺气体交换和提高全身氧运输[3]而实现的。本次研究探讨calpain抑制剂LLY-FMK是否减轻CPB/DHCA炎症反应性肺损伤。
1 材料与方法
1.1材料
1.1.1动物和分组 上海种幼猪16只,雌雄不拘,3~4 周龄,体质量7~10 kg, 由上海市松江区松联实验动物场提供。动物使用许可证号码为SYXK(沪)2003-0031。动物随机分为实验组(CPB前1 h静脉注射calpain抑制剂LLY-FMK 1 mg/kg)[3]和对照组(CPB前1 h静脉注射同剂量的生理盐水),每组8 只,本实验人员对实验组别盲。
1.1.2主要仪器和试剂 Servo 900C 呼吸机((Siemens, Munich, Germany);带储血过滤器的美敦力婴儿型膜式氧合器(Medtronic, Minneapolis, MN, USA);动脉微栓过滤器(宁波菲拉尔);Sarns 8000 型体外循环机( Terumo CVS, Ann Arbor, USA)。ELISA试剂盒(MN and MD Biosciences,San Jose,CA, USA)。western-blot检测试剂盒(Santa Cruz Biotechnology, Dallas, Texas, USA);Calpain抑制剂LLY-FMK(Enzyme Systems,Livermore, CA,USA);NF-κ B抗体(Sigma, USA)。
1.2动物手术模型建立 麻醉后气管插管,接呼吸机,设通气模式为控制性机械通气,呼吸频率20 次/min,潮气量8~10 ml/kg,吸入氧浓度60%~80%。股静脉建立静脉通道,股动脉置管监测动脉压并备抽血样行血气分析。胸骨正中切开,右心室流出道和左心耳置测压管监测肺动脉压和左心房压。电磁血流仪探头置肺动脉干测量心输出量。
1.3各组CPB操作与相关设置 将预充液(包括上海种成年白猪全血400 ml、血定安200 ml、适量复方林格氏液、肝素和碳酸氢钠等) 加入储血过滤器中,出血口连接管道经滚压泵组成左心灌注系统,动脉端接微栓过滤器。肝素化后, 常规升主动脉、右心耳插管建立CPB。连续监测直肠温度、心电图、心率、呼气末二氧化碳分压和血氧饱和度。围术期维持平均体动脉压30~ 60 mm Hg,动脉二氧化碳分压35~45 mm Hg,pH 值7.35~7.45;DHCA 期间实行α稳态管理。CPB开始,降温约30 min,肛温降至18~20 ℃时阻断主动脉,注入冷晶体心肌保护液(15 ml/kg),停止转流开始DHCA。60 min 后复温,开放主动脉恢复CPB,恢复机械通气,转流至肛温35℃,继续并行循环60 min 后停CPB。
1.4检测和观察
1.4.1检测指标 两组动物分别于CPB开始前和DHCA/CPB结束即刻两时点(简称为CPB前和CPB后),对相关指标进行测量和计算。①肺静态顺应性(Cstat):根据吸气停顿压(Ppause)和潮气量(TV)的测量数据,计算Cstat:Cstat=潮气量(TV)/Ppause(单位:ml/cmH2O)。②肺血管阻力(pulmonary vascular resistance,PVR):根据动物体质量及平均肺动脉压、左心房压和心输出量的测量数据,计算PVR; PVR=(平均肺动脉压-左心房压)×80/右心排量(单位:dyne·sec/cm5)。③肺组织炎性因子释放量:50 ml无菌PBS液(pH 7.2)慢慢输入肺里,按摩15 s,回收的支气管肺泡灌洗液,约10 ml,立即冷却到4℃,高速离心10 min后取上清液ELASA法检测肿瘤坏死因子α( tumor necrosis factor-α,TNF-α)浓度[4]。④Western blot法检测肺组织核转录因子kappa B(NF-κB)水平。⑤肺湿干重比值( wet/dry weight ratio , W/D):CPB后取小块肺组织称取质量并记录,于60℃恒温箱中置48 h,取出后称取质量并记录;计算W/D质量比以评价肺水肿程度。
1.4.2肺组织形态学观察 CPB结束后,取左下肺小块组织,4%甲醛溶液固定,HE 染色后光学显微镜下观察肺组织水肿和白细胞浸润情况。

2 结 果
两组动物在体重、性别比、实验前用药、麻醉用药及体外循环用药方面无统计学差异。各观察指标在CPB开始前组间差异无显著性。
2.1呼吸功能指标和肺水肿程度测定结果 见表1。
2.2支气管肺泡灌注液炎性因子含量和肺组织NF-κB活性测定 见表2,图1。
2.3肺组织形态学改变 对照组(图2)肺间质水肿,肺组织渗出增加; 肺泡壁由于单核细胞和中性粒细胞大量渗出而明显增厚,肺间质充满单核细胞和中性粒细胞。实验组(图3)肺泡间隔水肿和白细胞渗出均较对照组减轻,肺泡壁相对较薄,肺间质中单核细胞和中性粒细胞浸润较少。
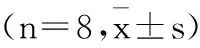
表1 呼吸功能指标比较
注:▲与CPB前比较P<0.05;◆与对照组比较P<0.05。
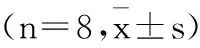
表2 炎性因子含量和NF-κB条带灰度值比较
注:▲与CPB前比较P<0.05;◆与对照组比较P<0.05。
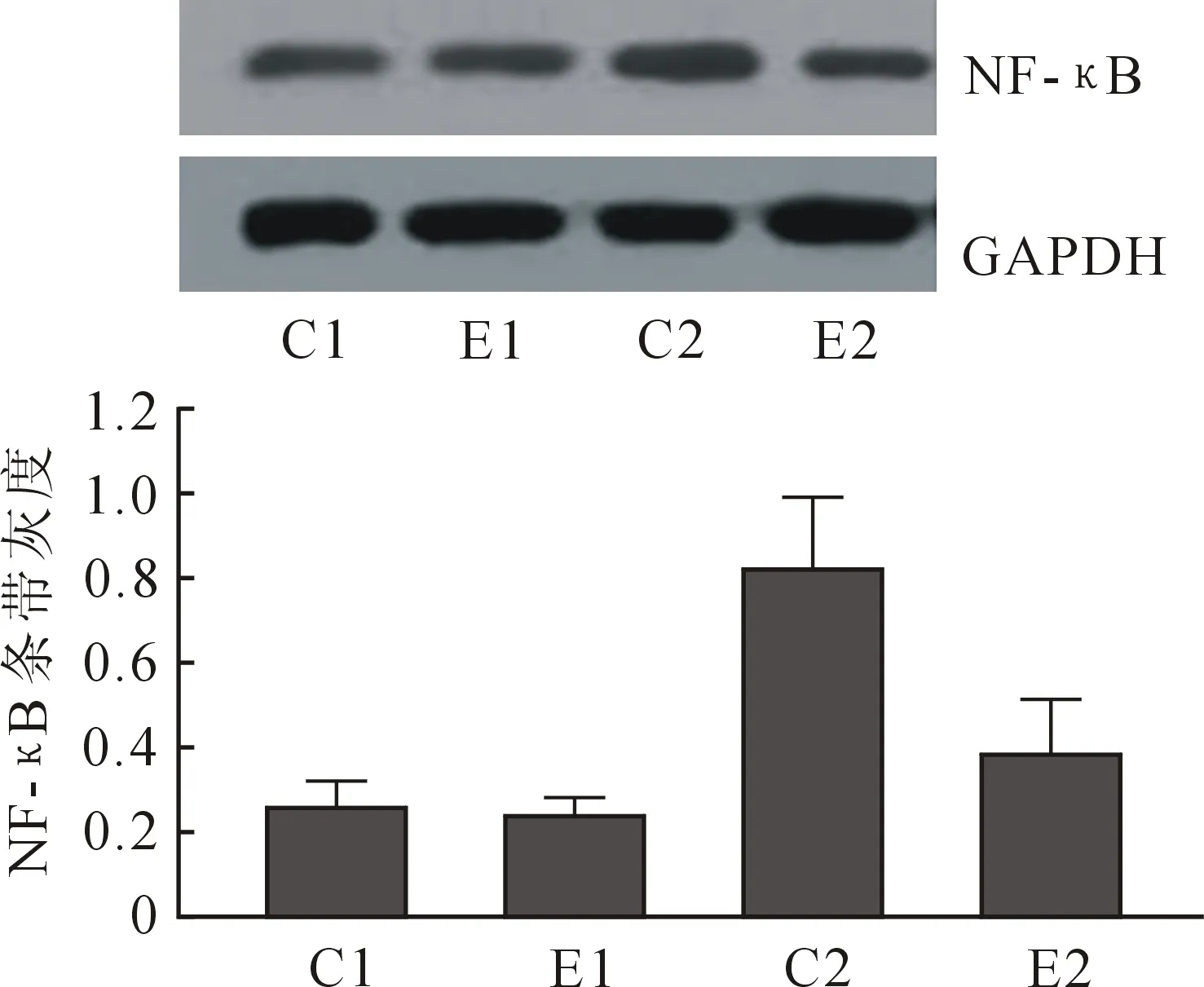
注:C1:对照组CPB前;E1:实验组CPB前;C2:对照组CPB后;E2:实验组CPB后;▲与CPB前比较P<0.05;◆与对照组比较P<0.05。图1 Western blot检测肺组织NF-κB蛋白含量
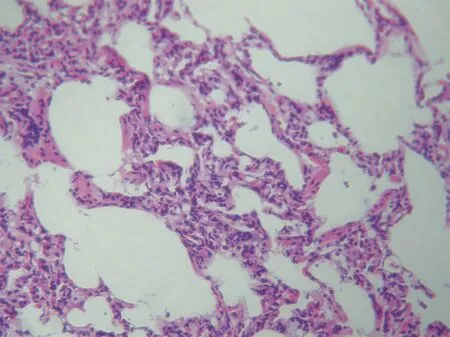
图2 对照组肺组织(×200)

图3 实验组肺组织(×200)
3 讨 论
DHCA是危重、复杂及低龄儿先天性心脏病手术常用CPB方法,新生儿及未成熟儿DHCA术后易出现呼吸衰竭,这主要与新出生儿的肺尚未完全成熟有关,因而DHCA肺保护也如同脑保护一样愈来愈成为研究热点之一。在当前常规心脏手术死亡率和并发症已得到满意控制前提下,解决危重儿DHCA术后肺损伤成为提高手术疗效,降低总死亡率的最有效途径,同时也是心血管外科基础研究和临床工作难点。
CPB引起的炎症反应对多种重要脏器和血液有形成分都有不同程度的损伤,国内外将这种反应和损伤称为“全身炎症反应综合征”(systemic responsive syndrom,SIRS)。除血液有形成分外,受到SIRS影响最大就是肺组织[5]。CPB炎症反应所致肺损伤的确切机理尚不清楚,可能的机理有:①CPB时血液与非生物材料接触引起白细胞和补体激活,黏附分子和细胞因子释放;②体外循环大部分时间内,肺组织无血流灌注,仅靠支气管动脉血供,即使在全流量转流灌注压充分的情况下,支气管血流也仅有基础值的13%左右,这证明CPB期间肺缺血状态。动物实验支气管肺泡灌洗液证实CPB期间肺区炎症反应可能就是由肺缺血引起[6]。如果是DHCA肺则完全处于缺血状态,再灌注后,大量白细胞由于变形能力受影响而被扣留在肺脏的微血管床,这些白细胞与肺内诱发的炎性物质相互影响游出血管外,释放出氧自由基等毒性产物,导致缺血脏器的进一步损伤,并加剧全身和该脏器的炎症反应。这就是肺的缺血再灌注损伤(lung ischemia reperfusion injury,LIRI)。缺血的肺组织细胞恢复灌注后不但不能迅速恢复正常的代谢机能,反而加重损伤,主要表现为再灌注肺组织充血、水肿。对引起肺组织缺血或缺氧损伤的疾病或器官移植等过程,都涉及缺血再灌注损伤。近年来研究显示,炎性反应在CPB的LIRI中起到重要的作用[7]。
Calpain是一种Ca2+依赖性半胱氨酸蛋白水解酶,广泛分布于绝大多数哺乳动物组织中,在细胞内发挥多种生理作用,如细胞骨架重塑、信号转导、细胞周期调控及凋亡。Calpain-1和calpain-2是最早发现也是研究最多的两个calpain家族成员,前者需微摩尔水平的Ca2+被激活,后者需毫摩尔水平的Ca2+被激活,两者的作用均受到内源性特异性抑制剂calpastatin的调节[8]。某些病理情况下,如缺血缺氧、氧化应激、细胞膜损伤等均可引起细胞内Ca2+升高,导致calpain被过度激活,接着裂解凋亡相关蛋白NF-kB 、Bcl-2、Bcl-xl、Bid、Bax及caspases等,或引起线粒体通透性增加,从而介导细胞凋亡。通过应用calpain抑制剂、基因敲除、calpastatin过表达等方法抑制calpain活性,起到良好的细胞保护作用[9]。
已有研究证实calpain在CPB心、脑、肾等脏器损伤中起重要作用,但是关于calpain与CPB肺损伤关系的研究报道很少。Duffy等建立幼猪CPB并DHCA的缺血再灌注模型,发现CPB和DHCA后calpain抑制剂能够降低肺组织ET-1水平,并维持肺内皮细胞一氧化氮合酶活性,从而使CPB后PVR下降,气体交换改善和全身氧运输量提高。证明calpain抑制剂能够降低不成熟动物CPB缺血再灌注的心肺功能损伤[3]。
笔者前期研究已建立幼猪DHCA模型,通过衡量肺区炎性介质、白细胞黏附分子证实了CPB再灌注及循环停止后初期肺组织是炎症反应区,DHCA加剧了CPB肺组织炎症反应,并通过呼吸功能测定、肺组织学检查和肺W/D评估肺损伤程度,发现炎性介质和黏附分子的表达和肺损伤程度有显著相关性[1-2]。本研究建立原幼猪CPB模型,尝试研究DHCA再灌注过程和CPB停止早期肺区炎症反应的发生机理。肺Cstat和PVR是综合反应肺功能的两个指标。本实验DHCA后,发现对照组和实验组CPB前后肺静态顺应性均显著降低(对照组P<0.001,实验组P<0.001),肺血管阻力都显著增加(对照组P=0.002,实验组P=0.004),说明不管有无calpain抑制剂干扰,DHCA后幼猪肺功能都显著受损。肺重量改变是评价肺损伤的重要指标之一,肺重量增加主要为肺含水量增加。LIRI的基本病理改变是肺毛细血管通透性增高,表现为血管内渗出增多,肺W/D增加,这是肺缺血再灌注损伤的病理基础,从而导致明显的肺气体交换功能障碍。本实验观察到,肺W/D CPB后两组均明显高于CPB前(对照组P<0.001,实验组P=0.04),进一步证明了DHCA后肺功能损伤。两组CPB前Cstat、PVR和W/D比值均无显著性差异(分别为P=0.07,P=0.68,P=0.94),而CPB后三个指标均出现显著性差异,calpain抑制剂干预后实验组相对于对照组肺静态顺应性显著提高(P=0.001),PVR显著降低(P=0.01),肺W/D显著降低(P=0.002),说明calpain抑制剂干预能减轻肺损伤程度,这与Duffy等[3]研究结果一致。
关于calpain与CPB期间炎症反应性肺损伤之间的关系还未有报道。有学者在大鼠在体胸膜炎和关节炎模型中使用calpain抑制剂,发现可以延缓急性和慢性炎症进展,从而提出抑制calpain活性可能是治疗炎症的一个新的靶向[10]。在一个由内毒素诱导肝炎的大鼠模型中,发现给calpain抑制剂组相对于对照组能明显减轻肝中性粒细胞渗出并减少中间地带肝坏死[11]。Stalker等在糖尿病大鼠模型中发现calpain活性增加在高血糖引起的血管炎症反应中起重要作用,抑制calpain活性可以降低细胞黏附分子表达和维持内皮细胞NO释放,从而减轻白细胞和内皮细胞相互作用[12]。所以笔者推测实验组使用calpain抑制剂后抑制了肺区炎症反应从而改善了肺功能。支气管肺泡灌洗液TNF-α水平能较好的反应肺区炎症反应。笔者实验中发现对照组CPB前后支气管肺泡灌洗液TNF-α显著升高(P=0.009),而实验组没有显著性改变(P=0.746),而且CPB后实验组相对于对照组支气管肺泡灌洗液TNF-α显著降低(P=0.014),说明实验组calpain抑制剂干扰后肺区炎症反应明显减轻。
NF-kB是调控炎症和免疫反应的主要核转录因子之一。在胞浆中NF-kB因与抑制蛋白(IkBs)结合而表现为无活性的形式。当机体受到外界刺激后,在蛋白激酶和蛋白磷酸化酶的参与下,IkB 即被磷酸化,从而被蛋白激酶降解, 并从NF-kB 二聚体上解离, 暴露出p50蛋白的核定位信号, NF-kB 即被激活, 转位到细胞核内与相应的靶基因kB 序列相结合, 诱导和增强相关基因的表达[13]。NF-kB 参与调控的基因有细胞因子、生长因子、趋化因子、炎性介质、黏附分子等,而这些物质在肺区炎症反应中起重要作用。目前国外研究表明, calpain参与了NF-kB的激活,其激活的途径可能是通过降解NF-kB 的抑制因子IkBα,从而使NF-kB转位入核并调控相关基因的表达[14]。实验性大鼠急性胰腺炎模型中,腹腔注射calpain抑制剂,可以减轻NF-kB的活性,降低肺组织内皮细胞间黏附分子-1(ICAM-1)表达的上调和脂质过氧化,从而减轻肺损伤[15]。笔者在实验中发现CPB后肺组织NF-kB的表达实验组相对于对照组显著降低(P=0.002),从而推测calpain抑制剂能抑制CPB所致的肺区炎症反应,其作用可能通过NF-kB介导。
CPB心脏术后肺功能障碍在心脏术后非常常见。Calpain在脏器缺血再灌注中的损伤机制已被证实,但从未见针对calpain抑制剂对DHCA炎症反应性肺损伤保护作用方面的报道。本研究具有创新性,且具备进一步深入研究机制和干预方法的潜力。如果研究得到预期结果,可进一步明确DHCA所致肺损伤的机制,并为其以后在临床应用打下基础。
[1]董莉亚, 郑景浩, 王利民,等. 肺缺血预处理在深低温停循环中肺保护的实验 [J]. 中国体外循环杂志,2008,6(2):108-112.
[2]Dong LY, Zheng JH, Qiu XX,etal. Ischemic preconditioning reduces deep hypothermic circulatory arrest cardiopulmonary bypass induced lung injury [J]. Eur Rev Med Pharmacol Sci, 2013, 17(13):1789-1799.
[3] Duffy JY, Schwartz SM, Lyons JM,etal. Calpain inhibition decreases endothelin-1 levels and pulmonary hypertension after cardiopulmonary bypass with deep hypothermic circulatory arrest[J]. Crit Care Med, 2005, 33(3):623-628.
[4]Li P, Li Y, Shao G,etal. Comparison of immune responses to intranasal and intrapulmonary vaccinations with the attenuated Mycoplasma hyopneumoniae 168 strain in pigs [J]. J Vet Med Sci, 2015, 77(5):519-525.
[5] Garlid KD, Dos SP, Xie ZJ,etal. Mitochondrial potassium transport: the role of the mitochondrial ATP-sensitive K(+) channel in cardiac function and cardioprotection [J]. Biochim Biophys Acta, 2003,1606(1-3):1-21.
[6] Schlensak C, Doenst T, Preusser S,etal. Cardiopulmonary bypass reduction of bronchial blood flow: A potential mechanism for lung injury in a neonatal pig model [J]. J Thorac Cardiovasc Surg, 2002, 123(6):1199-1205.
[7] Schlensak C, Doenst T, Preusser S,etal. Bronchial artery perfusion during cardiopulmonary bypass does not prevent ischemia of the lung in piglets: assessment of bronchial artery blood flow with fluorescent microspheres[J]. Eur J Cardiothorac Surg, 2001, 19(3):326-331.
[8] Bukowska A, Lendeckel U, Bode-Boger SM,etal. Physiologic and pathophysiologic role of calpain: implications for the occurrence of atrial fibrillation[J]. Cardiovasc Ther, 2012, 30(3):115-127.
[9] Mani SK, Balasubramanian S, Zavadzkas JA,etal. Calpain inhibition preserves myocardial structure and function following myocardial infarction [J]. Am J Physiol Heart Circ Physiol, 2009, 297(5): H1744-H1751.
[10] Cuzzocrea S1, McDonald MC, Mazzon E,etal. Calpain inhibitor I reduces the development of acute and chronic inflammation[J]. Am J Pathol, 2000, 157(6):2065-2079.
[11] Rose R, Banerjee A, Ramaiah SK. Calpain inhibition attenuates iNOS production and midzonal hepatic necrosis in a repeat dose model of endotoxemia in rats[J]. Toxicol Pathol, 2006, 34(6):785-794.
[12] Stalker TJ, Skvarka CB, Scalia R. A novel role for calpains in the endothelial dysfunction of Hyperglycemia [J]. FASEB J, 2003,17(11):1511-1513.
[13] Son G, Iimuro Y, Seki E,etal. Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCl4-induced liver injury and fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2007,293(3):G631-639.
[14] Letavernier E, Perez J, Bellocq A,etal. Targeting the calpain/calpastat in system as a new strategy to prevent cardiovascular remodeling in angiotensin II-induced hypertension [J].Circ Res, 2008, 102(6):720-728.
[15] Bukowska A, Lendeckel U, Bode-Boger SM,etal. Physiologic and Pathophysiologic Role of Calpain:Implications for the occurrence of Atrial Fibrillation[J].Cardiovasc Ther, 2012, 30(3):e115-127.
CalpaininhibitorLLY-FMKimprovespulmonaryfunctionindeephypothermiccirculatoryarrestcardiapulmonarybypass
Dong Li-ya, Zhang Yun-jiao, Huang Ya-jun, Xu Xi-le
DepartmenofThoracicandCardiovascularSurgery,ShanghaiXinhuaHospital,ShanghaiJiaotongUniversity,Schoolofmedicine,Shanghai200092,China
XuXi-le,Email:xuxile@xinhuamed.com.cn
ObjectiveTo evaluate the lung protective effects of calpain inhibitor in deep hypothermic circulatory arrest (DHCA), especially the inflammatory lung injury, and investigate whether its effect is mediated by NF-κB.MethodsUsing an animal model of DHCA, 16 piglets were divided randomly into two groups:control group and experimental group. Eight animals of experimental group were administered calpain inhibitor LLY-FMK (carbobenzoxy-leucinyl-leucinyl-tyrosine-fluoromethyl ketone) (1 mg/kg, intravenously) 60 mins before cardiopulmonary bypass, the other animals were administered saline as a control. At the beginning and end of CPB, lung static compliance(Cstat), pulmonary vascular resistance(PVR), TNF-α concentration of bronchoalveolar lavage fluid, NF-κB expressions of lung tissue and the lung wet/dry weight ratio (W/D) were measured. At the end of CPB, some lung tissues were fixed to observe pathological changes.ResultsAfter cardiopulmonary bypass, the Cstat decreased while, the PVR, the W/D, the NF-κB expressions of lung tissue increased in both groups, changes of experimental group were much less than those of control group. Content of TNF-α of bronchoalveolar lavage fluid in experimenatal group was lower than that in control group at the end of CPB, Infiltration of neutrophils, pulmonary edema and alveolar damage in experimental group decreased significantly compared with control group.ConclusionCalpain inhibitor can alleviate lung inflammatory response and improve lung function after DHCA, the improvement may be associated with the reduction of NF-κB activity.
Cardiapulmonary bypass; Deep hypothermic circulatory arrest; Calpain; Lung ischemic reperfusion injury
2016-11-07)
2016-12-22)
10.13498/j.cnki.chin.j.ecc.2017.03.15
200092 上海,上海交通大学医学院附属新华医院心胸外科
许喜乐,Email:xuxile@xinhuamed.com.cn
