微小 RNA-138-5p抑制肺癌细胞增殖、迁移和侵袭能力的机制研究
2017-09-22王向辉黄江平崔丰和钱海云
王向辉, 黄江平, 崔丰和, 钱海云
(华中科技大学同济医学院附属荆州医院心胸大血管外科, 湖北 荆州 434020)
微小 RNA-138-5p抑制肺癌细胞增殖、迁移和侵袭能力的机制研究
王向辉△, 黄江平, 崔丰和, 钱海云
(华中科技大学同济医学院附属荆州医院心胸大血管外科, 湖北 荆州 434020)
目的: 探讨微小RNA-138-5p(miR-138-5p)抑制肺癌细胞增殖、迁移和侵袭能力的相关机制。方法: 以肺癌细胞A549和H460作为研究对象,分别转染miR-NC(对照组)或miR-138-5p(实验组);生物信息学技术预测miR-138-5p的靶基因;RT-qPCR检测转染后细胞miR-138-5p、叉头框蛋白C1(FOXC1)mRNA和波形蛋白(vimentin) mRNA的相对表达量;Western blot法检测FOXC1、vimentin、E-cadherin、N-cadherin和β-catenin蛋白表达变化;MTS法和集落形成实验分别检测细胞的增殖能力;划痕愈合实验和Transwell 法检测细胞迁移和侵袭能力。结果: miR-138-5p过表达显著降低FOXC1和vimentin的mRNA及蛋白的表达(P<0.05),E-cadherin和β-catenin蛋白表达上调,N-cadherin蛋白表达下调,显著抑制肺癌细胞的增殖、迁移和侵袭能力(P<0.05)。结论: miR-138-5p 可以通过靶向干扰FOXC1和vimentin的表达抑制肺癌细胞的增殖、迁移和侵袭,可能是肺癌基因治疗的潜在靶点。
微小RNA-138-5p; 叉头框蛋白C1; 波形蛋白; 肺癌
肺癌是世界死亡率最高的癌症之一,尽管诊断方法、外科手术和放化疗技术近年来有很大的进展,但由于肺癌细胞具有高度的增殖、转移能力导致肺癌患者的预后依旧很差[1]。有效的分子靶向治疗成为肺癌研究的热点[2]。越来越多的证据表明微小RNA(microRNA,miRNA)的失调在各种肿瘤发病过程中发挥重要作用[3]。 miR-138-5p是miR-138 家族成员之一[4],其对肺癌细胞生物学行为的影响未见报道。本研究以人肺癌细胞A549和H460为研究对象,观察 miR-138-5p对肺癌细胞增殖、迁移和侵袭能力的影响,并探讨其可能的分子机制。
材料和方法
1材料
肺癌细胞系A549和H460购于中国科学院典型培养物保藏委员会细胞库(上海);胎牛血清、RPMI-1640培养基(HyClone);miR-138-5p 模拟物和miR-NC(上海吉玛制药技术有限公司);脂质体Lipofectamine 2000(Invitrogen);RT-qPCR试剂盒和MTS细胞活力试剂盒(武汉艾美捷科技有限公司);抗GAPDH、叉头框蛋白C1(forkhead box protein C1,FOXC1)、波形蛋白(vimentin)、上皮型钙黏蛋白(E-cadherin)、β-连环蛋白(β-catenin)和神经型钙黏蛋白(N-cadherin)抗体(Cell Signaling);辣根过氧化物酶标记的 II 抗(武汉博士德生物有限公司);ECL发光液(上海碧云天生物技术有限公司)。
2方法
2.1miR-138-5p靶基因预测 通过miRNA靶基因预测网站microRNA.org(http://www.microrna.org/microrna/home.do)和TargetScan(http://www.targetscan.org/vert_61/)并结合文献报道[4],我们认为miR-138-5p可能的靶基因为FOXC1和vimentin,具体序列互补见图1。

Figure 1. The binding site of miR-138-5p in the target gene 3’UTR.
图1miR-138-5p与目的基因3’UTR的结合位点
2.2细胞培养和转染 采用含10% 胎牛血清的RPMI-1640培养基培养肺癌细胞A549和H460,置于37 ℃、5% CO2的培养箱中培养。以处于对数生长期的肺癌细胞为转染对象,根据脂质体Lipofectamine 2000试剂说明书分别转染miR-NC(对照组)和miR-138-5p(实验组)至肺癌细胞。12 h后更换新鲜培养基。
2.3RT-qPCR检测mRNA 的表达 转染48 h,按照TRIzol试剂说明书提取总 RNA,逆转录合成 cDNA,以U6或GAPDH为内参照,使用RT-qPCR试剂盒进行扩增并采用2-ΔΔCt方法计算各组细胞miR-138-5p、FOXC1 mRNA和vimentin mRNA 的相对表达量,引物序列见表1。

表1 RT-qPCR引物序列
2.4Western blot法检测蛋白表达水平 转染48 h收集细胞,用含蛋白酶抑制剂的裂解液冰上裂解 30 min,提取总蛋白。依次完成10% SDS-PAGE,电转移至PVDF膜,5%牛血清白蛋白封闭,4 ℃下 I 抗孵育过夜,室温下 II 抗孵育1 h,ECL显影检测目的蛋白表达水平。
2.5MTS实验检测细胞活力 转染后24 h,消化吹打细胞,制成单细胞悬液,以每孔3 000个细胞接种于96孔板。于铺板后1、2、3、4和5 d分别采用MTS细胞活力试剂盒进行检测,绘制生长曲线。具体方法为每孔加入110 μL MTS稀释液,放回培养箱孵育2 h;清除气泡,酶标仪读取每孔在490 nm波长处吸光度(A)。
2.6集落形成实验 转染后24 h,消化吹打细胞,制成单细胞悬液。以每孔1 000个细胞接种于6孔板,培养10 d后,采用多聚甲醛固定和结晶紫染色,空气干燥后计数。集落形成率=集落数/接种的细胞数×100%。
2.7划痕愈合实验 消化收集各组细胞,接种 6 孔板,待细胞铺满孔底,用200 μL枪头小心在孔底划痕,PBS 洗涤 3 次,加入无血清培养基,置于培养箱内培养。于0 h、12 h和24 h观察拍照。划痕愈合率(%)=(0 h 划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
2.8Transwell实验 消化收集各组细胞,分别使用无血清培养基制成浓度为1×108cells/L的细胞悬液,在Transwell 小室的上室中加入细胞悬液200 μL,下室中加入600 μL含 10% 胎牛血清的培养基,培养箱内培养24 h。 取出Transwell小室,用棉签轻轻擦去上室未穿膜细胞和基质胶,甲醇固定15 min,0.1%结晶紫溶液染色30 min。镜下(×100)随机选取4个视野计数穿膜细胞数,取平均值。
3统计学处理
采用 SPSS 17.0 统计学软件进行数据分析。实验数据以均数±标准差(mean±SD)表示,组间差异比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1转染后细胞miR-138-5p、FOXC1mRNA和vimentinmRNA的表达
对照组和实验组转染后A549细胞中miR-138-5p的表达量分别为1.03±0.28和18 513.12±8 391.65 (t=4.41,P<0.01),实验组中FOXC1和vimentin的mRNA表达分别降低约45.5%(t=3.40,P<0.05)和27.1%(t=3.03,P<0.05);对照组和实验组H460细胞中miR-138-5p的表达量分别为1.01±0.16和25 629.68±4 610.69 (t=11.12,P<0.01),实验组中FOXC1和vimentin的mRNA表达分别降低约65.6%(t=3.61,P<0.05)和52.7% (t=3.53,P<0.05),见图2。

Figure 2. The mRNA expression levels of FOXC1 and vimentin. Mean±SD.n=4.*P<0.05vsmiR-NC group.
图2FOXC1和vimentin的mRNA表达水平
2靶基因及EMT相关蛋白的表达
与对照组相比,过表达miR-138-5p后,肺癌细胞中FOXC1、vimentin和N-cadherin蛋白的表达均明显降低,E-cadherin和β-catenin蛋白的表达明显升高,见图3。
3MTS法检测细胞活力的变化
与对照组相比,过表达miR-138-5p的A549和H460细胞活力在第5天均有显著差异(t=2.84,P<0.05;t=4.74,P<0.01),提示miR-138-5p能抑制肺癌细胞活力,见图4。
4集落形成实验的结果
对照组和实验组A549细胞的集落形成率分别为0.94%±0.36%和1.89%±0.48%(t=3.12,P<0.05),H460细胞的集落形成率分别为1.38%±0.23%和2.18%±0.51%(t=2.86,P<0.05)。过表达 miR-138-5p组细胞集落形成率明显降低,结合细胞活力的变化,表明miR-138-5p能抑制肺癌细胞的体外增殖能力,见图5。
5划痕愈合实验检测细胞迁移能力
对照组和实验组中A549细胞的划痕愈合率分别为66.73%±16.30%和37.87%±10.18%(t=3.00,P<0.05),H460细胞的划痕愈合率分别为60.36%±9.07%和33.06%±14.03%(t=3.27,P<0.05)。过表达 miR-138-5p组细胞划痕愈合率明显降低,表明miR-138-5p能抑制肺癌细胞的体外迁移能力,见图6。
6Transwell小室实验检测细胞侵袭能力
对照组和实验组A549细胞的穿膜细胞数分别为85±19和28±14 (t=4.91,P<0.05),H460细胞的穿膜细胞数分别为64±19和24±9 (t=3.72,P<0.05)。过表达 miR-138-5p组的穿膜细胞数明显降低,表明miR-138-5p能抑制肺癌细胞的体外侵袭能力,见图7。
讨 论
miRNA是一类长约22个核苷酸的内源性非编码RNA,miRNA的产生首先由初级转录产物(pri-miRNA)在细胞核中被RNase III (Drosha)切割形成前体 miRNA(pre-miRNA),经转运蛋白Exportin 5转运到细胞质,再由RNase III Dicer切割形成成熟的 miRNA[5]。miRNA通过不完全互补配对结合于靶基因mRNA的3’非翻译区(3′-untranslated region,3’UTR),形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC),抑制mRNA的翻译或者直接诱导mRNA的降解[6]。miRNA 广泛参与肿瘤细胞的增殖、凋亡、迁移和侵袭等多种生物学行为,在近些年的生命科学研究中,miRNA的研究已经成为生命科学最热门的研究领域之一[7]。研究发现miR-138-5p可抑制多种肿瘤的恶性生物学行为,比如miR-138-5p可通过靶向干扰SIRT1的表达抑制胰腺癌细胞的自噬[8]。在膀胱癌细胞中,miR-138-5p可通过干扰凋亡抑制蛋白家族成员survivin的表达抑制细胞的增殖和侵袭能力[9]。miR-138-5p可逆转包括白血病细胞、肺癌细胞的多药耐药性[10-11]。在肝癌细胞中,miR-138-5p通过干扰SOX9的表达,阻滞细胞周期的进展,抑制肝癌细胞的增殖[12]。miR-138-5p对肺癌细胞增殖、迁移和侵袭能力的影响及分子机制值得研究。
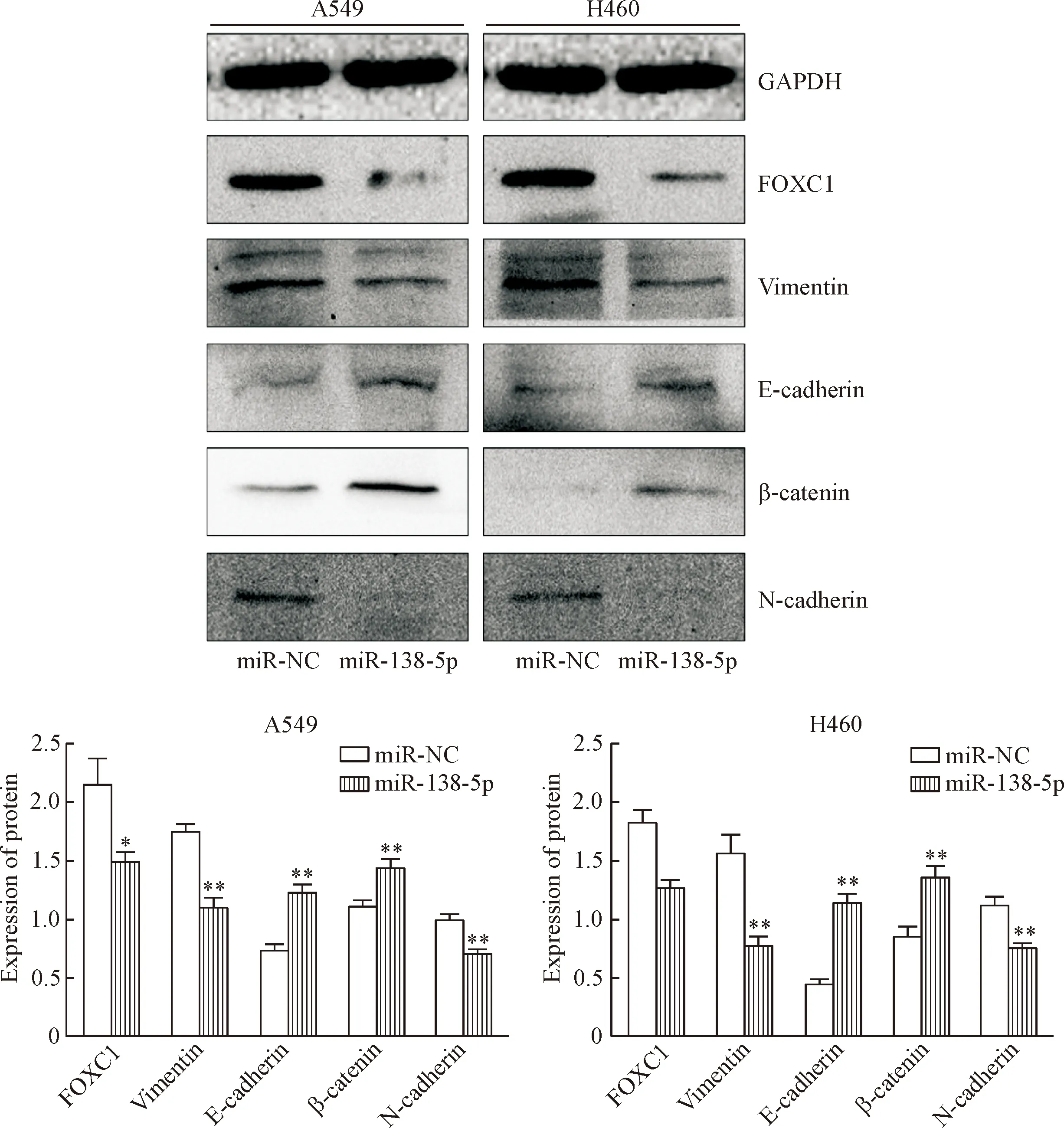
Figure 3. The expression levels of miR-138-5p target proteins and EMT-related proteins. Mean±SD.n=4.*P<0.05,**P<0.01vsmiR-NC group.
图3miR-138-5p靶蛋白及EMT相关蛋白的表达水平

Figure 4. The viability of A459 cells and H460 cells after transfection. Mean±SD.n=3.*P<0.05,**P<0.01vsmiR-NC group.
图4转染后A459和H460细胞活力的变化
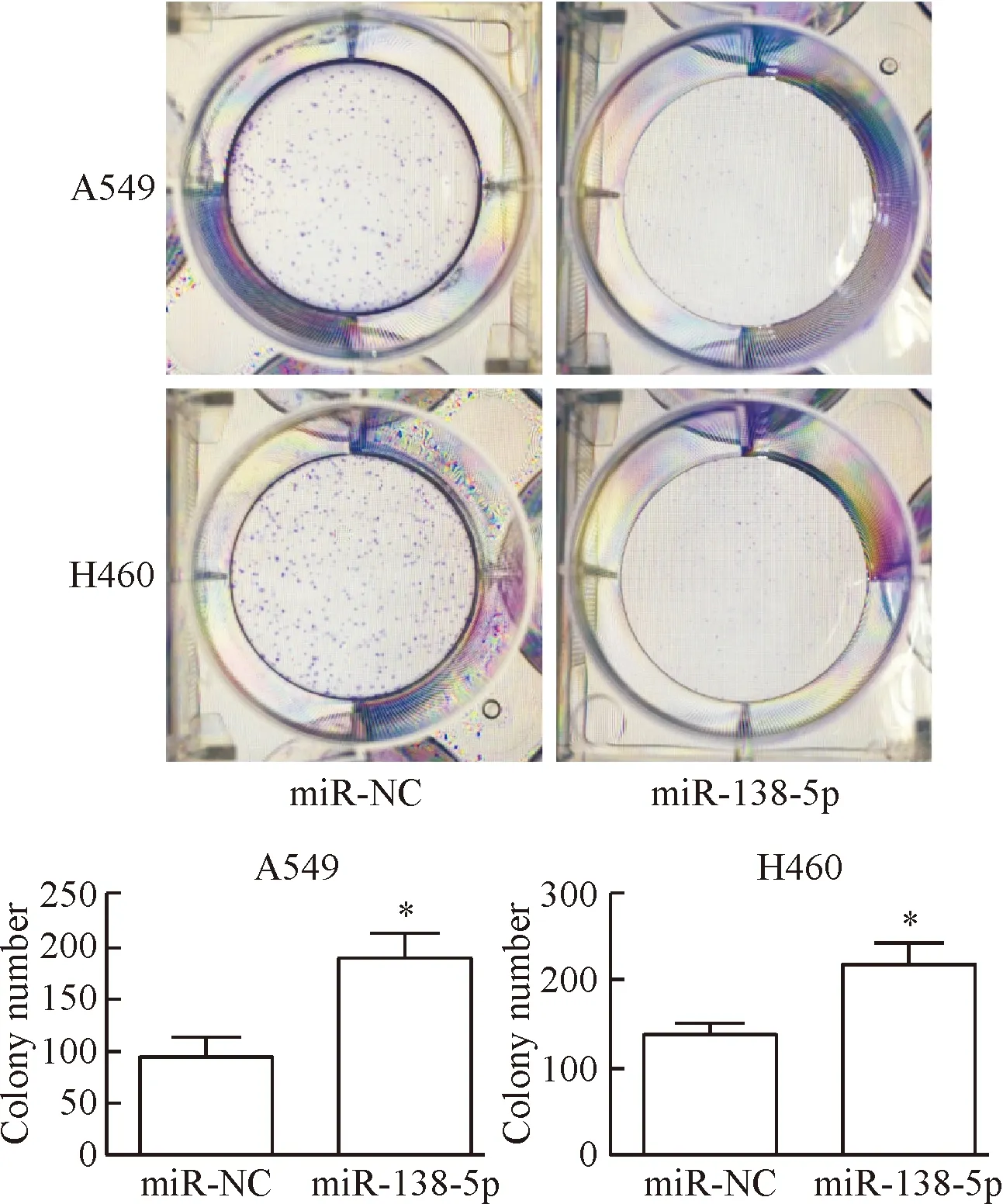
Figure 5. The effect of miR-138-5p on the colony formation capacity of lung cancer cells (crystal violet staining). Mean±SD.n=4.*P<0.05vsmiR-NC group.
图5miR-138-5p对肺癌细胞集落形成能力的影响
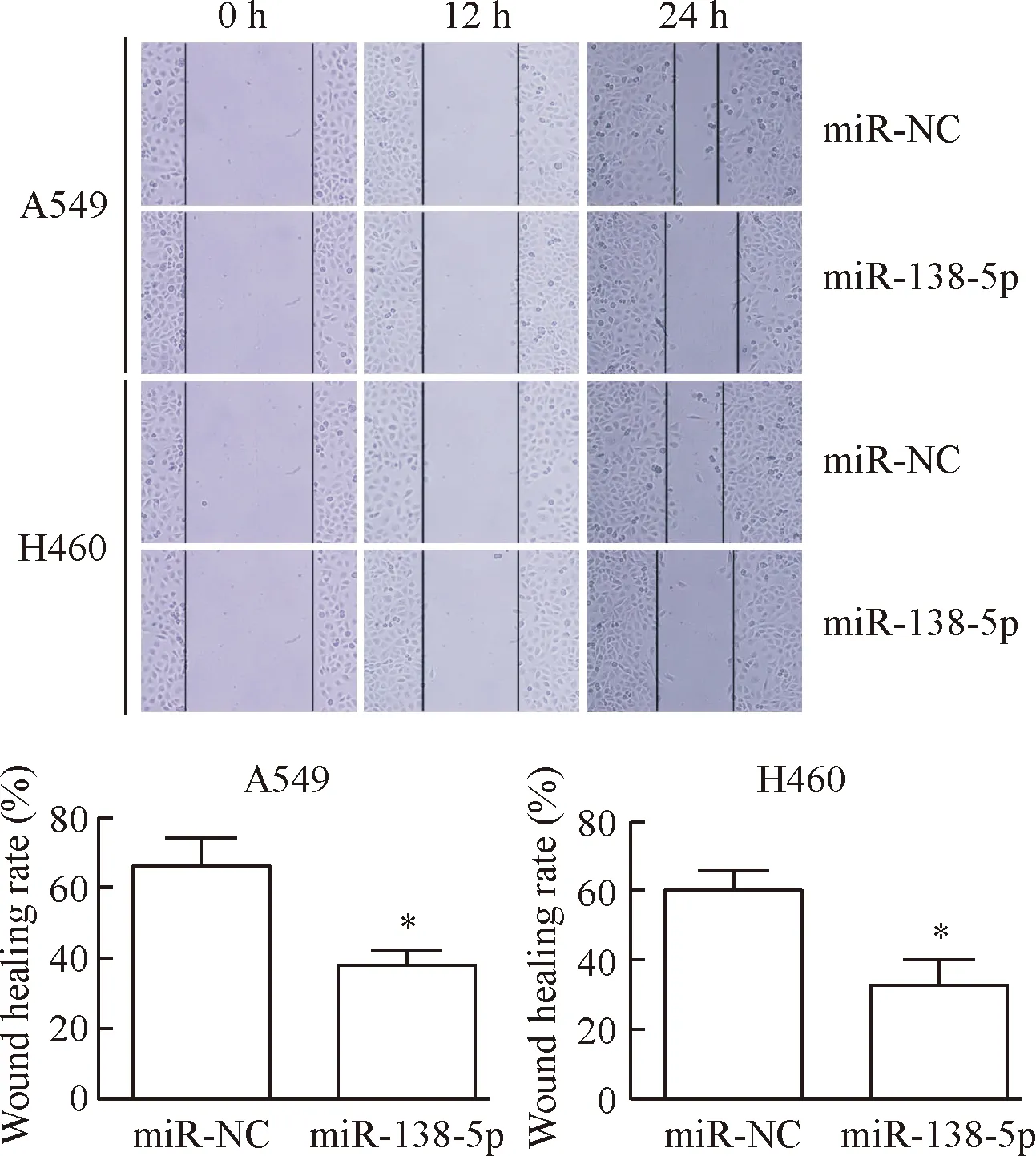
Figure 6. The effect of miR-138-5p on the migration ability of lung cancer cells (×100). Mean±SD.n=4.*P<0.05vsmiR-NC group.
图6miR-138-5p对肺癌细胞迁移能力的影响

Figure 7. The effect of miR-138-5p on the invasion ability of the lung cancer cells (crystal violet staining, ×100). Mean±SD.n=4.**P<0.01vsmiR-NC group.
图7miR-138-5p对肺癌细胞侵袭能力的影响(结晶紫染色)
miR-138-5p的靶基因鉴定是其功能研究的关键。我们参考文献报道[4],并结合miRNA靶基因预测网站microRNA.org和TargetScan,确定miR-138-5p的靶基因为FOXC1和vimentin。FOXC1属于 FOXC 亚族,通过抑制肿瘤细胞的增殖参与调控肿瘤的发生与发展[13]。Vimentin能促进细胞上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程,与肿瘤细胞的迁移、侵袭及耐药密切相关[14]。EMT过程主要表现为上皮细胞失去自身极性与特性,向间质细胞转化,EMT是肿瘤细胞获得迁移和侵袭能力的主要生物学机制,E-cadherin和β-catenin蛋白属于上皮表型,N-cadherin属于间充质表型,均与EMT过程密切相关[15-17]。本研究中,过表达miR-138-5p后,肺癌细胞中FOXC1和vimentin蛋白表达水平明显下降,MTS实验和集落形成实验显示肺癌细胞的活力和增殖能力下降,表明miR-138-5p可能通过干扰FOXC1的表达抑制肺癌细胞的增殖。同时,肺癌细胞EMT相关蛋白E-cadherin和β-catenin表达上调,N-cadherin表达下调,提示肺癌细胞EMT过程被抑制;划痕愈合实验和Transwell小室实验显示肺癌细胞迁移和侵袭能力显著下降,表明miR-138-5p可能通过干扰vimentin的表达抑制肺癌细胞的迁移和侵袭。
综上所述,miR-138-5p 可能通过靶向干扰FOXC1和vimentin的表达抑制肺癌细胞的增殖、迁移和侵袭,为以 miR-138-5p为治疗靶点的肺癌分子靶向治疗提供实验基础和理论依据。我们下一步将通过收集临床肺癌组织标本,观察miR-138-5p表达水平与患者肿瘤病理分期及预后的相关性,研究miR-138-5p在肺癌患者中的生物学标志价值。
[1] Nanavaty P, Alvarez MS, Alberts WM. Lung cancer screening: advantages, controversies, and applications[J]. Cancer Control, 2014, 21(1):9-14.
[2] Zhang Y, Yang Q, Wang S. MicroRNAs: a new key in lung cancer[J]. Cancer Chemother Pharmacol, 2014, 74(6):1105-1111.
[3] Tutar L, Tutar E, Özgür A, et al. Therapeutic targeting of microRNAs in cancer: future perspectives[J]. Drug Dev Res, 2015, 76(7):382-388.
[4] Yu C, Wang M, Li Z, et al. MicroRNA-138-5p regulates pancreatic cancer cell growth through targeting FOXC1[J]. Cell Oncol (Dordr), 2015, 38(3):173-181.
[5] Ding Y, Sun X, Shan PF. MicroRNAs and cardiovascular disease in diabetes mellitus[J]. Biomed Res Int, 2017, 2017:4080364.
[6] Oliveto S, Mancino M, Manfrini N, et al. Role of micro-RNAs in translation regulation and cancer[J]. World J Biol Chem, 2017, 8(1):45-56.
[7] Ayers D, Vandesompele J. Influence of microRNAs and long non-coding RNAs in cancer chemoresistance[J]. Genes (Basel), 2017, 8(3):E95.
[8] Tian S, Guo X, Yu C, et al. miR-138-5p suppresses autophagy in pancreatic cancer by targeting SIRT1[J]. Oncotarget, 2017, 8(7):11071-11082.
[9] Yang R, Liu M, Liang H, et al. miR-138-5p contributes to cell proliferation and invasion by targeting Survivin in bladder cancer cells[J]. Mol Cancer, 2016, 15:82.
[10] Gao Y, Fan X, Li W, et al. miR-138-5p reverses gefitinib resistance in non-small cell lung cancer cells via negatively regulating G protein-coupled receptor 124[J]. Biochem Biophys Res Commun, 2014, 446(1):179-186.
[11] Zhao X, Yang L, Hu J, et al. miR-138 might reverse multidrug resistance of leukemia cells[J]. Leuk Res, 2010, 34(8):1078-1082.
[12] Liu Y, Zhang W, Liu K, et al. miR-138 suppresses cell proliferation and invasion by inhibiting SOX9 in hepatocellular carcinoma[J]. Am J Transl Res, 2016, 8(5):2159-2168.
[13] Han B, Bhowmick N, Qu Y, et al. FOXC1: an emerging marker and therapeutic target for cancer[J]. Oncogene, 2017,36(28):3957-3963.
[14] Dave JM, Bayless KJ. Vimentin as an integral regulator of cell adhesion and endothelial sprouting[J]. Microcirculation, 2014, 21(4):333-344.
[15] Matsuzaki S, Darcha C, Pouly JL, et al. Effects of matrix stiffness on epithelial to mesenchymal transition-like processes of endometrial epithelial cells: Implications for the pathogenesis of endometriosis[J]. Sci Rep, 2017, 7:44616.
[16] Pantazi E, Gemenetzidis E, Teh MT, et al. GLI2 is a re-gulator of β-catenin and is associated with loss of E-cadherin, cell invasiveness and long-term epidermal regeneration[J]. J Invest Dermatol, 2017,137(8):1719-1730.
[17] Brilliant YM, Brilliant AA, Sazonov SV. Epithelial cadherins and associated molecules in invasive lobular breast cancer[J]. Arkh Patol, 2017, 79(1):12-18.
(责任编辑: 陈妙玲, 罗 森)
Mechanism of microRNA-138-5p inhibiting proliferation, migration and invasion of lung cancer cells
WANG Xiang-hui, HUANG Jiang-ping, CUI Feng-he, QIAN Hai-yun
(Department of Cardiothoracic Surgery, Jingzhou Hospital, Tongji Medical College, Huazhong University of Science and Technology, Jingzhou 434020, China. E-mail: jzyywxh@163.com)
AIM: To investigate the mechanism of microRNA-138-5p (miR-138-5p) inhibiting the proliferation, migration and invasion abilities of lung cancer cells.METHODS: The lung cancer A549 and H460 cells were transfected with miR-NC (control group) or miR-138-5p (experimental group). The bioinformatic analysis was performed to predict the target genes of miR-138-5p.The expression levels of miR-138-5p, forkhead box protein C1 (FOXC1) mRNA and vimentin mRNA were detected by RT-qPCR. The protein expression of FOXC1, vimentin, E-cadherin, N-cadherin and β-catenin was determined by Western blot. MTS method and colony formation assay were used to detect cell viability and proliferation ability. Wound healing assay and Transwell assay were used to detect cell migration and invasion ability.RESULTS: Over-expression of miR-138-5p significantly reduced the expression of FOXC1 and vimentin at mRNA and protein levels (P<0.05). The expression of E-cadherin and β-catenin were up-regulated and the expression of N-cadherin was down-regulated. The proliferation, migration and invasion abilities of the lung cancer cells were inhibited by the over-expression of miR-138-5p.CONCLUSION: miR-138-5p inhibits the proliferation, migration and invasion abilities of lung cancer cells by targeting FOXC1 and vimentin. It may be a potential target for lung cancer gene therapy.
MicroRNA-138-5p; Forkhead box protein C1; Vimentin; Lung cancer
1000- 4718(2017)09- 1631- 06
2017- 03- 22 [
] 2017- 06- 20
R734.3; R363
A
10.3969/j.issn.1000- 4718.2017.09.016
△通讯作者 Tel: 18107168104; E-mail: jzyywxh@163.com
