联合氢气吸入的液体复苏方案对脓毒性休克大鼠肾脏的保护作用*
2017-09-22单立平刘倩倩
刘 伟, 单立平, 刘倩倩, 刘 志△
(1中国医科大学附属第一医院急诊科,辽宁 沈阳 110001; 2中国医科大学附属盛京医院泌尿外科,辽宁 沈阳 110004)
联合氢气吸入的液体复苏方案对脓毒性休克大鼠肾脏的保护作用*
刘 伟1, 单立平2, 刘倩倩1, 刘 志1△
(1中国医科大学附属第一医院急诊科,辽宁 沈阳 110001;2中国医科大学附属盛京医院泌尿外科,辽宁 沈阳 110004)
目的: 评价联合2%氢气吸入的液体复苏方案对脂多糖(LPS)诱导的脓毒性休克大鼠肾脏的治疗效果。方法:60只Wistar大鼠随机分成4组(每组15只):正常对照(control)组,脓毒性休克(shock)组,脓毒性休克+液体复苏组(fluid组),脓毒性休克+2%氢气吸入联合液体复苏组(fluid+H2组)。大鼠麻醉后予呼吸机辅助通气,fluid+H2组给予2%氢气空气混合气,其余3组给予单纯空气吸入。10 mg/kg LPS静脉注射,建立脓毒性休克模型,control组给予等量生理盐水静脉注射。Fluid组和fluid+H2组给予相同液体复苏方案,维持平均动脉压于正常水平。4 h后,大鼠经腹主动脉放血处死,留取血液及肾脏标本。结果:联合2%氢气吸入的液体复苏方案与单纯液体复苏比较,血肌酐、尿素氮、中性粒细胞明胶酶相关脂质运载蛋白及肾脏组织TNF-α、IL-6水平明显降低,氧化应激损伤程度明显减轻。结论:联合2%氢气吸入的液体复苏方案更能减轻脓毒症所致急性肾损伤。
脓毒性休克; 急性肾损伤; 液体复苏; 氢气
近年来尽管对脓毒性休克的认识和治疗进展方面取得了很大成就,但脓毒性休克依然具有很高的发病率和病死率[1]。液体复苏是改善脓毒性休克有效循环血容量不足和降低多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)发生率的重要手段。大量临床试验已经证实早期液体复苏能明显改善脓毒性休克患者的预后[2-3]。然而液体复苏本身是一把双刃剑,在改善有效容量的基础上,也存在液体过负荷所导致的间质水肿及其随后可能发生的器官功能损伤的风险[4]。因此,如何有效实施液体复苏成为影响脓毒性休克患者预后的重要因素。
脓毒症危重症患者急性肾损伤(acute kidney injury,AKI)的发病率近65%[5],脓毒性休克患者若并发AKI将使死亡率明显增加[6]。因此保护脓毒性休克患者肾脏功能显得尤为重要。然而目前液体复苏仍然是临床上预防和治疗脓毒性休克过程中出现AKI的必要手段,此过程中必将存在由于液体过负荷导致肾脏功能恶化的风险,因此寻求更优化的液体复苏方案显得尤为迫切。
氢分子作为一种选择性的抗氧化剂,在多种疾病的动物模型中均表现出很好的治疗效果[7]。氢分子的作用机制主要包括选择性抗氧化、抑制凋亡和过度的炎症反应。我们以前研究发现联合2%氢气(hydrogen,H2)吸入的液体复苏方案可明显减轻脓毒性休克所致的急性肺损伤[8],因此本实验将再次利用脓毒性休克大鼠模型,探究联合2%氢气吸入的早期液体复苏方案对脓毒性休克所致AKI的治疗效果及相关机制。
材料和方法
1材料
1.1动物 60只健康雄性Wistar大鼠(180~200 g)均由中国医科大学实验动物部提供,并在清洁级动物房饲养繁殖。
1.2主要仪器 HX300动物呼吸机、HP便携式心电监护仪和OMNI血气分析仪(AVL);光学显微镜及电镜(Olympus)。
1.3主要试剂 脂多糖(lipopolysaccharides,LPS)购自Sigma;丙二醛(malonaldehyde,MDA)、超氧化物歧化酶(superroxide dismutase,SOD)及髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒购自南京建成生物工程研究所;白细胞介素6(interleukin-6,IL-6)、白细胞介素-10(interleukin-10)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin,NGAL)ELISA 试剂盒均购自武汉博士德生物工程有限公司;2%氢气、21%空气和77%氮气混合气体由中国医科大学医用气体站提供。
2方法
2.1动物分组及模型制作 实验动物随机分成4组,每组15只,正常对照组(control组)、脓毒性休克对照组(shock组)、液体复苏组(fluid组) 和液体复苏+2%氢气吸入组(fluid+H2组)。10%水合氯醛(300 mg/kg)经腹腔注射对大鼠进行麻醉,气管切开接呼吸机辅助通气,呼吸频率100次/分,潮气量10 mL/kg,fluid+H2组大鼠吸入气体为2%氢气空气混合气,其余3组吸入气体均为空气。左颈动脉穿刺,连接监护仪监测心率及平均动脉压( mean arterial pressure,MAP);股静脉穿刺留置导管,以备给药及补液,电热器维持体温。大鼠状态稳定 30 min 后, 除control组外,其余3组均静脉注射LPS 10 mg/kg(配制浓度10 g/L,推注时间不少于2 min,推注完毕再推入0.2 mL生理盐水将注射器内残存的LPS完全注入),建立脓毒性休克大鼠模型。control组静脉注入等量生理盐水。液体复苏方案: 每15 min给予生理盐水10 mL/kg,30 min后根据MAP水平,应用去甲肾上腺素(0.5~6 μg·kg-1·min-1) 维持MAP于正常水平[9]。记录各组大鼠的生命体征、补液量及去甲肾上腺素的用量。所有大鼠于模型建立成功4 h后经颈动脉放血处死,留取动脉血1 mL行血气分析,剩余血液3 000×g离心10 min,留取血清行肌酐(creatinine,Cr)、尿素氮(blood urea nitrogen,BUN)及NGAL检测。切除左肾,经PBS充分清洗后,以肾门为中心,向外放射状均匀切成4块,1块以4%多聚甲醛固定,留作光镜检测,1块以2.5%戊二醛固定留作电镜检测,剩余-80 ℃保存待检测氧化还原指标及炎性介质水平。
2.2肾功能检测 血清Cr及BUN水平用于评估大鼠肾脏功能,应用COBAS Mira化学检测仪(Roche)检测,具体步骤参照所购试剂盒说明书。
2.3NGAL的检测 应用ELISA试剂盒检测血清NGAL浓度,参照说明书进行操作。
2.4肾脏组织病理学观察 肾脏组织以4%多聚甲醛浸泡24 h以上,常规脱水、包埋,切成4 μm切片,用苏木素伊红(HE)染色,光镜下观察肾脏组织病理改变。另一个肾标本用2.5%戊二醛固定,脱水,嵌入环氧树脂,并制成超薄切片,用透射电镜观察细胞器的变化。
2.5肾脏组织中MDA、MPO、SOD 活力的测定 取肾脏组织匀浆,12 000×g离心20 min, 取上清液采用分光光度法测定MDA、MPO、SOD活性,检测步骤严格按照说明书进行操作。
2.6肾脏组织中炎性介质检测 将冻存的肾脏组织在冰上解冻、匀浆,4℃离心(3 000×g、15 min),ELISA法检测匀浆上清中TNF-α、IL-6和IL-10水平(检测步骤严格按说明书进行操作)。
3统计学处理
采用SPSS 13.0统计软件进行统计分析。数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
结 果
1MAP、血氧分压(PO2)、补液量及去甲肾上腺素的用量
本实验中MAP在静脉注射LPS后20 min降至正常的80%,fluid组和fluid+H2组在整个实验过程中MAP值无明显差异。fluid+H2组液体量和去甲肾上腺素用量明显少于fluid组。PO2在shock组明显降低,两种液体复苏方案均使PO2升高,但fluid+H2组升高的更为明显(P<0.05),见表1。
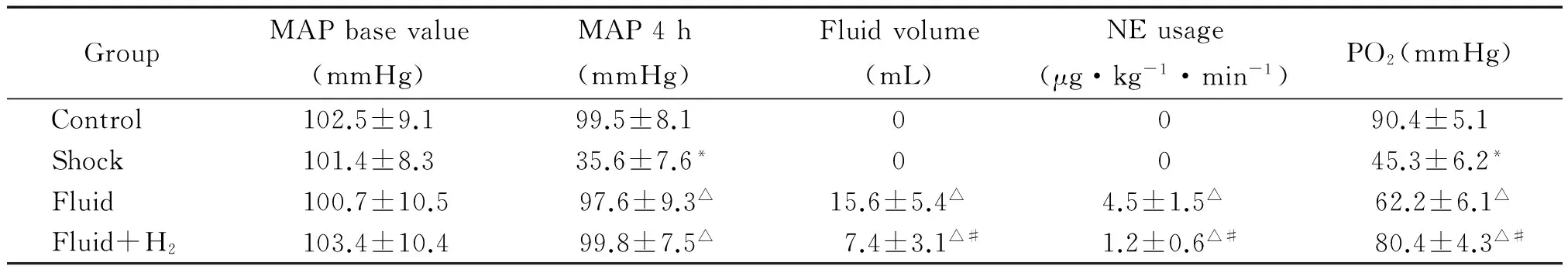
表1 各组MAP、PO2、补液量及去甲肾上腺素用量的比较
*P<0.05vscontrol;△P<0.05vsshock;#P<0.05vsfluid.
2血清Cr、BUN及NGAL水平
Shock组与control组比较,血清Cr、BUN及NGAL水平明显升高,两种液体复苏方案明显降低了血清Cr、BUN及NGAL水平,但fluid+H2组降低的更为明显(P<0.05)。虽然液体复苏降低了Cr和BUN水平,但BUN/Cr比值(control、shock、fluid及fluid+H2组BUN/Cr比值分别为0.18±0.05、0.19±0.06、0.17±0.04及0.17±0.05)在4组中的差异无统计学显著性,见图1。
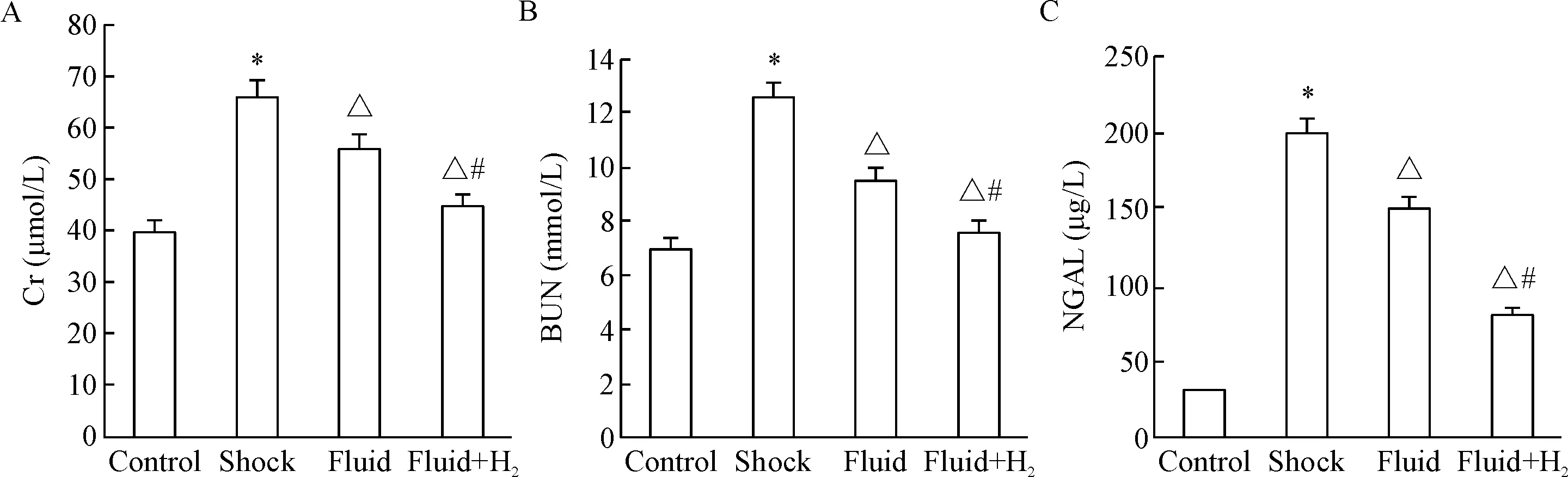
Figure 1. The levels of serum Cr (A), BUN (B) and NGAL (C) in different groups. Mean±SD.n=15.*P<0.05vscontrol;△P<0.05vsshock;#P<0.05vsfluid.
图1各组血清Cr水平、BUN水平和NGAL表达水平的比较
3肾脏组织病理学观察
Control组光镜下见正常肾小球及肾小管形态;shock组肾小管上皮细胞明显水肿、刷状缘破坏,间质水肿伴出血及炎性细胞侵润;fluid组和fluid+H2组光镜下肾小管上皮细胞损伤明显减轻,尤其是fluid+H2组损伤最轻。电镜下可见肾小球滤过膜由肾小球基底膜、伪足和内皮细胞组成:control组肾小球基底膜连续、厚度均匀,伪足排列整齐,内皮细胞清晰;shock组肾小球基底膜蜷曲、厚度不均,大部分伪足和内皮细胞融合,提示肾小球滤过膜损伤严重;fluid组和fluid+H2组肾小球滤过膜损伤明显改善,尤其fluid+H2组改善更明显,见图2。
4肾脏组织MDA、MPO和SOD水平的变化
Shock组与control组比较,MDA和MPO水平明显升高且伴随有SOD明显下降,液体复苏后MDA和MPO表达明显下降并伴随SOD升高,但此变化趋势在fluid+H2组更为明显,见图3。
5肾脏组织炎症介质的表达
ELISA检测结果显示shock组肾脏组织的TNF-α和IL-6表达与control组比较明显升高,液体复苏后TNF-α和IL-6表达明显下降,fluid+H2组与fluid组比较下降得更为明显(P<0.05);IL-10的表达在shock组、fluid组和fluid+H2组均明显升高,但3组间比较差异无统计学显著性;IL-6/ IL-10比值在fluid组和fluid+H2组明显下降,尤其在fluid+H2组下降更为明显(P<0.05),见图4。
讨 论
本实验结果提示联合2%氢气吸入的液体复苏方案与单纯液体复苏比较,显著降低维持正常MAP所需的液体及去甲肾上腺素用量。正如我们所知,过量的液体有导致器官水肿致靶器官功能恶化的风险,因此,联合氢气吸入的液体复苏方案更大的优化了脓毒性休克液体复苏的治疗效果,而减轻了其可能导致的弊端(液体过量)。

Figure 2. The images of kidney tissues with HE staining (A, ×200) and transmission electron microscopic analysis of glomerular filtration membrane (B, ×5 000) in different groups.
图2肾脏组织的HE染色和电镜下的超微结构观察
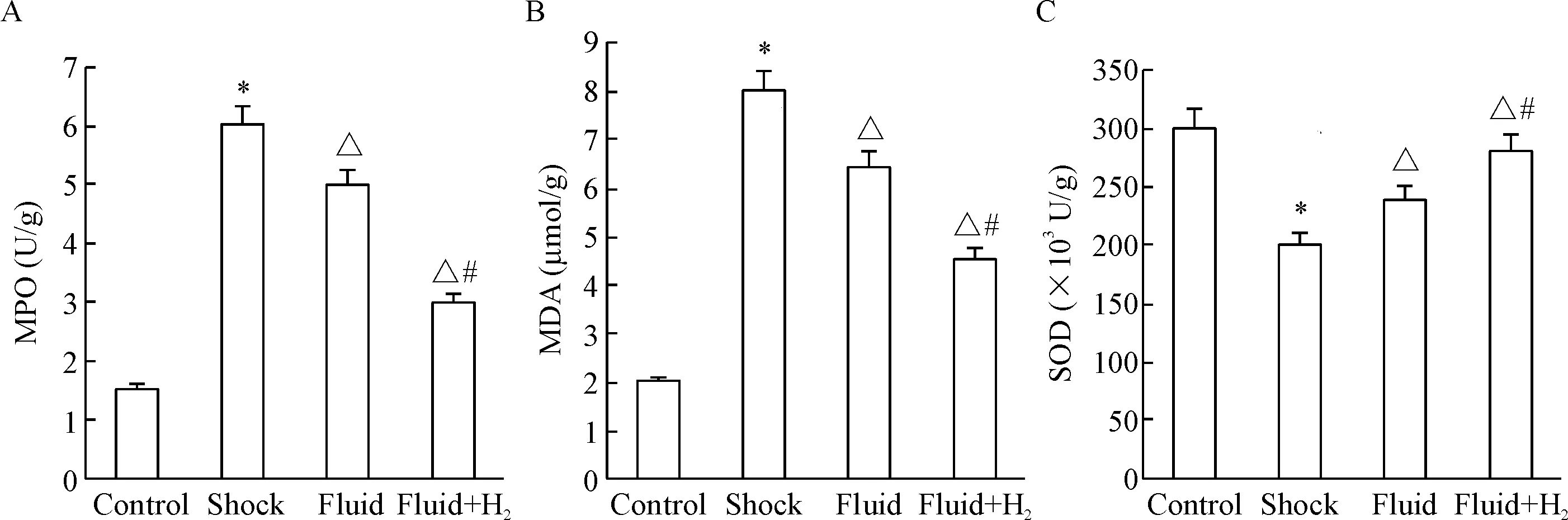
Figure 3. The changes of MPO (A), MDA (B) and SOD (C) in the renal tissues of different groups. Mean±SD.n=15.*P<0.05vscontrol;△P<0.05vsshock;#P<0.05vsfluid.
图3各组肾脏组织MPO、MDA和SOD水平的变化
本实验结果提示脓毒性休克诱导了明显的肾脏功能损伤,虽然2种液体复苏方案均明显降低了血Cr和BUN水平,但是BUN/Cr比值在4组中无明显变化。众所周知,BUN/Cr比值通常被用来区分肾前性或肾性氮质血症,在脓毒性休克时肾脏血流量明显下降,导致肾前性肾脏损伤。与此同时,LPS和缺血又可以诱导肾脏局部过量促炎介质的释放,导致肾实质性损伤。正如我们的实验结果所示,脓毒性休克组不但出现了血流动力学改变,肾脏病理及超微结构亦出现了明显的改变,这就解释了为何BUN/Cr比值在4组中无明显变化,即脓毒性休克致AKI既有肾前性因素又有肾性因素参与。
NGAL属于脂蛋白超级家族一员,生理情况下在上皮细胞中微量表达,而在肾小管损伤中,其可以出现明显表达升高,是AKI早期的生物标记物[10]。本实验中脓毒性休克组,NGAL明显升高,提示出现了明显的肾小管上皮细胞损伤,两种液体复苏方案均降低了NGAL的表达水平,但联合氢气吸入的液体复苏方案组NGAL降低的更明显,提示对肾小管更具保护作用。电镜结果提示脓毒性休克组肾小球滤过膜超微结构出现了明显的损伤,虽然两组液体复苏方案均改善了肾小球滤过膜的损伤,但联合氢气吸入组改善程度更为显著。因此联合氢气吸入的液体复苏方案与单纯液体复苏比较,更进一步减轻了肾小管上皮细胞及肾小球滤过膜的损伤程度,更能减轻AKI。
在脓毒症时,LPS激活中性粒细胞、巨噬/单核细胞及内皮细胞等,释放大量炎性介质及活性氧族,从多方面对脓毒性休克患者的预后产生负面影响[3]。同时肾小球入球小动脉收缩使肾血流减慢进一步继发中性粒细胞黏附和聚集。当低血压持续存在时,肾小球入球小动脉进一步收缩,导致肾脏缺氧和肾血管内皮细胞黏附分子高表达,这些更加促进中性粒细胞在血管内皮细胞的黏附。活化的中性粒细胞释放大量促炎介质和氧自由基,进一步加重肾脏缺氧和损伤[11]。因此改善氧合和降低氧化应激损伤对保护脓毒性休克所致AKI至关重要。本实验结果显示,联合氢气吸入的液体复苏方案与单纯液体复苏比较,不仅明显提高了血氧分压的水平,还使MPO、MDA表达明显下降,SOD表达明显升高,提示联合氢气吸入的液体复苏方案不仅显著改善的机体氧合,还明显降低了氧化应激损伤,对AKI具有显著的改善作用。

Figure 4. The levels of TNF-α (A), IL-6 (B), IL-10 (C) and ratio of IL-6/IL-10 (D) in the renal tissues of different groups. Mean±SD.n=15.*P<0.05vscontrol;△P<0.05vsshock;#P<0.05vsfluid.
图4肾脏组织TNF-α、IL-6、IL-10和IL-6/IL-10比值的变化
虽然脓毒性休克所致AKI具体机制仍不十分清楚,但过度炎症反应在此过程中扮演重要角色[12]。研究表明AKI时,TNF-α在肾小管上皮细胞过度表达伴随大量炎性细胞侵润并加重肾损伤,而应用TNF-α受体拮抗剂可以明显改善肾损伤程度[13]。IL-6在AKI时亦明显高表达,并且会同时加重肾脏和肺脏的损伤[14]。抑制TNF-α和IL-6的过度表达可显著减轻AKI。IL-10是重要的抗炎介质,能抑制促炎介质如TNF-α、IL-1β、IL-6 和 IL-8的表达,并且代表了机体代偿性抗炎反应(compensatory anti-inflammatory response syndrome,CARS)的能力。啮齿类动物模型显示,应用外源性IL-10对AKI具有明显治疗效果[15]。本实验中,脓毒性休克组TNF-α和IL-6表达明显升高,提示过度炎症反应参与AKI的发病过程,两种液体复苏方案均明显降低了TNF-α和IL-6的表达,但在联合氢气的液体复苏组降低的更为明显。CARS在脓毒症中通常被描述为迟发的炎症反应,但在本实验中IL-10的表达与TNF-α和IL-6几乎同步,即在实验终点时间均明显升高,且在脓毒性休克组和两种液体复苏组表达无明显差异。但是IL-6/IL-10比值在液体复苏后明显降低,尤其在联合氢气的液体复苏组。有研究报道IL-6/IL-10比值升高与脓毒症预后不良具有明显相关性[16]。因此本实验结果提示联合氢气的液体复苏方案与单纯液体复苏比较,不但进一步降低了促炎介质的表达,还更好的维持了促炎/抗炎的平衡,更能减轻AKI。
脓毒性休克过程中,微循环或毛细血管功能障碍直接影响液体复苏的效果。毛细血管透过度增加可引起渗漏致组织间隙的液体增加,导致器官水肿和有效循环血容量的不足,最终进一步加重器官缺血、缺氧和持续的低血压。早期液体复苏是治疗脓毒性休克的重要手段,但是如果治疗不当,复苏所用液体会导致器官水肿加重和器官功能衰竭。氢分子因为具有抗氧化、抑制凋亡和过度炎症反应的作用,在液体复苏过程中可能通过改善毛细血管的功能,减少了渗漏致组织间隙的液体量,因而更加优化了液体复苏积极的治疗效果,而减少了液体过量所致的弊端,对脓毒性休克所致AKI具有更好的治疗效果。
[1] Martin GS, Mannino DM, Eaton S, et al. The epidemiology of sepsis in the United States from 1979 through 2000[J]. N Engl J Med, 2003, 348(16):1546-1554.
[2] Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock[J]. N Engl J Med, 2001, 345(19):1368-1377.
[3] Trzeciak S, McCoy JV, Phillip Dellinger R, et al. Early increases in microcirculatory perfusion during protocol directed resuscitation are associated with reduced multi-organ failure at 24 h in patients with sepsis[J]. Intensive Care Med, 2008, 34(12):2210-2217.
[4] Marik PE, Linde-Zwirble WT, Bittner EA, et al. Fluid administration in severe sepsis and septic shock, patterns and outcomes: an analysis of a large national database[J]. Intensive Care Med, 2017, 43(5):625-632.
[5] Singbartl K, Kellum JA. AKI in the ICU: defnition, epidemiology, risk stratifcation, and outcomes[J]. Kidney Int, 2012, 81(9):819-825.
[6] Bagshaw SM, George C, Bellomo R, et al. A comparison of the RIFLE and AKIN criteria for acute kidney injury in critically ill patients[J]. Nephrol Dial Transplant, 2008, 23(5): 1569-1574.
[7] Dixon BJ, Tang J, Zhang JH. The evolution of molecular hydrogen: a noteworthy potential therapy with clinical signifcance[J]. Med Gas Res, 2013, 3(1):10.
[8] 刘 伟, 孙裕强, 孙 宁, 等. 液体复苏联合氢气吸入对脓毒性休克大鼠肺脏的作用[J]. 中国病理生理杂志, 2013, 29(1):116-120.
[9] Sennoun N, Montemont C, Gibot S, et al. Comparative effects of early versus delayed use of norepinephrine in resuscitated endotoxic shock[J]. Crit Care Med, 2007, 35(7): 1736-1740.
[10] Haase M, Bellomo R, Devarajan P, et al. Accuracy of neutrophil gelatinase-associated lipocalin (NGAL) in diagnosis and prognosis in acute kidney injury: a systematic review and meta-analysis[J]. Am J Kidney Dis, 2009, 54(6):1012-1024.
[11] Kurniati NF, van Meurs M, Vom HF, et al. Pleiotropic effects of angiopoietin-2 defciency do not protect mice against endotoxininduced acute kidney injury[J]. Nephrol Dial Transplant, 2013, 28(3):567-575.
[12] Wang W, Bansal S, Falk S, et al. Ghrelin protects mice against endotoxemia-induced acute kidney injury[J]. Am J Physiol Renal Physiol, 2009, 297(4):F1032-F1037.
[13] Knotek M, Rogachev B, Wang W, et al. Endotoxemic renal failure in mice: role of tumor necrosis factor independent of inducible nitric oxide synthase[J]. Kidney Int, 2001, 59(6):2243-2249.
[14] Grigoryev DN, Liu M, Hassoun HT, et al. The local and systemic inflammatory transcriptome after acute kidney injury[J]. J Am Soc Nephrol, 2008, 19(3):547-558.
[15] Deng J, Kohda Y, Chiao H, et al. Interleukin-10 inhibits ischemic and cisplatin-induced acute renal injury[J]. Kidney Int, 2001, 60(6):2118-2128.
[16] Taniguchi T, Koido Y, Aiboshi J, et al. Change in the ratio of Interleukin-6 to interleukin-10 predicts a poor outcome in patients with systemic inflammatory response syndrome[J]. Crit Care Med, 1999, 27(7):1262-1264.
(责任编辑: 卢 萍, 余小慧)
Liquid resuscitation combined with hydrogen inhalation reduce acute kidney injury during septic shock in rats
LIU Wei1, SHAN Li-ping2, LIU Qian-qian1, LIU Zhi1
(1Department of Emergency, First Hospital of China Medical University, Shenyang 110001, China;2Department of Urologic Surgery, Shengjing Hospital, China Medical University, Shenyang 110004, China. E-mail: lzsy2014@163.com)
AIM: To investigate the therapeutic effects of a novel fluid resuscitation protocol (early fluid resuscitation plus 2% hydrogen inhalation) on acute kidney injury during septic shock induced by lipopolysaccharide (LPS) in rats.METHODS: Male Wistar rats were randomly divided into 4 groups (15 rats per group): control group, septic shock group, septic shock with early fluid resuscitation group (fluid group) and septic shock with early fluid resuscitation plus 2% hydrogen inhalation group (fluid+H2group). The rats were ventilated, and a 2% hydrogen mixture was used in fluid+H2group. LPS (10 mg/kg) was administered to establish the septic shock model in rats and fluid resuscitation was performed in fluid group and fluid+H2group.RESULTS: Fluid resuscitation with 2% hydrogen inhalation decreased the le-vels of serum creatinine, blood urea nitrogen and neutrophil gelatinase-associated lipocalin. It also reduced oxidative stress injury and decreased renal tumor necrosis factor-α and interleukin-6 levels compared with fluid resuscitation alone.CONCLUSION: Early fluid resuscitation plus 2% hydrogen inhalation provided more protection against acute kidney injury du-ring septic shock.
Septic shock; Acute kidney injury; Fluid resuscitation; Hydrogen
1000- 4718(2017)09- 1703- 06
2016- 07- 27 [
] 2017- 03- 11
国家自然科学基金资助项目(No. 81571882)
R515.3;R363.2+1
A
10.3969/j.issn.1000- 4718.2017.09.027
△通讯作者 Tel: 024-83283055; E-mail: lzsy2014@163.com
