过表达整合素连接激酶促进心脏c-Kit+细胞的存活和增殖*
2017-09-22李菁菁李爱英王冬梅
李菁菁, 刘 玉, 赵 娟, 李爱英, 王冬梅△
(1中国人民解放军白求恩国际和平医院心血管内科, 2河北医科大学基础医学院细胞生物教研室,3河北省中医学院生物化学与生物学教研室, 河北 石家庄 050082)
·论著·
过表达整合素连接激酶促进心脏c-Kit+细胞的存活和增殖*
李菁菁1, 2, 刘 玉1, 赵 娟2, 李爱英3, 王冬梅1△
(1中国人民解放军白求恩国际和平医院心血管内科,2河北医科大学基础医学院细胞生物教研室,3河北省中医学院生物化学与生物学教研室, 河北 石家庄 050082)
目的: 探讨整合素连接激酶(ILK)过表达对心脏c-Kit+细胞存活和增殖的影响,以及移植ILK过表达的心脏c-Kit+细胞改善心肌梗死(MI)大鼠心功能的作用。方法: 从新生SD大鼠分离培养心脏c-Kit+细胞,构建含人ILK全长的腺病毒载体并感染心脏c-Kit+细胞。感染48 h后,应用细胞计数和CCK-8法测定细胞活力和增殖,并通过Western blot法检测c-Kit+细胞中增殖相关蛋白cyclin D1和增殖细胞核抗原(PCNA)的表达。40只8周龄SPF级大鼠经冠状动脉结扎建立MI模型,结扎15 min后于梗死区及梗死边缘区分3点通过心肌注射移植心脏c-Kit+细胞。采用随机数字表法将大鼠分为假手术组(sham组)、心梗+生理盐水注射组(MI组)、心梗+感染空载体的c-Kit+细胞注射组(Ad-null-c-Kit+cell组)和心梗+感染携带ILK腺病毒载体的c-Kit+细胞注射组(ILK-c-Kit+cell组),每组10只。术后2周,免疫组化法检测梗死区和梗死边缘区c-Kit的表达;术后4周,通过血流动力学检测心脏功能。结果: 过表达ILK促进了心脏c-Kit+细胞的存活和增殖(P<0.05)。过表达ILK的心脏c-Kit+细胞中cyclin D1和PCNA的表达明显增加(P<0.05)。细胞移植2周后,ILK-c-Kit+cell组心肌组织中c-Kit表达明显增加(P<0.05);细胞移植4周后,ILK-c-Kit+cell组大鼠心功能改善比Ad-null-c-Kit+cell组更明显(P<0.05)。结论: 过表达ILK通过提高cyclin D1和PCNA的表达,促进了心脏c-Kit+细胞的存活和增殖。ILK-c-Kit+细胞移植能更好地改善MI大鼠的心功能。
整合素连接激酶; 心脏c-Kit+细胞; 细胞存活; 细胞增殖; 心功能; 心肌梗死
心肌梗死(myocardial infarction,MI)后局部心肌组织缺血,心肌细胞大量死亡,纤维组织增生,进而导致左心室重构和缺血性心力衰竭,严重危害人类健康[1]。随着介入治疗和药物治疗等方法研究的进展,急性心肌梗死患者的生存率得到明显提高,但这些传统的方法不能使坏死心肌细胞再生,而由纤维组织代替,即不能从根本上使已经坏死的心肌修复,改善心肌的舒缩功能。近年来,研究发现在成体的心肌组织和骨髓中存在具有特异性心肌分化潜能的多能干细胞,即心肌干细胞(cardiac stem cells,CSCs)[2]。心肌梗死后,CSCs在多种机制下被动员至心肌缺血区,向心肌细胞等心肌谱系细胞分化,进而修复心脏,改善心功能,因而心肌干细胞移植逐渐成为最有前景的治疗手段之一[3]。然而移植到损伤局部组织的CSCs存活和增殖能力受限,大部分细胞因缺血缺氧的心肌微环境而死亡,难以达到预期治疗效果[4]。整合素连接激酶(integrin-linked kinase,ILK)是一种与细胞存活和增殖密切相关的蛋白,广泛表达在心血管系统,调节多种心血管细胞的生理和病理过程。例如,我们前期研究发现ILK参与调解血管平滑肌细胞的增殖和迁移[5];另有研究报道,ILK修饰的骨髓间充质干细胞(mesenchymal stem cells,MSCs)能改善梗死后大鼠心功能[6],提示ILK可能参与了MSCs移植诱导的心脏修复过程。c-Kit是干细胞表面的重要标志,心脏c-Kit+细胞主要来源于心脏,具有分化为多种心脏细胞类型的能力,比MSCs具有更强的心肌分化性和修复力,具有更好的治疗效果[7],因而在心脏c-Kit+细胞中过表达ILK可能成为提高其细胞移植治疗效果的手段之一。本研究探讨过表达ILK对心脏c-Kit+细胞存活和增殖的影响,进而观察经ILK修饰的心脏c-Kit+细胞移植对急性心肌梗死大鼠心功能的作用,以期为治疗缺血性心肌病提供更佳的手段和方法。
材料和方法
1动物
SPF级8周龄雄性SD大鼠,体重约280~350 g,以及新生SD大鼠均购自河北医科大学动物中心,许可证号为SCXK(冀)-1-003。
2主要试剂
II 型胶原酶和胰蛋白酶购自Gibco; IMDM和DMEM/Ham F-12培养基购自Invitrogen;兔抗鼠ILK多抗、小鼠抗大鼠c-Kit、β-actin和GAPDH单抗购自Santa Cruz;小鼠抗大鼠cyclin D1和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单抗购自Cell Signaling Technology;CCK-8试剂盒购自Dojindo;含人ILKcDNA全长的腺病毒载体(Ad-ILK)及对照空载体(Ad-null)购自北京诺赛公司;实验所用其它试剂和材料均购自Sigma。
3主要方法
3.1大鼠心脏c-Kit+细胞分离、纯化、扩增培养及腺病毒感染 根据文献报道[8],新生SD大鼠无菌操作下取出整个心脏,剪成1~2 mm3小块,PBS液冲洗。加入0.2%胰酶和0.1% II 型胶原酶,37 ℃消化5 min,重复3次。弃掉消化液,剩余组织块用完全移植物培养液(包括IMDM、10% FBS、1×105U/L青霉素、100 mg/L链霉素、2 mmol/L谷氨酰胺和0.1 mmol/L β-巯基乙醇)清洗2次后移入培养瓶培养。1周后,可看到组织块周围成纤维细胞层上出现小、圆、亮的细胞,按照快速消化洗脱法[9],用含0.53 mmol/L EDTA 和0.5 g/L 胰酶的PBS室温冲洗2遍收集脱落的细胞,以1×108/L的密度接种于培养瓶,用含35% IMDM/65% DMEM/Ham F-12的混合培养液(包含15% FBS、0.1 mmol/L β-巯基乙醇、10 μg/L EGF和20 μg/L bFGF)继续培养。流式细胞术分析c-Kit阳性率用于鉴定心脏c-Kit+细胞。心脏c-Kit+细胞生长至80%汇合度时,更换无血清培养基,按感染复数值200加入Ad-ILK或Ad-null,37 ℃孵育2 h,加入新鲜的培养基,继续培养48 h后流式细胞术再次分析c-Kit阳性率后,用于下列各实验。
3.2细胞计数仪及CCK-8法检测心脏c-Kit+细胞增殖 将心脏c-Kit+细胞以1×105/L密度接种于12孔板,生长到80%汇合度后,感染Ad-ILK或者Ad-null,感染后48 h,更换无血清培养基,继续培养48 h。0.25%胰酶消化Ad-ILK感染的心脏c-Kit+细胞、Ad-null感染的心脏c-Kit+细胞和未感染的心脏c-Kit+细胞(control),获得细胞悬液,按照说明书,3组细胞各取10 μL与10 μL台盼蓝混合均匀,将10 μL经过染色的样品加入到CountessTM细胞计数池玻片上,插入CountessTM自动细胞计数仪(Invitrogen)进行活细胞计数,实验重复3次。
心脏c-Kit+细胞以每孔2×103个接种于96 孔板,生长到80%汇合度后,感染Ad-ILK或者Ad-null。于感染前(0 h)和感染后24 h、48 h,按照CCK-8试剂盒说明书,加入含CCK-8的等体积培养基,在450 nm波长检测Ad-ILK感染的心脏c-Kit+细胞、Ad-null感染的心脏c-Kit+细胞和未感染的心脏c-Kit+细胞3组样品的吸光度,计算细胞活力,实验重复3次。
3.3大鼠心肌梗死模型的制备及分组 将40只大鼠按随机数字表法分为假手术组(sham组)、心梗+生理盐水注射组(MI组)、心梗+Ad-null感染的心脏c-Kit+细胞注射组(Ad-null-c-Kit+cell组)和心梗+Ad-ILK感染的心脏c-Kit+细胞注射组(ILK-c-Kit+cell组),每组10只。采用冠状动脉左前降支结扎法建立心肌梗死模型[9]。模型成功15 min后,直视下分3点在心肌梗死区及其梗死边缘区注射30 μL Ad-null感染的心脏c-Kit+细胞、Ad-ILK感染的心脏c-Kit+细胞(每30 μL 1×105个细胞)或生理盐水,心肌梗死区注射1次(10 μL),梗死边缘区分2次注射(每次10 μL)。术后给予大鼠常规处理。假手术组不结扎左冠状动脉也不注射。心肌梗死诊断标准为心电图示2个以上肢体导联或胸导联ST段弓背向上抬高。
3.4Western blot法检测心脏c-Kit+细胞中增殖相关基因及心肌组织中ILK的蛋白表达 分别提取细胞和心肌组织中的总蛋白,腺病毒感染48 h后,用RIPA裂解液分别提取Ad-ILK感染的心脏c-Kit+细胞、Ad-null感染的心脏c-Kit+细胞和未感染的心脏c-Kit+细胞3组细胞的总蛋白;行大鼠心肌梗死模型术后4周,处死大鼠,迅速取出心脏,0 ℃生理盐水清洗干净,沿室壁分离左右心室,每组收集3只大鼠的梗死区及梗死边缘区心肌组织。各组取等量蛋白(50 μg)行SDS-聚丙烯酰胺凝胶电泳,电转至PVDF膜,5% BSA室温封闭2 h后,分别加入抗cyclin D1、PCNA或ILK 的I 抗,4 ℃过夜,TBST洗涤3次,每次10 min,加入辣根过氧化物酶标记的 II 抗,室温孵育2 h,TBST洗涤3次,每次10 min,ECL显影。以GAPDH或β-actin为内参照。用Quantity One软件对Western blot条带进行灰度分析。
3.5免疫组化法检测大鼠心肌组织中c-Kit的蛋白表达 移植后2周,处死大鼠,迅速取出心脏,0 ℃生理盐水清洗干净,沿室壁分离左右心室,每组收集3只大鼠的梗死区及梗死边缘区心肌组织,置于4%多聚甲醛中固定,常规制作组织切片,脱蜡至水,用3% H2O2室温孵育10 min,PBS洗3次;给予1% Triton X-100通透20 min,PBS洗3次;之后滴加10 %正常羊血清室温封闭20 min;滴加 I 抗c-Kit(1∶100),4 ℃过夜,PBS洗3次;滴加 II 抗,室温2 h,PBS洗3次;镜下DAB显色,苏木精复染,常规脱水、干燥、透明和封片。显微镜下观察阳性表达的棕黄色颗粒,Image-Pro Plus 6.0软件图像分析系统进行累积吸光度测定。
3.6左心室功能的测定 术后4周,腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉大鼠,沿颈部正中切开,游离右颈总动脉,按常规方法将20 G导管插入左心室,另一端接上4道生理记录仪,记录大鼠最大左室收缩压(left ventricular systolic pressure,LVSP)、最大左室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室内压最大上升速率(+dp/dtmax)和左室内压最大下降速率(-dp/dtmax)。撤回导管至右颈总动脉,测量平均动脉压(mean arterial pressure,MAP),所有数据连续测量3次,每次间隔3 min。
4统计学处理
用SPSS 13.0软件进行数据分析。数据均采用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,组间两两比较采用 Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1心脏c-Kit+细胞的培养、鉴定及感染后ILK的表达
组织块培养1周后在梭形成纤维细胞层上出现小、圆、亮的细胞,折光度高,圆球状,核不可见, 呈团簇样集落生长。应用快速消化洗脱法收集细胞可获得较纯的心脏c-Kit+细胞,此时,大部分心脏c-Kit+细胞仍为球形,少量细胞向外伸展而形成梭形、 多边形或不规则异形等形状。流式细胞仪分析c-Kit阳性率可达到(85.68±7.34)%。Ad-ILK感染心脏c-Kit+细胞48 h后,c-Kit阳性率仍可达到(80.23±5.65)%,Western blot实验结果表明Ad-ILK感染后ILK表达明显增加,说明ILK得到有效表达,见图1。
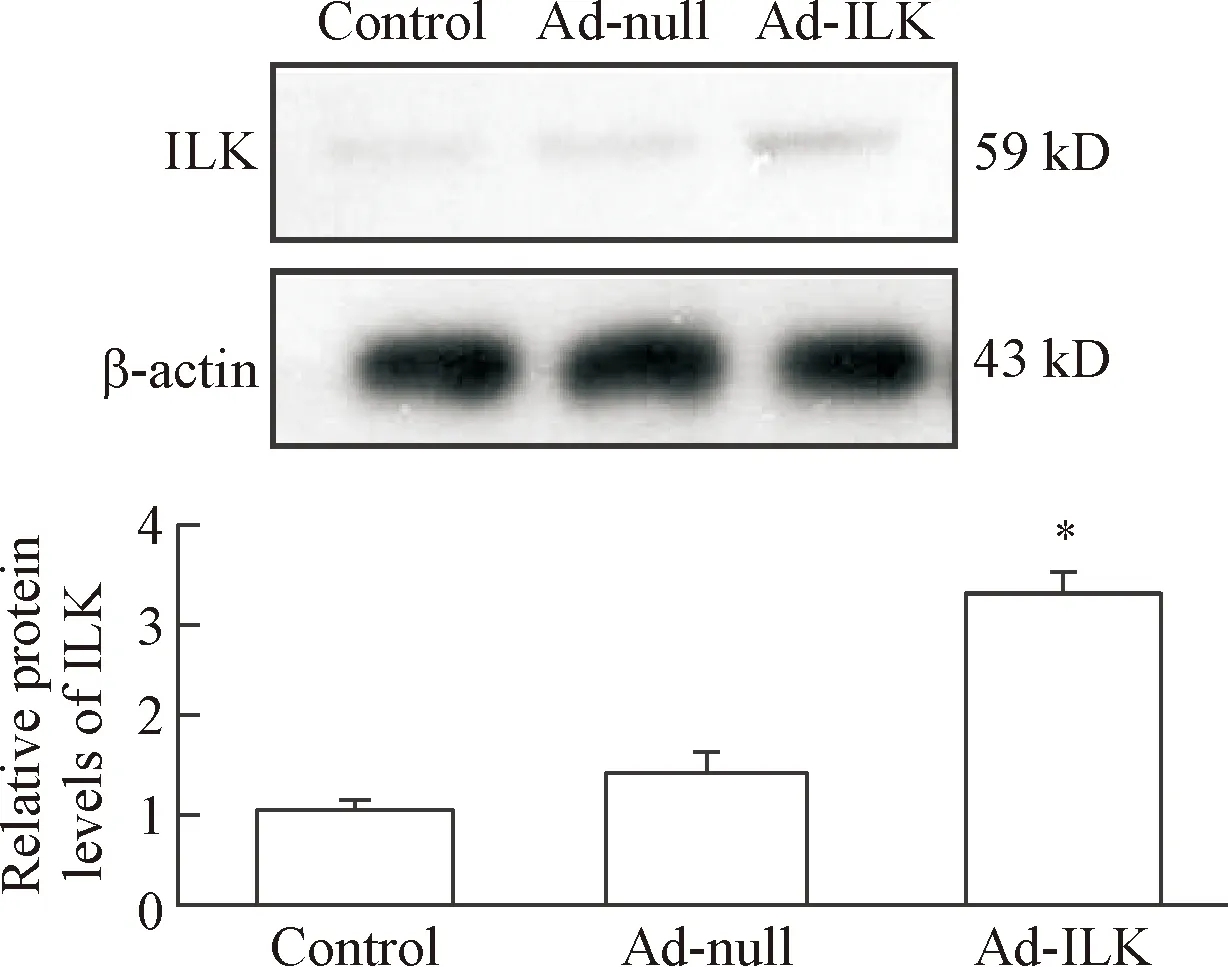
Figure 1. The protein expression of integrin-linked kinase (ILK) in the cardiac c-Kit positive cells determined by Wes-tern blot. Means±SD.n=3.*P<0.05vsAd-null.
图1心脏c-Kit+细胞中ILK的蛋白表达
2过表达ILK促进了心脏c-Kit+细胞的活力和增殖
细胞计数结果显示,过表达ILK后心脏c-Kit+细胞的活力与Ad-null感染的心脏c-Kit+细胞相比明显增加(P<0.05)。与对照组比较,Ad-null感染的心脏c-Kit+细胞的活力没有明显改变,见图2。这提示在血清饥饿条件下,ILK可以提高心脏c-Kit+细胞的存活能力。
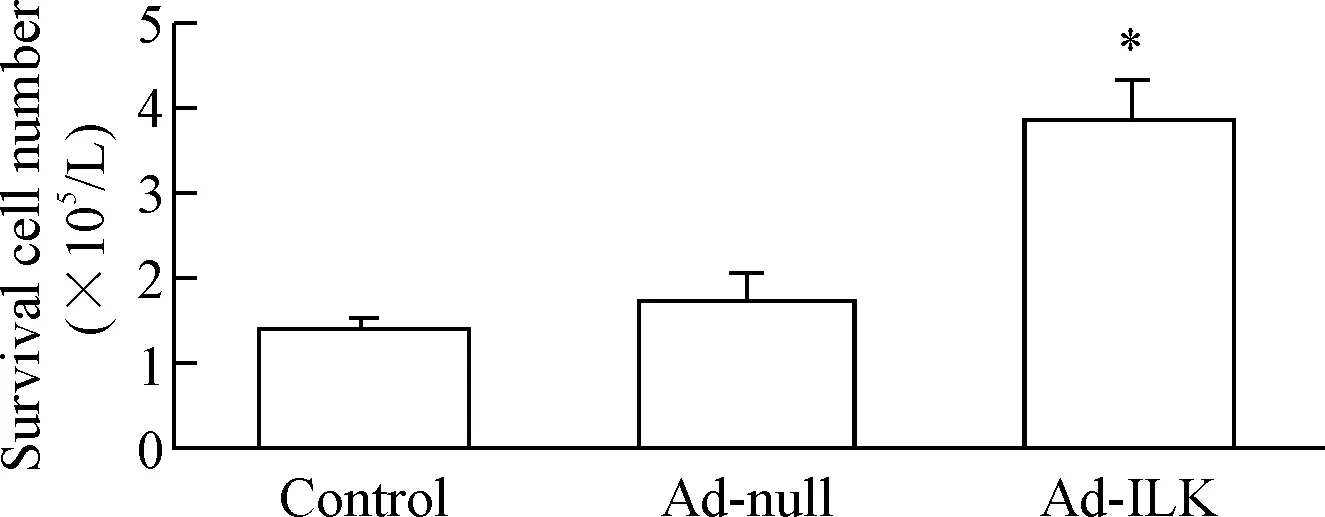
Figure 2. Cell counting results of cardiac c-Kit+cells. The number of survival cardiac c-Kit+cells was identified by cell counting after ILK overexpression for 48 h followed by serum starvation for another 48 h. Mean±SD.n=3.*P<0.05vsAd-null.
图2细胞计数仪测定过表达ILK对心脏c-Kit+细胞增殖的影响
细胞计数结果显示,过表达ILK后c-Kit+活细胞数为(4.80±0.53)×105/L,与Ad-null感染的心脏c-Kit+细胞相比明显增加(P<0.05)。CCK-8实验检测结果显示,感染ILK 48 h后,c-Kit+细胞的吸光度明显升高(P<0.05),而Ad-null感染的心脏c-Kit+细胞的吸光度与对照组相比没有明显改变,见图3。两种实验结果共同提示,过表达ILK可以促进心脏c-Kit+细胞的增殖。
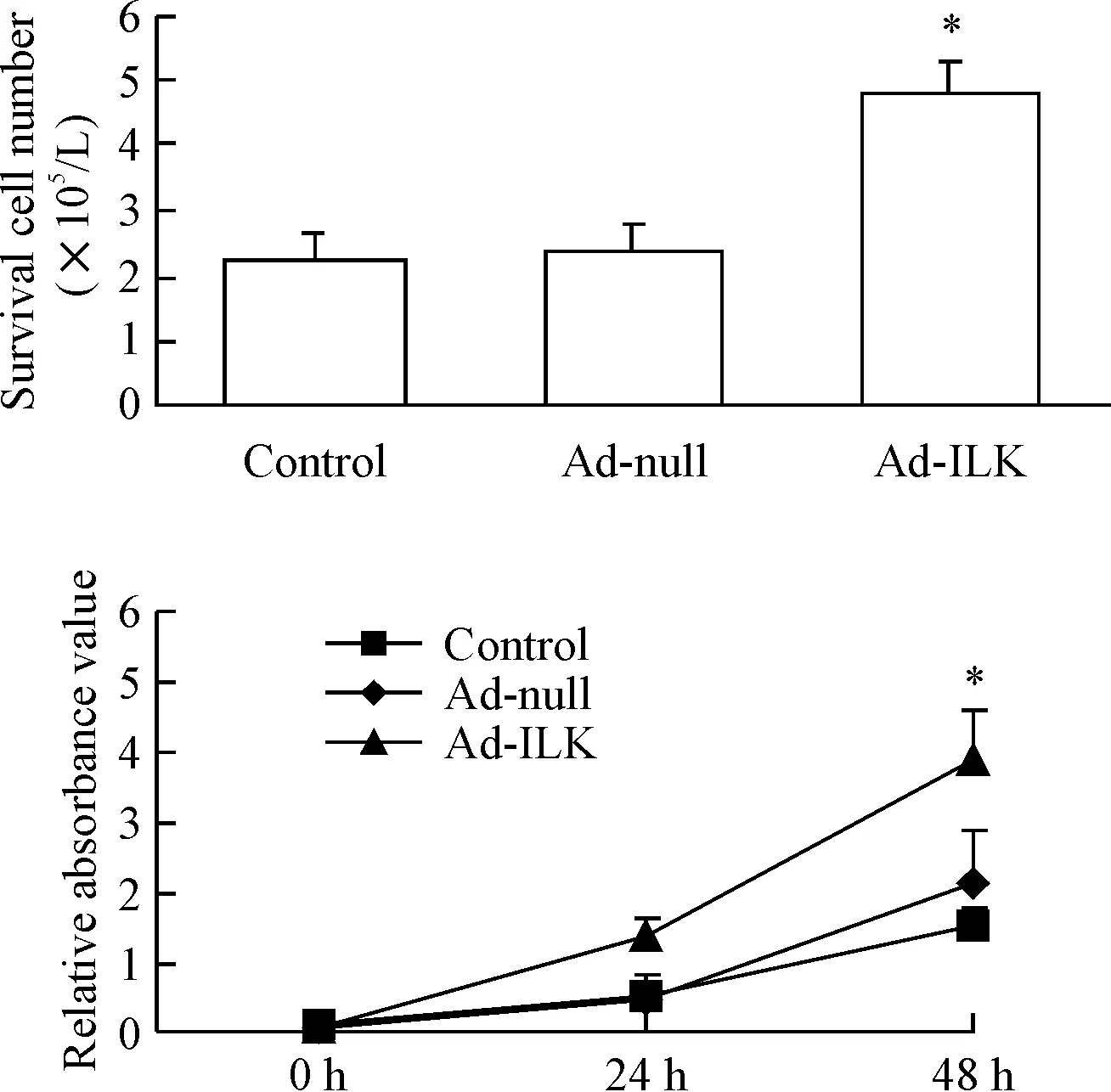
Figure 3. The proliferation of cardiac c-Kit+cells. A: the number of survival cardiac c-Kit+cells was identified by cell counting after 48 h of ILK overexpression; B: the viability of cardiac c-Kit+cells measured by CCK-8 assay. Means±SD.n=3.*P<0.05vsAd-null.
图3细胞计数术和CCK-8法测定过表达ILK对心脏c-Kit+细胞增殖的影响
3过表达ILK促进了心脏c-Kit+细胞中cyclinD1和PCNA的表达
Western blot实验结果显示,感染ILK 48 h后,心脏c-Kit+细胞中cyclin D1和PCNA表达明显增加(P<0.05),提示过表达ILK通过提高增殖相关蛋白cyclin D1和PCNA的表达促进了心脏c-Kit+细胞的增殖,见图4。

Figure 4. The protein expression of cyclin D1 and proliferating cell nuclear antigen (PCNA) in the cardiac c-Kit+cells determined by Western blot. Means±SD.n=3.*P<0.05vsAd-null.
图4心脏c-Kit+细胞中cyclinD1和PCNA的蛋白表达
4过表达ILK的心脏c-Kit+细胞移植增加了MI后心肌组织中c-Kit的表达
免疫组化结果显示,细胞移植2周后,ILK-c-Kit+cell组心肌组织中c-Kit表达明显增加(P<0.05),提示注射ILK过表达的心脏c-Kit+细胞能使MI后的心肌组织中保留更多的c-Kit+的干细胞,见图5。

Figure 5. Immunohistochemical results of c-Kit in the hearts of MI rats. The brown color represents a positive result. Means±SD.n=3.*P<0.05vsAd-null-c-Kit+cell.
图5免疫组化检测MI大鼠心肌组织中c-Kit的表达
5心功能测定结果
细胞移植4周后,Western blot实验结果显示,ILK蛋白表达在ILK-c-Kit+cell组仍显著高于Ad-null-c-Kit+cell组(P<0.05),间接说明此时仍有较多的ILK-c-Kit+细胞存活,见图6。用生理记录仪记录大鼠LVSP、LVEDP、+dp/dtmax、-dp/dtmax和MAP,其结果显示,ILK-c-Kit+cell组和Ad-null-c-Kit+cell组的LVSP、+dp/dtmax、 -dp/dtmax和MAP较MI组都显著增加(P<0.05),而LVEDP明显降低,ILK-c-Kit+cell组较Ad-null-c-Kit+cell组改变更明显(P<0.05),见表1。
讨 论
干细胞是指一类具有自我更新和多向分化潜能的细胞,能自我复制,并且在一定条件下能分化成具有特定功能的体细胞。以前的观点认为成熟哺乳动物的心脏是一个没有再生能力的终末分化器官,但随着研究的进展,已发现心脏中存在可增殖并且能够进行分化的细胞,即c-Kit+心肌干细胞[10]。心肌梗死后氧化应激反应及炎症反应增加,使梗死区心肌组织处于缺血缺氧的环境中,导致心肌细胞大量死亡。通过c-Kit+的心肌干细胞移植代替死亡的心肌细胞可以稳定病损心脏结构,防止心肌重塑,有益于心肌梗死区域的修复及愈合[11]。然而,研究表明心肌梗死后移植的干细胞很快就死亡,其存活和增殖能力都较低,不能达到完全改善心脏功能的作用[12],因此寻找提高心脏干细胞存活和增殖的方法,优化心脏干细胞移植的疗效是干细胞研究领域亟待解决的重要课题。国内外研究发现,应用基因调控的方法预处理干细胞可以起到一定的作用。例如,糖原合成酶激酶3(glycogen synthase kinase 3,GSK-3)过表达的MSCs移植能改善心梗后心功能[13];在MSCs中过表达bcl-2[14]或者livin[15]可抑制细胞凋亡,增加细胞存活,提高了MI的治疗效果。

Figure 6. The protein expression of integrin-linked kinase (ILK) in the hearts of MI rats determined by Western blot. Mean±SD.n=3.*P<0.05vsAd-null-c-Kit+cell.
图6MI大鼠心肌组织中ILK蛋白的表达
ILK是在研究整合素β1结合蛋白的过程中发现的一个多功能蛋白,参与调节细胞的存活,控制细胞形态和生长。在心血管系统,ILK同样发挥重要作用,Ding等[16]发现在心梗后大鼠心肌中注射表达ILK的腺病毒载体能促进血管新生,抑制细胞凋亡,从而改善心功能。本研究应用腺病毒感染的方法在心脏c-Kit+细胞中过表达ILK,细胞计数和CCK-8结果表明,心脏c-Kit+细胞的存活和增殖明显提高,且与增殖相关蛋白cyclin D1和PCNA的高表达有关。细胞实验的结果证实,过表达ILK是一种增加心脏c-Kit+细胞存活和增殖的有效手段。为了进一步验证ILK-c-Kit+细胞治疗心肌梗死的疗效,我们通过结扎冠状动脉左前降支建立大鼠MI模型,15 min后进行细胞移植,移植后4周,ILK-c-Kit+cell组大鼠心功能明显改善,效果要好于感染空载体的心脏c-Kit+细胞组。我们推测心功能的改善可能与增加的ILK-c-Kit+细胞存活和增殖有关,为了验证这一推测,我们调查了移植2周后心脏中c-Kit的表达,免疫组化结果表明,空载体组c-Kit+的细胞数量与MI组相比有所增加,但是没有显著性意义,可能是由于移植的细胞在心梗缺血缺氧环境中存活较少,大部分已经死亡造成的,这与其它相关报道一致[17]。而ILK-c-Kit+cell组大鼠中c-Kit+的细胞数量明显高于MI组和空载体组。虽然心脏c-Kit+细胞增加的原因有可能是细胞移植动员了组织中或循环系统中原有的心脏祖细胞(cardiac progenitor cells,CPCs)迁移到梗死区,但是结合本研究体外实验的结果,我们认为增加的c-Kit+细胞至少部分来源于移植的ILK-c-Kit+细胞;另外,移植4周时心肌组织中仍有较高的ILK表达,这都提示ILK过表达增加了心脏c-Kit+细胞在心脏的存活和后续的增殖,当然其具体作用机制和安全性仍需进一步研究,但这不失为一种提高移植后心脏c-Kit+细胞存活和增殖,并进一步提高治疗效果的手段。

表1 移植后4周各组大鼠心功能血流动力学测定
LVEDP: left ventricular end-diastolic pressure; LVSP: left ventricular systolic pressure; +dp/dtmax: maximal increase rate of left ventricular pressure; -dp/dtmax: maximal decrease rate of left ventricular pressure; MAP: mean arterial pressure.△P<0.05vssham;*P<0.05vsMI;#P<0.05vsAd-null-c-Kit+cell.
总之,过表达ILK可提高心脏c-Kit+细胞的存活和增殖,移植过表达ILK的心脏c-Kit+细胞能够更好地改善左心室功能,为优化心脏c-Kit阳性干细胞移植治疗提供了一个可行的方法。
[1] van den Borne SW, Diez J, Blankesteijn WM, et al. Myocardial remodeling after infarction: the role of myofibroblasts[J]. Nat Rev Cardiol, 2010, 7(1):30-37.
[2] Hansson E, Lindsay ME, Chien KR. Regeneration next: toward heart stem cell therapeutics[J]. Cell Stem Cell, 2009, 5(4):364-377.
[3] Kamdar F, Jameel MN, Score P, et al. Cellular therapy promotes endogenous stem cell repair [J]. Can J Physiol Pharmacol, 2012, 90 (10):1335-1344.
[4] Dimmeler S, Zeiher AM. Cell therapy of acute myocardial infarction: open questions[J]. Cardiology, 2009, 113(3):155-160.
[5] Li JJ, Han M, Wen JK, et al. Osteopontin stimulates vascular smooth muscle cell migration by inducing FAK phosphorylation and ILK dephosphorylation[J]. Biochem Biophys Res Commun, 2007, 356(1):13-19.
[6] 王 林, 童随阳, 刘浙波, 等. 整合素连接激酶修饰的骨髓间充质干细胞改善大鼠梗死后心脏心功能[J]. 武汉大学学报: 医学版, 2016, 37(2):173-176.
[7] Oskouei BN, Lamirault G, Joseph C, et al. Increased potency of cardiac stem cells compared with bone marrow mesenchymal stem cells in cardiac repair[J]. Stem Cells Translat Med, 2012, 1(2):116-124.
[8] Messina E, Angelis LD, Frati G, et al. Isolation and expansion of adult cardiac stem cells from human and murine heart[J]. Circ Res, 2004, 95(95):911-921.
[9] Liu Y, Wang J, Qi SY, et al. Reduced endoplasmic reti-culum stress might alter the course of heart failure via caspase-12 and JNK pathways[J]. Can J Cardiol, 2014, 30(3):368-375.
[10] 黄尧垚, 汤成春. 心脏自身干细胞的研究进展[J]. 中国组织工程研究与临床康复, 2010, 14(19):3560-3564.
[11] Chugh AR, Beache GM, Loughran JH, et al. Administration of cardiac stem cells in patients with ischemic cardiomyopathy: the SCIPIO trial: surgical aspects and interim analysis of myocardial function and viability by magnetic resonance[J]. Circulation, 2012, 126(11 suppl 1): S54-S64.
[12] Fisher SA, Doree C, Brunskill SJ, et al. Bone marrow stem cell treatment for ischemic heart disease in patients with no option of revascularization: a systematic review and meta-analysis [J]. PLoS One, 2013, 8(6):e64669.
[13] Cho J, Zhai PY, Maejima Y, et al. Myocardial injection with GSK-3-overexpressing bone marrow-derived mesenchymal stem cells attenuates cardiac dysfunction after myocardial infarction[J]. Circ Res, 2011, 108(4):478-489.
[14] 高 青, 李树人, 荀丽颖, 等. 经bcl-2基因修饰的骨髓间充质干细胞移植对缺血性心功能不全兔心功能及血管新生的影响[J]. 中国病理生理杂志, 2015, 31(4):640-646.
[15] 邹 兵, 谢军平, 吴清华, 等.Livin基因修饰的骨髓间充质干细胞移植治疗对急性心肌梗死大鼠心功能的影响[J]. 中国病理生理杂志, 2016, 32(3): 539-543.
[16] Ding L, Dong L, Chen X, et al. Increased expression of integrin-linked kinase attenuates left ventricular remodeling and improves cardiac function after myocardial infarction [J]. Circulation, 2009, 120(9):764-773.
[17] Sarkissian SD, Lévesque T, Noiseux N. Optimizing stem cells for cardiac repair: current status and new frontiers in regenerative cardiology[J]. World J Stem Cells, 2017, 9(1):9-25.
(责任编辑: 林白霜, 罗 森)
Overexpression of integrin-linked kinase improves survival and proliferation of cardiac c-Kit+cells
LI Jing-jing1,2, LIU Yu1, ZHAO Juan2, LI Ai-ying3, WANG Dong-mei1
(1Department of Cardiology, Bethune International Peace Hospital of People’s Liberation Army,2Department of Cell Biology, School of Basic Medicine, Hebei Medical University,3Department of Biochemistry and Biology, Hebei Traditional Chinese Medicine College, Shijiazhuang 050082, China. E-mail: wangdm1234@126.com)
AIM: To investigate the effects of integrin-linked kinase (ILK) overexpression on survival and proliferation of cardiac c-Kit+cells, and the role of ILK-overexpressing c-Kit+cell transplantation in cardiac function in a rat myocardial infarction (MI) model.METHODS: Cardiac c-Kit+cells were isolated from the hearts of neonatal Sprague-Dawley (SD) rats and cultured to prepare the ILK-c-Kit+cells by infected with recombinant adenoviral vector harboring human wild-typeILKcDNA. The survival and proliferation of cardiac c-Kit+cells were detected by cell counting and CCK-8 assay at 48 h after infection, respectively. The protein levels of cyclin D1 and proliferating cell nuclear antigen (PCNA) in the cardiac c-Kit+cells were examined by Western blot. MI was induced by coronary artery ligation in 40 adult rats. After 15 min, ILK-c-Kit+cells were transplanted into the hearts by myocardial injection at 3 different sites in the infracted zone and border zone. All rats were randomly divided into 4 groups: sham group, MI plus saline injection group (MI group), MI plus null vector-infected cardiac c-Kit+cell injection group (Ad-null-c-Kit+cell group), and MI plus ILK-overexpressing cardiac c-Kit+cells injection group (ILK-c-Kit+cell group), with 10 rats in each group. At 2 weeks after MI, the protein levels of c-Kit in MI hearts were investigated by immunohistochemical assay. At 4 weeks, left ventricular function was examined by hemodynamic measurement.RESULTS: The survival and proliferation of cardiac c-Kit+cells and the protein levels of cyclin D1 and PCNA were enhanced by ILK overexpression compared with Ad-null group. In MI rat model, the number of c-Kit+cells was increased by ILK-c-Kit+cell injection compared with Ad-null-c-Kit+cell group at 2 weeks after MI. Cardiac function was significantly improved in ILK-c-Kit+cell-transplanted rats.CONCLUSION: ILK overexpression improves survival and proliferation of cardiac c-Kit+cells by increasing the protein levels of cyclin D1 and PCNA. ILK-c-Kit+cell transplantation enhances the therapeutic efficiency of cardiac c-Kit+cells in the post-MI hearts of rats.
Integrin-linked kinase; Cardiac c-Kit+cells; Cell survival; Cell proliferation; Cardiac function; Myocardial infarction
1000- 4718(2017)09- 1537- 07
2017- 01- 17 [
] 2017- 05- 17
国家自然科学基金资助项目(No. 81573698);河北省科技支撑计划重大项目(No. 11276124D);河北省教育厅青年基金资助项目(No. 2011177)
R363.2+1
A
10.3969/j.issn.1000- 4718.2017.09.001
△通讯作者 Tel: 0311-87978777; E-mail: wangdm1234@126.com
