胃肠道间质瘤的内镜下诊疗策略
2017-09-21代震波周德俊
代震波,苏 薇,周德俊
(天津医科大学肿瘤医院,国家肿瘤临床研究中心,天津市肿瘤防治重点实验室,天津,300060)
·综 述·
胃肠道间质瘤的内镜下诊疗策略
代震波,苏 薇,周德俊
(天津医科大学肿瘤医院,国家肿瘤临床研究中心,天津市肿瘤防治重点实验室,天津,300060)
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是胃肠道最常见的间叶组织源性肿瘤,具有潜在恶性。近年随着健康查体意识的提高及内镜检查的普及,GIST的检出率逐年增高,其中体积较小、无明显症状的亚临床病灶(直径<2 cm)检出率明显提高。随着内镜下诊断的发展及微创治疗的应用,对此类GIST诊疗的报道逐渐增多,鉴于其潜在的恶性生物学行为,及早鉴别并选择合理的干预方式成为内镜诊疗的重点。本文现将此类GIST的恶性潜能判断及内镜下诊断、治疗处理原则等结合国内外相关文献作一综述。
胃肠道间质瘤;内窥镜检查;诊断;治疗;综述
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是胃肠道最常见的间叶组织源性肿瘤,常起因于KIT及PDGFRA(血小板源性生长因子受体α)基因突变。随着内镜检查的发展与普及,GIST的检出率逐年增加,目前多数研究报道的GIST发病率为每年10~15人/百万人[1],其中不乏体积较小、无明显临床症状的病灶。2010年NCCN指南中首次将直径<2 cm的GIST定义为“小GIST”[2]。2013年中国胃肠间质瘤诊断治疗共识中首次将直径≤1 cm的GIST定义为“微小GIST”[3]。这类GIST被认为同样具有恶性潜能,而目前内镜下微创手术的发展为其提供了治疗途径,但如何更合理的诊治这类特殊的GIST,成为临床关注的问题。
1 小GIST的恶性潜能
目前认为,局限性GIST的危险度评估应包括原发部位、瘤体大小、核分裂象及肿瘤是否破溃等,其中肿瘤破溃提示与高复发风险相关,但是否作为预后的独立危险因素尚存有争议。早在2002年美国国立卫生署(National Institutes of Health,NIH)提出共识,将肿瘤大小及核分裂象作为评价GIST预后的指标。随着多项回顾性研究的验证与发现,2008年NIH对共识进行了修订,将肿瘤原发部位及肿瘤破裂列入危险度评估指标[4]。目前欧洲及亚洲多国(包括中国)均采用此版评价系统。
2006年Miettinen提出AFIP(Armed Forces Institute of Pathology)风险评估分类,可大致估算出每例患者的复发风险(表1)[5]。《2013版WHO软组织肿瘤分类》及2013版NCCN指南均引入了此评估方法,而我国2013年共识也同时增加了AFIP风险评估作为参考。
表1 原发GIST恶性危险度评价表(AFIP分类)
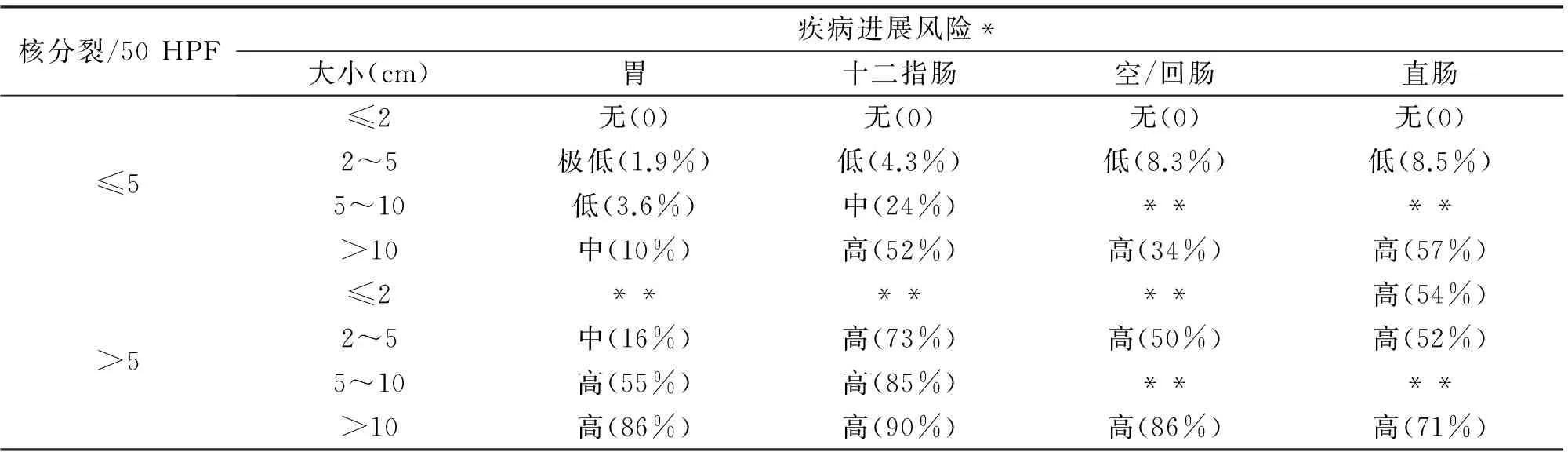
核分裂/50HPF疾病进展风险*大小(cm)胃十二指肠空/回肠直肠≤5≤2无(0)无(0)无(0)无(0)2~5极低(1.9%)低(4.3%)低(8.3%)低(8.5%)5~10低(3.6%)中(24%)****>10中(10%)高(52%)高(34%)高(57%)>5≤2******高(54%)2~5中(16%)高(73%)高(50%)高(52%)5~10高(55%)高(85%)****>10高(86%)高(90%)高(86%)高(71%)
*依据肿瘤相关死亡率与肿瘤转移定义。数据来自1 055例胃GIST、629例小肠GIST、144例十二指肠GIST、111例直肠GIST患者;**此类组及食道、胃肠道外GIST的病例数少,不足以预测恶性潜能。
目前,胃部小GIST的报道病例数较多,普遍认为大多数胃部GIST的生物学行为呈现惰性表现,侵袭性较弱,核分裂≤5/50 HPF的胃小GIST几乎无复发转移风险。但Huang等在对31例胃部小GIST切除患者的随访期间仍发现2例复发、1例肝转移,且该3例患者NIH评估均为极低危[6]。根据目前获得的证据,尚无一类GIST被定义为绝对良性。小肠GIST较胃GIST侵袭性高,而结直肠GIST的生物学行为更具侵袭性,有核分裂能力的肿瘤即使直径<2 cm也可出现复发与转移,因此不论肿瘤大小,核分裂>5/50 HPF即视为高度复发风险,应选择手术切除[7]。高晓东等在对412例小GIST的回顾性分析中发现胃部直径≤0.4 cm的微小GIST通常是良性的,应进行长期随访;直径>0.5 cm的小GIST即存在恶变风险,应选择手术切除;而位于直肠的小GIST(直径≤0.4 cm除外)核非典型性明显高于其他部位,具有较差的生物学行为,应及时手术治疗[8]。鉴于小GIST潜在的恶性生物学行为,部分学者认为针对小GIST的干预处理应采取谨慎态度,甚至早期积极干预。及早鉴别小GIST是否具备恶性潜能,并选择合理的干预方式已成为内镜诊疗的重点。
2 内镜下诊断
小GIST通常无明显临床症状,多由于其他症状或疾病进行内窥镜检查或手术时无意发现。胃肠镜检查的普及,成为发现黏膜下肿瘤(submucosal tumor,SMT)的主要检查手段,而近年超声内镜(endoscopic ultrasonography,EUS)的广泛应用,可根据SMT的声像特点对其性质进行初步诊断,EUS对GIST的诊断准确度较高,通常表现为来源于固有肌层的低回声占位,其恶性征象多表现为:边界不规则,内部强回声或回声不均匀、存在囊腔及溃疡出血等。但多数研究表明,小GIST多为良性病变,少数具有典型恶性征象。由于SMT标本极少通过常规镜下活检获得,使得术前明确诊断较困难。然而,许多术后诊断的评估研究中,GIST似乎是源于固有肌层的上皮下小肿瘤(subepithelial lesions of muscularis propria,MP-SEL)中最常见的诊断[9]。
内镜超声引导下细针穿刺(endoscopic ultrasound-guided fine-needle aspiration,EUS-FNA)是提高活检效率的有效方法。研究发现,EUS-FNA应用于胃SMT病理组织获取时,其结果与术后病理诊断的一致率达95.6%,对潜在恶性病变的判断准确率达94.2%[10]。文献报道[11],采用EUS-FNA获取病理结果对评价GIST的敏感性为78.4%,对于发生在胃部的GIST其诊断敏感性可达84%。但通常EUS-FNA主要应用于无法手术切除或怀疑具有恶性潜能的SMT。2013年日本黏膜下肿瘤诊断治疗指南提出,对于直径2~5 cm及<2 cm但可疑恶性的GIST,应采用EUS-FNA检查[12]。但对于直径<2 cm的小肿瘤,尤其直径<1 cm的微小肿瘤组织学样本,EUS-FNA获取困难且风险较高。此外,EUS-FNA虽为明确GIST诊断提供可能,但由于组织获取有限常常不足以提供能判断GIST恶性潜能的生物学信息,目前我国共识中对于可手术完整切除的GIST不推荐常规进行术前活检或穿刺。
Kamata等[13]将造影增强超声内镜(contrast enhanced EUS,CH-EUS)用于GIST诊断,提示镜下GIST血流灌注信号较周围正常组织增强,且存在不规则血管对灌注图像造成的异质增强;而<2 cm的病变中,血流灌注信号的增强是提示诊断GIST更为敏感的指标。CH-EUS显示肿瘤内畸形血管的存在可提示肿瘤切除前较高的恶性潜能[14-15]。
3 内镜下监测与治疗
针对<2 cm的GIST,2010年NCCN指南及2013年我国共识中均给出了相应的处理意见。局限的小GIST,如有症状,则应手术切除;胃部的无症状GIST,经EUS风险评估(不良因素包括不规则边界、囊性间隙、溃疡、回声灶、内部异质性),如存在不良因素,应予以切除;如无不良因素,可间隔6~12个月通过复查EUS进行严密随访。而位于小肠及结直肠的GIST,多呈现较高恶性度,建议及早手术切除,尤其直肠部位的GIST,如发生进展,可能减少保留肛门的机会。2014年欧洲医学肿瘤学会基于回顾性研究提出,组织学诊断的小GIST均应行手术切除,因为尽管此类GIST被归类于低风险,但在罕见情况下也可发生转移[16]。
对于EUS下拟诊断为GIST的胃部MP-SEL,被认为可通过EUS进行保守监测。一项回顾性分析中,28例保守观察的小型胃MP-SEL患者(EUS下75%的病例肿瘤<20 mm),平均随访48.5个月后未出现肿瘤相关的死亡与疾病进展;此外,在符合EUS监测的患者中,未发现肿瘤大小的显著变化及EUS下不良因素[17]。Imaoka等对132例胃上皮下小肿瘤进行5年的内镜下监测,发现仅2例出现病灶增大,手术切除后被诊断为GIST,但1例患者切除后出现肝转移[18]。Kim等研究了948例≤30 mm的胃上皮下小肿瘤患者,发现84例(8.5%)在平均随访24个月后出现显著的肿瘤大小变化和/或EUS回声形态变化。其中25例行手术/内镜切除术,19例被诊断为GIST,3例被认为是高风险,4例为中风险,10例为低风险,2例为极低风险;10~30 mm的肿瘤增长速度较<10 mm的肿瘤快得多[19]。相关研究也体现出内镜保守监测存在低估肿瘤进展风险的可能。
目前对于切除小GIST的主要手术方式国内外并无统一标准。随着内镜微创治疗技术的发展,经验丰富的内镜中心将内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)等技术应用于胃部小GIST的切除。多项研究表明,ESD对直径<5 cm、边界清晰、包膜完整的病灶是安全、有效的治疗方式[20-22]。但由于GIST多来源于黏膜下固有肌层,且与周围肌层组织关系密切,内镜下根治性切除具有一定难度,且完整剥离更容易导致出血、穿孔等并发症,因此,术前对患者进行全面的评估筛选是ESD成功应用的重要前提。
Hiki等引入腹腔镜联合内镜手术(laparoscopic and endoscopic cooperative surgery,LECS)在不过度切除胃的情况下进行黏膜下肿瘤切除[23]。Balde等将LECS与ESD进行比较,切除直径<2 cm的小GIST时,LECS与ESD治疗效果相当,但LECS组术中并发症发生率显著低于ESD组,认为小GIST的切除,LECS是ESD的安全替代方案[24]。日本一项多中心回顾性研究中,LECS被证明是安全可行的胃切除手术,其手术时间及并发症发生率合理,出血量少[25]。
内镜下全层切除术(endoscopic full-thickness resection,EFTR)为有效切除来源于固有肌层的肿瘤提供了新的技术支持,2010年我国学者首次在国际上报道了无腔镜辅助的内镜下全层切除胃固有肌层肿瘤。有研究比较了EFTR与腹腔镜辅助手术(laparoscopic-assisted surgery,LAC)切除小GIST的临床疗效、安全性及可行性,结果显示EFTR较LAC具有较低的并发症发生率,利于完整足量的获取肿瘤组织用于组织学诊断,认为EFTR可能是更安全有效的内镜下微创切除GIST的治疗方式,并且对于直径<2 cm的肿瘤可取代LAC[26]。
随着对内镜下治疗技术的不断探索与改进,多种微创手术已体现出了与外科手术相同的治疗效果,创伤小、康复快等优势使其成为治疗的选择趋势。但国内外学界对于GIST内镜下治疗的疗效及安全性一直争议不断,且缺乏中长期相关统计数据,因此目前相关指南及共识中并未对内镜下治疗作出常规推荐。
4 结 语
综上所述,小GIST仍存在潜在恶性,偶有转移行为发生,因此有的学者建议手术切除小肿瘤[27-28];而另一些学者认为,经风险评估为极低恶性潜能的肿瘤不应承担高昂的治疗成本与相应的手术风险[29]。但目前尚缺少明确的临床处置规范及指南,内镜下治疗需综合考虑手术的彻底性与安全性。对于小GIST仍需谨慎鉴别恶性潜能后选择合适的个体化治疗策略。
[1] Sφreide K,Sandvik OM,Sφreide JA,et al.Global epidemiology of gastrointestinal stromal tumours (GIST):A systematic review of population-based cohort studies[J].Cancer Epidemiol,2016,40:39-46.
[2] Demetri GD,von Mehren M,Antonescu CR,et al.NCCN Task Force report:update on the management of patients with gastrointestinal stromal tumors[J].J Natl Compr Canc Netw,2010,8 Suppl 2:S1-41.
[3] CSCO胃肠间质瘤专家委员会.中国胃肠间质瘤诊断治疗共识(2013年版)[S].临床肿瘤学杂志,2013,18(11):1030-1036.
[4] Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Hum Pathol,2008,39(10):1411-1419.
[5] Miettinen M,Lasota J.Gastrointestinal stromal tumors: pathology and prognosis at different sites[J].Semin Diagn Pathol,2006,23(2):70-83.
[6] Huang Z,Li Y,Zhao H,et al.Prognositic factors and clinicopathologic characteristics of small gastrointestinal stromal tumor of the stomach:a retrospective analysis of 31 cases in one center[J].Cancer Biol Med,2013,10(3):165-168.
[7] ESMO/European Sarcoma Network Working Group.Gastrointestinal stromal tumors:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[S].Ann Oncol,2012,23 Suppl 7:vii49-55.
[8] 高晓东,薛安慰,方勇,等.小胃肠间质瘤的临床病理特征[J].中华胃肠外科杂志,2015,18(4):338-341.
[9] Yegin EG,Duman DG.Small EUS-suspected gastrointestinal stromal tumors of the stomach:An overview for the current state of management[J].Endosc Ultrasound,2016,5(2):69-77.
[10] Mekky MA,Yamao K,Sawaki A,et al.Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors[J].Gastrointest Endosc,2010,71(6):913-919.
[11] Sepe PS,Moparty B,Pitman MB,et al.EUS-guided FNA for the diagnosis of GI stromal cell tumors:sensitivity and cytologic yield[J].Gastrointest Endosc,2009,70(2):254-261.
[12] Nishida T,Kawai N,Yamaguchi S,et al.Submucosal tumors:comprehensive guide for the diagnosis and therapy of gastrointestinal submucosal tumors[J].Dig Endosc,2013,25(5):479-489.
[13] Kamata K,Takenaka M,Kitano M,et al.Contrast-enhanced harmonic endoscopic ultrasonography for differential diagnosis of submucosal tumors of the upper gastrointestinal tract[J].J Gastroenterol Hepatol,2017 Feb 21.[Epub ahead of print]
[14] Zhao Y,Qian L,Li P,et al.The diagnostic value of endoscopic ultrasonography and contrast-enhanced harmonic endoscopic ultrasonography in gastrointestinal stromal tumors[J].Endosc Ultrasound,2016,5(2):111-117.
[15] Yamashita Y,Kato J,Ueda K,et al.Contrast-enhanced endoscopic ultrasonography can predict a higher malignant potential of gastrointestinal stromal tumors by visualizing large newly formed vessels[J].J Clin Ultrasound,2015,43(2):89-97.
[16] Cho JW,Korean ESD Study Group.Current Guidelines in the Management of Upper Gastrointestinal Subepithelial Tumors[J].Clin Endosc,2016,49(3):235-240.
[17] Yegin EG,Kani T,Banzragch M,et al.Survival in patients with hypoechoic muscularis propria lesions suggestive of gastrointestinal stromal tumors in gastric wall[J].Acta Gastroenterol Belg,2015,78(1):12-17.
[18] Imaoka H,Sawaki A,Mizuno N,et al.Incidence and Clinical Course of Submucosal Lesions of the Stomach[J].Gastrointest Endosc,2005,61(5):AB167.
[19] Kim MY,Jung HY,Choi KD,et al.Natural history of asymptomatic small gastric subepithelial tumors[J].J Clin Gastroenterol,2011,45(4):330-336.
[20] Catalano F,Rodella L,Lombardo F,et al.Endoscopic submucosal dissection in the treatment of gastric submucosal tumors:results from a retrospective cohort study[J].Gastric Cancer,2013,16(4):563-570.
[21] Yu C,Liao G,Fan C,et al.Long-term outcomes of endoscopic resection of gastric GISTs[J].Surg Endosc,2017 Apr 19.[Epub ahead of print]
[22] He Z,Sun C,Zheng Z,et al.Endoscopic submucosal dissection of large gastrointestinal stromal tumors in the esophagus and stomach[J].J Gastroenterol Hepatol,2013,28(2):262-267.
[23] Hiki N,Yamamoto Y,Fukunaga T,et al.Laparoscopic and endoscopic cooperative surgery for gastrointestinal stromal tumor dissection[J].Surg Endosc,2008,22(7):1729-1735.
[24] Balde AI,Chen T,Hu Y,et al.Safety analysis of laparoscopic endoscopic cooperative surgery versus endoscopic submucosal dissection for selected gastric gastrointestinal stromal tumors:a propensity score-matched study[J].Surg Endosc,2017,31(2):843-851.
[25] Matsuda T,Nunobe S,Kosuga T,et al.Laparoscopic and luminal endoscopic cooperative surgery can be a standard treatment for submucosal tumors of the stomach:a retrospective multicenter study[J].Endoscopy,2017,49(5):476-483.
[26] Wang H,Feng X,Ye S,et al.A comparison of the efficacy and safety of endoscopic full-thickness resection and laparoscopic-assisted surgery for small gastrointestinal stromal tumors[J].Surg Endosc,2016,30(8):3357-3361.
[27] Joensuu H,Fletcher C,Dimitrijevic S,et al.Management of malignant gastrointestinal stromal tumours[J].Lancet Oncol,2002,3(11):655-664.
[28] Akahoshi K,Sumida Y,Matsui N,et al.Preoperative diagnosis of gastrointestinal stromal tumor by endoscopic ultrasound-guided fine needle aspiration[J].World J Gastroenterol,2007,13(14):2077-2082.
[29] Lok KH,Lai L,Yiu HL,et al.Endosonographic surveillance of small gastrointestinal tumors originating from muscularis propria[J].J Gastrointestin Liver Dis,2009,18(2):177-180.
1009-6612(2017)08-0631-04
10.13499/j.cnki.fqjwkzz.2017.08.631
周德俊,E-mail:tjzlyynjzdj@163.com
R735
:A
2017-06-08)
