胰腺神经内分泌肿瘤的腹腔镜治疗分析
2017-09-21杨志英谭海东刘立国孙永亮刘笑雷周文颖
司 爽,杨志英,谭海东,刘立国,孙永亮,徐 力,刘笑雷,周文颖,黄 笳
(中日友好医院,北京,100029)
·论 著·
胰腺神经内分泌肿瘤的腹腔镜治疗分析
司 爽,杨志英,谭海东,刘立国,孙永亮,徐 力,刘笑雷,周文颖,黄 笳
(中日友好医院,北京,100029)
目的:探讨胰腺神经内分泌肿瘤的腹腔镜治疗方法及效果。方法:2014年6月至2017年6月采用完全腹腔镜手术治疗胰腺神经内分泌肿瘤5例,其中男3例,女2例,患者32~62岁。无功能胰腺神经内分泌肿瘤3例,2例表现为腹部不适,1例无症状;功能性胰腺神经内分泌肿瘤2例,均为胰岛素瘤,表现为反复发作的低血糖症状。病程1周~5年。结果:5例均成功施行完全腹腔镜胰腺神经内分泌肿瘤切除术,术后经病理证实符合胰腺神经内分泌肿瘤。手术时间65~420 min,出血量50(20,700) ml,输血1例。术后平均住院(6.4±2.3) d。术后胰腺生化瘘2例,经保守治疗后痊愈。无术后出血、腹腔感染等严重并发症发生。结论:腹腔镜手术治疗无功能性胰腺神经内分泌肿瘤具有创伤小、康复快的优点,是安全、有效的治疗方法。对于功能性胰腺神经内分泌肿瘤,在术前、术中精准定位的基础上,也可选择腹腔镜手术治疗。
胰腺肿瘤;神经内分泌瘤;腹腔镜检查
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)占原发性胰腺肿瘤的3%[1],根据患者的临床症状、肿瘤的激素分泌情况,可分为功能性、无功能性胰腺神经内分泌肿瘤两类。功能性pNENs约占pNENs的20%,其中最常见的为胰岛素瘤。随着腹腔镜手术技术的不断进步,越来越多的pNENs可选择腹腔镜手术治疗[2]。2014年6月至2017年6月我院采用腹腔镜手术治疗不同类型的pNENs 5例,现将体会报道如下。
1 资料与方法
1.1 临床资料 2014年6月至2017年6月我院为5例pNENs患者施行腹腔镜手术治疗,其中男3例,女2例,32~62岁,中位年龄53岁。术前通过临床表现及影像学检查诊断为pNENs。其中根据腹部B超、造影超声、超声内镜、增强CT、增强MRI等辅助检查明确肿瘤定位诊断(图1);根据患者临床表现、血清学检查、生长抑素受体显像等明确肿瘤定性诊断。术前3例定性为无功能性神经内分泌肿瘤,临床表现为腹胀、腹痛者2例,无症状1例;2例患者定性为功能性pNENs,临床表现为典型的Whipple三联征,结合术前生长抑素受体显像等检查明确为胰岛素瘤。胰岛素瘤患者术前予以加餐,使术前清晨血糖控制在2.8 mmol/L以下且未出现低血糖症状为宜,以利术中血糖的监控并判断肿瘤是否切除干净。病程1周~5年。肿瘤均位于胰体尾部,1例合并左肝转移病灶(位于肝脏Ⅱ、Ⅲ及Ⅳb段)(表1)。
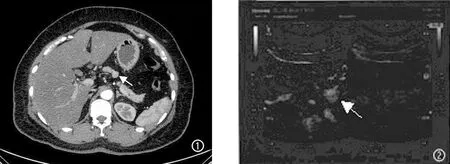
图1 pNENs术前定位(①:腹部CT可见胰体部类圆形病变;②:造影超声可见高增强的类圆形病变)
表1 pNENs所在部位及手术方式

肿瘤位置手术方式胰体尾及左肝腹腔镜胰体尾脾切除、左肝转移灶及胆囊切除术胰体尾腹腔镜胰体尾脾切除术胰体尾腹腔镜保留脾脏的胰体尾切除术胰体尾腹腔镜胰体尾肿瘤切除、胆囊切除术胰体尾腹腔镜胰体尾肿瘤切除术
1.2 手术方法 气管插管静吸复合全身麻醉,患者取平卧位,两腿分开。术者立于患者右侧,第一助手立于左侧,持镜助手立于两腿之间。于脐窝下缘做弧形切口,气腹针穿刺建立CO2气腹,压力维持在12~14 mmHg。穿刺10 mm Trocar,置入30度腹腔镜。腹腔镜监视下分别于右腹直肌外侧脐上2 cm处穿刺12 mm Trocar作为主操作孔,左、右锁骨中线肋缘下2 cm及左腋前线肋缘下2 cm穿刺5 mm Trocar作为辅助孔。置入镜头后,首先常规顺序探查腹腔,明确肝脏、腹膜、盆腔等部位有无转移。用超声刀打开胃结肠韧带,显露胰腺,术中常规腹腔镜下超声全面探查胰腺,明确肿瘤部位及其与周围血管、组织间的关系,同时避免遗漏术前未发现的肿瘤。定位明确后,根据肿瘤所在部位选择相应的手术方式。pNENs局部切除术中超声确定胰腺病变位置后,沿肿物与正常胰腺的边界用超声刀逐步切开胰腺组织,夹闭或缝扎所遇血管分支,将肿物完整剥除(图2~图5)。切除过程中尤应注意有无胰管损伤,如主胰管损伤,则转行胰腺中段切除胰肠吻合术或胰体尾切除术。胰体尾脾切除术中超声探查定位后,于胰颈上缘分出脾动脉,用Hem-o-lok夹闭后离断,以控制脾脏血流、减少出血。逐步依次离断脾结肠、脾胃、脾肾及脾膈韧带,将脾脏及胰体尾部向右侧掀起。切开胰腺与横结肠系膜根部交界处的腹膜,于脾静脉后方沿胰体尾与腹膜后的间隙充分游离胰体尾。将脾静脉游离后用Hem-o-lok夹闭并离断。用Endo-GIA离断胰腺,切除标本。胰腺残端腔镜下缝合封闭。保留脾脏的胰体尾切除术(Kimura法)术中超声定位肿瘤后,于胰颈上缘分离出脾动脉,于胰腺下缘分离并显露肠系膜上静脉、脾静脉、门静脉。用Endo-GIA离断胰腺,将胰体向左翻起后上提,仔细沿脾动静脉走行离断其与胰腺间的血管穿支;较大分支用Hem-o-lok夹闭。切断胰尾部与脾门间的结缔组织,完全游离胰体尾部,切除标本。胰腺残端腔镜下缝合封闭。同时行左肝联合肝段切除的病例,术中超声定位肝脏病变部位,沿预切除线用超声刀打开肝脏表面,可吸收夹处理较粗的血管、胆管,Endo-GIA分次离断肝脏组织,切除标本。仔细检查创面及有无胆漏、出血。切除过程中可阻断肝门,以减少出血。对于胰岛素瘤病例,术中行血糖动态监测,术中确认血糖升高至1倍以上或5.6 mmol/L,以作为肿瘤切除干净的标准。最后,观察胰腺残端或剥除面有无出血、胰瘘,可疑处予以缝合加固。标本置入取物袋,适当扩大主操作孔后取出。创面常规放置引流,依次缝合各切口。
1.3 并发症的评估 统计手术时间、术中出血及输血量、术后进食时间、术后下床活动时间、术后住院时间及并发症发生情况等指标。术后胰瘘标准采用国际胰腺外科研究组修订的2016版定义及分级系统[3]。
1.4 随访 采用门诊及电话随访,时间截至2017年7月。
2 结 果
2.1 手术情况 本组5例pNENs患者均成功施行完全腹腔镜下pNENs切除术,包括胰体尾脾切除术1例,保留脾脏的胰体尾切除术1例(Kimura法),胰体尾脾切除联合肝转移灶及胆囊切除1例,胰体尾肿瘤局部切除2例(1例联合行胆囊切除)。手术时间65~420 min,术中出血量50(20,700) ml;输血1例,输血量400 ml。3例患者为无功能性pNENs,2例为功能性pNENs(胰岛素瘤)。
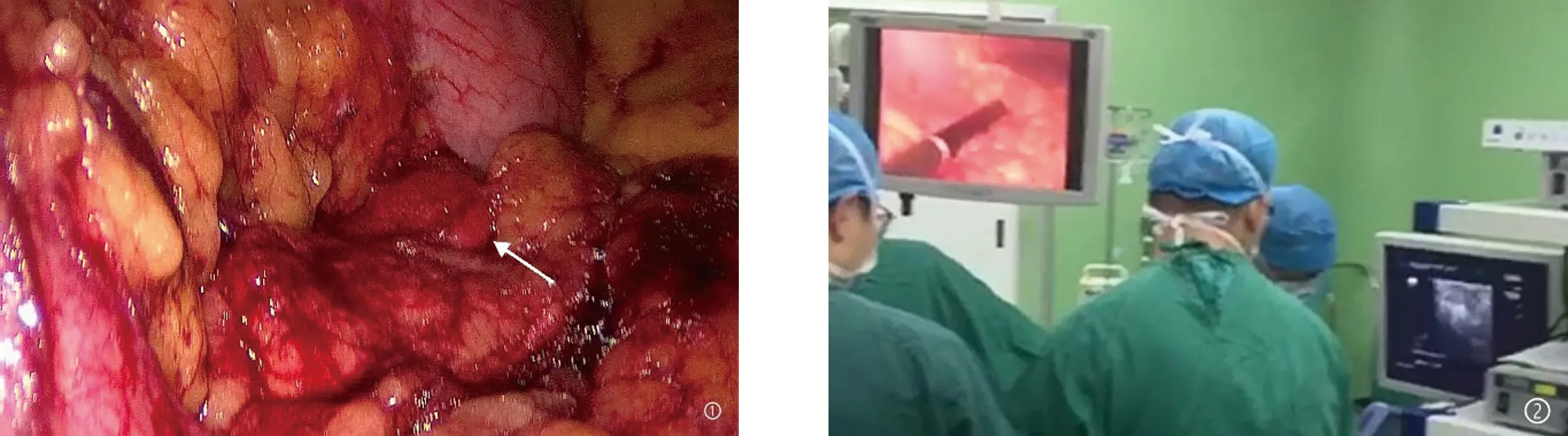
图2 胰体上方可见类圆形病变图3 术中超声全面探查
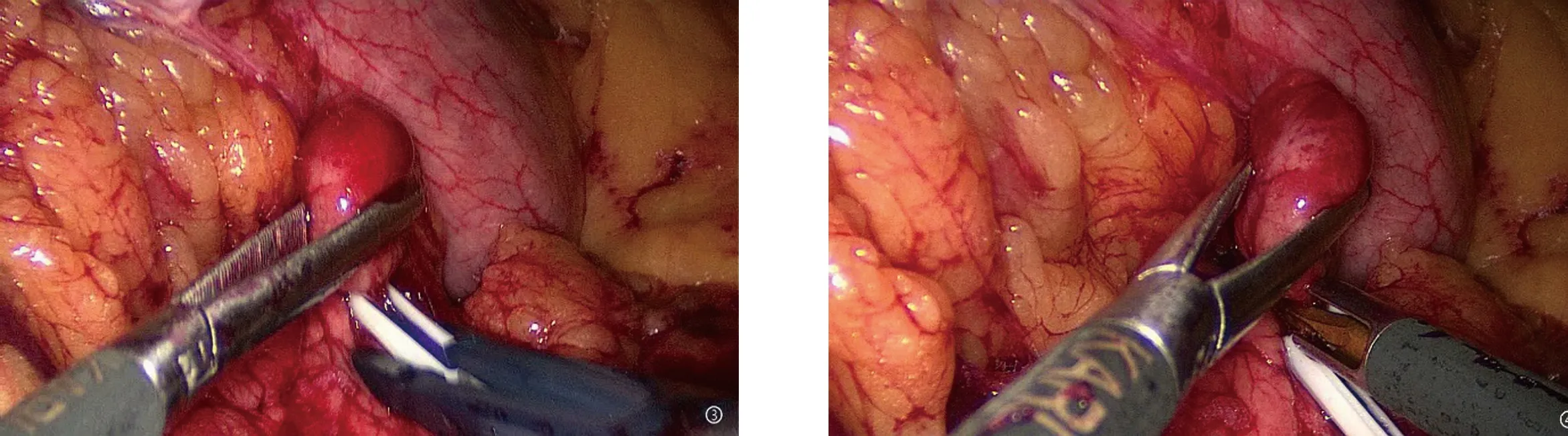
图4 可吸收夹夹闭供血血管图5 超声刀切除肿物
2.2 术后恢复情况 5例患者术后均经病理证实为pNENs。术后住院4~10 d,平均(6.4±2.3) d。术后第1~2天开始下床活动,术后1~5 d恢复进食。术后发生胰腺生化瘘2例,经保守治疗于术后2周左右拔管后痊愈。均无术后出血、腹腔感染等严重并发症发生。
2.3 随访 术后患者均获随访,3例无功能pNENs患者随访21~36个月,未发生肿瘤复发或转移。2例胰岛素瘤患者随访1~30个月,术后无低血糖症状发作。本组患者均未出现明显胰腺内外分泌功能不足表现。
3 讨 论
3.1 腹腔镜在pNENs治疗中的应用选择 随着腹腔镜手术技术的进步,采用腹腔镜手术治疗pNENs的病例不断增加,由无功能性pNENs逐渐推广到功能性pNENs,手术指征也不断扩大。依据《胰腺神经内分泌肿瘤治疗指南》[3],我们对不同类型的pNENs采用了不同的手术治疗方式,术后取得了较满意的疗效。在具体手术操作方面,对于外生性或不累及胰管的pNENs,采用腹腔镜下局部切除的方法;根据肿瘤与脾门的关系,采用保留或不保留脾脏的腹腔镜胰体尾切除术;对于合并可切除的肝转移灶,采用腹腔镜下一期手术切除。本组未讨论胰头神经内分泌肿瘤的处理。有学者对胰头的pNENs也采用了腹腔镜胰十二指肠切除术等术式,取得了满意效果[4]。在pNENs的治疗中,选择腹腔镜手术的依据,一方面在于肿瘤本身的情况,如位置、大小、与周围血管组织的关系、有无功能等;另一方面在于术者经验,如腹腔镜下胰肠吻合技术的熟练程度、胰腺残端处理的可靠程度等。
3.2 腹腔镜在功能性pNENs中的应用 1996年Sussman等报道了第1例腹腔镜下胰岛素瘤切除术[5],此后,腹腔镜下胰岛素瘤切除术逐步开展。成功施行腹腔镜胰岛素瘤手术的关键在于对肿瘤的精确定位[6]。相较开腹手术,腹腔镜手术失去了对肿瘤的直接触觉反馈,难度更高,术中无法明确肿瘤部位往往是中转开腹的主要原因。对于肿瘤的定位,除术前影像学检查外,还可从以下方面着手:术中需进行常规腹腔镜下超声探查[7],除与术前肿瘤定位相对应外,还应警惕多发肿瘤的存在,避免遗漏术前未发现的病灶;术中应进行外周血血糖监测,以证实确实完整切除肿瘤。术中我们还采用了血清胰岛素监测的方法[8],根据胰岛素释放情况协助判断肿瘤是否完整切除,在胰岛素瘤的诊治中积累了一定经验。
3.3 腹腔镜在pNENs治疗中的优势与难点 腹腔镜pNENs手术具有创伤小、康复快的优点。本组5例pNENs患者,术后平均住院(6.4±2.3) d,术后1~2 d下床活动,术后1~5 d恢复进食,体现了腹腔镜手术创伤小、康复快的优点。而对于胰岛素瘤患者,为减轻低血糖发作的症状,患者往往长期加餐导致过度肥胖,如果行开腹手术,切口、创伤较大,且容易发生切口脂肪液化等愈合不良情况。因此,对于定位明确的胰岛素瘤,腹腔镜手术的微创优势尤为明显。
同时,相较胰腺导管腺癌或慢性胰腺炎而言,pNENs患者的胰腺质地通常更加柔软,因而胰瘘发生的危险性较高。本组5例中,2例发生术后胰瘘,经过一段时间的引流后顺利拔管。按照国际胰腺外科研究组的最新分级与定义[3],均属于胰腺生化瘘,已不属于真正意义上的胰瘘。对于腹腔镜胰腺手术中胰瘘的预防,可参考以下方法:(1)注意胰腺创面的处理,对可疑之处进行腹腔镜下缝扎,尤其可找到胰管断端的病例。(2)如发现主胰管损伤,不应一味强调局部切除,应及时行规则性胰腺切除,以减少胰瘘的发生。(3)创面应常规放置合适的引流,待患者进食胰液分泌增加后根据引流情况逐渐退管,直至拔管,可减少胰瘘的发生及术后再次穿刺引流。(4)对于胰腺质地软、找不到胰管、胰腺腺体较厚、预计胰瘘发生高风险的患者,必要时行小切口辅助胰肠吻合,既可保证患者的安全,又不过于增加创伤,可根据术者经验选择。本组2例患者,因引流放置、处理得当,避免了术后再次穿刺治疗,减少了患者的痛苦。
总之,对于无功能性pNENs,腹腔镜手术具有创伤小、康复快的优点,是安全、有效的治疗方法。对于功能性pNENs,在术前、术中精准定位的基础上,也可选择腹腔镜手术治疗。相信随着腹腔镜技术的不断进步及术者经验的不断积累,腹腔镜手术在pNENs中的应用会越来越广泛。
[1] 中华医学会外科学分会胰腺外科学组.胰腺神经内分泌肿瘤治疗指南(2014)[S].中华肝胆外科杂志,2014,20(12):841-843.
[2] Tamburrino D,Partelli S,Renzi C,et al.Systematic review and meta-analysis on laparoscopic pancreatic resections for neuroendocrine neoplasms (PNENs)[J].Expert Rev Gastroenterol Hepatol,2017,11(1):65-73.
[3] Bassi C,Marchegiani G,Dervenis C,et al.The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula:11 Years After[J].Surgery,2017,161(3):584-591.
[4] 黄超杰,张人超,牟一平,等.腹腔镜手术治疗胰腺神经内分泌肿瘤的临床疗效[J].中华消化外科杂志,2014,13(10):776-779.
[5] Sussman LA,Christie R,Whittle DE.Laparoscopic excision of distal pancreas including insulinoma[J].Aust N Z J Surg,1996,66(6):414-416.
[6] Aggeli C,Nixon AM,Karoumpalis I,et al.Laparoscopic surgery for pancreatic insulinomas:an update[J].Hormones(Athens),2016,15(2):157-169.
[7] Mehrabi A,Fischer L,Hafezi M,et al.A systematic review of localization,surgical treatment options,and outcome of insulinoma[J].Pancreas,2014,43(5):675-686.
[8] Yang Z,Tan H,Sun Y,et al.Intraoperative portal vein insulin assay combined with occlusion of the pancreas for complex pancreatogenous hypoglycemia:Two cases report[J].Medicine (Baltimore),2016,95(26):e3928.
(英文编辑:黄 鑫)
Clinicalanalysisoftotallylaparoscopicsurgeryforpancreaticneuroendocrineneoplasms
SIShuang,YANGZhi-ying,TANHai-dong,etal.
DepartmentofGeneralSurgery,China-JapanFriendshipHospital,Beijing100029,China
Objective:To discuss the clinical efficacy of totally laparoscopic surgery for pancreatic neuroendocrine neoplasms (pNENs).Methods:The clinical data of 5 patients who were scheduled for laparoscopic surgery of pNENs from Jun.2014 to Jun.2017 were retrospectively analyzed.3 males and 2 females were enrolled in this study,with a median age of 53 years (range 32 to 62 years).3 cases got nonfunctional pNENs,in which two cases got clinical symptom of abdominal distension and one had no symptom;2 cases got functional pNENs (insulinoma) with symptom of recurrent attacks of hypoglycemia.The course of disease ranged from one week to 5 years.Results:Laparoscopic treatment of pNENs was successfully performed in 5 patients.The diagnosis of pNENs was confirmed by pathology for all the cases.The operative time was 65-420 min.The intraoperative blood loss was 50 (20,700) ml,only one case accepted blood transfusion.The postoperative hospital stay was (6.4±2.3) d.Two patients got postoperative pancreatic biochemical fistula and were cured by conservative treatment.Postoperative hemorrhage or abdominal infection was not found in any cases.Conclusions:Totally laparoscopic surgery is a safe,efficient and minimally invasive procedure for nonfunctional pNENs with quick recovery.And with accurate localization before and during operation,it is also a suitable method for functional pNENs.
Pancreatic neoplasms;Neuroendocrine tumors;Laparoscopy
1009-6612(2017)08-0584-04
10.13499/j.cnki.fqjwkzz.2017.08.584
杨志英,E-mail:yangzhy@aliyun.com
司 爽(1983—)男,中日友好医院普通外科主治医师,主要从事肝胆胰疾病的诊断与外科治疗方面的研究。
R736.7
:A
2017-07-18)
