纳米碳淋巴示踪剂在乙状结肠癌及高位直肠癌腹腔镜根治术中的应用
2017-09-21李国强邓志刚向春华向荣超柳万忠
鲍 峰,李国强,邓志刚,向春华,向荣超,智 星,刘 文,柳万忠,龙 煊
(绵阳市中心医院,四川 绵阳,621000)
·论 著·
纳米碳淋巴示踪剂在乙状结肠癌及高位直肠癌腹腔镜根治术中的应用
鲍 峰,李国强,邓志刚,向春华,向荣超,智 星,刘 文,柳万忠,龙 煊
(绵阳市中心医院,四川 绵阳,621000)
目的:探讨纳米碳淋巴示踪剂在乙状结肠癌及高位直肠癌腹腔镜根治术中的临床应用价值。方法:回顾分析2010年5月至2016年12月为153例乙状结肠癌及高位直肠癌患者行腹腔镜根治术的临床资料,59例患者术前1 d肠镜下于肿瘤周围注射纳米碳(观察组),94例患者直接手术(对照组);分析比较两组大体标本情况及淋巴结检出情况。结果:与对照组相比,观察组标本长度较短[(17.8±5.3) cm vs. (19.7±4.2) cm,P=0.020],近切缘距肿瘤距离较短[(7.3±3.7) cm vs.(8.6±3.3) cm,P=0.028)],远切缘距肿瘤距离较短[(4.7±1.8) cm vs.(5.7±2.6) cm,P=0.014)],淋巴结检出数量较多[(16.9±6.5) vs.(11.2±5.9),P<0.001],淋巴结<12枚比例较低(13.6% vs. 59.6%,P<0.001)。结论:腹腔镜乙状结肠癌及高位直肠癌腹腔镜根治术中应用纳米碳淋巴示踪技术有助于指导合理选择手术切除范围,提高淋巴结检出率,具有较高的临床应用价值。
结直肠肿瘤;腹腔镜检查;淋巴转移;纳米碳
结直肠癌作为常见的恶性肿瘤,目前在世界上居女性恶性肿瘤发病率的第二位,男性中居第三[1]。在中国,其发病率也在逐年升高;据统计,已位居恶性肿瘤死亡的第五位[2-3],并有逐渐年轻化的趋势[4]。术后局部复发、远处转移是导致患者术后死亡的主要原因之一,据统计,约40%的结直肠癌患者因术后局部复发或远处转移导致死亡[5]。结直肠癌最常见的转移途径是经淋巴途径[6-7],据报道,伴有淋巴结转移的结直肠癌患者5年生存率仅为30%~40%,显著低于不伴有淋巴结转移的患者[8]。因此一直以来淋巴结转移情况始终是分期的重要方面,是预测预后的重要影响因素,也因此成为决定术后辅助治疗的重要依据[9]。然而目前现有的常规检查,如CT、MR等对于淋巴结转移敏感性仍不高[10],极大的影响了术前分期的准确性,结直肠癌患者的术后辅助治疗仍有赖于术后病理分期。目前腹腔镜手术治疗结直肠癌已得到广泛认同与普及,但由于腹腔镜缺乏术中触觉感知,对于浸润较浅的肿瘤,术中如何准确定位、切除合适长度的肠管,并清扫足够数量与范围的淋巴结一直是临床医师关注的问题。本研究通过对乙状结肠癌、直肠上段癌患者术前1 d在结肠镜下肿瘤周围注射纳米碳混悬液标记肿瘤及淋巴结,指导腹腔镜结直肠癌根治术的切除范围及淋巴结检查,取得了良好的临床效果。现报道如下。
1 资料与方法
1.1 临床资料 回顾分析2010年5月至2016年12月绵阳市中心医院普通外科收治的乙状结肠癌、腹膜返折以上直肠上段癌患者共153例(本研究排除腹膜返折以下的直肠癌,是考虑到上段直肠淋巴引流是沿肠系膜下动脉至主动脉旁区域,而由于下段直肠癌具有较复杂的转移途径至盆壁淋巴结,因此未纳入本研究),术前均经超声内镜、增强CT或MR检查分期为cT2~3NxM0,其中男86例,女67例;患者32~88岁,平均(61.2±12.2)岁。术前充分告知使用纳米碳标记的利弊,患者自愿选择是否使用纳米碳混悬液,纳米碳组于术前1 d在结肠镜下于肿瘤周围注射纳米碳混悬液(观察组,n=59),对照组直接进行手术(对照组,n=94)。本研究已得到绵阳市中心医院伦理审查委员会的批准。
1.2 染色方法 观察组患者均于术前1 d在结肠镜下于肿瘤周围黏膜下分4点注射纳米碳混悬液50 mg/ml,每点注射约0.25 ml。
1.3 手术方法 两组患者手术均严格遵循全直肠系膜切除术[11]、全结肠系膜切除术原则[12]及标准D3根治术的手术方法与原则[13],术中操作遵循肿瘤非接触性分离,肿物均为完整切除,两端切缘要求有足够的肠管,取出肿瘤时保护切口。患者均应用中心血管高位结扎技术。手术均由同一组医师完成,采用气管插管全身麻醉,患者取大字位,采用5孔法施术。
1.4 淋巴结检查 观察组:术中根据纳米碳染色部位确定肿瘤位置及切除范围,标本切除后,根据黑染部位及触摸法相结合的方法寻找淋巴结并记录;对照组直接采用触摸法寻找淋巴结并记录。标本常规苏木素-伊红染色观察淋巴结转移情况。
1.5 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料若呈正态分布,则以均数±标准差表示,采用t检验,否则用中位数和四分位数M(Q1,Q3)表示,采用秩和检验;计数资料比较采用χ2检验。检验水准α=0.05。
2 结 果
2.1 一般情况 两组患者顺利完成手术,无一例中转开腹。观察组术中发现肿瘤周围黑染、沿肠系膜血管分布的淋巴结黑染(图1)。按全直肠系膜切除术、全结肠系膜切除术原则并参考淋巴结染色范围完成结直肠癌根治及D3淋巴结清扫;对照组15例术中再次行肠镜定位后完成手术。两组患者年龄、性别、肿瘤部位、浸润深度、手术时间、术中出血量、住院时间等差异无统计学意义(P>0.05),见表1。
2.2 标本情况 两组患者肿瘤最大径相当,差异无统计学意义(P>0.05),切除标本经检查均为R0切除。观察组标本长度、近切缘距离、远切缘距离均显著小于对照组,差异有统计学意义(P<0.05),见表2。
2.3 淋巴结检出情况 观察组共检出淋巴结996枚,每人10~45枚,平均(16.9±6.5)枚;对照组1 057枚,每人2~29枚,平均(11.2±5.9)枚。观察组淋巴结检出数量显著高于对照组,差异有统计学意义(P<0.001)。观察组8例(13.6%)患者淋巴结<12枚,显著低于对照组[56例(59.6%)](P<0.001)。两组转移率、淋巴结转移率差异无统计学意义(P>0.05)。见表2。
3 讨 论
经过20余年的发展,腹腔镜结直肠癌手术在世界范围内已得到广泛开展,经过循证医学的证实,其远期疗效与开腹手术相当[14-15]。然而,尽管腹腔镜结直肠癌手术具有良好的放大效应,使得术中解剖间隙及结构更清晰,神经保护及淋巴结清扫更容易实现,但也由于缺乏触觉感受,对于肿瘤浸润深度较浅的结直肠癌术中往往难以定位,给确定合理的手术范围增加了难度,本研究中,对照组15例患者术中不得不再次行肠镜检查,以确定肿瘤部位,延长了手术时间、麻醉时间,影响了后续操作。尤其乙状结肠及上段直肠癌,患者多存在乙状结肠冗长、肠段弯曲等特点,使得术前肠镜描述的距离与实际距离有较大出入。实际操作中,术者为了能更好的达到根治效果,往往扩大切除范围,使得切除肠段较长。我们发现,未经术前纳米碳标记的乙状结肠癌、高位直肠癌患者,切除肠段长度、近切缘距离、远切缘距离均显著长于经纳米碳标记的患者,差异有统计学意义(P<0.05)。切除肠段过长会影响患者术后的排便功能,研究显示吻合口以下保留3.0~3.5 cm的直肠黏膜,患者的生活质量明显优于仅存留2~3 cm的患者[16]。而由于切除肠段过长,导致吻合口张力过高,可能使吻合口缺血挛缩,引起吻合口狭窄,影响术后恢复及正常的排便功能[17]。Wang等[18]通过对26例患者术前行纳米碳标记后再行腹腔镜结直肠癌手术,发现经纳米碳术前注射后肿瘤更容易定位,避免了不合理肠段的切除,减少了手术创伤及术后并发症的发生。
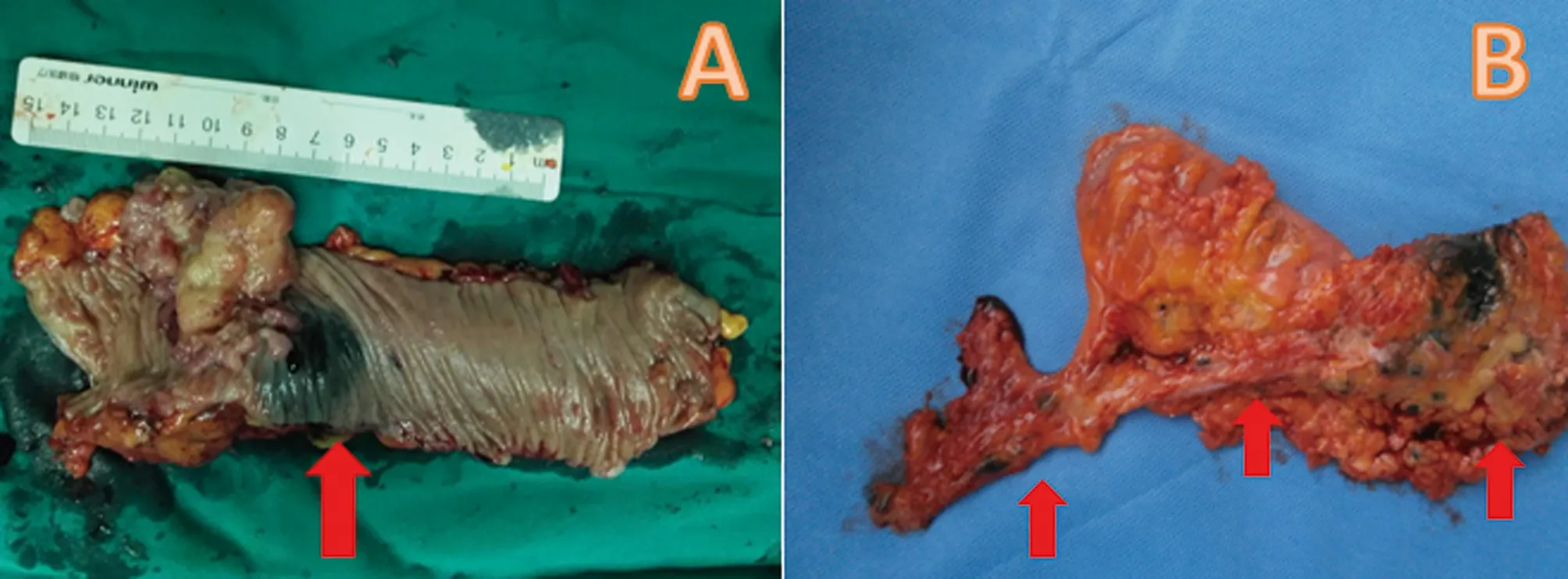
图1 标本(A:应用纳米碳后肿瘤黑染,箭头处;B:应用纳米碳后黑染的淋巴结,箭头处)
表1 两组患者一般情况的比较
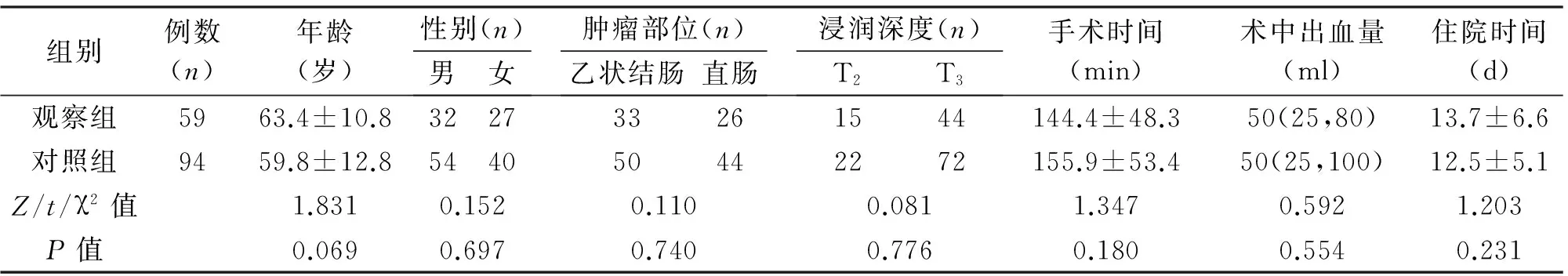
组别例数(n)年龄(岁)性别(n)男女肿瘤部位(n)乙状结肠直肠浸润深度(n)T2T3手术时间(min)术中出血量(ml)住院时间(d)观察组5963.4±10.8322733261544144.4±48.350(25,80)13.7±6.6对照组9459.8±12.8544050442272155.9±53.450(25,100)12.5±5.1Z/t/χ2值1.8310.1520.1100.0811.3470.5921.203P值0.0690.6970.7400.7760.1800.5540.231
表2 两组患者标本情况的比较
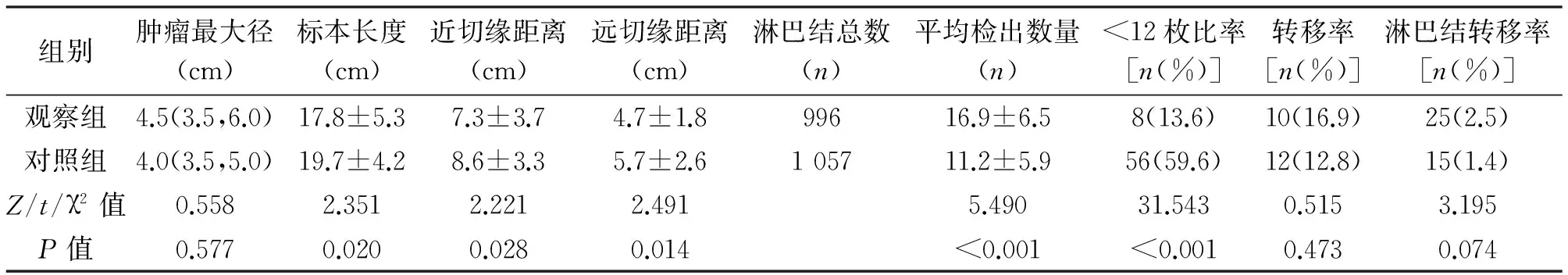
组别肿瘤最大径(cm)标本长度(cm)近切缘距离(cm)远切缘距离(cm)淋巴结总数(n)平均检出数量(n)<12枚比率[n(%)]转移率[n(%)]淋巴结转移率[n(%)]观察组4.5(3.5,6.0)17.8±5.37.3±3.74.7±1.899616.9±6.58(13.6)10(16.9)25(2.5)对照组4.0(3.5,5.0)19.7±4.28.6±3.35.7±2.6105711.2±5.956(59.6)12(12.8)15(1.4)Z/t/χ2值0.5582.3512.2212.4915.49031.5430.5153.195P值0.5770.0200.0280.014<0.001<0.0010.4730.074
随着纳米技术的发展,纳米材料的淋巴示踪剂也相应问世,纳米碳混悬液就是其中之一。纳米碳混悬液是由150 nm的光滑碳颗粒制成的黑色混悬液[19],具有对淋巴结较高的亲和性、稳定性好、滞留时间长、不容易穿过毛细血管等优点[20],是良好的淋巴示踪剂。本研究采用纳米碳示踪剂定位肿瘤、辅助淋巴结显色,使术中定位肿瘤更加准确、容易,切除的标本长度及切缘距离更加合理,同时也大大提高了淋巴结的检出数量,平均淋巴结检出数显著提高(P<0.05),淋巴结<12枚的患者比率明显低于对照组(P<0.05)。患者转移率、淋巴结转移率也有所提高,但差异无统计学意义(P>0.05)。但对于淋巴结分期由N0提升为N1或N2的患者而言,术后可得到更加合理的辅助治疗,这对于降低复发率、提高生存率非常有意义。
现有研究表明,较高的淋巴结获取数量与较好的预后显著相关[21-23]。因此,目前NCCN指南推荐的对于结直肠癌患者,术后准确分期所应获取淋巴结数量至少为12枚[24]。我国结直肠癌指南对于术前未行辅助治疗的患者,术后淋巴结分期的最少淋巴结数量也规定为12枚[25]。然而实际临床工作中,仍有不少患者的淋巴结检出数量少于12枚,比例甚至高达50%[26]。本研究中对照组淋巴结数量少于12枚的患者比例高达59.6%(56/94)。可见,在目前普遍应用传统方法获取淋巴结的情况下,临床上仍有相当比例的患者术后淋巴结送检数量难以达到12枚的要求。同时,由于相当数量的淋巴结是微小淋巴结(直径<5 mm),通过一般的触摸法很难挑选出来,影响了术后的准确分期。张相春等[27]回顾分析了术前1~3 d肠镜下于肿瘤周围纳米碳注射后再行腹腔镜结直肠根治术的26例患者的临床资料,发现微小淋巴结检出率高达31.6%,远远高于未标记组(16.5%)(P<0.001)。此外,在结直肠癌淋巴结转移方式中还存在跳跃转移的现象,其比例高达10%~30%[28]。因此,NCCN结直肠癌指南建议,对于获取淋巴结数量低于12枚的Ⅱ期患者应视为术后复发的高危患者,推荐术后辅助治疗[2-24]。
总之,纳米碳淋巴示踪剂应用于乙状结肠癌及高位直肠癌的腹腔镜根治术中,有助于指导合理选择手术切除范围,提高淋巴结检出率,具有较高的临床应用价值。相信随着我国社会经济的发展,医改的深入,纳米碳淋巴示踪剂的价格会逐步降低,使得越来越多的结直肠癌患者受益。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Chen W,Zheng R,Zeng H,et al.Annual report on status of cancer in China,2011[J].Chin J Cancer Res,2015,27(1):2-12.
[3] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[4] You YN,Xing Y,Feig BW,et al.Young-onset colorectal cancer:is it time to pay attention?[J].Arch Intern Med,2012,172(3):287-289.
[5] Cai GX,Cai SJ.Multi-modality treatment of colorectal liver metastases[J].World J Gastroenterol,2012,18(1):16-24.
[6] Harris GJ,Church JM,Senagore AJ,et al.Factors affecting local recurrence of colonic adenocarcinoma[J].Dis Colon Rectum,2002,45(8):1029-1034.
[7] Kanemitsu Y,Kato T,Hirai T,et al.Survival after curative resection for mucinous adenocarcinoma of the colorectum[J].Dis Colon Rectum,2003,46(2):160-167.
[8] Baxter NN,Virnig DJ,Rothenberger DA,et al.Lymph node evaluation in colorectal cancer patients:a population-based study[J].J Natl Cancer Inst,2005,97(3):219-225.
[9] Ueno H,Mochizuki H,Akagi Y,et al.Optimal colorectal cancer staging criteria in TNM classification[J].J Clin Oncol,2012,30(13):1519-1526.
[10] 王亚宁,时高峰,杜煜.比较MSCT与MRI在结直肠癌术前分期诊断中的价值[J].中国医学影像技术,2011,27(4):772-775.
[11] Heald RJ,Husband EM,Ryall RD.The mesorectum in rectal cancer surgery-the clue to pelvic recurrence?[J].Br J Surg,1982,69(10):613-616.
[12] Hohenberger W,Weber K,Matzel K,et al.Standardized surgery for colonic cancer:complete mesocolic excision and central ligation-technical notes and outcome[J].Colorectal Dis,2009,11(4):354-364.
[13] Watanabe T,Itabashi M,Shimada Y,et al.Japanese Society for Cancer of the Colon and Rectum (JSCCR) Guidelines 2014 for treatment of colorectal cancer[J].Int J Clin Oncol,2015,20(2):207-239.
[14] Ohtani H,Tamamori Y,Arimoto Y,et al.A meta-analysis of the short- and long-term results of randomized controlled trials that compared laparoscopy-assisted and open colectomy for colon cancer[J].J Cancer,2012,3:49-57.
[15] Ohtani H,Tamamori Y,Azuma T,et al.A meta-analysis of the short- and long-term results of randomized controlled trials that compared laparoscopy-assisted and conventional open surgery for rectal cancer[J].J Gastrointest Surg,2011,15(8):1375-1385.
[16] Pollack J,Holm T,Cedermark B,et al.Long-term effect of preoperative radiation therapy on anorectal function[J].Dis Colon Rectum,2006,49(3):345-352.
[17] 顾晋,潘宏达.直肠前切除综合征的防范与处理[J].中华胃肠外科杂志,2016,19(4):366-369.
[18] Wang W,Wang R,Wang Y,et al.Preoperative colonic lesion localization with charcoal nanoparticle tattooing for laparoscopic colorectal surgery[J].J Biomed Nanotechnol,2013,9(12):2123-2125.
[19] Fiorito S,Serafino A,Andreola F,et al.Toxicity and biocompatibility of carbon nanoparticles[J].J Nanosci Nanotechnol,2006,6(3):591-599.
[20] 葛现才,殷德英,辛群,等.纳米碳示踪联合腹腔镜技术在结肠癌中的应用价值[J].腹腔镜外科杂志,2016,21(10):796-798.
[21] McDonald JR,Renehan AG,O' Dwyer ST,et al.Lymph node harvest in colon and rectal cancer:Current considerations[J].World J Gastrointest Surg,2012,4(1):9-19.
[22] Ahmadi O,Stringer MD,Black MA,et al.Clinico-pathological factors influencing lymph node yield in colorectal cancer and impact on survival:analysis of New Zealand Cancer Registry data[J].J Surg Oncol,2015,111(4):451-458.
[23] Park IJ,Yu CS,Lim SB,et al.Prognostic implications of the number of retrieved lymph nodes of patients with rectal cancer treated with preoperative chemoradiotherapy[J].J Gastrointest Surg,2014,18(10):1845-1851.
[24] Engstrom PF,Arnoletti JP,Benson AB 3rd,et al.NCCN Clinical Practice Guidelines in Oncology:colon cancer[J].J Natl Compr Canc Netw,2009,7(8):778-831,838-881.
[25] 国家卫生计生委医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2015版)[S].中华胃肠外科杂志,2015,18(10):961-973.
[26] Storli KE,Sφndenaa K,Bukholm IR,et al.Overall survival after resection for colon cancer in a national cohort study was adversely affected by TNM stage,lymph node ratio,gender,and old age[J].Int J Colorect Dis,2011,26(10):1299-1307.
[27] 张相春,王延磊,晏伟,等.纳米碳淋巴示踪剂在腹腔镜结直肠癌手术中的应用探讨[J].中华医学杂志,2015,95(32):2612-2615.
[28] Bao F,Zhao LY,Balde AI,et al.Prognostic impact of lymph node skip metastasis in Stage Ⅲ colorectal cancer[J].Colorectal Dis,2016,18(9):O322-329.
(英文编辑:邵 毅)
Applicationoflymphnodelabelingwithcarbonnanoparticlesinlaparoscopicradicalresectionforsigmoidandupperrectalcancer
BAOFeng,LIGuo-qiang,DENGZhi-gang,etal.
DepartmentofGeneralSurgery,MianyangCentralHospital,Mianyang621000,China
Objective:To investigate the value of lymph node labeling with carbon nanoparticles in laparoscopic radical resection for sigmoid and upper rectal cancer.Methods:From May 2010 to Dec.2016,the clinical data of 153 patients who underwent laparoscopic radical resection for sigmoid and upper rectal cancer were retrospectively analyzed.Among them,59 patients (the observation group) were injected with carbon nanoparticles into the periphery of the tumor under colonoscopy on the first day before the operation,while 94 patients (the control group)
operation directly.The conditions of the gross specimen and the number of the harvested lymph nodes were compared between the two groups.Results:Compared with the control group,the mean length of the gross specimen was significantly shorter [(17.8±5.3) cm vs. (19.7±4.2) cm,P=0.020],the mean distance from superior margin to tumor was significantly shorter [(7.3±3.7) vs. (8.6±3.3) cm,P=0.028],the mean distance from inferior margin to tumor was significantly shorter [(4.7±1.8) cm vs. (5.7±2.6),P=0.014],the mean number of the harvested lymph nodes was significantly more [(16.9±6.5) vs. (11.2±5.9),P<0.001],and the rate of less than 12 harvested lymph nodes was significantly fewer (13.6% vs. 59.6%,P<0.001) in the observation group.Conclusions:Application of lymph node labeling with carbon nanoparticles in laparoscopic radical resection of sigmoid and upper rectal cancer contributes to confirming the reasonable excision extension,improving the lymph node detection rate,and is of high clinical application value.
Colorectal neoplasms;Laparoscopy;Lymphatic metastasis;Carbon nanoparticles
1009-6612(2017)08-0600-05
10.13499/j.cnki.fqjwkzz.2017.08.600
李国强,E-mail:liguoqiangzxyy@163.com
鲍 峰(1984—)男,四川省绵阳市中心医院普通外科主治医师,主要从事胃肠外科的研究。
R735.3+4
:A
2017-01-17)
