中药材规范化种植茯苓化学成分研究△
2017-09-21郑艳杨秀伟
郑艳,杨秀伟
(北京大学 天然药物及仿生药物国家重点实验室 药学院 天然药物学系,北京 100191)
·基础研究·
中药材规范化种植茯苓化学成分研究△
郑艳,杨秀伟*
(北京大学 天然药物及仿生药物国家重点实验室 药学院 天然药物学系,北京 100191)
目的:研究中药材规范化种植茯苓的化学成分。方法:采用硅胶、高效液相色谱等柱色谱方法进行分离纯化,通过化合物的谱学数据鉴定其结构。结果:从茯苓菌核95%乙醇水溶液提取物中分离鉴定了14个化合物,分别为麦角甾-7,22-二烯-3β-醇(1)、3-表去氢土莫酸(2)、3-O-乙酰基-16α-羟基栓菌酸(3)、猪苓酸C(4)、去氢茯苓酸(5)、茯苓酸(6)、6α-羟基猪苓酸C(7)、去氢土莫酸(8)、土莫酸(9)、29-羟基猪苓酸C(10)、茯苓羊毛脂酮A(11)、3β,16α-二羟基羊毛脂-7,9(11),24-三烯-21-酸(12)、25-羟基茯苓酸(13)、茯苓羊毛脂酮B(14)。结论:中药材规范化种植茯苓中具有丰富的特征性羊毛脂烷型三萜,为茯苓的主要生物活性物质基础。
中药材规范种植;茯苓;多孔菌科;羊毛脂烷型三萜;生物活性物质基础
传统药食两用中药茯苓系多孔菌科真菌Poriacocos(Schw.)Wolf.的干燥菌核。茯苓可用于中药配方和100多种中成药原料,还用于历代宫廷御膳及民间食品如茯苓饼、白雪糕、云片、茯苓酒、茯苓点心、长寿挂面等。据全国中药资源普查资料显示,20世纪90年代以前,茯苓野生蕴藏量约500万kg,家种500~1000万kg。我国每年药用、食用和出口需求量约1000~1300万kg,仅次于甘草、当归用量,为药用量较大的中药之一。在我国加入世界贸易组织后有140多个国家接受中医药,供需矛盾近年来迅速扩大,用量以10%~20%幅度增加。为满足公众对中药的需求和延长中药产业链、保证其质量,“九五”期间及以后,我国政府大力、积极引导建立国家中药材规范化种植(GAP)基地,在湖北省罗田县九资河示范建立了茯苓规范化种植基地,并制定了相应的规范化种植标准操作规程(SOP)[1]。已有许多研究结果表明茯苓药效的物质基础是其含有的羊毛脂烷类的三萜[2-5],且中药物质基础研究是中药继承、发展、创新的关键科学问题[6]。为保证茯苓药材的质量和为进一步优化其SOP提供科学依据,本文对湖北省罗田县九资河中药材规范化种植基地栽培的茯苓的物质基础进行了研究,分离出14个化合物,根据其理化常数、质谱(MS)和核磁共振波谱(NMR)数据分别鉴定为麦角甾-7,22-二烯-3β-醇(ergosta-7,22-dien-3β-ol,1)、3-表去氢土莫酸(3-epidehydrotumulosic acid,2)、3-O-乙酰基-16α-羟基栓菌酸(3-O-acetyl-16α-hydroxytrametenolic acid,3)、猪苓酸C(polyporenic acid C,4)、去氢茯苓酸(dehydropachymic acid,5)、茯苓酸(pachymic acid,6)、6α-羟基猪苓酸C[6α-hydroxypolyporenic acid C;3-oxo-6,16α-dihydroxy-lanosta-7,9(11),24(31)-trien-21-oic acid,7]、去氢土莫酸(dehydrotumulosic acid,8)、土莫酸(tumulosic acid,9)、29-羟基猪苓酸C(29-hydroxypolyporenic acid C,10)、茯苓羊毛脂酮A(poriacosone A,11)、3β,16α-二羟基羊毛脂-7,9(11),24-三烯-21-酸[3β,16α-dihydroxylanosta-7,9(11),24-trien-21-oic acid,12]、25-羟基茯苓酸(25-hydroxypachymic acid,13)、茯苓羊毛脂酮B(poriacosone B,14)。前文报道了化合物10[7]、11[8]、13[7]和14[8]的详细结构鉴定,本文报道其他化合物详细的结构鉴定。
1 仪器与材料
XT-4A型显微熔点测定仪(北京泰克仪器有限公司,北京),温度计未校正;Thermo Nicolet Nexus 470型傅里叶红外光谱仪(Thermo Nicolet Corporation,USA);PERKIN-ELMER 243B旋光仪(Perkin Elmer Inc.,Wellesley,Massachusetts,USA);Jasco J-810圆二色散光谱仪(JASCO Corporation,Tokyo,Japan);MDS SCIEX API QSTAR型质谱仪(ESI-TOF-MS;Applied Biosystems/MDS Sciex.,Foster,CA,USA)和Finnigan TRACE 2000型质谱仪(EI-MS;Thermo Finnigan Inc.,San Jose,CA,USA);Varian INOVA-500型超导核磁共振仪(Varian Corporation,Palo Alto,CA,USA),四甲基硅烷为内标。半制备高效液相色谱(HPLC)仪(Dionex Co.,CA,USA),色谱柱为Phenomenex Prodigy ODS(250 mm×21.2 mm,10 μm;Phenomenex Inc.,Torrance,CA,USA)。GF254薄层色谱(TLC)硅胶板分别为青岛海洋化工厂(青岛,中国)和Merck公司(Darmstadt,Germany)产品;200~300目柱色谱用硅胶(青岛海洋化工厂)。分析纯乙醇、甲醇(MeOH)、乙酸乙酯(EtOAc)、三氯甲烷(CHCl3)、丙酮、环己烷(北京化工厂)。
实验材料茯苓菌核采自湖北省罗田县九资河茯苓GAP基地,经北京大学药学院杨秀伟教授鉴定为多孔菌科真菌茯苓Poriacocos(Schw.)Wolf.。凭证标本存放在北京大学药学院天然药物及仿生药物国家重点实验室。
2 提取与分离
干燥的茯苓菌核粗粉10.5 kg用95%乙醇水回流提取5次,时间分别为2、1、1、1、1 h;合并提取液、减压回收溶剂,得乙醇提取浸膏130.7 g(收率为1.24%,下同)。取此浸膏加1300 mL甲醇混悬后用2倍量的环己烷萃取7次,合并萃取液、减压回收萃取剂,得环己烷萃取物16.2 g(0.15%)。将残留甲醇液减压蒸干后得到的浸膏分散于1000 mL水中,依次用2倍量EtOAc和水饱和的正丁醇各萃取5次,得EtOAc萃取物36.8 g(0.35%)、正丁醇萃取物17.2 g(0.16%)和萃取后的水溶性部分60.5 g(0.58%)。
将环己烷萃取物16.2 g用硅胶(200~300目)进行柱色谱分离,环己烷-EtOAc(49∶1→30∶1→10∶1→5∶1→3∶1→2∶1→1∶1→0∶1,V/V)梯度洗脱,每100 mL为1个流分,共得到151个流分。所得流分经硅胶TLC检测,相似流分合并后,共得到5个组分(A~E)。组分A(Fr.62~69)再经硅胶(200~300目)柱色谱纯化,环己烷-EtOAc梯度洗脱,将析出的结晶以甲醇重结晶,得到化合物1(40 mg);组分B(Fr.85~89)再经硅胶柱色谱纯化,环己烷-EtOAc(5∶1)洗脱和甲醇重结晶,得到一无色针晶,以半制备HPLC分离,流动相为MeOH-H2O-HCOOH(76∶24∶0.05),得到化合物2(18 mg)。
将EtOAc萃取部分浸膏36.8 g用硅胶(200~300目)柱色谱分离,CHCl3-MeOH(30∶1→10∶1→5∶1→2∶1→1∶1→0∶1)梯度洗脱,每50 mL为一流分,共得到258个流分。洗脱液经硅胶TLC检测,相似流分合并后,共得到5个组分(A~E)。组分A(Fr.6)经甲醇重结晶后为无色针状结晶,经半制备HPLC纯化(MeOH-H2O-HCOOH=80∶20∶0.05),分别得到化合物3(13 mg)和4(24 mg)。组分B(Fr.7~10)经硅胶柱色谱分离,CHCl3-EtOAc(3∶1)洗脱,得到结晶状物质;甲醇重结晶后经半制备性HPLC分离纯化(MeOH-H2O-HCOOH=80∶20∶0.05),分别得到化合物5(90 mg)和6(740 mg)。组分C(Fr.22~46)反复经硅胶柱色谱分离纯化,甲醇重结晶,得到化合物7(16 mg)。组分D(Fr.100~150)反复经硅胶柱色谱分离纯化,甲醇重结晶,将得到的无色结晶以半制备性HPLC分离纯化(MeOH-H2O-HCOOH=75∶25∶0.06),分别得到化合物8(90 mg)和9(44 mg)。组分E(Fr.151~200)反复经硅胶柱色谱分离纯化后再经半制备性HPLC(MeOH-H2O-HCOOH=73∶27∶0.05;60∶40∶0.05)纯化,分别得到化合物10(11 mg)、11(12 mg)、12(10 mg)、13(12 mg)和14(8 mg)。
3 结构鉴定
化合物10[7]、11[8]、13[7]和14[8]的详细结构鉴定见前报。
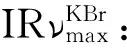
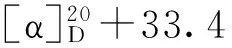
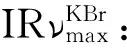
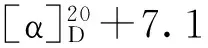


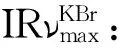
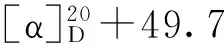
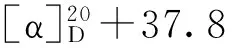
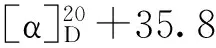
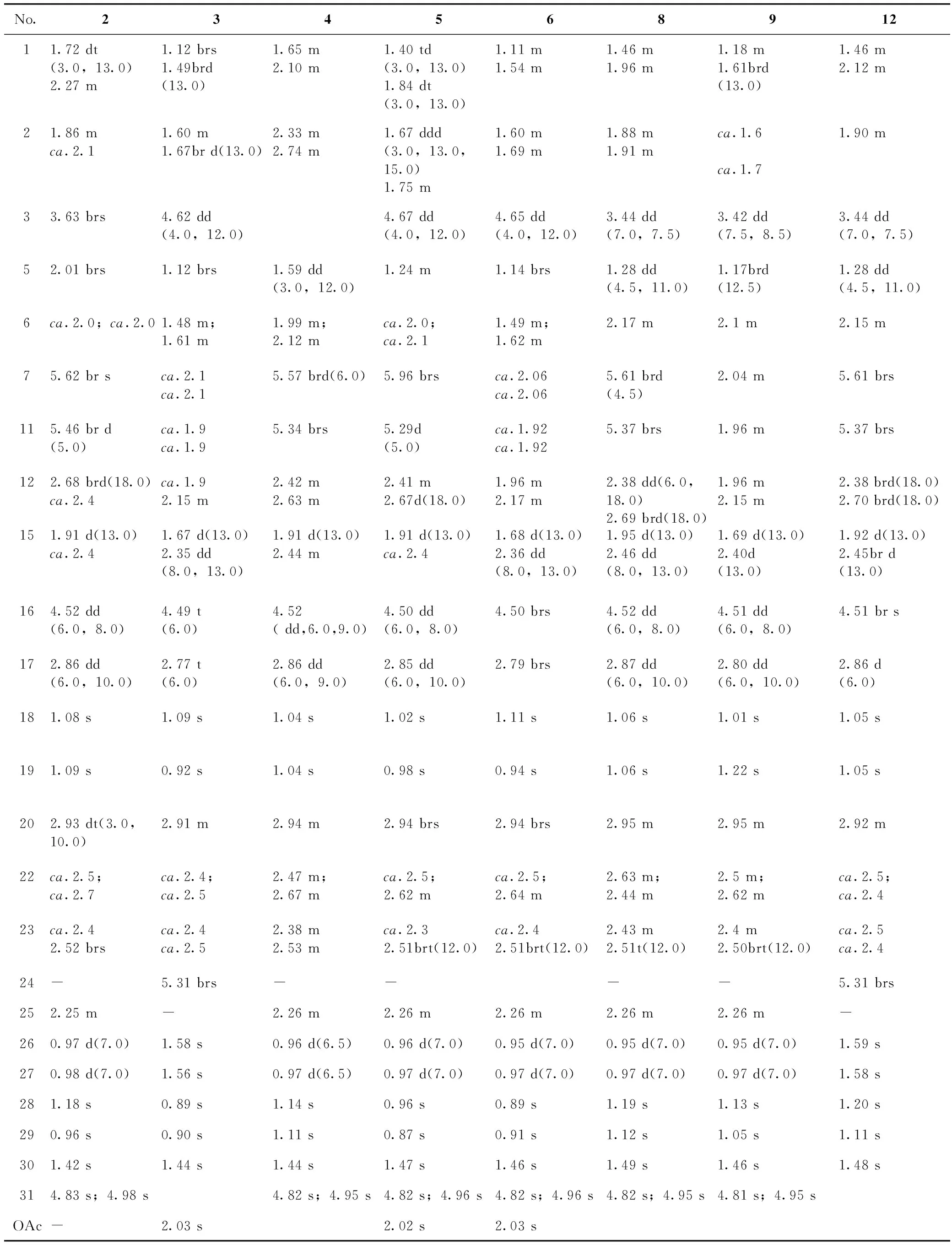
表1 化合物2~6、8、9和12的1H-NMR数据(500 MHz,C5D5N)
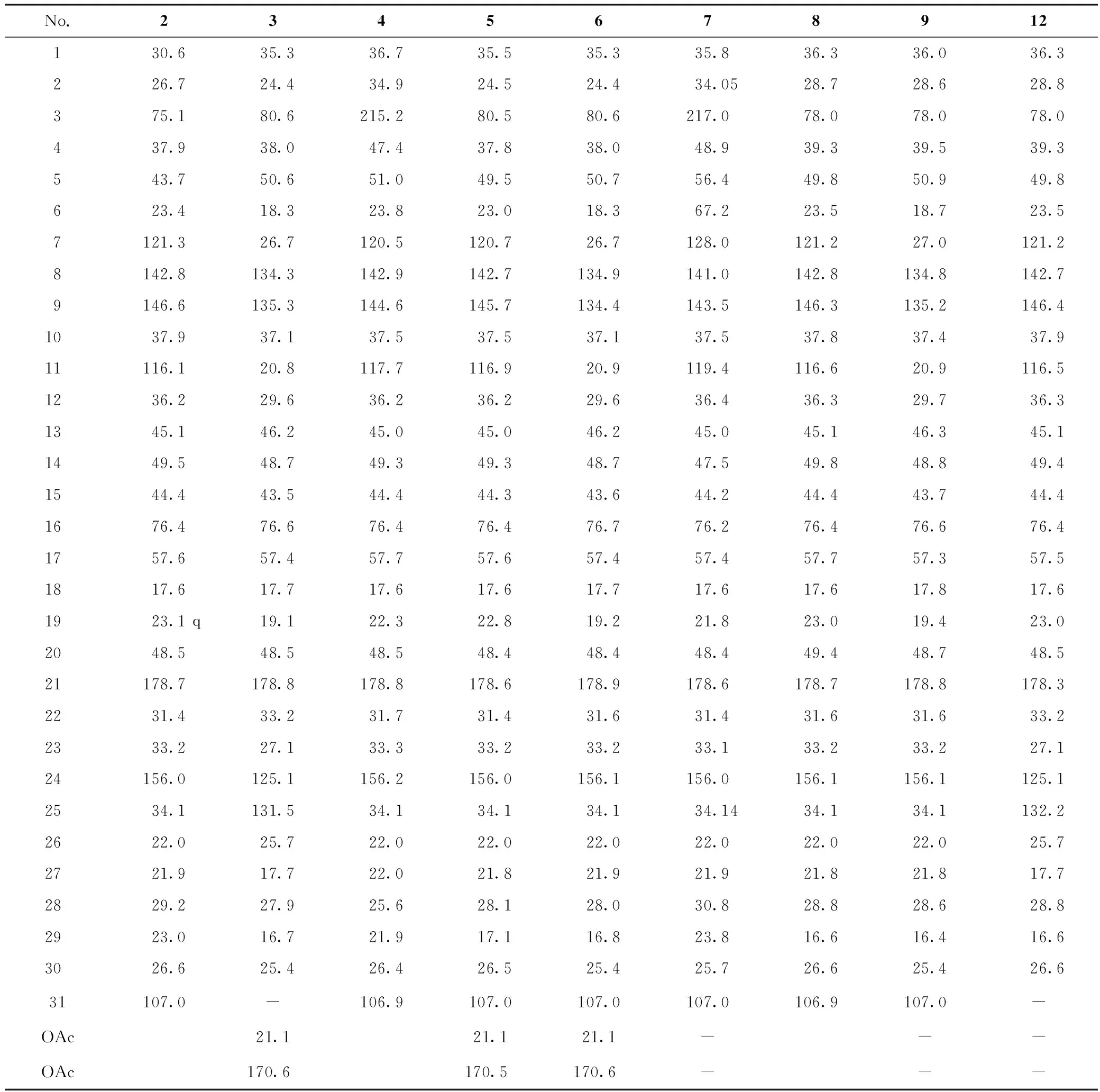
表2 化合物2~9和12的13C-NMR数据(125 MHz,C5D5N)
4 讨论
茯苓分布于中国、韩国、日本、加拿大、美国和澳大利亚等国,中国除东北、西北西部、内蒙古、西藏外均有分布。由于它突出的药用和食用价值及其可栽培性[16-17],引起了世界各国的广泛重视。已有研究结果表明,茯苓具有调节免疫功能、抗肿瘤、抗炎、抗衰老等多方面的药理作用[18],茯苓提取物及含有的猪苓酸C具有增强巨噬细胞产生集落刺激因子的作用,有望在临床上治疗白细胞下降[12]。茯苓含有化学结构特征性强的羊毛脂型三萜[18-21],为主要化学成分。43批次市售茯苓样品分析结果表明,有20个共有成分[20],包括化合物2~6,8,9,茯苓新酸(poricoic acid)BM、E,去氢齿孔酸(dehydroeburicoic acid)和去氢栓菌酸(dehydrotrametenolic acid);体外人源肠Caco-2细胞单层模型预测化合物2、4[22]、6[23]、7[22]可经肠吸收转运进入体内。给大鼠灌胃茯苓提取物,在血浆中仅能检测到化合物6,但在尿液中除可检测到化合物6外,还能检测到茯苓新酸A、B、G、HM,25-羟基茯苓新酸H(25-hydroxyporicoic acid H)和26-羟基茯苓新酸DM(26-hydroxyporicoic acid DM)[21];给大鼠灌胃化合物6,表现出良好的血浆药代动力学性质[24];化合物8在大鼠体外肝微粒体的生物转化研究中可转化为化合物5和9[25]。基于中药体内过程行为已成为中药有效成分和有效效应物质的发现策略之一[26]。上述这些研究结果充分证明茯苓中某些羊毛脂型三萜成分可吸收进入体内,发挥生物学作用。
20世纪70年代以来,福建、广东、广西、云南进行了茯苓的大量引种栽培,近年湖南、四川、浙江、贵州等均有迅速发展;“九五”末期,湖北省承担了“茯苓规范化种植研究”国家课题[27-28],实现了茯苓的规模化种植,“茯苓规范化种植基地优化升级及系列产品综合开发研究”亦列入“十二五”国家科技支撑计划,并于2015年8月14日通过科技部项目验收。茯苓产业在福建和湖南亦得到很大程度的发展。但是,都缺乏与生物活性相关联的全面综合指标性成分质量评价的客观标准。为此,本文研究了湖北省罗田县中药材规范化种植基地栽培茯苓的物质基础,明确了其主要化学成分为羊毛脂型三萜,为其规范化种植SOP的优化升级和质量标准制订提供了科学依据,为其药效物质基础的确定奠定了基础。
[1] 么厉,程恵珍,杨智.中药材规范化种植(养殖)技术指南[M].北京:中国农业出版社,2006:1201-1207.
[2] Akihisa T,Mizushina Y,Ukiya M,et al.Dehydrotrametenonic acid and dehydroeburiconic acid fromPoriacocosand their inhibitory effects on eukaryotic DNA polymerase α and β[J].Biosci Biotechnol Biochem,2004,68(2):448-450.
[3] Ukiya M,Akihisa T,Tokuda H,et al,Inhibition of tumor-promoting effects by poricoic acids G and H and other lanostane-type triterpenes and cytotoxic activity of poricoic acids A and G fromPoriacocos[J].J Nat Prod,2002,65(4):462-465.
[4] Nukaya H,Yamashiro H,Fukazawa H,et al,Isolation of inhibitors of TPA-induced mouse ear edema from Hoelen,Poriacocos[J].Chem Pharm Bull,1996,44(4):847-849.
[5] Tai T,Akita Y,Kinoshita K,et al,Anti-emetic principles ofPoriacocos[J].Planta Med,1995,61(6):527-530.
[6] 杨秀伟.中药物质基础研究是中药继承、发展、创新的关键科学问题[J].中国中药杂志,2015,40(17):3429-3434.
[7] Zheng Y,Yang X W.Two new lanostane triterpenoids fromPoriacocos[J].J Asian Nat Prod Res,2008,10(4):289-292.
[8] Zheng Y,Yang X W.Poriacosones A and B,two new lanostane triterpenoids fromPoriacocos[J].J Asian Nat Prod Res,2008,10(7):640-646.
[9] Keller A C,Maillard M P,Hostettmann K.Antimicrobial steroids from the fungusFomitopsispinicola[J].Phytochemistry,1996,41(4):1041-1046.
[10] Tai T,Shingu T,Kikuchi T,et al.Triterpenes from the surface layer ofPoriacocos[J].Phytochemistry,1995,39(5):1165-1169.
[11] Tai T,Shingu T,Kikuchi T,et al.Isolation of lanostane-type triterpene acids having an acetoxyl group from sclerotia ofPoriacocos[J].Phytochemistry,1995,40(1):225-231.
[12] 李静,黎红,许津.茯苓中集落刺激因子诱生剂的分离鉴定[J].中国药学杂志,1997,32(7):401-403.
[13] Simes J J H,Wootton M,Ralph B J,et al.6α-Hydroxypolyporenic acid C[J].J Chem Soc[Section] D:Chem Commun,1969,19:1150-1151.
[14] 许先栋,许津,顾惠儿,等.茯苓环酮双烯三萜酸的晶体结构和分子结构研究[J].中国药物化学杂志,1994,4(1):23-27.
[15] Tai T.On the constituents ofPoriacocosWolf.Dissertation[G].Kobe:Kobe Gakuin University,1996:74.
[16] Igari N,Minoura S,Sano T,et al.Cultivation of sclerotia ofWolfiporiacocos[J].Nat Med,2000,54(5):237-240.
[17] 傅杰,王克勤,方红,等.茯苓药源及生产栽培现状[J].中药研究与信息,2002,4(2):24-25.
[18] 马玲,尹蕾,王兵,等.茯苓研究进展[J].亚太传统医药,2015,11(12):55-59.
[19] Li S P,Wang Z X,Gu R,et al.A new epidioxy-tetracyclic triterpenoid fromPoriacocosWolf[J].Nat Prod Res,2016,30(15):1712-1717.
[20] Zhou X,Zhang Y S,Zhao Y,et al.An LC fingerprint study ofPoriacocos(Schw.)Wolf[J].Chromatographia,2009,69(11/12),1283-1289.
[21] Ling Y,Chen M C,Wang K,et al.Systematic screening and characterization of the major bioactive components ofPoriacocosand their metabolites in rats by LC-ESI-MSn[J].Biomed Chromatogr,2012,26(9):1109-1117.
[22] 郑艳,杨秀伟.茯苓三萜类化合物在人源Caco-2细胞单层模型中的吸收研究[J].中国中药杂志,2008,33(13):1596-1601.
[23]Zheng Y,Yang X W.Absorption and transport of pachymic acid in the human intestinal cell line Caco-2 monolayers[J].J Chin Integr Med,2008,6(7):704-710.
[24]AlatengqimugeY,YangXW,ZhengY,etal.LCanalysisandpharmacokineticstudyofpachymicacidafterintravenousadministrationtorats[J].Chromatographia,2008,67(9-10):807-811.
[25] 阿拉腾其木格,杨秀伟.去氢土莫酸在大鼠体外肝微粒体中的生物转化研究[J].中国新药杂志,2008,17(15):1303-1307,1325.
[26] 杨秀伟.基于体内过程的中药有效成分和有效效应物质的发现策略[J].中国中药杂志,2007,32(5):365-370.
[27] 王克勤,方红,苏玮,等.茯苓药材规范化种植研究要点[J].中药研究与信息,2001,3(8):13-14.
[28] 王克勤,尹旭仁,黄鹤,等.湖北茯苓生产现状及产业化发展对策[J].中国现代中药,2012,14(12):24-27.
Chemical Constituents from Sclerotium ofPoriacocosCultivated in GAP Base for Chinese Medicinal Materials
ZHENG Yan,YANG Xiuwei*
(State Key Laboratory of Natural and Biomimetic Drugs,Department of Natural Medicines,School of Pharmaceutical Sciences,Peking University,Beijing 100191,China)
Objective:To study the chemical constituents of 95%ethanol aqueous extract of the sclerotium ofPoriacocos(Schw.)Wolf..Methods:The compounds were separated and purified by repeated column chromatography on silica gel and high performance liquid chromatography,and their structures were determined by spectroscopic data analyses.Results:Fourteen compounds were obtained and identified as ergosta-7,22-dien-3β-ol(1),3-epidehydrotumulosic acid(2),3-O-acetyl-16α-hydroxytrametenolic acid(3),polyporenic acid C(4),dehydropachymic acid(5),pachymic acid(6),6α-hydroxypolyporenic acid C(7),dehydrotumulosic acid(8),tumulosic acid(9),29-hydroxypolyporenic acid C(10),poriacosone A(11),3β,16α-dihydroxylanosta-7,9(11),24-trien-21-oic acid(12),25-hydroxypachymic acid(13),poriacosone B(14),respectively.Conclusion:The sclerotium ofP.cocoscultivated in Good Agricultural Practices(GAP)Base for Chinese Medicinal Materials contains abundant and characteristic lanostane-type triterpenoids,which are principal bioactive substance foundation of the sclerotium ofP.cocos.
Poriacocoscultivated in GAP Base for Chinese Medicinal Materials;Poriacocos;Polyporaceae;lanostane-type triterpenoids;bioactive substance foundation
“十二五”国家科技支撑专项(2011BAI07B08)
] 杨秀伟,教授,研究方向:中药有效物质基础;Tel:(010)82801569;E-mail:xwyang@bjmu.edu.cn
10.13313/j.issn.1673-4890.2017.1.009
2016-10-30)
*[
