DNA 甲基转移酶抑制剂 SGI-1027 对人肝细胞癌细胞增殖及凋亡的影响
2017-09-21孙宁张佳林张城硕焦奥陈保民
孙宁,张佳林,张城硕,焦奥,陈保民
(中国医科大学附属第一医院肝胆外科暨器官移植科,沈阳 110001)
DNA 甲基转移酶抑制剂 SGI-1027 对人肝细胞癌细胞增殖及凋亡的影响
孙宁,张佳林,张城硕,焦奥,陈保民
(中国医科大学附属第一医院肝胆外科暨器官移植科,沈阳 110001)
目的探讨 SGI-1027 对肝细胞癌细胞增殖及凋亡的影响。方法给予不同浓度(0、5、10、15、20、25、30 和 35 μmol/L)的SGI-1027 处理 Huh7 细胞 24 h 后,MTS 法检测 SGI-1027 对 Huh7 细胞增殖活性的影响。实验组 Huh7 细胞中加入 SGI-1027 30 μmol/L,对照组 Huh7 细胞中仅加入等量 0.1%DMSO;碘化丙啶染色和流式细胞仪检测 SGI-1027 对 Huh7 细胞周期的影响;Annexin V-FITC/PI双染法和流式细胞仪检测 SGI-1027 对 Huh7 细胞凋亡的影响;TUNEL 染色观察 SGI-1027 处理后 Huh7 细胞形态变化。结果SGI-1027 在 Huh7 细胞中的 IC50为 27.3 μmol/L,SGI-1027 能够抑制 Huh7 细胞增殖,并呈剂量依赖性。SGI-1027不影响 Huh7 细胞周期;SGI-1027 能够诱导 Huh7 细胞凋亡,对照组和实验组的凋亡率分别为(3.242±0.204)%和(46.57±2.512)%(P < 0.05)。TUNEL 染色观察对照组细胞呈圆形,而实验组细胞呈典型凋亡表现,对照组和实验组凋亡细胞百分率分别为(1.077±0.407)%和(58.24±8.427)%(P < 0.05)。结论SGI-1027 能够抑制 Huh7 细胞增殖,并且能够诱导其凋亡。
DNA 甲基化;DNA 甲基转移酶抑制剂;SGI-1027;肝细胞癌
原发性肝癌是我国常见的消化系统恶性肿瘤,发病率排名第 4 位,致死率排名第 3 位[1]。肝细胞癌是原发性肝癌中最常见的一种,其对化疗的不敏感性和易耐药性很大程度上限制了化疗药物在治疗中的应用,而其靶向治疗尚处于起步阶段,索拉非尼对患者生存率的影响甚微。随着研究的不断深入,个体化基因治疗开始引起人们的重视[2]。
近年来,研究[3]发现表观遗传学改变(特别是DNA甲基化)与肿瘤的发生密切相关。哺乳动物的DNA甲基化修饰与抑制基因的表达、亲本印记、X染色体失活和抑制基因组重复元素等有关[4-5]。重复元素的低甲基化会导致基因组不稳定,而基因启动子区高甲基化则与基因沉默、细胞增殖、凋亡和DNA修复有关,所以DNA异常甲基化与肿瘤抑制基因功能失活密切相关[6],但不同于导致基因失活的其他原因,DNA甲基化是一个可逆的过程,因此寻找能够抑制或逆转甲基化的药物是基因治疗的一个关键靶点。
DNA 甲基转移酶(DNA methyltransferases,DNMTs)抑制剂可通过抑制DNA 甲基化的激活恢复抑癌基因的表达活性和功能,从而抑制肿瘤细胞的生长,诱导其凋亡,因此DNMTs抑制剂可作为潜在的抗癌药物应用于癌症治疗[7-9]。最近,非核苷类 DNMTs抑制剂的出现进一步推动了去甲基化治疗的进展。SGI-1027 是一种新型的 DNMTs小分子抑制剂[10-11],它并不通过与 RNA 或 DNA 结合来抑制 DNMTs的活性,而是通过诱导降解DNMTs达到去甲基化的目的。但目前关于 SGI-1027 的去甲基化作用对人肝细胞癌细胞增殖、凋亡的影响尚无研究。因此,本研究主要探讨 SGI-1027对肝细胞癌细胞增殖及凋亡的影响,了解 SGI-1027 的作用机制,为今后去甲基化药物应用于肝细胞癌的治疗提供新的理论和实验依据。
1 材料与方法
1.1 实验材料与仪器
人肝细胞癌细胞Huh7购自中国科学院细胞库;DMEM 培养基(美国 Invitrogen 公司);胎牛血清 FBS(美国 Life Technologies 公司);SGI-1027(美国 Selleck公司);MTS检测试剂盒(美国Promega公司);二甲基亚砜(DMSO,美国MPBIO公司);细胞周期检测试剂盒、细胞凋亡检测试剂盒、TUNEL检测试剂盒(凯基生物技术有限公司);PBS(0.01 mol/L,pH 7.4,福州迈新生物技术开发有限公司);4%多聚甲醛、Triton X-100(索莱宝生物科技有限公司)。酶标仪(美国 Thermo 公司);BD FACSCalibur流式细胞仪(美国 Becton Dickinson 公司);荧光显微镜 DMI4000(德国Leica公司)。
1.2 细胞培养
Huh7细胞单层贴壁生长于配置好的DMEM培养基中,内含 10%胎牛血清、青霉素 G 浓度 100 U/L、链霉素浓度 100 μg/L,37 ℃、5%CO2恒温密闭式培养箱中培养,隔天换液,取对数生长期细胞进行实验。
1.3 细胞增殖活性测定
按 照 药 品 说 明 配 制 SGI-1027 50 mmol/L 储 存液,分装后存放于-80 ℃待用。工作液浓度为 30 μmol/L。细胞铺板密度为 1×104/孔,接种于 96 孔板,培养 24 h 后加入不同浓度(0、5、10、15、20、25、30和 35 μmol/L)的 SGI-1027,其 中 0 组 仅 加 入 0.1% DMSO,24 h 后每孔加入 20 μL MTS 液(注意避光),置于 37 ℃孵箱 4 h。酶标定量仪在波长 490 nm、参考波长为 450 nm 下测定光密度值;细胞存活率(%)=(OD实验组-OD调零孔)/(OD对照组-OD调零孔)×100。测定 SGI-1027 作用于 Huh7 细胞的 IC50为 27.3 μmol/L,故后续实验中选用 30 μmol/L 作为实验组给药浓度,药物处理时间为24 h。
1.4 检测细胞周期
细胞培养同前。细胞铺板密度为 2×105/孔,接种于 6孔板,对照组仅加入 0.1%DMSO,实验组加入30 μmol/L SGI-1027,24 h 后 0.25%不含 EDTA 胰酶消化收集,逐步按照细胞周期检测试剂盒说明书操作,流式细胞仪检测细胞周期。
1.5 检测细胞凋亡
细胞培养、实验分组、细胞铺板、细胞处理及消化细胞方法同前。PBS 洗涤细胞 2 次,2 000 r/min 离心 5 min,收集细胞数不能少于(1~5)×105,逐步按照细胞凋亡检测试剂盒说明书操作,1 h 内流式细胞仪检测细胞凋亡。
1.6 TUNEL染色
细胞培养、实验分组、细胞铺板、细胞处理方法同前。按照TUNEL检测试剂盒说明书要求操作,荧光显微镜下观察细胞形态改变,激发波长 543 nm,发射波长 571 nm,拍照后计数细胞凋亡率。凋亡率(%)=凋亡细胞数/接种细胞数×100。
1.7 统计学分析
采 用 SPSS 19.0 统 计 软 件 对 数 据 进 行 统 计 分析。所有实验均进行3次,数据以x± s表示,细胞增殖活性及 IC50的组间比较采用单因素方差分析,实验组与对照组两两比较采用配对样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 SGI-1027 抑制 Huh7 细胞增殖活性
MTS 法检测不同浓度梯度 SGI-1027 处理 24 h后Huh7 细胞增殖活性的变化。结果显示:当 SGI-1027 的给药剂量达到 20 μmol/L 时便对 Huh7 细胞的增殖活性产生抑制,而当给药剂量达到 35 μmol/L时细胞的增殖活性受到明显的抑制。另外,SGI-1027 作用于 Huh7 细胞的 IC50为 27.3 μmol/L(图 1)。
2.2 SGI-1027 不影响 Huh7 细胞周期
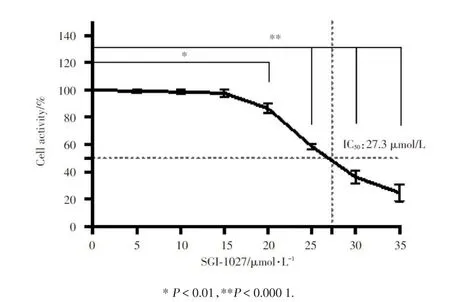
图1 不同浓度SGI-1027对Huh7细胞增殖活性的影响Fig.1 Effect of various concentrations of SGI-1027 on the proliferative viability of Huh7 cells
碘化丙啶(propidium iodide,PI)染色和流式细胞仪检测 SGI-1027 对 Huh7 细胞周期的影响,结果显示:对照组和实验组中 G1期细胞比例分别为(73.810±1.357)%和(72.547±2.724)%;S 期细胞百分比分别为(17.017±1.443)%和(14.140±1.067)%;G2期 细 胞 比 例 分 别(8.377 ± 1.542)% 和(6.110 ± 4.116)%,实验组与对照组间各期细胞比例均无统计学差异(P > 0.05),SGI-1027 并不影响 Huh7 的细胞周期,见图2。
2.3 SGI-1027 促进 Huh7 细胞凋亡
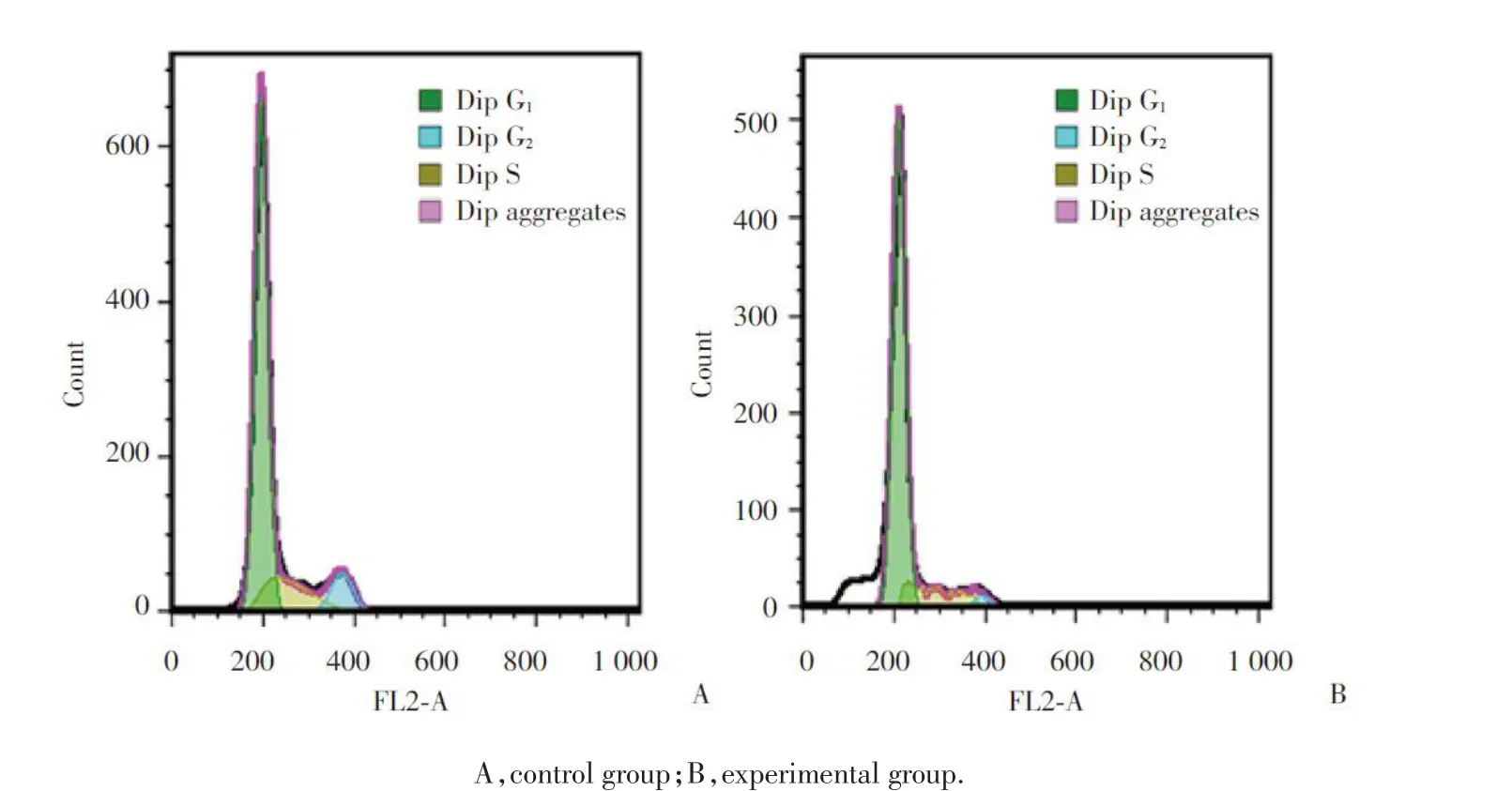
图2 SGI-1027 对 Huh7 细胞周期的影响Fig.2 Effects of SGI-1027 on the cell cycle of Huh7 cells
Annexin V-FITC/PI双染法和流式细胞仪检测实验组和对照组Huh7细胞的凋亡情况,结果显示:实验组 Huh7 细胞在给予 SGI-1027 去甲基化处理 24 h后,可检测到大量早期凋亡细胞和晚期凋亡细胞,而对照组中,不论早期凋亡细胞还是晚期凋亡细胞都很少被检测到,计算对照组和实验组的细胞凋亡率分别为(3.242±0.204)%和(46.57±2.512)%,差异有统计学意义(P< 0.05),见图 3。
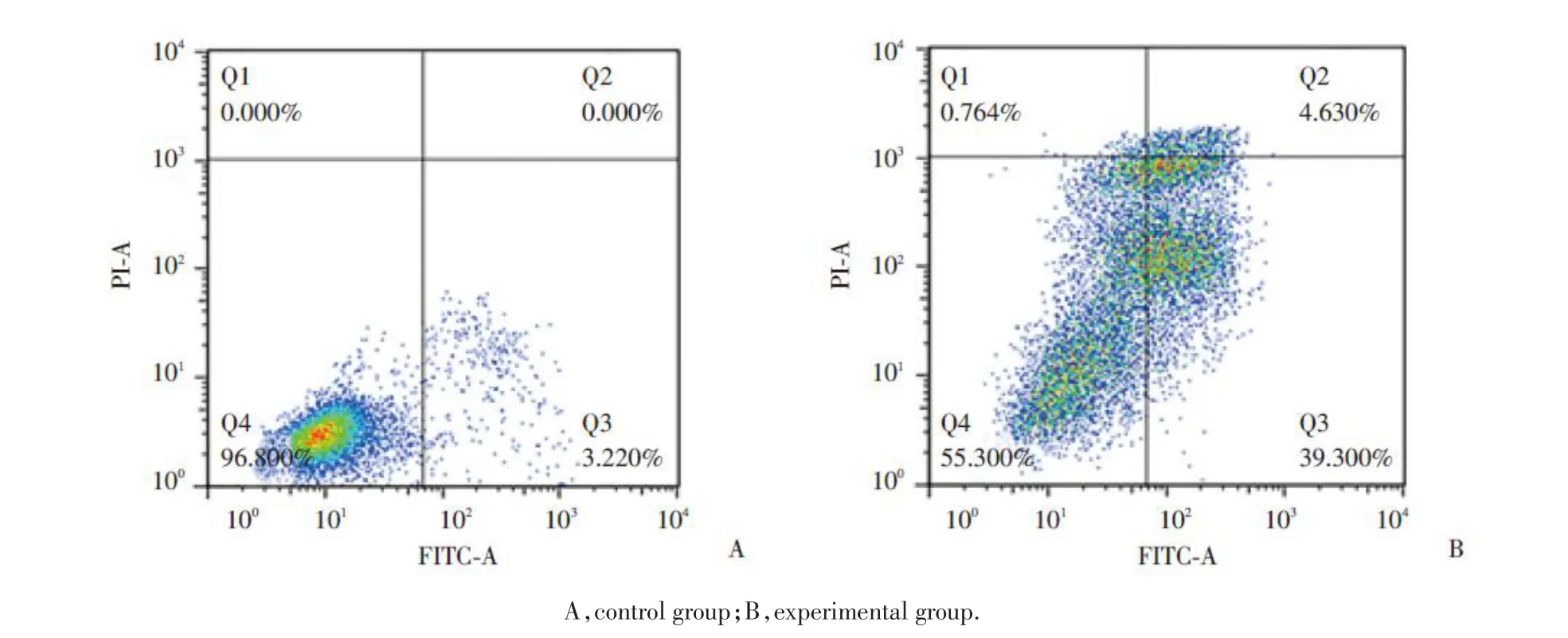
图3 SGI-1027 对 Huh7 细胞凋亡的影响Fig.3 Effect of SGI-1027 on the apoptosis of Huh7 cells
另外,本研究还采用TUNEL染色法对实验组和对照组中Huh7细胞的形态改变进行了观察,同时进一步验证 SGI-1027 对 Huh7 细胞凋亡的促进作用。结果发现:实验组Huh7细胞可观察到细胞收缩、核染色或染色质凝集、细胞凋亡小体形成等典型的细胞凋亡表现,而对照组Huh7细胞形态呈圆形,且实验组中荧光染色后的凋亡细胞比对照组更明亮。对照组和实验组凋亡细胞百分率分别为(1.077± 0.407)% 和(58.240 ± 8.427)% ,差 异 有 统 计 学 意 义(P< 0.05),见图 4。
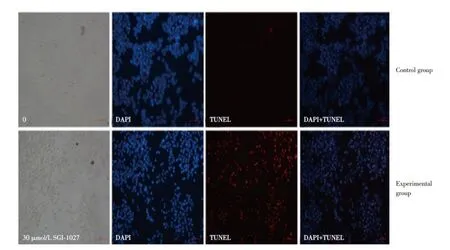
图4 TUNEL染色法观察Huh7细胞形态的改变Fig.4 TUNEL staining was used to observe the morphological changes of Huh7 cells
3 讨论
DNMTs是DNA甲基化修饰中必不可少的关键因素,在其催化下S-腺苷甲硫氨酸的甲基转移到胞嘧啶形成 5-甲基胞嘧啶,从而形成甲基化[12]。因此,对于DNMTs抑制剂的研究成为抗癌药物研究领域的一大热点。近几年来,已有一些DNMTs抑制剂正处于临床前期和临床研究评价阶段,比如5-氮杂胞苷、地西他滨、法扎拉滨等[13]。事实上,地西他滨已通过美国食品药品监督管理局批准,并用于骨髓增生异常综合征的治疗[14]。但这些药物共同的特点是均为核苷类抑制剂,它们可以与DNA结合或同时结合DNA和RNA形成新的产物,所以此类药物性质不稳定和相对较高的细胞毒性限制了其在临床中的应用[15-16]。另外还有 SGI-110(以前称为 S110),它是一种复合抑制剂,含有5-氮杂胞苷核苷酸和脱氧鸟苷的同时含有5-氮杂脱氧胞苷的一部分,虽然研究显示 SGI-110 抑制 DNA 甲基化非常有效,但其稳定性和细胞毒性与地西他滨相同[17]。
SGI-1027是一种新型喹啉类非核苷类抑制剂,性状稳定并具有高度亲脂性(单基团吡啶类似物),它可以通过抑制DNMTs的活性从而达到去甲基化的目的,恢复抑癌基因的活性。此外,它并不与RNA或DNA结合,所以其稳定性和毒性相比传统的核苷类 DNMTs抑制剂低[10]。到目前为止,其去甲基化作用对肿瘤细胞生物学行为的影响尚无研究报道,特别是其抑制肿瘤细胞增殖和诱导细胞凋亡的研究甚少。
本研究中,MTS检测结果显示SGI-1027能够抑制肝细胞癌细胞的增殖活性,并呈剂量依赖性。通常细胞增殖的抑制作用与细胞周期进程和细胞凋亡有关,然而本研究发现 SGI-1027 对 Huh7 的细胞周期没有明显的影响。为了进一步研究 SGI-1027抑制Huh7细胞增殖活性与细胞凋亡之间是否存在一定的关系,本研究使用 Annexin V-FITC/PI双染法及流式细胞仪检测细胞凋亡,同时采用TUNEL染色观察其去甲基化作用对Huh7细胞形态的影响。流式细胞仪分析显示,给予有效剂量的 SGI-1027 去甲基化后,早期和晚期凋亡细胞的比例明显增加。此外,TUNEL 染色显示,SGI-1027 去甲基化与细胞凋亡的形态学改变具有显著相关性。说明 SGI-1027对Huh7细胞增殖活性的抑制主要与其能够诱导细胞凋亡有关,而与细胞周期无关。
综上所述,SGI-1027 去甲基化作用能够在体外抑制Huh7细胞的增殖活性并能诱导Huh7细胞凋亡,这可能与其通过去甲基化作用逆转一些促凋亡基因的异常甲基化状态使其重新表达有关,但具体的分子机制仍需今后进一步的研究和探索。
[1]CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.DOI:10.3322/ caac.21338.
[2]DAI ZJ,TANG W,LU WF,et al.Antiproliferative and apoptotic effects of beta-elemene on human hepatoma HepG2 cells[J].Cancer Cell Int,2013,13(1):27.DOI:10.1186/1475-2867-13-27.
[3]ESTELLER M.Epigenetic gene silencing in cancer:the DNA hypermethylome[J].Hum Mol Genet,2007,16(1):R50-R59.DOI:10.1093/hmg/ddm018.
[4]BONASIO R,TU S,REINBERG D.Molecular signals of epigenetic states[J].Science,2010,330(6004):612-616.DOI:10.1126/science.1191078.
[5]FENG S,JACOBSEN SE,REIK W.Epigenetic reprogramming in plant and animal development[J].Science,2010,330(6004):622-627.DOI:10.1126/science.1190614.
[6]HERMAN JG,BAYLIN SB.Gene silencing in cancer in association with promoter hypermethylation[J].N Engl J Med,2003,349(21):2042-2054.DOI:10.1056/NEJMra023075.
[7]KONDO Y.Epigenetic cross-talk between DNA methylation and histone modifications in human cancers[J].Yonsei Med J,2009,50(4):455-463.DOI:10.3349/ymj.2009.50.4.455.
[8]ESTELLER M.Epigenetics in cancer[J].N Engl J Med,2008,358(11):1148-1159.DOI:10.1056/NEJMra072067.
[9]DEDEURWAERDER S,DEFRANCE M,CALONNE E,et al.Evaluation of the infinium methylation 450K technology[J].Epigenomics,2011,3(6):771-784.DOI:10.2217/epi.11.105.
[10]DATTA J,GHOSHAL K,DENNY WA,et al.A new class of quinoline-based DNA hypomethylating agents reactivates tumor suppressor genes by blocking DNA methyltransferase 1 activity and inducing its degradation[J].Cancer Res,2009,69(10):4277-4285. DOI:10.1158/0008-5472.CAN-08-3669.
[11] GROS C,FLEURY L,NAHOUM V,et al.New insights on the mechanism of quinoline-based DNA methyltransferase inhibitors[J].J Biol Chem,2015,290(10):6293-6302.DOI:10.1074/jbc. M114.594671.
[12] HOLLIDAY R,PUGH JE,DNA modification mechanisms and gene activity during development[J].Science,1975,187(4173):226-232.
[13]GHOSHAL K,BAI S.DNA methyltransferases as targets for cancer therapy[J].Drugs Today(Barc),2007,43(6):395-422.DOI:10.1358/dot.2007.43.6.1062666.
[14]OKI Y,AOKI E,ISSA J.P.Decitabine-bedside to bench[J].Crit Rev Oncol Hematol,2007,61(2):140-152.DOI:10.1016/j.critrevonc.2006.07.010.
[15]GORBUNOVA V,SELUANOV A,MITTELMAN D,et al.Genomewide demethylation destabilizes CTG.CAG trinucleotide repeats in mammalian cells[J].Hum Mol Genet,2004,13(23):2979-2989. DOI:10.1093/hmg/ddh317.
[16]MUND C,HACKANSON B,STRESMANN C,et al.Characterization of DNA demethylation effects induced by 5-Aza-2’-deoxycytidine in patients with myelodysplastic syndrome[J].Cancer Res,2005,65(16):7086-7090.DOI:10.1158/0008-5472.CAN-05-0695.
[17]YOO CB,JEONG S,EGGER G,et al.Delivery of 5-aza-2’-deoxycytidine to cells using oligodeoxynucleotides [J].Cancer Res,2007,67(13):6400-6408.DOI:10.1158/0008-5472.CAN-07-0251.
(编辑 陈 姜)
Effect of DNA Methyltransferase Inhibitor SGI-1027 on Proliferation and Apoptosis of Human Hepatocellular Carcinoma Cells
SUN Ning,ZHANG Jialin,ZHANG Chengshuo,JIAO Ao,CHEN Baomin
(Department of Hepatobiliary and Transplantation Surgery,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo elucidate the inhibitory effect of SGI-1027 on cell proliferation and apoptosis of Huh7 cells.MethodsHuh7 cells were treated with different concentrations(0,5,10,15,20,25,30,and 35 μmol/L)of SGI-1027 for 24 h.MTS assay was performed to detect cell proliferation.Huh7 cells treated with 0.1%DMSO were used as the control group,and those treated with 30 μmol/L SGI-1027 as the experimental group.Flow cytometry was performed to study the cell cycle,and Annexin V-FITC/PI detection for studying cell apoptosis.TUNEL staining was performed to observe changes in cell morphology.ResultsThe results of the MTS assay revealed that SGI-1027 significantly inhibited the proliferation of Huh7 cells in a dose-dependent manner,and the IC50was 27.3 μmol/L.SGI-1027 did not block the cell cycle of Huh7 cells,but induced cell apoptosis in Huh7 cells.The rates of apoptosis were 3.242% ± 0.204%in the control group and 46.57% ± 2.512%in the experimental group(P < 0.05).In the experimental group,typical apoptotic nucleus alterations were observed by fluorescence microscopy after TUNEL staining.The percentage of apoptotic cells was 1.077% ± 0.407%in the control group and 58.24% ± 8.427%in the experimental group(P < 0.05).ConclusionSGI-1027 inhibits Huh7 cell proliferation and induces apoptosis in vitro.
DNA methylation;DNA methyltransferase inhibitor;SGI-1027;hepatocellular carcinoma
R979.1
A
0258-4646(2017)09-0807-05
http://kns.cnki.net/kcms/detail/21.1227.R.20170906.1318.016.html
10.12007/j.issn.0258-4646.2017.09.009
沈阳市科学技术计划(F13-212-9-00)
孙宁(1986-),女,医师,博士.
张佳林,E-mail:jlzcmu@126.com
2017-03-31
网络出版时间:2017-09-06 13:18
