中性粒细胞与晚期动脉粥样硬化关系的研究进展①
2017-09-20王建茹
王建茹 刘 萍
(上海中医药大学附属龙华医院,上海200032)
中性粒细胞与晚期动脉粥样硬化关系的研究进展①
王建茹 刘 萍
(上海中医药大学附属龙华医院,上海200032)
动脉粥样硬化(Atherosclerosis,AS)是一种免疫系统参与的慢性炎症性疾病,常累及大中型动脉,是多种心脑血管疾病主要的共同病理基础。炎症反应和活化的免疫细胞被普遍认为是AS的驱动因素,其中单核细胞、巨噬细胞、不同亚型的淋巴细胞等免疫和炎症细胞对AS病理过程的影响已被广泛的研究[1]。中性粒细胞虽然是人体固有免疫中重要的高效效应细胞,但是因其寿命短、更新迅速、表型变化、缺乏特异性标记等原因,导致在过去一段时间内中性粒细胞在AS病理过程中的作用机制未被研究者重视[1,2]。晚期AS常表现为不稳定粥样斑块及继发性的血栓形成,其中不稳定粥样斑块又以薄的纤维帽,血管微钙化,较大的坏死核及斑块内脆弱的新生微血管为特征[1-5]。近年来,随着研究的不断深入及研究手段和技术的提高,研究者发现并阐释了中性粒细胞的某些功能和作用介导了晚期AS的病理过程。本文拟从纤维帽、动脉粥样硬化钙化、坏死核形成、斑块内血管新生及出血、动脉粥样硬化血栓形成等方面对中性粒细胞在晚期AS中的作用进行综述如下。
1 中性粒细胞与纤维帽的厚薄
纤维帽的厚薄受多种因素影响,但主要依赖于细胞外基质成分(Extracellular matrix components,ECM)合成和降解之间的平衡,中性粒细胞可通过释放蛋白酶降解ECM,而关于其对ECM合成影响的研究较少[6]。基质金属蛋白酶(Matrix metalloproteinases,MMPs)可以降解大量的ECM如弹性蛋白、胶原蛋白、纤维蛋白等导致纤维帽变薄。研究显示中性粒细胞源的胶原酶(MMP-1、MMP-8、MMP-13)通过降低胶原含量促进了AS不稳定斑块的发展[7,8]。有症状的颈动脉粥样硬化患者表现为MMP-2和薄纤维帽呈正相关,同时MMP-9与大的脂质核呈正相关;Anti-ApoA-1 IgG处理ApoE-/-小鼠后,高含量的MMP-9和低含量的胶原与斑块处的中性粒细胞含量呈正相关而不是巨噬细胞[9,10],也就是说中性粒细胞源明胶酶(MMP-2、MMP-9)通过调控斑块处胶原的含量影响了纤维帽的厚度。中性粒细胞弹性蛋白酶(Neutrophil elastase,NE)与巨噬细胞弹性蛋白酶一样也可降解弹性蛋白、胶原、纤连蛋白、蛋白多糖,并且与不稳定斑块具有相关性,但NE能否作为AS潜在的标志仍需进一步研究[1]。髓过氧化物酶(Myeloperoxidase,MPO)是中性粒细胞活化后释放的高含量的初级颗粒,可作为AS的危险标记[11]。易损AS斑块与中性粒细胞源的MPO浸润具有相关性,MPO产生的活性氧(Reactive oxygen species,ROS)可以提高MMP-8、MMP-9的活性,增强白细胞的聚集和ECM的降解,影响纤维帽的稳定性[12]。
2 中性粒细胞与动脉粥样硬化钙化
血管钙化虽然是AS发展过程中的不利事件,但证据显示,斑块形成后血管钙化可能具有双重作用,既能促进不稳定、易破裂斑块的形成也可稳定粥样斑块。在炎症条件下,血管平滑肌细胞和巨噬细胞释放的基质小泡以及血管平滑肌细胞、巨噬细胞凋亡体中的钙在病变处沉积并形成微钙化,而微钙化又进一步诱导炎症反应和钙沉积,这种正反馈机制能引起纤维帽变薄并增加其局部应力,有利于不稳定斑块的形成;在弱炎症条件及促成骨环境中,血管平滑肌细胞存活增多并向成骨分化转移形成片状钙化,促进斑块的稳定及纤维化[3,13]。中性粒细胞与淋巴细胞比值(Neutrophil-to-lymphocyte ratio,NLR)与AS密切相关,高NLR水平能预测AS的病理进展,与动脉硬化、冠状动脉钙化积分独立相关[14,15]。大样本队列研究显示,NLR与冠状动脉疾病的患病率、病变程度有密切的关系,与冠状动脉狭窄、钙化、冠脉内血栓形成具有正相关性[16]。NLR能反映缺血性中风患者主动脉弓钙化的严重程度,早期NLR水平的异常有助于发现2型糖尿病和糖尿病视网膜病变患者的亚临床AS病变[17,18]。以上研究表明,中性粒细胞参与了动脉粥样硬化钙化,但其具体调控机制仍需进一步探索。
3 中性粒细胞与坏死核的形成
坏死核的形成是晚期AS不稳定斑块的重要病理特征,凋亡的血管平滑肌细胞和巨噬细胞不能被吞噬细胞及时清除,随之形成继发性坏死,这一过程是坏死核形成的主要原因[5,19]。近几年的研究发现,人和鼠晚期AS病变处均有大量中性粒细胞的聚集,表明中性粒细胞可能参与了AS坏死核的形成过程[8,20]。胞葬作用是指巨噬细胞等吞噬细胞通过寻我信号分子、食我信号分子及调理素将凋亡细胞清除的过程,其在AS的发展过程中具有重要的作用[19,21]。
调理素乳脂肪球表皮生长因子8蛋白(Milk fat globule-egf factor 8 protein,MFG-E8)一方面与凋亡细胞上的“食我信号”磷脂酰丝氨酸(Phosphatidylserine,PS)结合,另一方面与吞噬细胞上的整合素结合促进胞葬作用。中性粒细胞释放的高迁移率族蛋白1(High mobility group box-1 protein,HMGB1)与凋亡细胞上的PS结合抑制巨噬细胞的胞葬作用但对非PS依赖形式的胞葬作用无影响,同时也能与MFG-E8竞争性的结合αvβ3[22]。晚期糖基化终末产物受体(Receptor for advanced glycation end products,RAGE)与凋亡细胞上的PS结合促进了胞葬作用,HMGB1作为RAGE的配体与RAGE竞争性的结合PS抑制胞葬作用[23]。中性粒细胞通过释放一些蛋白酶裂解胞葬作用相关信号分子来抑制胞葬作用,如释放基质金属蛋白酶ADAM17裂解CD36和原癌基因酪氨酸激酶(MER proto-oncogene,tyrosine kinase,MerTK)[24,25];中性粒细胞源丝氨酸蛋白酶裂解C5aR使其不能与凋亡细胞释放的寻我信号核糖体蛋白S19低聚物结合,减少凋亡细胞的清除[26,27]。另外,中性粒细胞可以促进脂质的氧化,这些氧化的脂质与凋亡细胞具有相似的抗原表位,一方面与凋亡细胞竞争性的结合吞噬细胞,另一方面又可进一步损伤胞葬作用相关信号分子[5,12,19,21]。以上研究表明,中性粒细胞通过抑制胞葬作用参与了坏死核的形成。在AS晚期阶段,吞噬细胞的胞葬作用功能障碍导致大量凋亡的中性粒细胞聚集及继发性坏死,同时中性粒细胞寿命短且易自发凋亡,这表明除了巨噬细胞和血管平滑肌细胞的凋亡,中性粒细胞的凋亡在坏死核的形成中也具有重要的作用。
4 中性粒细胞与斑块内血管新生及出血
缺血、缺氧、炎症是晚期AS斑块内血管新生的重要条件,中性粒细胞自身就是促炎细胞可以使单核细胞向斑块处募集,诱导M1型和泡沫化的巨噬细胞,进而加重炎症反应[4,6,28];在AS病变处脂质、促炎因子等多种胞外刺激能诱导中性粒细胞呼吸爆发产生大量的ROS,耗氧增加[11];另外,斑块内新生血管通透性强可作为血液中炎性细胞、脂质成分、红细胞等渗入斑块的通道,进一步加重斑块内的炎症反应及缺氧微环境,促进斑块内血管新生[4]。
斑块内新生血管的不成熟是斑块内出血的主要原因,新生血管内皮细胞间结合欠佳,基膜不完整,管壁薄且脆性大易破裂出血。中性粒细胞分泌的蛋白酶参与了血管生成素-1(Angiopoietin-1,Ang-1)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)等促血管生成因子的降解,同时Ang-1的降解还能引起血管生成素-2(Angiopoietin-2,Ang-2)相对性增多,而Ang-2的增多能增加内皮细胞的凋亡和微血管的炎症,促进斑块内出血[4]。促动脉粥样硬化因子裂解斑块内的红细胞,大量的血红蛋白、血红素铁被释放出来进而催化氧化应激反应,损伤斑块内不成熟的新生血管,引起斑块内出血[4,29]。斑块内的巨噬细胞能通过CD163清除沉积在病变处的血红蛋白和亚铁血红素,中性粒细胞弹性蛋白酶却能裂解CD163胞外域降低巨噬细胞清除血红蛋白的能力[30]。另外,活化的中性粒细胞颗粒蛋白MPO、NADPH氧化酶等产生大量的ROS加剧了斑块内促氧化的微环境。
综上所述,晚期AS病变处的中性粒细胞能创造斑块内血管新生所需的缺氧、炎症条件,而新生血管又可作为血液中的中性粒细胞渗入斑块内的通道,促进了斑块内血管新生;同时,中性粒细胞通过降解促血管生成因子,增强氧化应激反应,加剧了斑块内新生血管的不成熟状态,诱导了斑块内出血。
5 中性粒细胞与动脉粥样硬化血栓形成
晚期不稳定粥样斑块的破裂及继发性血栓形成是急性心血管事件的主要诱因。多项临床研究从人闭塞的冠状动脉提取血栓标本并分析其成分,结果发现血小板、红细胞、活化的中性粒细胞是斑块破裂后动脉血栓的主要组成成分[31]。中性粒细胞可能通过释放大量ROS、MMPs导致内皮细胞表面缺损、斑块破裂以及中性粒细胞与血小板相互作用,促进了AS血栓形成[32]。中性粒细胞在AS发展过程中对炎症与凝血之间的联系发挥着重要作用。Borissoff等分别用FII-/WTApoE-/-小鼠和TMPro/ProApoE-/-小鼠构建血液凝固性降低和增强的模型小鼠,研究血液凝血状态在AS发病机制中的作用,结果发现中性粒细胞及其蛋白酶与凝血级联反应具有潜在的相关性[33]。
中性粒细胞胞外诱捕网(Neutrophil extracellular traps,NETs)是活化的中性粒细胞形成的一种胞外网状结构,它以去致密化的染色质为框架,其上附着有中性粒细胞的颗粒蛋白如NE、MPO、组蛋白、组织蛋白酶G等。NETs的组蛋白、核酸、丝氨酸蛋白酶、组织因子等能激活内外途径凝血级联反应导致AS血栓形成,另外NETs还可通过与内皮细胞、血小板、红细胞等相互作用促进血栓形成[34,35]。Megens等[36]首次报道人和鼠AS病变处均有NETs的存在,其他多项临床研究也均发现NETs参与了AS血栓形成并且NETs可以作为预测AS严重程度、促凝状态及未来心血管事件的生物学标记[37]。
既往的观点认为AS和静脉血栓栓塞(Venous thromboembolism,VTE)是两个不同病理特征的疾病,但近几年的研究显示,两者之间有着一定的联系。VTE和AS血栓形成存在一些共同的危险因素,VTE患者显著增加了AS血栓形成的各种临床表现,AS血栓形成导致的有症状的心血管事件(如心肌梗死)同样也能提高患者形成VTE的概率,因此有学者推测静脉和动脉血栓形成是一个疾病的两个方面[38-40]。NETs不仅可以导致AS血栓形成,而且还参与了VTE的病理过程,另外,中性粒细胞源的微粒(Neutrophil-derived microparticles,NMPs)具有促凝的作用,参与了AS血栓形成和VTE的病理过程,也就是说NETs和中性粒细胞源的微粒可能在AS血栓形成和VTE的发生发展过程中发挥着重要的链接作用[11,40]。
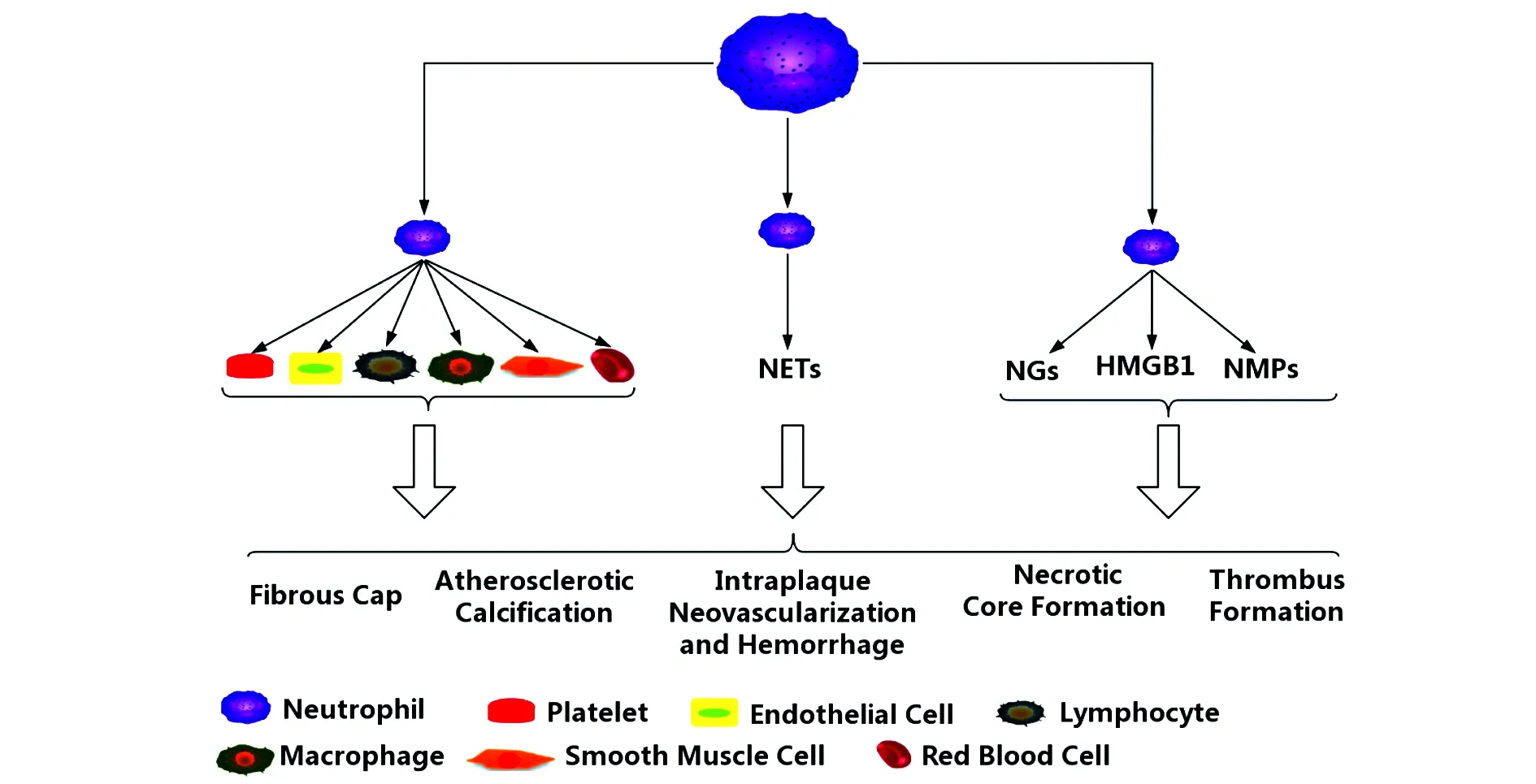
图1 中性粒细胞在晚期动脉粥样硬化中的作用Fig.1 Role of neutrophils in advanced atherosclerosisNote: NGs.Neutrophil granules;NMPs.Neutrophil-derived microparticles;NETs.Neutrophil extracellular traps;HMGB1.High mobility group box-1 protein.
6 总结与展望
综上所述,中性粒细胞通过释放颗粒蛋白、形成NETs及与其他细胞相互作用参与了晚期AS的相关病理过程(见图1)。尽管学者们进行了大量的临床和实验研究证明了中性粒细胞介导了晚期AS的发展,但现阶段的研究仍存在一些不足和盲区,比如中性粒细胞导致动脉粥样硬化钙化形成的具体病理机制以及调控微钙化和片状钙化互相转化的分子机制仍未彻底阐释,需要进一步探索;有关中性粒细胞是否可以通过调控ECM的合成影响纤维帽厚薄的研究较少;另外,NETosis(NETs的形成过程称之为NETosis)是一种特殊的与细胞凋亡、坏死均不同的细胞死亡类型,不表现“食我信号”(凋亡细胞特征性标记磷脂酰丝氨酸外翻),因此不能被吞噬细胞胞葬作用清除,而其被清除的具体机制目前尚未有相关报道。目前证据显示,中性粒细胞促进了晚期AS的进展,增加了AS病理机制的复杂性,同时也表明针对中性粒细胞的治疗策略可能是防治晚期AS的潜在性靶点;但是,中性粒细胞是人体防御病原体侵袭的第一道防线,直接影响中性粒细胞功能的治疗方法需要特别注意。总之,深入探索中性粒细胞在晚期AS中的致病作用,对全面理解AS的形成和有效地防治晚期动脉粥样硬化及与其相关的心脑血管疾病有着重要的意义。
[1] Carbone F,Mach F,Montecucco F.Update on the role of neutrophils in atherosclerotic plaque vulnerability[J].Curr Drug Targets,2015,16(4):321-333.
[2] Pende A,Artom N,Bertolotto M,etal.Role of neutrophils in atherogenesis:an update[J].Eur J Clin Invest,2016,46(3):252-263.
[3] Pugliese G,Iacobini C,Blasetti Fantauzzi C,etal.The dark and bright side of atherosclerotic calcification[J].Atherosclerosis,2015,238(2):220-230.
[4] Chistiakov DA,Orekhov AN,Bobryshev YV.Contribution of neovascularization and intraplaque haemorrhage to atherosclerotic plaque progression and instability[J].Acta Physiol (Oxf),2015,213(3):539-553.
[5] Silvestre-Roig C,de Winther MP,Weber C,etal.Atherosclerotic plaque destabilization:mechanisms,models,and therapeutic strategies[J].Circ Res,2014,114(1):214-226.
[6] Soehnlein O.Multiple roles for neutrophils in atherosclerosis[J].Circ Res,2012,110(6):875-888.
[7] Jickling GC,Liu D,Ander BP,etal.Targeting neutrophils in ischemic stroke:translational insights from experimental studies[J].J Cereb Blood Flow Metab,2015,35(6):888-901.
[8] Rotzius P,Thams S,Soehnlein O,etal.Distinct infiltration of neutrophils in lesion shoulders in ApoE-/-mice[J].Am J Pathol,2010,177(1):493-500.
[9] Heo SH,Cho CH,Kim HO,etal.Plaque rupture is a determinant of vascular events in carotid artery atherosclerotic disease:involvement of matrix metalloproteinases 2 and 9[J].J Clin Neurol,2011,7(2):69-76.
[10] Montecucco F,Vuilleumier N,Pagano S,etal.Anti-Apolipoprotein A-1 auto-antibodies are active mediators of atherosclerotic plaque vulnerability[J].Eur Heart J,2011,32(4):412-421.
[11] Chistiakov DA,Bobryshev YV,Orekhov AN.Neutrophil′s weapons in atherosclerosis[J].Exp Mol Pathol,2015,99(3):663-671.
[12] Hartwig H,Silvestre Roig C,Daemen M,etal.Neutrophils in atherosclerosis.A brief overview[J].Hamostaseologie,2015,35(2):121-127.
[13] Shanahan CM.Inflammation ushers in calcification:a cycle of damage and protection?[J].Circulation,2007,116(24):2782-2785.
[14] Balta S,Celik T,Mikhailidis DP,etal.The relation between atherosclerosis and the neutrophil-lymphocyte ratio[J].Clin Appl Thromb Hemost,2016,22(5):405-411.
[15] Park BJ,Shim JY,Lee HR,etal.Relationship of neutrophil-lymphocyte ratio with arterial stiffness and coronary calcium score[J].Clin Chim Acta,2011,412(11-12):925-929.
[16] Verdoia M,Barbieri L,Di Giovine G,etal.Neutrophil to lymphocyte ratio and the extent of coronary artery disease:results from a large cohort study[J].Angiology,2016,67(1):75-82.
[17] Zhou S,Cai B,Zhang Y,etal.The relationship between neutrophil-to-lymphocyte ratio and aortic arch calcification in ischemic stroke patients[J].J Stroke Cerebrovasc Dis,2017,26(6):1228-1232.
[18] Wang RT,Zhang JR,Li Y,etal.Neutrophil-lymphocyte ratio is associated with arterial stiffness in diabetic retinopathy in type 2 diabetes[J].J Diabetes Complications,2015,29(2):245-249.
[19] Kojima Y,Weissman IL,Leeper NJ.The role of efferocytosis in atherosclerosis[J].Circulation,2017,135(5):476-489.
[20] Ionita MG,vanden Borne P,Catanzariti LM,etal.High neutrophil numbers in human carotid atherosclerotic plaques are associated with characteristics of rupture-prone lesions[J].Arterioscler Thromb Vasc Biol,2010,30(9):1842-1848.
[21] Linton MF,Babaev VR,Huang J,etal.Macrophage apoptosis and efferocytosis in the pathogenesis of atherosclerosis[J].Circ J,2016,80(11):2259-2268.
[22] Friggeri A,Yang Y,Banerjee S,etal.HMGB1 inhibits macrophage activity in efferocytosis through binding to the alphavbeta3-integrin[J].Am J Physiol Cell Physiol,2010,299(6):C1267-1276.
[23] Friggeri A,Banerjee S,Biswas S,etal.Participation of the receptor for advanced glycation end products in efferocytosis[J].J Immunol,2011,186(11):6191-6198.
[24] Driscoll WS,Vaisar T,Tang J,etal.Macrophage ADAM17 deficiency augments CD36-dependent apoptotic cell uptake and the linked anti-inflammatory phenotype[J].Circ Res,2013,113(1):52-61.
[25] Garbin U,Baggio E,Stranieri C,etal.Expansion of necrotic core and shedding of Mertk receptor in human carotid plaques:a role for oxidizedpolyunsaturated fatty acids?[J].Cardiovasc Res,2013,97(1):125-133.
[26] Van den Berg CW,Tambourgi DV,Clark HW,etal.Mechanism of neutrophil dysfunction:neutrophil serine proteases cleave and inactivate the C5a receptor[J].J Immunol,2014,192(4):1787-1795.
[27] Nishiura H,Zhao R,Yamamoto T.The role of the ribosomal protein S19 C-terminus in altering the chemotaxis of leucocytes by causing functional differences in the C5a receptor response[J].J Biochem,2011,150(3):271-277.
[28] Horckmans M,Ring L,Duchene J,etal.Neutrophils orchestrate post-myocardial infarction healing by polarizing macrophages towards a reparative phenotype[J].Eur Heart J,2017,38(3):187-197.
[29] Michel JB,Martin-Ventura JL,Nicoletti A,etal.Pathology of human plaque vulnerability:mechanisms and consequences of intraplaque haemorrhages[J].Atherosclerosis,2014,234(2):311-319.
[30] Moreno JA,Ortega-Gómez A,Delbosc S,etal.In vitro and in vivo evidence for the role of elastase shedding of CD163 in human atherothrombosis[J].Eur Heart J,2012,33(2):252-263.
[31] Badimon L,Vilahur G.Neutrophil extracellular traps:a new source of tissue factor in atherothrombosis[J].Eur Heart J,2015,36(22):1364-1366.
[32] Gomes Quinderé AL,Benevides NM,Carbone F,etal.Update on selective treatments targeting neutrophilic inflammation in atherogenesis and atherothrombosis[J].Thromb Haemost,2014,111(4):634-646.
[33] Borissoff JI,Otten JJ,Heeneman S,etal.Genetic and pharmacological modifications of thrombin formation in apolipoprotein e-deficient mice determine atherosclerosis severity and atherothrombosis onset in a neutrophil-dependent manner[J].PLoS One,2013,8(2):e55784.
[34] Badimon L,Vilahur G.Neutrophil extracellular traps:a new source of tissue factor in atherothrombosis[J].Eur Heart J,2015,36(22):1364-1366.
[35] Branzk N,Papayannopoulos V.Molecular mechanisms regulating NETosis in infection and disease[J].Semin Immunopathol,2013,35(4):513-530.
[36] Megens RT,Vijayan S,Lievens D,etal.Presence of luminal neutrophil extracellular traps in atherosclerosis[J].Thromb Haemost,2012,107(3):597-598.
[37] Döring Y,Soehnlein O,Weber C.Neutrophil Extracellular Traps in Atherosclerosis and Atherothrombosis[J].Circ Res,2017,120(4):736-743.
[38] Undas A.Atherosclerosis and venous thromboembolism-similarities[J].Kardiol Pol,2013,71(12):1223-1228.
[39] Riva N,Donadini MP,Ageno W.Epidemiology and pathophysiology of venous thromboembolism:similarities with atherothrombosis and the role of inflammation[J].Thromb Haemost,2015,113(6):1176-1183.
[40] Mozzini C,Garbin U,Fratta Pasini AM,etal.An exploratory look at NETosis in atherosclerosis[J].Int Emerg Med,2017,12(1):13-22.
[收稿2017-03-13]
(编辑 张晓舟)
10.3969/j.issn.1000-484X.2017.09.031
①本文为国家自然科学基金资助项目(No.81573739)。
王建茹(1988年-),男,博士,主治医师,主要从事中西医结合心血管疾病的诊疗和预防研究。
及指导教师:刘 萍(1966年-),女,博士,教授,主任医师,博士生导师,主要从事中西医结合防治心血管疾病的研究。
R54
A
1000-484X(2017)09-1418-04
