抗TSLP全人源单链抗体的体外亲和力成熟①
2017-09-20先德群年四季叶迎春徐文峰
先德群 年四季 叶迎春 徐文峰 袁 青
(西南医科大学基础医学院,泸州646000)
抗TSLP全人源单链抗体的体外亲和力成熟①
先德群 年四季 叶迎春 徐文峰 袁 青②
(西南医科大学基础医学院,泸州646000)
目的:对抗TSLP-scFv全人源单链抗体进行单点突变,以提高其亲和力。方法:本研究前期筛选了特异性好的抗TSLP-scFv,本研究利用Discovery Studio系统模拟TSLP和抗TSLP-scFv 三维结构,进行分子对接,对结合表位氨基酸进行随机突变,选取可显著提高其亲和力的氨基酸突变点,根据突变位点设计引物,采用重叠延伸PCR对氨基酸位点进行突变。将突变后的scFv基因与表达载体pLZ16连接,转化E.coli DH5αF′,表达后筛选亲和力提高的抗TSLP-scFv。结果:DS系统筛选出可以提高scFv亲和力的5个单点突变氨基酸位点,PCR扩增出突变后的抗TSLP-scFv DNA片段大小为1 000 bp左右。将测序正确的菌株进行表达,通过ELISA筛选出与抗原结合力提升的抗TSLP-scFv;通过生物大分子相互作用技术,测定单抗的亲和力,突变后的scFv M4亲和力较突变前提高了10倍左右。结论:成功提升了抗TSLP-scFv全人源单链抗体的亲和力。
抗TSLP-scFv;全人源单链抗体;分子对接;亲和力
胸腺基质淋巴细胞生成素(Thymic stromal lymphopoietin,TSLP)是具有四螺旋束折叠结构的短链型细胞因子,与 IL-7类似,属于IL-2细胞因子家族成员[1]。由Firend等[2]首次从胸腺基质细胞培养上清液中分离而得名。人TSLP基因位于染色体5q22.1,邻近特应性细胞因子基因簇5q31,该基因簇主要编码Th2型细胞因子IL-4、IL-5、IL-9和IL-13[3]。在肺和皮肤的上皮细胞中发现了最高水平的TSLP,并且成纤维细胞、ASMC(气道平滑肌细胞)、内皮细胞、肥大细胞、巨噬细胞/单核细胞、粒细胞和DC(树突状细胞)也能产生TSLP[4]。TSLP通过激活髓样树突状细胞(mDC),促进Th0细胞向Th2型细胞分化,产生大量的IL-4、IL-13、IL-5和TNF-α等Th2型细胞因子,从而导致过敏性炎症的发生[5]。TSLP也能作用于CD4+T细胞和肥大细胞,增强Th2型炎症反应[6,7]。最近的研究发现,TSLP与多种肿瘤也存在相关性。在乳腺癌、肺癌、皮肤T细胞淋巴瘤、急性B淋巴细胞性白血病(B-ALL)和宫颈癌等疾病中,TSLP表达量均上升[8-12]。
以上研究表明,针对TSLP和TSLPR信号通路,制备抗TSLP的中和性抗体,将会为多种疾病提供新的治疗方法。本研究前期筛选了抗TSLP单链抗体,但其亲和力不高。目前采用Discovery Studio (DS)系统对单链抗体进行单点突变以提高其亲和力,并进行了实验验证,从而制备亲和力高的抗TSLP全人源单链抗体。
1 材料与方法
1.1材料 引物由Invitrogen公司合成;pLZ16载体为PUC质粒改进后的载体;ExTaq酶、T4 DNA连接酶、NotⅠ和NcoⅠ限制性内切酶购自TaKaRa公司;DNA marker标准分子量1 000 bp、2 000 bp购自TaKaRa公司;高纯度质粒小提试剂盒购自康为世纪公司;标准蛋白rHuTSLP、E.coli DH5αF′购自Gene公司。
1.2方法
1.2.1抗TSLP全人源单链抗体基因突变点的选定 将本研究前期筛选得到的抗TSLP全人源单链抗体序列与TSLP抗原序列输入DS软件系统,与NCBI晶体库模型比对,选择与目标序列相似度最高的晶体结构,进行同源建模。将抗TSLP-scFv作为受体、TSLP作为配体,通过ZDOCK软件程序对蛋白分子进行柔性对接,然后使用RDOCK将对接结果优化。通过计算分析抗原-抗体结合表位,选取24个关键氨基酸进行饱和突变,最终选择5个可以提高抗体亲和力的氨基酸进行单点突变。
1.2.2抗TSLP突变基因的扩增 根据选定的5个突变位点,利用重叠延伸PCR原理分别设计引物(表1),送至Invitrogen公司合成,分别对突变点M1、M2、M3、M4、M5进行突变。以前期筛选的含抗TSLP单链抗体基因的质粒为模板,每个突变位点的引物相互配对,分别进行PCR扩增。扩增程序为94℃ 2 min, 98℃ 30 s,55℃ 30 s, 72℃ 1 min,32次循环,最后72℃延伸10 min。将扩增后每个位点前、后两部分产物分别配对,按94℃ 2 min,98℃ 30 s,60℃ 30 s, 72℃ 1 min,10次循环, 72℃延伸10 min 扩增后,加入上游引物scFv84F-TSLP,下游引物KM168,再按以上程序扩增20个循环,得到5个突变后的抗TSLP-scFv PCR产物。
1.2.3突变后单链抗体的克隆和表达 将突变后的单链抗体PCR产物与表达载体pLZ16(含FLAG和His-tag标签)分别进行NotⅠ和NocⅠ双酶切,使用T4 DNA连接酶连接后转入DH5αF′感受肽中。将测序正确的阳性克隆子与突变前的scFv菌株过夜培养后,取5 ml 接种到100 ml LBA (含终浓度为100 μg/ml氨苄青霉素)的培养基中,37℃,200 r/min培养至OD600=0.6 左右,加入终浓度为1 mmol/L IPTG 于32℃诱导表达5 h 。收集沉淀,使用1×PBS重悬沉淀后,于冰上超声破碎细菌,离心收集上清用于检测。
1.2.4ELISA检测单链抗体的表达水平 用包被液50 μl+单链抗体(scFv-TSLP和M4)上清50 μl混匀后包被酶标孔,37℃包被2 h。加封闭液(1×PBST 含5% 脱脂奶粉)37℃封闭1 h后,加入Anti-Flag-HRP, 37℃保温湿育1 h。洗涤后用TMB显色液室温避光显色30 min,于OD450处读取吸光值。
1.2.5间接ELISA检测单链抗体 采用包被液(0.1 mol/L NaHCO3/Na2CO3溶液,pH9.6)稀释TSLP纯化蛋至终浓度为50 g/ml,于4℃过夜包被酶标孔,加入封闭液( 1 × PBST 含5% 脱脂奶粉) 于37℃封闭酶标孔1 h后,加入单链抗体表达上清(上清预先用封闭液分别稀释1×、10×、100×),37℃保湿孵育1 h,洗涤后加入用封闭液稀释4 000×的Anti-Flag-HRP,37℃孵育1 h。洗涤后加入TMB底物显色液,室温避光显色30 min,OD450处读取吸光值。以突变前的抗TSLP-scFv作为阳性对照,比较吸光值的差异。
1.2.6生物大分子相互作用测定单链抗体的亲和力 取突变后的单链抗体M4裂解上清液4 μl,偶联至生物传感器(anti-Flag)。再取不同浓度(20、40、80 μg/ml)的标准rHuTSLP蛋白各4 μl,依次与传感器相互作用。通过系统分析抗原抗体的结合与解离过程,计算出亲和力KD值,以测定单链抗体的亲和力。
表1单链抗体单点突变引物的设计
Tab.1DesignofprimersforsingleaminoacidmutationofscFv
2 结果
2.1通过DS软件系统选定单点突变位点
2.1.1抗原、抗体同源模型的建立 利用DS软件系统对TSLP抗原和scFv-TSLP抗体进行同源建模,考虑溶剂效应,并选择合适的分子力场,对TSLP和scFv-TSLP进行结构优化,得到稳定的骨架式三维构象(图1)。其中图1A是scFv-TSLP的全景图,图1B是TSLP的局部图。
2.1.2抗原、抗体的分子对接 将抗TSLP-scFv作为受体、TSLP作为配体,通过ZDOCK进行分子对接。在对接计算过程中,允许配体和受体的构象发生自由变化,使得到的对接结果精度较高,并使用RDCOK将对接结果进行优化。图2A是抗原-抗体结合的稳定复合物飘带模型,左侧是TSLP的4个螺旋结构,右侧是scFv的轻链和重链。
2.1.3分析抗原-抗体结合表面及选择氨基酸突变点 通过计算抗原-抗体结合表位,对结合内表面进行分析,选取24个关键氨基酸进行饱和突变。在考虑温度、pH值等条件下,计算每个氨基酸的突变能量及稳定性。最终选择5个突变后能量负值较大且稳定性较高的氨基酸进行单点突变(表2)。图2B是抗原抗体结合活性部位的全景图。图2C是结合表面的局部放大图,其中THR、SER、GLY是需突变的位点。

图1 TSLP抗原与抗TSLP单链抗体的同源建模Fig.1 Homology modeling of TSLP and anti-TSLP scFvNote: A.The three-dimensional structure of scFv against TSLP;B.The three-dimensional structure of TSLP(red-O,yellow-S,gray-C,blue-N,white-H).
2.2重叠延伸PCR对突变点进行单点突变 根据重叠延伸PCR原理,使每个突变点的引物配对,扩增出每个突变点的前(a)、后(b)段基因,并将前后段基因进行连接,连接后的目的基因大小约为1 000 bp(图3A、B)。
2.3单链抗体的表达和ELISA检测 将5个突变单链抗体(M1、M2、M3、M4、M5 )PCR产物与表达载体pLZ16连接后,经生物公司测序和NCBI BLAST比对,发现突变单链抗体M1、M2、M4、M5序列正确,M3含有终止密码子。因pLZ16表达载体含有抗氨苄青霉素基因,所以使用氨苄青霉素作为抗性筛选以表达目的蛋白。同时该融合表达载体含有Flag标签,所以使用HRP标记的Anti-Flag单克隆抗体进行ELISA检测。间接ELISA筛选出突变单链抗体M4,结合抗原的能力较突变前明显上升(图4A)。

图2 抗原抗体结合表面分析及单链抗体氨基酸位点的虚拟突变Fig.2 Analysis of antigen-antibody binding surface and virtual mutation of key amino acid of scFvNote: A.Molecular docking of TSLP and anti-TSLP-scFv; B.Analysis of antigen-antibody binding surface;C.Virtual mutation of key amino acid of scFv.
表2突变后能提高亲和力的氨基酸
Tab.2MutatedaminoacidswhichcouldimproveaffinityofscFv
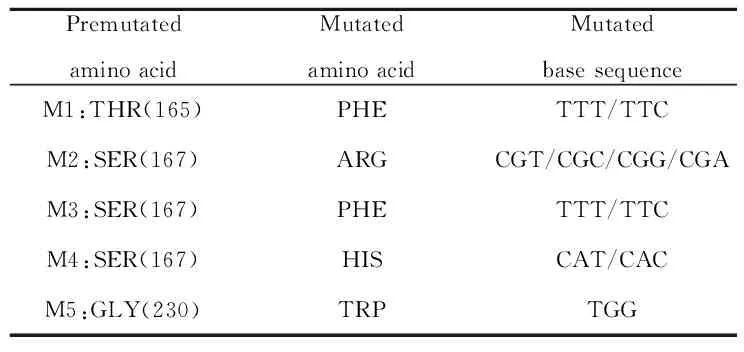
PremutatedaminoacidMutatedaminoacidMutatedbasesequenceM1:THR(165)PHETTT/TTCM2:SER(167)ARGCGT/CGC/CGG/CGAM3:SER(167)PHETTT/TTCM4:SER(167)HISCAT/CACM5:GLY(230)TRPTGG

图3 PCR扩增突变单链抗体基因Fig.3 Amplification of mutated scFvs by PCRNote: A .Amplification of front part (a) and latter part (b) containing mutated amino acid of scFv by PCR;B. Link of the front part and latter part containing mutated amino acid by overlapping extension PCR.

图4 ELISA检测表达的抗TSLP单链抗体Fig.4 Detection of scFvs against TSLP by ELISANote: A.Indirect ELISA detection of the binding of scFvs with TSLP by coating TSLP antigen in the plate wells(scFv-TSLP was not mutated, M1/M2/M4/M5 were mutated);B.ELISA detection of the expression level of non-mutated scFv and mutated scFv M4 by coating the expressed scFv directly in the plate wells;C.Indirect ELISA detection of the binding of non-mutated scFv and mutated scFv M4 with TLSP by coating the TSLP antigen in the ELISA plate wells.
ELISA检测单链抗体表达水平时,突变单链抗体M4虽然其表达水平比突变前低(图4B),但间接ELISA结果显示其结合TSLP抗原蛋白的能力却比突变前高(图4C),说明突变单链抗体M4较突变前其亲和力得到了提高。
2.4BIAcore技术测定单链抗体的亲和力 为进一步验证突变单链抗体M4其亲和力较突变前提高了,我们使用Anti-Flag生物传感器捕获M4后,与不同浓度的标准rHuTSLP抗原蛋白相互作用,得到反应曲线。通过分析其结合与解离过程,计算出突变单链抗体M4的亲和力KD值为3.089e-8,较突变前提高了10倍左右。
3 讨论
TSLP是一种上皮细胞来源的细胞因子,广泛表达于多种细胞和组织,其中以肺和皮肤的上皮细胞中表达量最高[4]。TSLP结合其高亲和力的异质二聚体受体复合物,该受体复合物包括TSLPR和IL-7Rα两个亚基。TSLPR在多种类型的细胞上表达,包括骨髓树突状细胞(mDC)、CD4+和CD8+T细胞、Treg细胞、B细胞、肥大细胞、NK细胞、单核细胞、CD34+祖细胞、嗜酸性粒细胞和嗜碱性粒细胞、气道平滑肌和气道上皮细胞等[4,13]。越来越多的研究证实,TSLP与多种临床疾病密切相关。其中包括变应性疾病中的特异性皮炎、变应性鼻炎和过敏性哮喘[14-16]。也包括自身免疫性疾病,如类风湿性关节炎、炎性肠病等[17,18]。还包括多种肿瘤性疾病,如乳腺癌、肺癌、皮肤T细胞淋巴瘤、B-ALL和宫颈癌等[8-12]。另有研究证实,在重症肌无力(MG)和原因不明的复发性流产患者中,TSLP表达量较正常人明显降低[12,19]。最近有研究表明,在哮喘患者中,使用抗TSLP单克隆抗体治疗,不改变外周血中Treg细胞的比例[20]。以上结果强烈支持,针对TSLP制备中和性单克隆抗体,将具有广泛的临床应用潜力。但需要对TSLP及其受体TSLPR的生物学功能作进一步的研究,以确定抗TSLP单克隆抗体的适应证及禁忌证。
本研究前期已从噬菌体文库中筛选出抗TSLP全人源单链抗体,该单链抗体具有特异性强、体外中和TSLP等特点[21]。但通过噬菌体展示技术制备的单链抗体亲和力较低。本实验通过ZDOCK计算机技术,模拟分子对接,选取突变位点,进行实验突变,最终突变后的单链抗体M4亲和力较突变前提高了约10倍左右。以上结果表明,通过DS软件系统模拟分子对接,设计突变位点,能有效提高抗体的亲和力,并较单纯地实验寻找突变位点更省时、更经济。但是,本实验中抗体亲和力的提升不是特别显著,可能与计算机技术不能完全模拟实验时的各种条件(如:温度、湿度、pH、溶液环境等)有关。另外,单链抗体具有半衰期短,易形成二聚体失活等缺点。本实验后期,拟将亲和力提高的单链抗体基因重组到真核表达载体,构建真核表达系统。为后期的体外生物学功能实验、动物实验和临床应用奠定基础。
[1] Watanabe N,Wang YH,Lee HK,etal.Hassall′s corpuscles instruct dendritic cells to induce CD4+CD25+regulatory T cells in human thymus[J].Nature,2005,436(7054):1181-1185.
[2] Friend SL,Hosier S,Nelson A,etal.Athymic stromal cell line supports in vitro development of surface IgM+ B cells and produces a novel growth factor affecting B and T lineage cells[J].Exp Hematol,1994,22(3):321-328.
[3] Harada M,Hirota T,Jodo AI,etal.Thymic stromal lymphopoietin gene promoter polymorphisms are associated with susceptibility to bronchial asthma[J].Am J Respirat cell Mol Biol,2011,44(6):787-793.
[4] Watson B.Thymic stromal lymphopoietin:a central regulator of allergic asthma[J].Expert Opinion Thera Targets,2014,18(7):771-785.
[5] Soumelis V,Reche PA,Kanzler H,etal.Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP[J].Nat Immunol,2002,3(7):673-680.
[6] Al-Shami A,Spolski R,Kelly J,etal.A role for TSLP in the development of inflammation in an asthma model[J].J Exp Med,2005,202(6):829-839.
[7] Rochman Y,Spolski R.New insights into the regulation of T cells by gamma(c) family cytokines[J].Nat Rev Immunol,2009,9(7):480-490.
[8] Erdmann RB,Gartner JG,Leonard WJ.Lack of functional TSLP receptors mitigates Th2 polarization and the establishment and growth of 4T1 primary breast tumours but has different effects on tumour quantities in the lung and brain[J].Scand J Immunol,2013,78(5):408-418.
[9] Li H,Zhao H,Yu J,etal.Increased prevalence of regulatory T cells in the lung cancer microenvironment:a role of thymic stromal lymphopoietin[J].Cancer Immunol Imunother,2011,60(11):1587-1596.
[10] Takahashi N,Sugaya M,Suga H,etal.Thymic stromal chemokine TSLP acts through Th2 cytokine production to induce Cutaneous T-cell lymphoma[J].Cancer Res,2016,76(21):6241-6252.
[11] Lo Kuan E.Thymic stromal lymphopoietin and cancer[J].J Immunol,2014,193(9):4283-4288.
[12] Zhang Y.Effects of TSLP on obstetrical and gynecological diseases[J].Am Reprod Immunol(New York, N.Y.:1989),2017,77(1):doi:10.1111/aji.12.612.
[13] Semlali A,Jacques E, Koussih L,etal.Thymicstromallymph-opoietin-induced human asthmatic airway epithelial cell proliferation through an IL-13-dependent pathway[J].J Allergy Clin Immunol,2010,125(4):844-850.
[14] Tatsuno K,Fujiyama T,Yamaguchi H,etal.TSLP directly interacts with skin-homing Th2 cells highly expressing its receptor to enhance IL-4 production in atopic dermatitis[J].J Invest Dermatol,2015,135(12):3017-3024.
[15] Akasaki S,Matsushita K,Kato Y,etal.Murine allergic rhinitis and nasal Th2 activation are mediated via TSLP-and IL-33-signaling pathways[J].Int Immunol,2016,28(2):65-76.
[16] Mitchell PD.Epithelial derived cytokines in Asthma[J].Chest,2017,151(6):1338-1344.
[17] 孙延鹏,卢祖能,王云甫.胸腺基质淋巴细胞生成素与自身免疫性疾病的研究进展[J].医学研究杂志,2013,42(1):183-186.
[18] Park JH,Jeong DY,Peyrin-Biroulet L,etal.Insight into the role of TSLP in inflammatory bowel diseases[J].Autoimmun Rev,2017,16(1):55-63.
[19] 孙延鹏,卢祖能,孙 强,等.重症肌无力胸腺基质淋巴细胞生成素表达与CD4+CD25+Foxp3+Treg 细胞表型的研究[J].中国神经免疫学和神经病学杂志,2012, 19(6):439-443.
[20] Baatjes AJ,Smith SG,Dua B,etal.Treatment with anti-OX40L or anti-TSLP does not alter the frequency of T regulatory cells in allergic asthmatics[J].Allergy,2015,70(11):1505-1508.
[21] 朱建光,袁 青,黄 黎,等.抗TSLP全人源单链抗体筛选与初步鉴定[J].中国免疫学杂志,2014,30(12):1662-1665,1669.
[收稿2017-03-07 修回2017-04-14]
(编辑 张晓舟)
AffinitymaturationofhumanscFvanti-TSLPinvitro
XIANDe-Qun,NIANSi-Ji,YEYing-Chun,XUWen-Feng,YUANQing.
TheSchoolofBasicMedicalScience,SouthwestMedicalUniversity,Luzhou646000,China
Objective:To single amino acid mutation of the full human scFvs against TSLP to enhance its affinity.Methods: The specific scFvs against TSLP was screened in our previous study and here the three-dimensional structures of TSLP and anti-TSLP scFvs were simulated by Discovery Studio system,then the molecular docking was made.The amino acids of binding epitope were randomly mutated and the mutated amino acids were selected which could remarkably improve the affinity of scFvs.The primers were designed based on the sequence of mutation amino acids and the scFv sequences were mutated by the overlapping extension PCR.The DNA of mutated scFvs was ligated with the expression vector pLZ16 and transformed into E.coli DH5αF′.Then the scFvs were expressed and the scFvs with improved affinity were selected by ELISA and BIAcore.Results: The five scFvs with single amino acid mutation were screened out by DS system,which could elevate the affinity of scFvs.The mutated anti-TSLP-scFvs were amplified by PCR,which size was about 1 000 bp.The mutated scFvs with correct sequence were expressed,and the mutated scFvs with improved affinity were detected by ELISA and BIAcore.The affinity of selected mutated scFv (M4) has been about 10 times higher than the scFv nonmutation.Conclusion: The affinity of anti-TSLP-scFv has been improved successfully.
Anti-TSLP-scFv;Full human scFv;Molecular docking;Affinity
10.3969/j.issn.1000-484X.2017.09.005
先德群(1983年-),女,硕士,主治医师,主要从事重组抗体研究。
及指导教师:袁 青(1978年-),女,博士,教授,博士生导师,主要从事重组抗体研究,Email:yuanqing_ok@hotmail.com。
R392.11R786
A
1000-484X(2017)09-1301-05
①本文为四川省科技厅项目(2015JY0218,LY-96)和四川省教育厅项目(16TD0022,17ZB0487)。
②西南医科大学药学院药理学教研室,泸州646000。
