二甲双胍对U937细胞增殖、周期及凋亡的影响
2017-09-20李君茹李会方张丽芸左大明陈政良
李君茹 李会方 周 嘉 张丽芸 卢 晓 左大明 陈政良
(南方医科大学基础医学院免疫教研室,广州510515)
二甲双胍对U937细胞增殖、周期及凋亡的影响
李君茹 李会方 周 嘉 张丽芸 卢 晓 左大明 陈政良
(南方医科大学基础医学院免疫教研室,广州510515)
目的:探究二甲双胍(metformin)对U937细胞增殖、周期及凋亡的影响。方法:以U937细胞为研究对象,予不同浓度的二甲双胍处理,分别在24、48和72 h收集细胞。CCK-8法检测细胞增殖情况,流式检测细胞凋亡及细胞周期,并使用Western blot方法检测促凋亡蛋白Bax、抑凋亡蛋白Bcl-2、p-AMPK、p53的表达情况。结果:CCK8结果显示二甲双胍抑制U937的增殖,且呈时间-剂量依赖性。流式结果显示二甲双胍处理后细胞周期停滞在G0/G1期,G0/G1期细胞比例的增加呈时间-剂量依赖性。二甲双胍可诱导细胞凋亡,且凋亡率呈剂量依赖性;二甲双胍浓度为20 mmol/L时,凋亡率呈时间依赖性。Western blot结果显示二甲双胍处理后,p-AMPK、p53、Bax的表达上调,而Bcl-2的表达下调。结论:二甲双胍能抑制U937细胞的增殖,阻滞细胞周期在G0/G1期,诱导细胞凋亡;其机制可能与其上调胞内促凋亡蛋白Bax的表达、下调抑凋亡蛋白Bcl-2的表达、激活AMPK/p53通路有关。
二甲双胍;U937细胞;增殖;细胞周期;凋亡;AMPK/p53
二甲双胍是目前用于治疗糖尿病的一线口服药物[1],其主要药理作用是通过抑制肝葡萄糖输出,改善外周组织对胰岛素的敏感性、增加对葡萄糖的摄取和利用而降低血糖[2]。近年来,二甲双胍的抗肿瘤作用受到了极大的关注,研究发现二甲双胍具有抑制特定肿瘤生长的作用[3,4]。二甲双胍的抗肿瘤机制成为研究热点[5-8]。但目前研究多集中于二甲双胍对实体肿瘤的作用,其对恶性血液系统疾病的研究报道较少。本实验研究二甲双胍对人单核细胞白血病细胞系U937细胞的作用,观察其对U937细胞增殖、周期及凋亡的影响,并探讨其可能机制,以期初步了解二甲双胍在血液病肿瘤中的作用。
1 材料与方法
1.1主要材料及试剂 RPMI1640培养基和胎牛血清(FBS)均购自Gibco公司;二甲双胍为美国Sigma公司产品;Cell Counting Kit-8法试剂盒购自上海同仁;Annexin V/PI细胞凋亡检测试剂盒、细胞周期检测试剂盒购自南京凯基;BCA蛋白定量试剂盒购于杭州联科生物公司;用于免疫印迹的抗Bax抗体购自DB Biotech公司,抗Bcl-2抗体购自ImmunoWay公司,抗p-AMPK、AMPK、p53抗体购自Abcam公司。
1.2实验方法
1.2.1CCK-8法分析细胞增殖情况 将U937细胞密度调整为1×105ml-1,接种于96孔培养板,实验组和对照组每孔加细胞悬液100 μl,空白组加入100 μl完全培养液;实验组加入二甲双胍,使其终浓度为1.25、2.5、5、10、20、40 mmol/L,每组设三个复孔;分别培养48 h、72 h后,再每孔各加入10 μl CCK-8试剂,37℃孵育培养4 h,测A450 nm值。按公式计算细胞的存活率:细胞的存活率=(实验孔OD-空白孔OD)/(对照孔OD-空白孔OD)×100%。
1.2.2流式细胞术检测细胞周期 将U937细胞密度调整至1×105ml-1,接种于6孔培养板,每孔1 ml;实验组加入二甲双胍,使其终浓度至5、10、20 mmol/L,对照组加入与实验组等体积的完全培养液;分别培养24、48 h后收集细胞,用70%的冷乙醇4℃固定2 h至过夜;按细胞周期检测试剂盒说明书,加100 RNase 37℃水浴30 min;再加入400 μl PI染色混匀,4℃避光30 min;上机检测。
1.2.3Annexin V-FITC和碘化丙锭(PI)双标记法检测细胞凋亡 将U937细胞密度调整至1×105ml-1,接种于6孔培养板,每孔1 ml;实验组加入二甲双胍,使其终浓度至5、10、20 mmol/L,对照组加入与实验组等体积的完全培养液;分别培养24、48、72 h后收集细胞,用冷PBS洗涤2次,后将细胞重悬于100 μl 1×结合缓冲液中,分别加入Annexin V-FITC和PI各5 μl,混匀,室温避光反应15 min后,进行流式细胞仪检测。在双变量流式分析的散点图上,左下象限为正常细胞(Annexin V-/PI-);右下象限为早期凋亡细胞(Annexin V+/PI-);右上象限为中晚期凋亡以及坏死的细胞(Annexin V+/PI+)。
1.2.4Western blot检测Bax、Bcl-2、p-AMPK、p53 (1)将U937细胞密度调整至1×105ml-1,接种于6孔培养板,每孔1 ml;实验组加入二甲双胍,使其终浓度至5、10、20 mmol/L,对照组加入与实验组等体积的全培;(2)分别培养24、48、72 h后收集细胞并裂解,提取细胞内总蛋白;(3)BCA蛋白定量试剂盒进行蛋白定量,100℃下变性3 min,加入5×loading buffer;(4)配制12%分离胶和4%积层胶;取30 μg裂解蛋白上样;(5)电转移至PVDF膜上:200 mA,2 h;(6)含5 BSA的TBST溶液室温封闭1 h;(7)加入相应一抗4℃孵育过夜,TBST洗膜3次,加入HPR-抗鼠/抗兔抗体室温1 h,TBST洗膜5次;(8)ECL曝光。
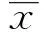
2 结果
2.1二甲双胍对U937细胞增殖的影响 CCK-8检测结果显示,不同浓度二甲双胍作用U937细胞48、72 h后,各组细胞的生长均受到显著抑制,且随着药物浓度增加和作用时间的延长,抑制作用逐渐增加,呈时间-剂量依赖性,各时间点、各浓度组比较差异具有统计学意义(P<0.05),见图1。48、72 h的半数抑制浓度(IC50)分别为18、7 mmol/L。在进一步实验中选择与IC50接近的5、10、20 mmol/L进行细胞周期及细胞凋亡检测。
2.2二甲双胍对U937细胞周期的影响 流式结果显示,不同浓度二甲双胍作用U937细胞24、48 h后,各组细胞停滞在G0/G1期的比例增加,且随着药物浓度增加和作用时间的延长,G0/G1期所占百分比逐渐增多,呈时间-剂量依赖性,各时间点、各浓度组比较差异具有统计学意义(P<0.05),见图2。
2.3二甲双胍对U937细胞凋亡的影响 流式结果显示,二甲双胍作用于U937细胞72 h后,5、10、20 mmol/L组的细胞早期凋亡率及中晚期凋亡率均呈增高趋势,且与对照组相比,5、10、20 mmol/L组的细胞凋亡率差异均具有统计学意义(P<0.05),见图3。与对照组相比,20 mmol/L二甲双胍作用24、48和72 h的细胞凋亡率呈增加趋势,且差异具有统计学意义(P<0.05),见图4。
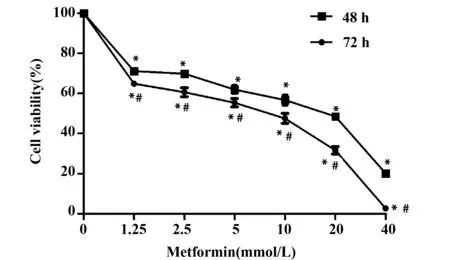
图1 二甲双胍抑制U937的增殖,且呈时间-剂量依赖性Fig.1 Metformin inhibited U937 cells proliferation in a time- and dose-dependent mannerNote: *.Vs control group(metformin 0 mmol/L),P<0.05;#.vs 48 h group,P<0.05.
2.4二甲双胍对U937细胞Bax、Bcl-2表达的影响 U937细胞经二甲双胍作用72 h后,收集细胞, 进行Western blot检测。与对照组相比,促凋亡蛋白Bax的表达随着二甲双胍浓度递增而逐渐增加,而抗凋亡蛋白Bcl-2的表达逐渐减弱,见图5A;以20 mmol/L二甲双胍作用于U937细胞,Western blot结果显示,随着时间的延长,Bax的表达逐渐增强,同时Bcl-2的表达逐渐减弱,见图5B。
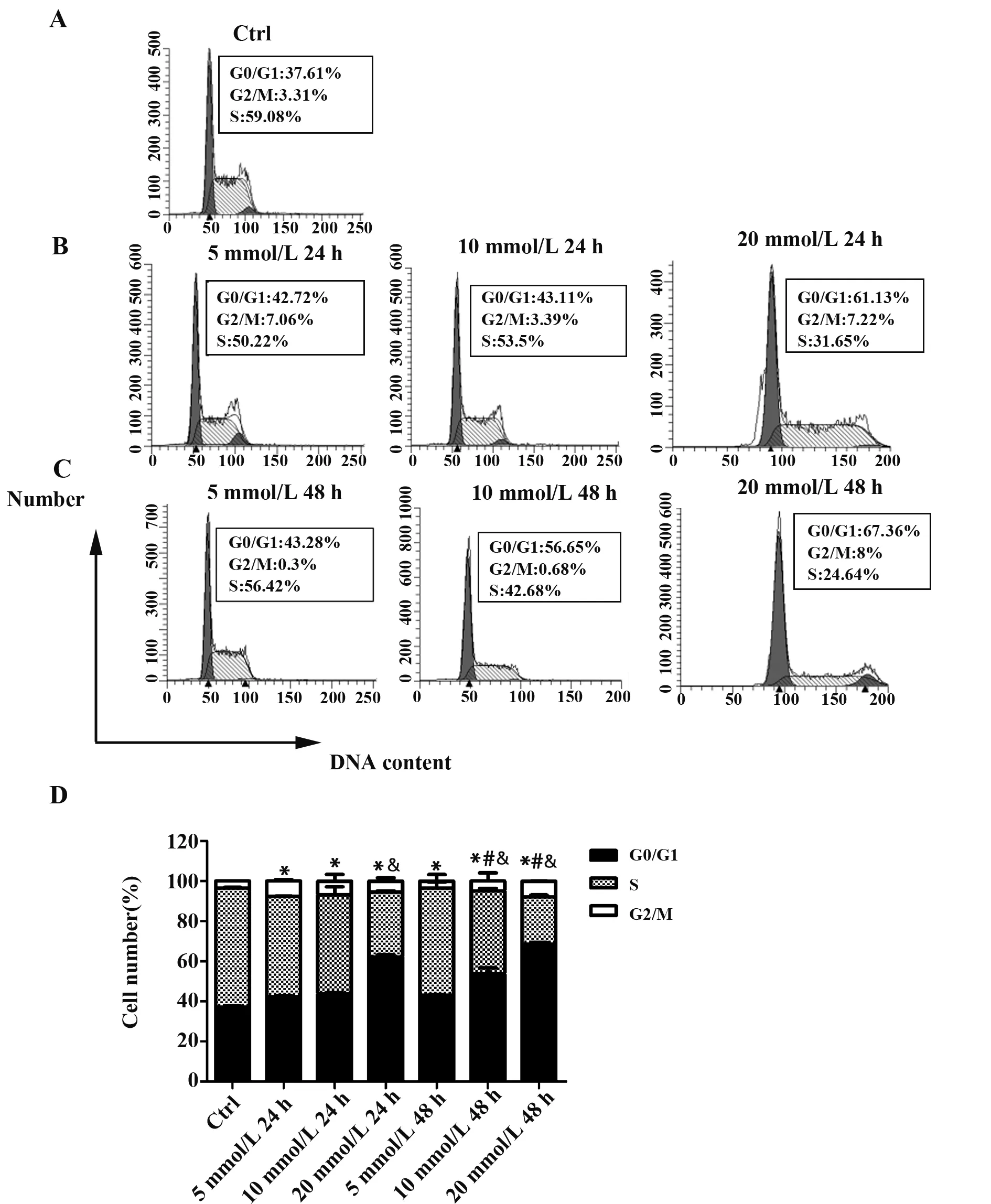
图2 二甲双胍使细胞周期停滞在G0/G1期Fig.2 Metformin blocked cell cycle at G0/G1 phaseNote: Vs control group(metformin 0 mmol/L),*.P<0.05;vs 24 h group,#.P<0.05;vs the previous concentration group at the same time,&.P<0.05.
图3 二甲双胍诱导U937的凋亡,呈剂量依赖性Fig.3 Metformin induced cell apoptosis in a dose-depen-dent mannerNote: Vs control group(metformin 0 mmol/L),*.P<0.05;vs the previous time point,#.P<0.05.
2.5二甲双胍对U937细胞p-AMPK、p53表达的影响 U937细胞经二甲双胍作用72 h后,收集细胞,进行Western blot检测。与对照组相比,p-AMPK、p53的表达随着二甲双胍浓度递增而逐渐增加,见图6A;以20 mmol/L二甲双胍作用于U937细胞,Western blot结果显示,随着时间的延长,p-AMPK、p53的表达逐渐增强,见图6B。
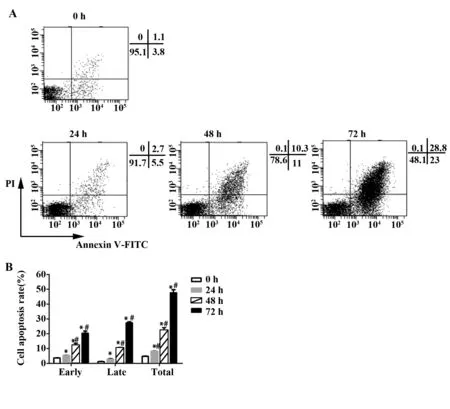
图4 二甲双胍诱导U937的凋亡,呈时间依赖性Fig.4 Metformin induced cell apoptosis in a time-dependent mannerNote: Vs 0 h,*.P<0.05;vs the previous concentration group,#.P<0.05.
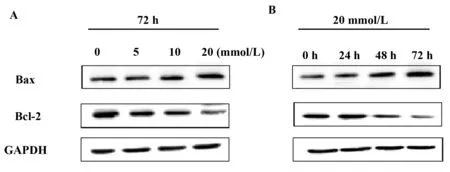
图5 二甲双胍对凋亡相关蛋白Bax和Bcl-2表达的影响Fig.5 Expression of Bax was up-regulated while Bcl-2 expression was down-regulated after metformin treat-ment
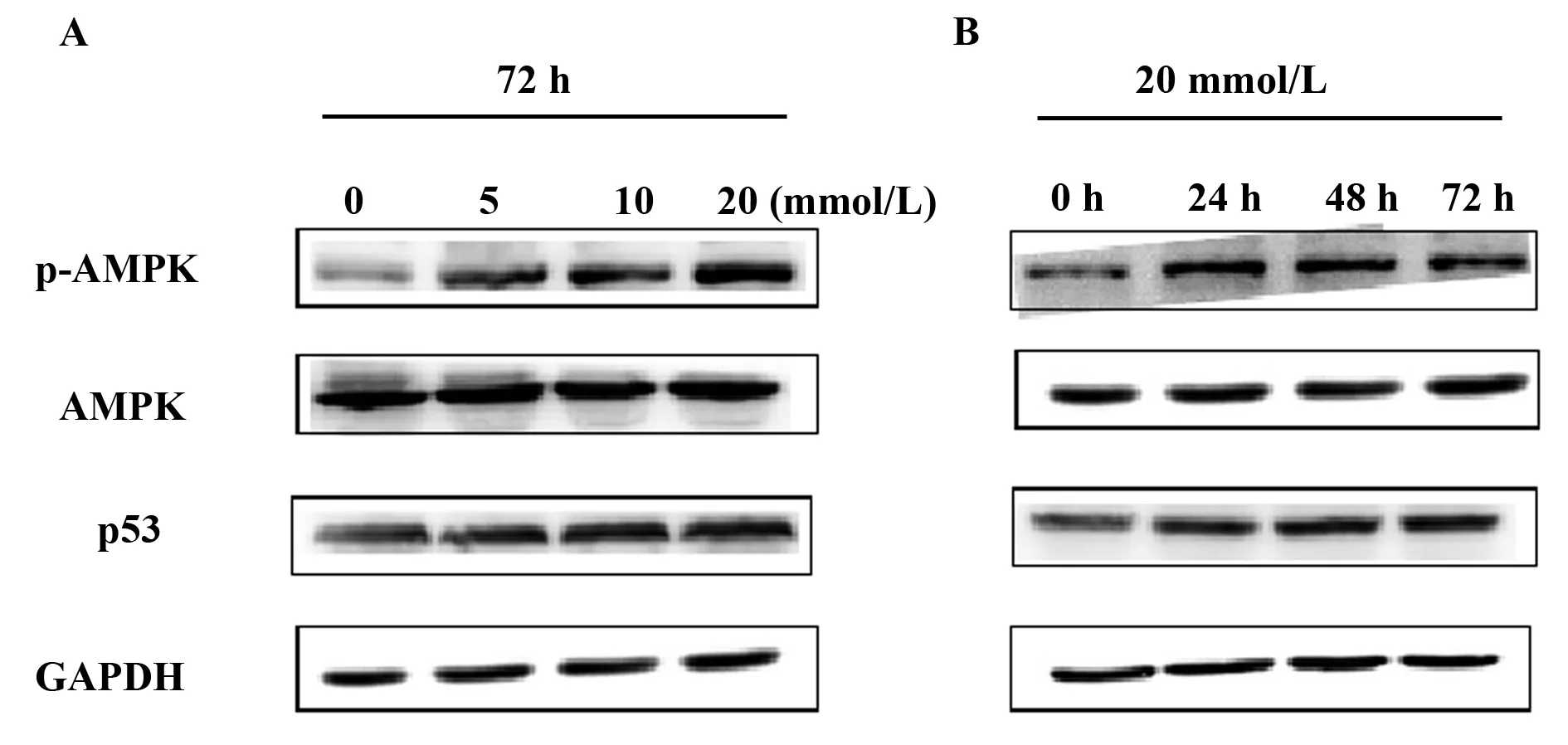
图6 二甲双胍对p-AMPK、p53表达的影响Fig.6 Expression of p-AMPK,p53 on metformin treatment
3 讨论
急性白血病是一种严重危害人类健康的恶性血液病,尤其难治性白血病治疗颇为棘手,是目前国内外血液学工作者研究的焦点。传统的细胞毒疗法(化疗和放疗)存在骨髓抑制等严重的不良反应,且临床上5年生存率仍然很低,因此,继续寻找新的、更为合理的治疗途径是十分必要的。近年来关于肿瘤与能量代谢关系的研究越来越多,能量代谢的重编程已成为肿瘤的特征标志之一[9]。AMPK是机体细胞代谢的关键分子,而二甲双胍是一种重要的AMPK激动剂,主要通过活化AMPK通路来减少肝脏糖异生,同时促进外周组织对葡萄糖的摄取,从而间接达到降低血糖的作用[10]。目前已有实验研究显示二甲双胍对多种实体肿瘤细胞具有抑制增殖的作用,包括肺癌、乳腺癌、前列腺癌等[11-13]。关于其对恶性血液系统疾病的研究报道较少,因此本实验旨在观察二甲双胍对人白血病细胞U937的作用,初步探讨其可能的机制。
本实验用不同浓度的二甲双胍处理白血病细胞U937,CCK-8法检测其增殖情况,结果显示二甲双胍抑制U937细胞的增殖,且这一抑制作用可随着使用药物浓度的增加和作用时间的延长逐渐增强,呈时间-剂量依赖性,48、72 h的半数抑制浓度(IC50)分别为18、7 mmol/L,提示二甲双胍对U937细胞的生长有抑制作用。细胞周期的失控是肿瘤发生的重要原因之一,抗肿瘤药物对肿瘤细胞的增殖抑制作用常通过对细胞分裂产生周期阻滞而实现[14-16]。因此本实验中观察了二甲双胍处理后细胞的细胞周期的情况,发现二甲双胍作用后U937细胞周期停滞在G0/G1期,且呈现一个时间-剂量依赖性,提示二甲双胍对U937细胞的增殖抑制作用与细胞周期的阻滞相关。目前关于二甲双胍对多种实体肿瘤细胞具有抑制增殖的作用均与细胞凋亡的诱导有关[11-13],而细胞凋亡的中心环节是激发了蛋白酶组成的级联反应并受细胞内部多种基因的直接调控,其中,最重要的调控基因为Bcl-2基因家族。Bcl-2基因家族可分为抑制凋亡的Bcl-2亚族(Bcl-2、Bcl-xl、Bcl-w、Mcl-1、CED9等)和促进凋亡的Bax亚族(Bax、Bak、Bcl-XS、Bad、Bik、Bid等),它们表达的蛋白质分别称为Bcl-2蛋白和Bax蛋白。Bcl-2蛋白阻抑细胞凋亡,Bax蛋白则促进细胞凋亡,两者表达失衡可能改变细胞凋亡的进程。在本次研究中,流式细胞仪的结果显示二甲双胍能提高U937细胞的凋亡率,并呈时间-剂量依赖性,Western blot检测的结果也显示其上调促凋亡蛋白Bax的表达同时下调了抗凋亡蛋白Bcl-2的表达,表明二甲双胍通过影响Bcl-2家族蛋白的表达调控来诱导U937细胞的凋亡。
二甲双胍在体内主要通过激活AMPK通路来影响糖代谢,提示其对肿瘤细胞抵制作用也可能与AMPK通路有关[12,17]。目前有研究表明AMPK确实可以通过负调控mTOR信号抑制肿瘤细胞的生长[18],也有研究提出AMPK可以通过上调p53蛋白的表达水平来发挥抗肿瘤作用的观点[19,20]。通过活化AMPK通路发挥抗肿瘤的作用可存在多种机制的共同作用、相互影响,其中具体的复杂机制尚未完全的阐明。本次研究发现二甲双胍作用于U937细胞后,AMPK的磷酸化蛋白表达水平、p53的表达水平均上调。已知在肝癌细胞系HepG2中AMPK通路的活化可以上调p53蛋白的表达,而二甲双胍可以通过影响AMPK/p53通路来促进细胞的凋亡并抑制细胞的增殖[19,20]。我们的研究结果则提示U937细胞中二甲双胍也可能通过影响AMPK/p53通路来抗肿瘤,但是AMPK是否直接影响p53信号及p53信号接下去是如何发挥抗肿瘤作用的机制相当复杂,是否与其他的通路和机制间相互作用,尚需进一步研究。
综上所述,本研究发现二甲对白血病细胞U937细胞生长也具有抑制作用,其机制与诱导细胞G0/G1期阻滞、调控细胞凋亡、激活AMPK/p53通路有关。本研究结果提示二甲双胍可考虑用于实体瘤的治疗外,也有可能作为一种用于血液系统肿瘤治疗的侯选药物。然而,需要指出的是,目前关于二甲双胍和肿瘤的相关研究所用的剂量均是高于其作为降糖药(血药浓度:约0.465~2.5 mg/L)的剂量,而结合我们的结果来看,可以考虑在进一步的研究中降低药物剂量,延长作用时间,最好作为辅助药物搭配其他的抗瘤药物使用。因此,二甲双胍对其他不同的白血病细胞系或原代细胞的作用及机制是什么,和其他抗瘤药物搭配使用的效果如何,仍需要进一步的体外和体内实验来进行探讨。
[1] Bailey CJ,Turner RC.Metformin[J].N Engl J Med,1996,334(9):574-579.
[2] Matthaei S,Greten H.Evidence that metformin ameliorates cellular insulin-resistance by potentiating insulin-induced translocation of glucose transporters to the plasma membrane[J].Diabete Metab,1991,17(1 Pt 2):150-158.
[3] Christodoulou MI,Scorilas A.Metformin and anti-cancer therapeutics:hopes for a more enhanced armamentarium against human neoplasias?[J].Curr Med Chem,2017,24(1):14-56.
[4] Emami RA,Fisel P,Nies AT,etal.Metformin and cancer:from the old medicine cabinet to pharmacological pitfalls and prospects[J].Trends Pharmacol Sci,2013,34(2):126-135.
[5] Cai D,Sun H,Qi Y,etal.Insulin-like growth factor 1/mammalian target of rapamycin and AMP-activated protein kinase signaling involved in the effects of metformin in the human endometrial cancer[J].Int J Gynecol Cancer,2016,26(9):1667-1672.
[6] Zhou G,Yu J,Wang A,etal.Metformin restrains pancreatic duodenal homeobox-1 (PDX-1) function by inhibiting erk signaling in pancreatic ductal adenocarcinoma[J].Curr Mol Med,2016,16(1):83-90.
[7] Cufi S,Corominas-Faja B,Vazquez-Martin A,etal.Metformin-induced preferential killing of breast cancer initiating CD44+CD24-/lowcells is sufficient to overcome primary resistance to trastuzumab in HER2+human breast cancer xenografts[J].Oncotarget,2012,3(4):395-398.
[8] Buzzai M,Jones RG,Amaravadi RK,etal.Systemic treatment with the antidiabetic drug metformin selectively impairs p53-deficient tumor cell growth[J].Cancer Res,2007,67(14):6745-6752.
[9] Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[10] Zhou G,Myers R,Li Y,etal.Role of AMP-activated protein kinase in mechanism of metformin action[J].J Clin Invest,2001,108(8):1167-1174.
[11] Wang J,Gao Q,Wang D,etal.Metformin inhibits growth of lung adenocarcinoma cells by inducing apoptosis via the mitochondria-mediated pathway[J].Oncol Lett,2015,10(3):1343-1349.
[12] Zakikhani M,Dowling R,Fantus IG,etal.Metformin is an AMP kinase-dependent growth inhibitor for breast cancer cells[J].Cancer Res,2006,66(21):10269-10273.
[13] Dirat B,Ader I,Golzio M,etal.Inhibition of the GTPase Rac1 mediates the antimigratory effects of metformin in prostate cancer cells[J].Mol Cancer Ther,2015,14(2):586-596.
[14] Yang K,Gao K,Hu G,etal.CTGF enhances resistance to 5-FU-mediating cell apoptosis through FAK/MEK/ERK signal pathway in colorectal cancer[J].Onco Targets Ther,2016,9:7285-7295.
[15] Fodor T,Szanto M,Abdul-Rahman O,etal.Combined treatment of MCF-7 cells with AICAR and methotrexate,arrests cell cycle and reverses warburg metabolism through AMP-activated protein kinase (AMPK) and FOXO1[J].PLoS One,2016,11(2):e150232.
[16] Jo DW,Kim YK,Yun PY.The influence of p53 mutation status on the anti-cancer effect of cisplatin in oral squamous cell carcinoma cell lines[J].J Korean Assoc Oral Maxillofac Surg,2016,42(6):337-344.
[17] 陈兆煜,王连唐,陈雁扬.二甲双胍通过激活腺苷酸活化蛋白激酶(AMPK)的抗肿瘤机制[J].中国肺癌杂志,2013,16(8):427-432.
[18] Vazquez-Martin A,Oliveras-Ferraros C,Menendez JA.The antidiabetic drug metformin suppresses HER2 (erbB-2) oncoprotein overexpression via inhibition of the mTOR effector p70S6K1 in human breast carcinoma cells[J].Cell Cycle,2009,8(1):88-96.
[19] He G,Zhang YW,Lee JH,etal.AMP-activated protein kinase induces p53 by phosphorylating MDMX and inhibiting its activity[J].Mol Cell Biol,2014,34(2):148-157.
[20] Sun Y,Tao C,Huang X,etal.Metformin induces apoptosis of human hepatocellular carcinoma HepG2 cells by activating an AMPK/p53/miR-23a/FOXA1 pathway[J].Onco Targets Ther,2016,9:2845-2853.
[收稿2016-12-05 修回2017-01-20]
(编辑 许四平 刘格格)
Effectofmetforminonproliferation,cellcycleandapoptosisofU937cells
LIJun-Ru,LIHui-Fang,ZHOUJia,ZHANGLi-Yun,LUXiao,ZUODa-Ming,CHENZheng-Liang.
DepartmentofImmunology,SchoolofBasicMedicalSciences,SouthernMedicalUniversity,Guangzhou510515,China
Objective:To study the effect of metformin on proliferation,cell cycle and apoptosis of U937 cells.Methods: U937 cells were treated with different concentrations of metformin,collected cells in 24,48 and 72 hours.Subsequently,cell proliferation was assessed by CCK-8 assay,and the cell cycle and apoptosis were analyzed by flow cytometry (FCM).The expression of Bcl-2,Bax,p-AMPK,p53 were determined by Western blot.Results: The proliferation of U937 cells was inhibited by metformin in a time-and dose-dependent manner.Metformin-treated cells were arrested at G0/G1 phase,the cell frequency at G0/G1 phase was increased in a time-and dose-dependent manner.Metformin also induced cell apoptosis in a dose-dependent manner.It showed that 20 mmol/L metformin induced cell apoptosis in a time-dependent manner.The expression of p-AMPK,p53,Bax was up-regulated while Bcl-2 expression was down-regulated after metformin treatment.Conclusion: Metformin could inhibit the U937 cell proliferation,block the cell cycle at G0/G1 phase,and induce cell apoptosis,which may partially be attribute to the up-regulation of Bax,down-regulation of Bcl-2,activation of AMPK/p53 signaling.
Metformin;U937;Proliferation;Cell cycle;Apoptosis;AMPK/p53
10.3969/j.issn.1000-484X.2017.09.008
李君茹(1990年-),女,在读硕士,主要从事天然免疫方面的研究,E-mail:656069451@qq.com。
及指导教师:陈政良(1957年-),男,博士,教授,主要从事天然免疫方面的研究,E-mail:zhlchen@smu.edu.cn。
R73.36
A
1000-484X(2017)09-1315-05
