长链非编码CDKN2B调控miR-19对慢性髓细胞白血病的影响①
2017-09-20王高峰李月灵李慧川
王高峰 李月灵 彭 红 李慧川
(黄河科技学院医学院,郑州450063)
长链非编码CDKN2B调控miR-19对慢性髓细胞白血病的影响①
王高峰 李月灵 彭 红 李慧川②
(黄河科技学院医学院,郑州450063)
目的:探讨长链非编码CDKN2B调控miR-19的表达影响慢性髓细胞白血病细胞的生物学行为的方式及其机制。方法:qPCR检测不同白血病细胞中CDKN2B的表达情况;双荧光素酶报告基因检测CDKN2B与miR-19的相互作用;MTT增殖实验和流式细胞检测CDKN2B对HL-60细胞增殖和凋亡的影响;划痕愈合实验检测沉默CDKN2B后白血病HL-60细胞迁移能力的变化;Transwell侵袭实验检测沉默CDKN2B后白血病HL-60细胞侵袭能力的变化;划痕愈合实验和Transwell侵袭实验检测沉默CDKN2B后miR-19对HL-60细胞迁移和侵袭能力的影响;鬼笔环肽染色检测沉默MEG3后细胞骨架微丝微管形态变化;Western blot检测沉默CDKN2B后PI3K/AKT信号通路蛋白的表达情况。结果:在HL-60细胞中CDKN2B表达水平最低;CDKN2B能与miR-19的3′UTR特异性结合;过表达CDKN2B可以抑制HL-60细胞增殖能力,促进其凋亡行为;沉默CDKN2B可以增强白血病HL-60细胞侵袭和迁移能力;过表达CDKN2B后细胞骨架表现为伪足减少,运动能力减弱;肌动蛋白表达水平下调;过表达CDKN2B后PI3K/AKT通路蛋白表达情况相应下调。结论:CDKN2B可以靶向调节miR-19调控白血病细胞生物学行为。
CDKN2B;白血病;miR-19; 鬼笔环肽
慢性髓细胞白血病是血液恶性肿瘤中发病率较高的肿瘤类型,其发病率和死亡率在血液系统肿瘤中都处于较高水平[1]。虽然近年来白血病的筛查和诊治方面的进展较快,提高了白血病患者的预期寿命,但是一旦白血病细胞发生扩散和远处转移,其预后仍较差[2]。因此探讨白血病的分子靶向基因治疗对提高白血病的早期诊断率十分重要。
CDKN2B可以编码细胞周期蛋白依赖性激酶,可在骨髓细胞和巨核细胞分化过程中呈现选择性表达的状态[3]。 CDKN2B的异常表达和慢性髓细胞白血病的发生有一定的关联,可能是诱导髓细胞突变的独立调控因素[4]。表观遗传学研究也表明CDKN2B基因沉默是白血病分子治疗方向的可能靶标[5]。
微小RNA(miRNA)是一种非编码的短单链RNA,可以通过结合其3′非翻译区来调控多个靶基因的功能,诱导靶向miRNA的直接降解或翻译抑制过程[6]。较多研究表明,通过调控致癌基因和肿瘤抑制基因的表达水平可以将miRNA表达与恶性肿瘤的发展进程联系起来[7]。此外,miRNA的基因调控与疾病进展密切相关,miRNA与肿瘤的恶性转移相关[8,9]。这些miRNA的表达变化是诊断和治疗髓细胞白血病的可能治疗靶点,因为每种miRNA影响下游多种蛋白质的表达,对白血病细胞生物学行为的影响是十分复杂且关键的[10]。
在本研究中,我们探讨CDKN2B的异常表达对慢性髓细胞白血病细胞增殖、凋亡、迁移与侵袭行为的调控情况,并通过探讨其下游miR-19分子的变化,研究其对髓细胞白血病细胞抑制作用的具体机制。
1 材料与方法
1.1细胞系和试剂 原代髓细胞白血病细胞株KG-1、HL-60、KU812和THP-1由复旦大学中山医院细胞研究所提供。细胞培养条件:所有细胞株在RPMI1640培养基,含有10%FBS,100 mg/ml青霉素和100 mg/ml链霉素的培养基中,37℃在5%CO2培养箱中培养。ROCK、RhoA、p-PI3K、p-AKT和mTOR抗体均购于美国Abcam公司(ab45171、ab54835、ab182651、ab38449、ab32028)。
1.2方法
1.2.1miR-19慢病毒病毒感染 通过慢病毒转染获得过表达miR-19的细胞,将编码miR-19或空载体的慢病毒感染到HL-60细胞中。并根据制造商的说明书使用Lipofectamine 2000(Invitrogen,Carlsbad,CA)将其转染入细胞48 h,通过GFP表达选择具有稳定miR-19表达的克隆细胞株。
1.2.2qPCR实验 使用Trizol(Invitrogen)从HL-60细胞系提取总RNA,并通过测量其在260 nm处的吸光度来定量测定总RNA的浓度。使用SYBRH Green PCR Kit进行qPCR分析。miR-19和U6的引物(内部对照)购自QIAGEN。 使用RQ=2-ΔΔCT方法计算miRNA的倍数变化。通过qPCR测定白血病细胞株中的相对miRNA水平,使用GAPDH作为内部对照引物。实验重复3次。CDKN2B的前体序列如下:(正向)5′-CTATGTTTGAATAATTCCAG-3′和(反向)5′-CGCGTCGCCGCGUUAAGAAC-3′。
1.2.3双荧光素酶报告基因 验证CDKN2B和miR-19的相关关系,我们使用双荧光素酶测定,将24孔板中的CDKN2B或NC细胞与0.4 mg萤火虫荧光素酶报告载体和0.08 mg含有海肾萤光素酶(Promega)的pRL-TK对照载体共转染,按照使用方法操作,在转染后48 h制备裂解物。使用双荧光素酶报告基因测定系统(Promega)测量荧光素酶活性。将萤火虫荧光素酶活性标准化后测定海肾萤光素酶活性。实验重复3次。
1.2.4MTT增殖实验 将对数期HL-60细胞使用胰蛋白酶消化后,制成单细胞悬浮液并以1×103细胞/孔的密度接种到96孔板中。 在细胞培养7 d后,加入20 μl MTT测定液,每孔充分混合均匀,并在37℃下孵育4~6 h。然后使用无菌吸管吸出上清液,每孔加入150 μl二甲基亚砜(DMSO),在室温下搅拌10 min保证晶体充分溶解。然后在24、48、72和96 h进行MTT实验测定波长为490 nm时的吸光度,计算白血病细胞的增殖情况。实验重复3次。
1.2.5细胞凋亡实验 (1)实验前约24 h,接种两瓶HL-60细胞,标记①、②,每瓶含约6 ml培养液,置37℃,5%CO2培养箱培养。(2)实验前约2.5 h,当细胞密度达到70%,①号瓶加入三尖杉酯碱200 μl,使终浓度为1 μg/ml,②号瓶中加入同等量PBS(pH7.4)作对照。共同放入培养箱中继续培养2.5 h。(3)染色:将瓶中的细胞摇匀取200 μl于1.5 ml的离心管中,加入HO 33342母液2 μl,PI 20 μl,染色15 min。 (4)滴片:取一载玻片用双面胶围成一小室,从离心管中各取以上染色后的细胞悬液10 μl,加入小室内盖上盖玻片,荧光镜下用紫外激发光,高倍镜下观察,区别三种细胞,并统计三者比例,计算凋亡率。
1.2.6划痕愈合实验 将HL-60细胞(48 h)进行胰蛋白酶消化,并将适量细胞平铺在6孔板上。使用200 μl无菌枪头轻划孔板,每个孔划4~5次,尽量保证所划线处于平行状态,放置37℃恒温细胞培育箱,在24、48、72 h后,分别用适量PBS冲洗孔板,显微镜下观察HL-60细胞迁移的距离。然后对比两组之间的统计学差异。
1.2.7Transwell侵袭实验 通过Transwell对HL-60细胞侵袭能力进行测定。将HL-60细胞在含有0.1%FBS的DMEM中培养。 24 h后,将2×105个饥饿过的HL-60细胞接种在上室中,将具有10%FBS和HGF(20 ng/ml)的培养基置于下室中。在37℃下孵育24 h后,小心地擦去上室膜表面的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净过后,于倒置显微镜下计数。实验重复3次。
1.2.8鬼笔环肽染色观察细胞骨架形态变化 制作HL-60细胞爬片;24 h后4%多聚甲醛固定15 min,0.5%Triton X-100/PBS在室温下孵育破膜10 min;1 μl FITC-Phallodin储存液加入50 μl PBS中配成工作液,用以染色细胞骨架,在室温下孵育40~60 min,完全清洗后吸去多余水分,加荧光封片液封片,置于荧光显微镜下观察。实验重复3次。
1.2.9Western blot实验 用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白,并将其转移到硝酸纤维素膜上(Bio-Rad,Hercules,CA)。使用5%脱脂牛奶充分封闭膜,并与一抗(浓度1∶1 000),内参GAPDH(浓度1∶2 000),4℃,孵育过夜。次日,TBST充分冲洗过后,使用二抗辣根酶标记物(浓度1∶2 000)孵育2 h,TBST充分冲洗过后,使用增强的化学发光试剂ECL显影液检测目标蛋白的表达水平。
1.3统计学分析 所有的统计分析均采用SPSS 16.0软件包(SPSS,Chicago,IL)进行,P<0.05表示差异具有统计学意义。 使用Wilcoxon秩和检验分析CDKN2B在白血病细胞中的差异表达。采用最小差别t检验分析两组。
2 结果
2.1qPCR检测不同慢性髓细胞中CDKN2B的表达 qPCR结果表明:(图1 A)与其他细胞株相比,HL-60细胞中CDKN2B mRNA表达水平明显降低[(0.18±0.02)vs(0.75±0.04),P<0.05],差异有统计学意义;结合以上结果,考虑CDKN2B在白血病中起抑癌作用,我们挑选HL-60为进一步实验细胞株。图1B显示,使用慢病毒LV5-CDKN2B转染HL-60细胞,免疫荧光显示转染效率高于80%。qPCR也显示慢病毒转染后CDKN2B的表达明显下调,差异具有统计学意义(图1C)。
2.2双荧光素酶检测CDKN2B和miR-19之间的关联 为明确与CDKN2B相关的miRNA的情况,我们使用生物信息学预测工具,为明确与CDKN2B相关的miRNA的情况,我们使用生物信息学预测工具,发现CDKN2B和miR-19有相似的结合位点序列,为了验证CDKN2B能否与miR-19 3′UTR结合,我们将LV5-CDKN2B与miR-19共转染到白血病细胞293U中。荧光素酶报告基因结果显示(图2A、B):LV5-CDKN2B可以明显抑制miR-19的荧光素酶活性。结果表明,LV5-CDKN2B能与miR-19的3′UTR特异性结合。
2.3CDKN2B的表达对慢性髓细胞HL-60增殖和凋亡的影响 为了研究CDKN2B对HL-60细胞增殖和凋亡能力的影响。MTT细胞增殖实验结果如图3A所示,与NC对照组相比,LV5-CDKN2B组的细胞的增殖速度明显降低[(0.856±0.089)% vs (0.215±0.025)%,P=0.028],培养60 h后的差异具有统计学意义(图3A)。流式细胞实验结果显示:相比NC组,LV5-CDKN2B组的HL-60细胞凋亡数目明显增加[(82.32±8.62)% vs(15.24±1.56)%,P<0.05],差异具有统计学意义(图3B)。综上所述,过表达CDKN2B后可以明显抑制HL-60细胞株的增殖能力,促进其凋亡行为。

图1 qPCR检测CDKN2B的表达水平Fig.1 Expression level of CDKN2B was detected by qPCRNote: A.qPCR detection of CDKN2B expression in different cell lines;B.Immunofluorescence was used to detect lentivirus transfection efficiency;C.qPCR was used to detect the expression of CDKN2B after lentivirus transfection.*.P<0.05.
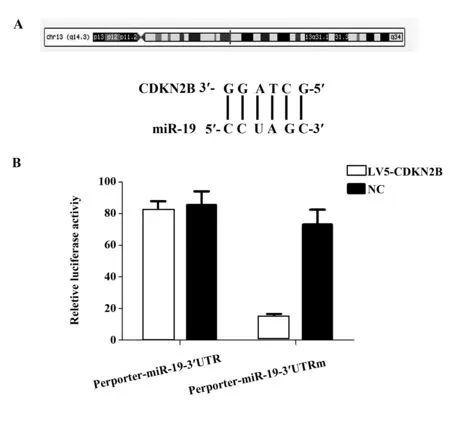
图2 双荧光素酶实验检测CDKN2B和miR-19之间的关系Fig.2 Double luciferase assay to detect relationship between CDKN2B and miR-19Note: A.Binding site of CDKN2B to miR-19;B.double luciferase to detect the relationship between CDKN2B and miR-19.
2.4CDKN2B的表达对HL-60细胞迁移和侵袭的影响 通过细胞划痕实验检测CDKN2B对HL-60细胞株迁移情况的影响。LV5-CDKN2B组的细胞的迁移速率比其对照组明显下调[24 h(25.62±3.64)% vs (13.65±2.06)%,P=0.025;48 h(50.68±5.06)%vs (24.98±3.28)%,P=0.038;72 h(83.86±7.95)%vs (47.26±5.69)%,P=0.008)],差异具有统计学意义(图4A)。过表达CDKN2B后可以明显抑制HL-60细胞株的迁移能力。如图4B所示,Transwell侵袭实验检测CDKN2B对HL-60细胞株侵袭情况的影响。LV5-CDKN2B组的细胞的侵袭细胞数目比其对照组明显减少[(86.9±10.2) vs (18.6±1.9),P=0.011],差异具有统计学意义。综上所述,过表达CDKN2B后可以明显抑制HL-60白血病细胞株的迁移和侵袭能力。
2.5CDKN2B对HL-60细胞骨架形态及功能的影响作用 细胞骨架鬼笔环肽染色结果显示(图5A):与NC对照组相比,LV5-CDKN2B组HL-60细胞F-actin染色明显减少,细胞膜褶皱形成减少,胞浆内伪足数目明显减少。

图3 CDNK2B对HL-60细胞增殖和凋亡行为的影响Fig.3 Effect of CDKN2B on proliferation and apoptosis of HL-60 cellsNote: A.MTT assay to detect the proliferation of HL-60 cells;B.Flow cytometry was used to detect the apoptosis behavior of HL-60 cells.
Western blot结果显示(图5B):与NC组相比,LV5-CDKN2B组中的ROCK和RhoA蛋白激酶的表达水平明显下调[ROCK(79.52±5.91)% vs(13.26±4.24)%,P<0.05;RhoA(82.19±11.25)% vs (19.66±8.2)%,P<0.05]。表明过表达CDKN2B的表达后可以下调ROCK和RhoA蛋白激酶的水平。

图4 CDKN2B对HL-60细胞迁移和侵袭能力的影响Fig.4 Effects of CDKN2B on migration and invasion of HL-60 cellsNote: A.Scratch healing test to detect changes in migration capacity of HL-60 cells;B.Transwell invasion assay to detect the invasion of HL-60 cells.*.P<0.05.

图5 CDKN2B对HL-60细胞骨架和肌动蛋白表达水平的影响Fig.5 Effect of CDKN2B on cytoskeleton and actin expression in HL-60 cellsNote: A.Phalloidin staining to detect HL-60 cytoskeleton morphological changes;B.Western blot was used to detect the expression of actin family protein.*.P<0.05.

图6 CDKN2B对PI3K/AKT通路蛋白表达水平的影响Fig.6 Effect of CDKN2B on PI3K/AKT signaling pathway protein expressionNote: *.P<0.05.
2.6CDKN2B的表达对PI3K/AKT信号通路的激活作用 我们探讨CDKN2B调控HL-60细胞的生物学行为是否和PIK3/AKT信号通路相关。Western blot实验结果显示,过表达CDKN2B之后PIK3/AKT信号通路中的p-PI3K、p-AKT和mTOR蛋白表达相应下调[(77.3±6.34)% vs (20.2±1.76)%,(125.7±14.67)% vs (31.36±3.06)%,(88.3±6.95)% vs (22.2±2.18)%,P=0.016],差异有统计学意义(图6)。说明过表达CDKN2B后HL-60细胞的生物学行为的改变可能是通过PI3K/AKT信号通路调控的。
3 讨论
慢性骨髓性白血病(CML)最初是在20世纪被发现的,在一个多世纪的发展过程中,其治疗方面的进展未取得明显的进步[11]。目前主要靠放射治疗和多种化疗药物联合应用以提高患者生活质量,延长患者的生存期。但是目前最根本的治疗方案仍是骨髓抑制,但是其副作用也是相当明显的,所以寻求新的分子治疗方案是目前亟待解决的问题。之前有相关实验通过比较基因组间的杂交分型和分子遗传分析显示在慢性髓细胞白血病中,CDKN2B基因广泛存在,但是,也有不足10%的白血病患者中存在CDKN2B的缺失[12]。有研究报道,CDKN2B是通过抑制细胞周期蛋白依赖性激酶Cdk4和Cdk6的活性而起到调节作用[13]。CDNK2B的产物通过结合Mdm2,进而抑制Mdm2介导的抑癌基因p53的降解来调节肿瘤抑制蛋白的活性,CDKN2B属于细胞周期蛋白依赖性激酶抑制剂的基因家族,其在细胞周期转录调控中的作用是极其重要的[14,15]。该家族的其他成员还有CDKN2A、CDKN2C和CDKN2D,CDKN2A和CDKN2B是众所周知的肿瘤抑制基因,其在各种类型的人类肿瘤中都存在表达异常的状况[16,17]。CDKN2C基因的突变也在人类肿瘤中有过报道,但相比CDKN2B作用就相对较小。
我们发现在绝大多数慢性髓细胞白血病中CDKN2B的表达缺失情况是非常常见的[18]。在HL-60白血病细胞模型中CDKN2B与下游相关miRNA存在显著的相关性。我们观察到与其他类型白血病细胞株相比,HL-60细胞中CDKN28的表达情况下调明显,且通过双荧光素酶实验检测到,CDKN2B和miR-19之间存在上下游调节关系,即CDKN2B可以影响miR-19的活性,从而调控miR-19对白血病细胞株生物学行为的影响。
miR-19参与多种人类癌症的发生和进展过程,是目前研究较为热门的miRNA之一。不仅涉及促进肿瘤生长、增殖、抗细胞凋亡等过程,甚至可以对肿瘤细胞的分化、复发及耐药性有一定的调控作用[19,20]。但是不同的研究表明miR-19在不同的肿瘤类型中扮演的角色不同,多数情况下扮演一个促癌miRNA的角色[21]。Wong等[22]在乳腺癌芯片中发现,miR-19在绝大部分芯片中呈现低表达状态。而Landais[23]也发现在胶质瘤细胞中存在100余种miRNA表达异常,而miR-19是相对表达异常的一种miRNA。然而在慢性髓细胞白血病患者中,尚未有研究明确指出miR-19的具体表达和相关作用。
令人感兴趣的是,在以往的研究中,CDKN2B尽管表现出明显的抑癌作用,但是鲜有学者进行深一步的研究继续探讨,对CDKN28的具体作用机制都涉足不多。有研究表明,CDKN2B的表达增高,可以导致多种肿瘤细胞的迁移和侵袭能力减弱。Mohseny等[24]研究表明,CDKN2B的表达水平与骨肉癌的分级分期有关,并且CDKN2B与骨肉瘤的浸润和转移范围呈一定相关关系。本研究通过沉默CDKN2B的表达,发现HL-60细胞的增殖、迁移和侵袭能力变强,细胞凋亡数目减少,结合前面实验结果,表明CDKN2B在髓细胞白血病的发生、发展过程中起重要作用。本研究通过生物信息学分析证实,CDKN2B与miR-19有直接相互作用,进一步通过双荧光素酶报告基因证实,CDKN2B可与miR-19的 3′UTR存在结合位点,表明CDKN2B可以调控miR-19的表达从而激活下游相关因子的活性。
本研究通过使用qPCR检测CDKN2B和miR-19在慢性髓细胞白血病细胞株中的表达情况,同时进一步探讨CDKN2B与miR-19的相互作用关系,并验证CDKN2B与miR-19在HL-60细胞增殖、迁移和侵袭过程中的作用,证实CDKN2B可用通过影响白血病HL-60细胞的迁移和侵袭能力,通过PI3K/AKT信号通路对白血病细胞的恶性生物学行为进行干扰。间接表明PI3K/AKT信号通路在CDKN2B调控miR-19影响白血病细胞生物学功能的过程中起到一定作用。提示CDKN2B可能参与白血病细胞增殖、迁移和侵袭过程,为慢性髓细胞白血病的诊治、预后和监测治疗效果提供一定的理论支持。
[1] Cancer Genome Atlas Research Network.Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia[J].N Engl J Med,2013,2013(368):2059-2074.
[2] Corces-Zimmerman MR,Hong WJ,Weissman IL,etal.Preleukemic mutations in human acute myeloid leukemia affect epigenetic regulators and persist in remission[J].Proc Natl Acad Sci,2014,111(7):2548-2553.
[3] Aesoy R,Gradin K,Aasrud KS,etal.Regulation of CDKN2B expression by interaction of Arnt with Miz-1-a basis for functional integration between the HIF and Myc gene regulatory pathways[J].Molecular Cancer,2014,13(1):54.
[4] Nicolae-Cristea AR,Benner MF,Zoutman WH,etal.Diagnostic and prognostic significance of CDKN2A/CDKN2B deletions in patients with transformed mycosis fungoides and primary cutaneous CD30-positive lymphoproliferative disease[J].British J Dermatol,2015,172(3):784-788.
[5] Levy L,Hill CS.Smad4 dependency defines two classes of transforming growth factor β (TGF-β) target genes and distinguishes TGF-β-induced epithelial-mesenchymal transition from its antiproliferative and migratory responses[J].Mole Cell Biol,2005,25(18):8108-8125.
[6] Lewis A,Mehta S,Hanna LN,etal.Low serum levels of microRNA-19 are associated with a stricturing Crohn′s disease phenotype[J].Inflammatory Bowel Diseases,2015,21(8):1926-1934.
[7] 陈 勇,徐兴祥,陈龙邦.靶向 miRNA 的肿瘤干细胞治疗策略[J].肿瘤,2013,33(1):97-102.
[8] Beltran H,Yelensky R,Frampton GM,etal.Targeted next-generation sequencing of advanced prostate cancer identifies potential therapeutic targets and disease heterogeneity[J].Eur Urol,2013,63(5):920-926.
[9] Erener S,Mojibian M,Fox JK,etal.Circulating miR-375 as a biomarker of β-cell death and diabetes in mice[J].Endocrinology,2013,154(2):603-608.
[10] Kim-Prieto C,Diener E,Tamir M,etal.Integrating the diverse definitions of happiness:A time-sequential framework of subjective well-being[J].J Happiness Studies,2005,6(3):261-300.
[11] Experts in Chronic Myeloid Leukemia.The price of drugs for chronic myeloid leukemia (CML) is a reflection of the unsustainable prices of cancer drugs:from the perspective of a large group of CML experts[J].Blood,2013,121(22):4439-4442.
[12] Conti RM,Padula WV,Larson RA.Changing the cost of care for chronic myeloid leukemia:the availability of generic imatinib in the USA and the EU[M].Chronic Myeloid Leukemia.Springer International Publishing,2016:231-255.
[13] 李洁茹,马怀幸,李苏宜.mTOR通路基因甲基化与肿瘤能量代谢[J].肿瘤代谢与营养电子杂志,2016,3(3):186-190.
[14] Aesoy R,Gradin K,Aasrud KS,etal.Regulation of CDKN2B expression by interaction of Arnt with Miz-1-a basis for functional integration between the HIF and Myc gene regulatory pathways[J].Mol Cancer,2014,13(1):54.
[15] Wan G,Mathur R,Hu X,etal.Long non-coding RNA ANRIL (CDKN2B-AS) is induced by the ATM-E2F1 signaling pathway[J].Cellular Signalling,2013,25(5):1086-1095.
[16] Mafi Golchin M,Ghaderian SMH,Akhavan-Niaki H,etal.Analysis of two CDKN2B-AS polymorphisms in relation to coronary artery disease patients in north of iran[J].Intern J Mole Cell Med(IJMCM),2017,6(1):31-37.
[17] Wolter M,Reifenberger J,Blaschke B,etal.Oligodendroglial tumors frequently demonstrate hypermethylation of the CDKN2A(MTS1,p16INK4a),p14ARF,and CDKN2B(MTS2,p15INK4b)tumor suppressor genes[J].J Neuropathol Exp Neurol,2001,60(12):1170-1180.
[18] Brakensiek K,Wingen LU,Länger F,etal.Quantitative high-resolution CpG Island Mapping with PyrosequencingTMreveals disease-specific methylation patterns of the CDKN2B gene in myelodysplastic syndrome and myeloid leukemia[J].Clin Chem,2007,53(1):17-23.
[19] Mavrakis KJ,Wolfe AL,Oricchio E,etal.Genome-wide RNA-mediated interference screen identifies miR-19 targets in Notch-induced T-cell acute lymphoblastic leukaemia[J].Nat Cell Biol,2010,12(4):372-379.
[20] Ye H,Liu X,Lv M,etal.MicroRNA and transcription factor co-regulatory network analysis reveals miR-19 inhibits CYLD in T-cell acute lymphoblastic leukemia[J].Nucleic Acids Res,2012,40(12):5201-5214.
[21] 耿凌云,王 欣.MicroRNA 在慢性淋巴细胞白血病中的研究进展[J].中国实验血液学杂志,2014,22(1):255-258.
[22] Wong P,Iwasaki M,Somervaille TCP,etal.The miR-17-92 microRNA polycistron regulates MLL leukemia stem cell potential by modulating p21 expression[J].Cancer Res,2010,70(9):3833-3842.
[23] Landais S,Landry S,Legault P,etal.Oncogenic potential of the miR-106-363 cluster and its implication in human T-cell leukemia[J].Cancer Res,2007,67(12):5699-5707.
[24] Mohseny AB,Szuhai K,Romeo S,etal.Osteosarcoma originates from mesenchymal stem cells in consequence of aneuploidization and genomic loss of Cdkn2[J].J Pathol,2009,219(3):294-305.
[收稿2017-04-19]
(编辑 倪 鹏)
Effectoflong-chainnon-codingCDKN2BonmiR-19inchronicmyeloidleukemia
WANGGao-Feng,LIYue-Ling,PENGHong,LIHui-Chuan.
MedicalSchoolofYellowRiverInstituteofScienceandTechnology,Zhengzhou450063,China
Objective:To investigate the effect of long-chain non-coding CDKN2B targeting miR-19 on the biological behavior of chronic myeloid leukemia cells and its mechanism.Methods: The expression of CDKN2B in different leukemia cells were detected by qPCR.Double luciferase reporter gene was used to detect the interaction between CDKN2B and miR-19.MTT proliferation assay and flow cytometry were used to detect the effect of CDKN2B on the proliferation and apoptosis of HL-60 cells.The changes of migration ability of leukemia HL-60 cells after overexpress of CDKN2B were detected by scratch test.The changes of invasion ability of leukemia HL-60 cells after silencing CDKN2B were detected by Transwell invasion assay.Scaling healing experiment and Transwell invasion assay were used to detect the effect of miR-19 on the migration and invasion of leukemia cells after silencing CDKN2B.The morphological changes of cytoskeleton microfilament microtubules after silencing CDKN2B were detected by phalloidin staining.Western blot was used to detect the expression of PI3K/AKT signaling pathway after silencing CDKN2B.Results: The expression level of CDKN2B was the lowest in leukemia cell HL-60.CDKN2B binds specifically to the 3′UTR of miR-19;overexpression of CDKN2B could inhibit the proliferation and enhance the apoptosis of leukemia HL-60 cells.Overexpression of CDKN2B can inhibit the invasion and migration of leukemia HL-60 cells.After overexpressed of CDKN2B,the cytoskeleton showed decreased pseudopodia and decreased exercise capacity.The expression of actin was down-regulated.The expression of PI3K/AKT pathway protein was down-regulated after overexpressed of CDKN2B.Conclusion: CDKN2B can target the regulation of miR-19 to regulate the biological behavior of leukemia cells.
CDKN2B;Leukemia;miR-19;Phalloidin
10.3969/j.issn.1000-484X.2017.09.021
王高峰(1975年-),女,硕士,实验师(工程师),主要从事药剂学方面研究,E-mail:cassssi@sina.com。
R733.7
A
1000-484X(2017)09-1375-06
①本文为河南省教育厅重点研究项目(15B350003)。
②郑州大学第一附属医院肝胆外科,郑州450052。
