蛋白酶体抑制剂MG132对大鼠胶原诱导性关节炎的干预机制①
2017-09-20宁丽常蹇孝丽蒋红梅
宁丽常 蹇孝丽 岳 萍 蒋红梅
(贵州医科大学临床微生物和免疫教研室 ,贵阳550004)
·临床免疫学·
蛋白酶体抑制剂MG132对大鼠胶原诱导性关节炎的干预机制①
宁丽常 蹇孝丽②岳 萍③蒋红梅
(贵州医科大学临床微生物和免疫教研室 ,贵阳550004)
目的:探讨蛋白酶体抑制剂MG132对大鼠胶原诱导性关节炎(Collagen induced arthritis,CIA)的干预效果及作用机制。方法:48只雌性SD大鼠被随机分为空白对照组、CIA模型组、MG132干预模型组,每组16只CIA模型组和MG132干预模型组注射牛Ⅱ型胶原建立CIA模型大鼠,初次免疫后第21天,干预组大鼠以1 mg/kg的剂量每天1次,连续14天皮下注射MG132。建模起每周观察大鼠关节肿胀程度,计算关节炎指数(Arthritis index,AI),第42天后称重并处死大鼠;HE染色观察关节滑膜组织的病理改变;荧光底物测定法检测滑膜组织20S蛋白酶体的活性;蛋白质印迹法(Western blot)检测大鼠关节滑膜组织NF-κB/p65、IκBα蛋白的表达情况。结果:与CIA模型组比较,MG132干预模型组大鼠关节炎指数在注射MG132后一周明显降低(P<0.05),关节滑膜组织未见明显增生,只伴有少量炎性细胞浸润。与空白对照组大鼠比较,CIA模型组大鼠关节滑膜组织20S蛋白酶体活性增高;与CIA模型组大鼠比较,MG132皮下注射干预后关节滑膜组织20S蛋白酶体活性降低(P<0.05)。与空白对照组比较,CIA模型组大鼠关节滑膜组织高表达NF-κB/p65蛋白,其中胞核NF-κB/p65表达增高更为明显(P<0.01),注射蛋白酶体抑制剂MG132干预后,其滑膜组织胞浆及胞核NF-κB/p65蛋白表达均显著减少(P<0.01)。与空白对照组比较,CIA模型组大鼠关节滑膜低表达IκBα蛋白(P<0.01),注射MG132干预后关节滑膜IκBα蛋白表达显著增多(P<0.01)。结论:大鼠CIA体内实验显示,蛋白酶体抑制剂MG132经皮下注射可明显改善大鼠关节炎症状,其作用机制可能与MG132降低大鼠CIA关节滑膜组织20S蛋白酶体活性,减少其底物蛋白IκBα的表达,从而抑制NF-κB活性有关。
胶原诱导性关节炎;蛋白酶体抑制剂MG132;20S蛋白酶体;NF-κB;IκBα蛋白
类风湿性关节炎(Rheumatoid arthritis,RA)是一种由多种细胞因子参与的、以关节滑膜炎症为主要特征的全身性自身免疫性疾病。主要表现为对称性的多个小关节僵硬、疼痛和肿胀,随着病情的发展后期常常可能导致关节畸形以及活动功能受限[1,2]。虽然近年来在细胞和分子水平上关于RA的机制研究已经取得了一些成果,但其确切病因仍未完全明确,目前仍未找到治疗RA的理想药物。因此,继续研究RA的发病机制并且寻找有效的治疗药物有着重要的意义。
泛素-蛋白酶体途径(Ubiquitin proteasome pathway,UPP)是生物体内蛋白质选择性降解的重要途径之一。而起催化核心作用的20S蛋白酶体是UPP的重要组成部分,目前针对UPP的抑制剂主要是通过选择性地抑制20S蛋白酶体的活性来发挥作用[3,4]。同时,蛋白酶体抑制剂可抑制IκB蛋白的降解从而抑制NF-κB的活性,这是近年来免疫、炎症等研究领域的热点[5]。在炎症及自身免疫性疾病的发生发展中,NF-κB作为主要调控多种免疫和炎症基因表达的转录因子起着重要的作用[6,7]。以NF-κB作为靶点,通过对NF-κB通路激活的抑制,有望成为RA治疗的一条新途径。NF-κB的激活可以通过UPP来调节[8,9]。蛋白酶体抑制剂可抑制蛋白酶体的活性使IκB稳定,从而抑制NF-κB的活性,减少NF-κB通路参与的炎症因子的表达。
本实验用蛋白酶体抑制剂MG132皮下注射干预大鼠胶原诱导性关节(Collagen induced arthritis,CIA),观察其对CIA大鼠关节炎指数(AI)、关节滑膜组织病理形态、滑膜组织20S蛋白酶体活性及NF-κB/p65、IκBα蛋白表达的影响,探讨蛋白酶体抑制剂MG132对大鼠CIA的干预效果及作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 雌性SD大鼠,清洁级,体重(180±20.13)g,购自重庆动物中心,实验动物使用许可证号:SCXK(渝)2012-0005。动物房使用许可证号:SYXK(黔):2002-0001。动物饲料使用许可号:SCXK(渝)2007-0006。
1.1.2主要试剂及仪器 MG132 批号S2619 (Selleck)、牛Ⅱ型胶原(Bovine Collagen Type Ⅱ,BⅡC)批号C7806、弗氏完全佐剂(FCA)批号F5881(Sigma)、Western blot一抗:兔源NF-κB/p65单克隆抗体 批号8242p (CST)、兔源IκBα单克隆抗体 批号ab32518 (Abcam),内参:鼠源GAPDH单克隆抗体 批号60004-1-Ig、鼠源LaminB1单克隆抗体 批号66095-1-Ig (武汉三鹰),二抗:辣根过氧化物酶标记羊抗兔IgG 批号BS13278、辣根过氧化物酶标记羊抗鼠IgG 批号BS12478 (南京巴傲得生物科技有限公司),BCA蛋白浓度测定试剂盒 批号PC0020-20140919(北京索莱宝科技有限公司)、蛋白酶体活性检测试剂盒 批号APT280-2648190(德国 millipore公司)、20S蛋白酶体检测试剂盒 批号CSB-EQ027420HU (武汉华美生物工程有限公司)、ELX800酶标仪(美国 Bio-tek公司)等。
1.2实验方法
1.2.1实验动物分组与处理 雌性SD大鼠48只,适应性饲养一周后被随机分为空白对照组、CIA模型组、MG132干预模型组三组,每组16只。按组分笼饲养,室温15~25℃,自然采光,普通饲料喂养,自由饮水。
1.2.2CIA大鼠模型的复制 牛Ⅱ型胶原(BⅡC)10 mg溶于5 ml配制好的0.1 mol/L的醋酸溶液中,在冰浴中搅拌使之充分溶解,配制成浓度为2 mg/ml的胶原溶液,置于4℃冰箱过夜。次日再将弗氏完全佐剂(Freund′s complete adjuvant,CFA)与配制好的胶原溶液按照1∶1等体积混合,在冰浴中充分乳化,乳化完全的标准为将乳剂滴入清水中不扩散,乳化完全后的胶原乳剂浓度为1 mg/ml,置于4°C冰箱备用。参照文献[10]来复制CIA大鼠模型,CIA模型组和MG132干预模型组大鼠在其左后足跖部皮内多点注射乳化完全的胶原乳剂,每只注射200 μl,初次注射后第14天在尾根部皮下多点注射相同剂量的胶原乳剂以加强免疫,复制胶原诱导性关节炎大鼠模型,空白对照组同方法注射同剂量的生理盐水。
1.2.3蛋白酶体抑制剂MG132干预 粉末状的MG132溶解在二甲亚砜(DMSO)中,配制成5 mg/ml的浓度然后放在-20℃冰箱备用。在初次注射胶原乳剂建模后第21天,MG132干预模型组和单纯MG132对照组大鼠用微量注射器以1 mg/kg的量皮下注射MG132,每天1次,连续注射14 d[11]。用同样方法空白对照组和CIA模型组大鼠注射相同剂量的溶剂DMSO,三组在初次免疫后第42天即注射完MG132后一周处死大鼠。
1.2.4关节炎指数 按5级评分法评价大鼠关节炎指数(Arthritis index,AI)[12],计算各组大鼠初次免疫第7、14、21、28、35、42天关节炎指数,并记录。
1.2.5关节滑膜组织病理观察 用10%的中性福尔马林将关节滑膜组织固定24 h,制石蜡切片,HE染色,光镜下观察关节滑膜细胞增生情况及炎症细胞浸润等情况。
1.2.6大鼠滑膜组织20S蛋白酶体活性检测 96孔板每孔加入30 μg蛋白样品、10 μl蛋白酶体亚基(Suc-LLVY-AMC)、10 μl的10×buffer(包括250 mmol/L HEPES,pH7.5,5 mmol/L EDTA,0.5% NP-40,0.01% SDS),再用去离子水补足体积至100 μl,空白对照孔不加蛋白样品,其他成分同样品孔,充分振荡混匀。60℃孵育1 h,采用多功能酶标仪测定反应产物的荧光强度(激发波长:380 nm,发射波长:460 nm)。该组蛋白酶体的活性用每组测得的荧光强度值减去空白对照孔的值表示。
1.2.7Western blot法检测大鼠关节滑膜组织NF-κB/p65、IκBα蛋白的表达情况 按试剂盒说明书对滑膜组织核蛋白和浆蛋白的提取;用BCA蛋白定量法测核蛋白和浆蛋白的浓度,SDS-PAGE凝胶电泳、转膜、封闭、 一抗孵育、 二抗孵育和 ECL发光显色。采用凝胶成像系统成像,图像分析软件进行分析,以各组目的条带灰度值与相应内参灰度值的比值进行半定量分析。
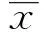
图1 各组大鼠关节炎指数变化Fig.1 Comparisons of arthritis indexes(AI)of rats in every group
2 结果
2.1MG132干预后大鼠一般情况变化 空白对照组大鼠生长良好,饮食正常,活动自如,反应灵敏度CIA模型组大鼠从造模后第7天开始,被注射足开始出现明显红肿,并慢慢累及趾间关节、跖间关节、踝关节等,在第14天进行加强免疫后,对侧足开始由跖趾关节至踝关节出现不同程度的肿胀。第21天左右达高峰,关节红肿逐渐加重,甚至出现踝关节及四肢关节红肿,行动迟缓、跛行,并缓慢出现关节强直、畸形以至活动障碍。MG132干预模型组大鼠在造模第21天出现明显关节炎症状后皮下注射蛋白酶体抑制剂MG132,两周后被注射足及对侧足的红肿程度有所减轻,且少有关节功能障碍和关节畸形,大鼠行动较灵活。
2.2大鼠关节炎指数变化 各组大鼠关节炎指数见图1、表1。与空白对照组在同一时间点比较,CIA模型组和MG132干预模型组大鼠在初次免疫第7天后关节炎指数开始升高,并在第21天达到最高(P<0.05)。在连续注射MG132干预14 d后一周即建模第42天与模型组同一时间点比较,在初次免疫第22天开始皮下注射MG132对CIA大鼠进行干预,大鼠关节炎指数有所下降(P<0.05)。


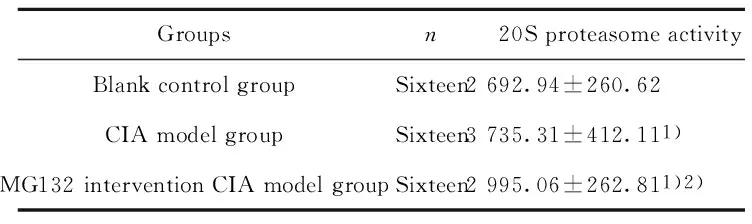
Groupsn20SproteasomeactivityBlankcontrolgroupSixteen2692.94±260.62CIAmodelgroupSixteen3735.31±412.111)MG132interventionCIAmodelgroupSixteen2995.06±262.811)2)
Note:The 20S proteasome activity was expressed by the fluorescence intensity of each experimental group minus the experimental blank hole fluorescence intensity.Compared with the blank control group 1)P<0.05,Compared with CIA model group 2)P<0.05.


GroupsnSeventhdaysFourteenthdaysTwenty-firstdaysTwenty-eighthdaysThirty-fifthdaysForty-seconddaysBlankcontrolgroupSixteen000000CIAmodelgroupSixteen2.44±0.511)6.13±0.891)11.00±0.891)10.31±1.301)10.19±1.471)9.44±1.211)MG132interventionCIAmodelgroupSixteen2.50±0.521)5.94±1.071)10.69±1.301)9.38±1.091)9.06±1.121)7.88±1.461)2)
Note:Compared with the blank control group at the same time,1)P<0.05;compared with the CIA model group at the same time,2)P<0.05.

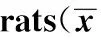

GroupsnCytosolicNF-kappaB/p65NuclearNF-kappaB/p65CytosolicIkappaBalphaBlankcontrolgroupSixteen1.01±0.010.12±0.010.73±0.06CIAmodelgroupSixteen1.75±0.021)1.09±0.041)0.57±0.061)MG132interventionCIAmodelgroupSixteen1.23±0.041)2)0.68±0.021)2)0.71±0.012)
Note:the data in the table is the gray value analysis by image J software,In each band gray value ratio and the corresponding reference gray value representation.Compared with the blank control group,1)P<0.01;compared with CIA model group,2)P<0.01.
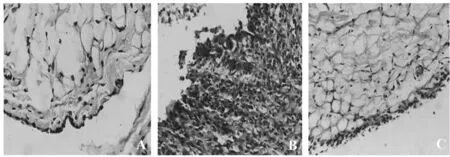
图2 各组大鼠关节滑膜组织病理(HE染色,×400)Fig.2 Histological characteristics of synovial tissue in rats(HE staining,×400)Note:A.Blank control group;B.CIA model group;C.MG132 intervention CIA model group.
2.3大鼠关节滑膜组织病理形态观察 空白对照组大鼠关节滑膜组织由1~3层滑膜细胞及滑膜下层组成,滑膜细胞排列规则,未见炎性细胞浸润(图2A)。CIA模型对照组大鼠关节滑膜组织明显增厚,滑膜细胞明显增生,并见大量炎性细胞浸润(图2B)。MG132干预模型组大鼠滑膜组织细胞轻度增生,伴有少量炎性细胞浸润(图2C)。
2.4大鼠滑膜组织20S蛋白酶体活性 如表2结果显示,与空白对照组比较,CIA模型组大鼠关节滑膜组织20S蛋白酶体活性明显增强(P<0.05)。通过皮下注射MG132干预后,其关节滑膜组织20S蛋白酶体活性明显下降,与CIA模型组相比较差异有统计学意义(P<0.05)。
2.5Western blot法检测大鼠关节滑膜组织NF-κB/p65、IκBα蛋白的表达情况 如表3、图3结果显示,与空白对照组比较,CIA模型组大鼠关节滑膜组织胞浆及胞核NF-κB/p65蛋白的相对表达量均显著增多(P<0.01),而胞浆IκBα蛋白相对表达量减少(P<0.05)。相对于CIA模型组,在其皮下注射MG132干预后其滑膜组织胞浆及胞核NF-κB/p65蛋白的相对表达量均明显减少,而胞浆IκBα蛋白相对表达量则明显增多,与CIA模型组比较差异有显著统计学意义(P<0.01)。
图3 各组大鼠关节滑膜组织NF-κB/p65、IκBα蛋白的表达情况Fig.3 Protein expression of NF-κB/p65,IκBα in synovial tissue of ratsNote:1.Blank control group;2.CIA model group;3.MG132-intervention CIA model group.
3 讨论
RA是一种常见的、与遗传相关并有多种因素参与的自身免疫性疾病,其主要原因在于免疫调节因素如免疫耐受的失衡。目前对RA的治疗主要依赖于改善病情抗风湿药(DMARDs),包括甲氨蝶呤、糖皮质激素和生物制剂的早期积极治疗。一般单用DMARDs会限制其长期疗效,这可能是因为多药耐药的结果。因此,在RA治疗上,很有必要继续研究新型药物及其作用机制[1]。
本实验皮下注射蛋白酶体抑制剂MG132来干预CIA大鼠,实验结果表明,皮下注射MG132干预CIA大鼠后大鼠关节肿胀及功能障碍明显减轻,关节炎指数亦显著降低,炎症症状明显缓解。同时关节滑膜组织病理学显示滑膜增生明显减少,只伴有少量的炎性细胞浸润,结果提示皮下注射蛋白酶体抑制剂MG132对CIA大鼠的炎症症状能有效改善,并对疾病的进一步发展能有效缓解。
UPP是细胞内ATP依赖的蛋白质选择性降解的主要途径,是真核细胞内重要的蛋白质调控系统,参与细胞凋亡、MHCⅠ 类抗原的递呈、细胞周期以及细胞内信号转导等多种生理过程,对维持细胞的稳态具有十分重要的意义[13]。UPP中具有蛋白酶催化活性的核心部分是20S蛋白酶体[14]。在系统性红斑狼疮、皮肌炎和多发性硬化症患者的血清中检测到抗蛋白酶体的自身抗体存在[15-17]。本实验检测了CIA大鼠滑膜组织20S蛋白酶体活性,结果显示,与空白对照组比较,CIA模型组大鼠关节滑膜组织中20S蛋白酶体活性显著升高,提示在CIA大鼠的关节滑膜组织中UPP存在异常。而当皮下注射蛋白酶体抑制剂MG132后,CIA大鼠关节滑膜组织中20S蛋白酶体活性显著下降。
大量研究结果表明,NF-κB信号通路是炎症反应调控机制的中心环节,NF-κB在许多免疫和炎症反应的调节中起重要作用[18]。近年来研究发现,UPP与细胞炎症反应信号转导分子NF-κB的激活、失活等密切相关,是免疫细胞炎症反应机制研究中的热点[8,9]。本实验显示,体内皮下注射蛋白酶体抑制剂MG132干预CIA模型大鼠效果良好,为了进一步探讨其作用机制,我们检测了炎症相关转录因子NF-κB/p65及其抑制蛋白IκBα在滑膜组织中的表达水平。实验结果显示,与空白对照组大鼠比较,CIA模型组大鼠关节滑膜组织高表达NF-κB/p65蛋白,其中以胞核的NF-κB/p65蛋白表达增高更加显著;当用MG132干预CIA模型大鼠后,与CIA模型组相比,大鼠关节滑膜组织胞浆及胞核的NF-κB/p65蛋白表达量均显著降低。相对于空白对照组,IκBα蛋白在CIA模型组大鼠关节滑膜组织中的表达减少,当用MG132干预后其表达量又显著增多。蛋白酶体抑制剂可以通过抑制蛋白酶体的活性来稳定IκB,阻止NF-κB进入细胞核,从而抑制NF-κB的活性,减少NF-κB通路参与的炎症因子表达,减轻炎症反应。
本实验用蛋白酶体抑制剂MG132干预CIA模型大鼠后大鼠关节的炎症症状明显减轻,关节滑膜病理显示滑膜轻度增生,通过进一步探讨其干预机制发现MG132可能主要是通过降低关节滑膜组织20S蛋白酶体活性使IκB蛋白降解减少而阻止NF-κB进入细胞核,从而抑制NF-κB的活性使得炎症症状有所减轻。综上所述,本研究应用蛋白酶体抑制剂对SD大鼠实验性类风湿性关节炎(CIA)进行干预,显示了有意义的治疗效果,其临床应用价值值得进一步探讨。
[1] Mclnnes IB,Schett G.The pathogenesis of rheumatoid arthritis[J].N Engl J Med,2011,365(23):2205-2219.
[2] 耿学丽,李晓明,陈向华,等.类风湿性关节炎免疫学研究进展[J].承德医学院学报,2015,32(1):67-70.
[3] 陈紫萱.蛋白酶体抑制剂MG132对人肝癌细胞增殖和凋亡的影响[J].海峡药学,2014,26(11):142-143.
[4] Pandit B,Gartel AL.Proteasome inhibitors induce p53-independent apoptosis in human cancer cells[J].Am J Pathol,2011,178(1):355-360.
[5] 吕春秀,汪治宇.泛素-蛋白酶体抑制剂的研究及应用进展[J].中国老年学杂志,2011,31(23):4735-4738.
[6] Tornatore L,Thotakura AK,Bennett J,etal.The nuclear factor κappaB signaling pathway:Integrating metabolism with inflammation[J].Trends Cell Biol,2012,22(11):557-566.
[7] Vallabhapurapu S,Karin M.Regulation and function of NF-κappaB transcription factors in the immune system[J].Annu Rev Immunol,2009,27(6):693-733.
[8] Liu S,Chen ZJ.Expanding role of ubiquitination in NF-κappaB signaling[J].Cell Res,2011,21(1):6-21.
[9] Skaug B,Jiang X,Chen ZJ.The role of ubiquitin in NF-κappaB regulatory pathways[J].Annu Rev Biochem,2009,78(7):769-796.
[10] 胡恒贵,尹向飞,蒋红梅.核因子-κB 寡聚脱氧核苷酸诱骗剂处理树突状细胞对大鼠胶原诱导性关节炎治疗作用研究[J].蚌埠医学院学报,2012,37(6):633-635,638.
[11] Ahmed AS,Ahmed M,Jian J,etal.Proteasome inhibitor MG132 modulates inflammatory pain by central mechanisms in adjuvant arthritis[J].Int J Rheumatic Diseases,2014,2014:12353.
[12] Han YH,Park WH.MG132,a proteasome inhibitor decreased the growth of Calu-6 lung cancer cells via apoptosis and GSH depletion[J].Toxicol Vitro,2010,24(4):1237-1242.
[13] Fierabracci A.Proteasome inhibitors:a new perspective for treating autoimmune diseases[J].Current Drug Targets,2012,13(13):1665-1675.
[14] Kisselev AF,van der Linden WA,Overkleeft HS.Proteasome inhibitors:an expanding army attacking a unique target[J].Chem Biol,2012,19(1):99-115.
[15] Egerer K,Kuckelkorn U,Rudolph PE,etal.Circulating proteasomes are markers of cell damage and immunologic activity in autoimmune diseases[J].J Rheumatol,2002,29(10):2045-2052.
[16] Sixt SU,Dahlmann B.Extracellular,circulating proteasomes and ubiquitin-incidence and relevanc[J].Biochim Biophys Acta,2008,1782(12):817-823.
[17] Morawietz L,Martinez-Gamboa L,Scheffler S,etal.Expression of proteasomal immunosubunit beta1i is dysregulated in inflammatory infiltrates of minor salivary glands in Sjogren′s syndrome[J].J Rheumatol,2009,36(12):2694-2703.
[18] Gao LN,Feng QS,Zhang XF,etal.Tetrandrine suppresses articular inflammatory response by inhibiting pro-inflammatory factors via NF-κB inactivation[J].J Orthop Res,2016,34(9):1557-1568.
[收稿2017-04-06 修回2017-05-03]
(编辑 许四平 刘格格)
InterventioneffectofproteasomeinhibitorMG132inratswithcollagen-inducedarthritis
NINGLi-Chang,JIANXiao-Li,YUEPing,JIANGHong-Mei.
DepartmentofClinicalMicrobiologyandImmunology,GuizhouMedicalUniversity,Guiyang550004,China
Objective:To explore the intervention effect of proteasome inhibitor MG132 in rats with collagen-induced arthritis(CIA),which resembles human rheumatoid arthritis(RA).Methods:Forty-eight female SD rats were randomly divided into three groups,including blank control group,CIA model group and MG132-treated group.There were sixteen rats in each group.Rats in CIA model group and MG132-treated model group were injected with type Ⅱ collagen to established CIA rats.21 days after the initial immunization,the rats in the MG132-treated model group were injected subcutaneously with 1 mg/kg MG132 once daily for 2 weeks.42 days after the initial immunization,the change of paw-swelling and the arthritis scores were determined.The synovial pathology examination was performed with HE staining.The 20S proteasome activity in synovial tissue was measured by fluorescence substrate assay.The expression of NF-κB/p65,IκBα in synovial tissue were analyzed by Western blot.Results:Proteasome inhibitor MG132 significantly attenuated the severity of arthritis and histopathological changes in CIA rats.Compared with the blank control group,the 20S proteasome activity was increased significantly in the CIA model group(P<0.05),and decreased after injection of MG132.Compared with CIA rats,the expression of NF-κB/p65 significantly decreased in rats treated with MG132(P<0.01).Compared with the blank control group,the expression of IκBα protein decreased in CIA model group.After injected with MG132,the protein was significantly increased(P<0.01).Conclusion:The proteasome inhibitor MG132 may attenuates the severity of arthritis and histopathological changes in CIA rats.These effects may be mediated through the inhibition of NF-κB activity.
Collagen induced arthritis;Proteasome inhibitor MG132;20S proteasome;NF-κB;IκBα protein
10.3969/j.issn.1000-484X.2017.09.018
①本文为国家自然科学基金地区科学基金项目(No.81660361)和贵阳市科技局贵州医科大学联合资金国家自然科学基金培育项目(No.GY2015-38)资助。
宁丽常(1992年-),女,在读硕士,主要从事自身免疫性疾病研究,E-mail:1273754337@qq.com。
及指导教师:蒋红梅(1973年-),女,博士,教授,硕士生导师,主要从事自身免疫性疾病研究,E-mail:646117948@qq.com。
R593.22
A
1000-484X(2017)09-1361-05
②贵阳中医学院第一附属医院检验科,贵阳550004。
③贵州医科大学物理教研室,贵阳550004。
