米曲霉脂肪酶催化鱼油酯酯交换制备高含量EPA/DHA甘油酯的研究
2017-09-16郑建永张石自王升帆
郑建永,张石自,王升帆,李 俊,汪 钊
(1.浙江工业大学 生物工程学院,浙江省生物有机合成技术研究重点实验室,杭州 310014;2.浙江医药股份有限公司 新昌制药厂,浙江 新昌 312500)
米曲霉脂肪酶催化鱼油酯酯交换制备高含量EPA/DHA甘油酯的研究
郑建永1,2,张石自1,王升帆2,李 俊1,汪 钊1
(1.浙江工业大学 生物工程学院,浙江省生物有机合成技术研究重点实验室,杭州 310014;2.浙江医药股份有限公司 新昌制药厂,浙江 新昌 312500)
利用米曲霉脂肪酶催化甘油酯型鱼油和乙酯型鱼油的酯酯交换反应制备高含量EPA/DHA甘油酯,考察了底物摩尔比、反应温度、酶添加量和摇床转速对酶催化反应的影响,得到了最优酶催化反应条件:甘油酯型鱼油与乙酯型鱼油摩尔比1∶3,酶添加量14%,反应温度70℃,摇床转速150 r/min。在最优的酶催化反应条件下反应18 h,产物甘油酯型鱼油EPA和DHA含量可达到39.72%。在优化条件下对米曲霉WZ007菌丝体重复使用6次,甘油酯型鱼油产品中的EPA和DHA含量仍保持在34.51%。
脂肪酶;鱼油;EPA;DHA;酯酯交换;米曲霉
脂肪酶广泛存在于自然界中,包括动物、植物和微生物,例如在人和动物体内,各类脂肪酶的功能主要是控制消化、吸收和脂蛋白代谢等过程[1-3]。微生物脂肪酶主要来源于细菌和真菌,由于其来源广泛、生产周期短、易于生产,细菌胞外脂肪酶被广泛应用于食品、香料、清洁剂、手性医药中间体和其他一些化学品的生产中[4-5]。传统的物理化学法制备高含量EPA和DHA甘油酯的方法包括低温结晶法,金属盐沉淀法和超临界流体萃取法[6]。与物理化学法相比,微生物酶法具有催化效率高、选择性高,在工业化生产中能耗低等优势[7];微生物酶法反应条件温和,对n-3 PUFA的结构不会造成破坏[8]。酶催化反应可在无溶剂体系中进行,从而避免了庞大的生产设备,生产安全系数更高。目前有关酶法酯酯交换的研究报道较少,国内有学者在这方面有所研究。郭正霞等[9]利用国产固定化假丝酵母脂肪酶催化甘油酯型鱼油和乙酯型鱼油酯酯交换,制备高PUFA含量的甘油酯型鱼油,优化条件下得到的甘油三酯中DHA和EPA的含量分别为13.10%和33.40%。宋诗军等[10]以酶催化选择性醇解反应得到的混合甘油酯和乙酯鱼油为原料,加入底物质量2%的Novozym 435为催化剂,在100 Pa真空条件下,60℃磁力搅拌6 h,产物经过分子蒸馏处理后,得到以甘油三酯为主的产品,其中DHA和EPA含量分别为28.6%和40.4%。近年来酶法催化富集n-3 PUFA的方法越来越受到关注[11-12],但是研究通常采用商品化脂肪酶作为催化剂,存在酶的价格昂贵和使用成本较高等问题。因此,本课题组利用具有自主知识产权的高活性全细胞脂肪酶催化制备富集n-3 PUFA产品,降低了成本,具有重要的理论意义和应用价值。
利用实验室保藏的米曲霉WZ007菌丝体所含脂肪酶催化甘油酯型鱼油和乙酯型鱼油的酯酯交换反应制备高含量EPA和DHA甘油酯,并对各因素对酶催化反应的影响进行研究。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
甘油酯型鱼油(EPA含量11.5%,DHA含量14.5%)、乙酯型鱼油(EPA含量26.0%,DHA含量21.5%),由浙江医药股份有限公司新昌制药厂提供。正己烷等化学试剂购自国药集团化学试剂有限公司。米曲霉WZ007菌株(中国典型培养物保藏中心,保藏号CCTCC M206105)为本实验室保藏菌株。
1.1.2 仪器与设备
Agilent 6890气相色谱仪,Avanti J-E高速冷冻离心机,B2-2FA2004电子分析天平,ALPHA 2-4 LD plus真空冷冻干燥机,HWY-2112恒温水浴摇床等。
1.2 试验方法
1.2.1 米曲霉菌丝体的制备
米曲霉WZ007发酵培养基组成:蛋白胨20 g/L,橄榄油10 mL/L,KH2PO41 g/L,MgSO40.5 g/L,NaCl 0.5 g/L,pH自然。在30 L发酵罐中进行发酵培养,温度30℃和转速200 r/min条件下培养36 h后,过滤除去培养液,用蒸馏水洗涤数次后收集菌丝体,滤干蒸馏水后加入少量磷酸盐缓冲液(0.1 mol/L,pH 7.0)浸泡,在-60℃条件下真空冷冻干燥48 h,将米曲霉菌丝体4℃冰箱保存备用。
1.2.2 酶催化酯酯交换反应
在50 mL磨口具塞三角瓶中加入一定量的甘油酯型鱼油和乙酯型鱼油(总质量10 g),一定量的米曲霉菌丝体,用保鲜膜密封,置于一定温度和转速的恒温水浴摇床上,开始反应,定时取样气相色谱分析产物中乙酯型鱼油EPA和DHA的含量。
1.2.3 产物中EPA和DHA含量计算
产物甘油酯型鱼油EPA和DHA的含量(Y)由下式计算。
式中:X1和X2分别表示反应前和反应后乙酯型鱼油EPA和DHA的总含量;n(EE)和n(TAGs)分别表示原料中乙酯型鱼油和甘油酯型鱼油的物质的量;Y1表示原料甘油酯中EPA和DHA的总含量,在本试验中为26.0%。
2 结果与讨论
2.1 底物摩尔比对酶催化酯酯交换反应的影响
反应底物总质量为10 g,甘油酯型鱼油与乙酯型鱼油的摩尔比范围为1∶1~1∶4.5,酶添加量为底物总质量的10%(即1 g,每个样品3个平行),于50 mL 磨口具塞三角瓶。在30℃,200 r/min水浴摇床中反应18 h,气相色谱检测产物中乙酯型鱼油EPA和DHA含量,并计算产物甘油酯型鱼油EPA和DHA含量,结果如图1所示。
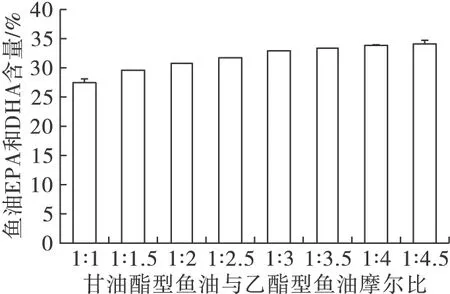
图1 底物摩尔比对酶催化酯酯交换反应的影响
由图1可知,产物甘油酯型鱼油EPA和DHA的含量随着甘油酯型鱼油与乙酯型鱼油摩尔比的增大而缓慢增加,当底物摩尔比增大到1∶3.5以后,甘油酯型EPA和DHA的含量基本不变,说明此时反应达到平衡。综合考虑后续分离的能耗,选择甘油酯型鱼油与乙酯型鱼油摩尔比1∶3作为后续试验的反应底物摩尔比。
2.2 反应温度对酶催化酯酯交换反应的影响
反应底物甘油酯型鱼油与乙酯型鱼油摩尔比1∶3,酶添加量10%,于50 mL磨口具塞三角瓶。控制反应温度分别为30、40、50、55、60、65、70℃和75℃,摇床转速200 r/min,反应时间18 h。气相色谱检测产物中乙酯型鱼油EPA和DHA含量,并计算产物甘油酯型鱼油EPA和DHA含量,结果如图2所示。
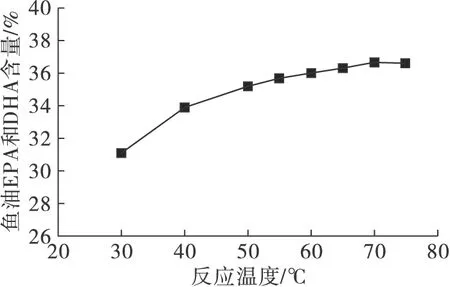
图2 反应温度对酶催化酯酯交换反应的影响
由图2可知,产物甘油酯型鱼油EPA和DHA的含量随反应温度的升高而增加,说明随着反应温度的升高,脂肪酶的活性缓慢提高,并在70℃时,甘油酯型EPA和DHA含量达到最大值(36.61%),当反应温度继续升高到75℃时,甘油酯型鱼油EPA和DHA含量没有继续增加,说明米曲霉WZ007菌丝体在反应体系中具有很好的热稳定性。综合考虑热量的能耗,选择70℃为后续试验的反应温度。
2.3 酶添加量对酶催化酯酯交换反应的影响
反应底物甘油酯型鱼油与乙酯型鱼油摩尔比1∶3,酶添加量分别为10%、12%、14%、16%和18%,于50 mL磨口具塞三角瓶。反应温度70℃,摇床转速200 r/min,反应时间18 h。气相色谱检测产物中乙酯型鱼油的EPA和DHA含量,计算产物甘油酯型鱼油的EPA和DHA含量,结果如图3所示。
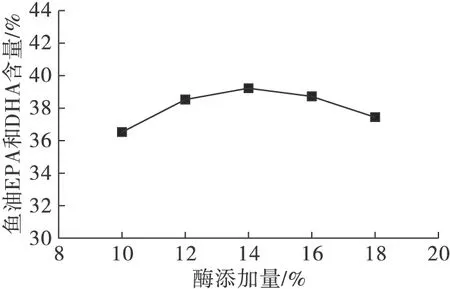
图3 酶添加量对酶催化酯酯交换反应的影响
由图3可知,当酶添加量从底物质量的10%上升到14%时,产物甘油酯型鱼油EPA和DHA的含量随酶添加量的增加而增大。当酶添加量为14%时,甘油酯型鱼油EPA和DHA含量达到最大,为39.32%。继续增加酶添加量,反应体系变得黏稠,传质受阻,甘油酯型鱼油EPA和DHA的含量反而降低。因此,选择14%为后续试验的酶添加量。
2.4 摇床转速对酶催化酯酯交换反应的影响
在50 mL具塞三角瓶中加入甘油酯型鱼油与乙酯型鱼油摩尔比1∶3,酶添加量14%,控制摇床转速分别为100、150、200、250 r/min和300 r/min,反应温度70℃,反应时间18 h。气相色谱检测产物中乙酯型鱼油EPA和DHA含量,计算产物甘油酯型鱼油EPA和DHA含量,结果如图4所示。
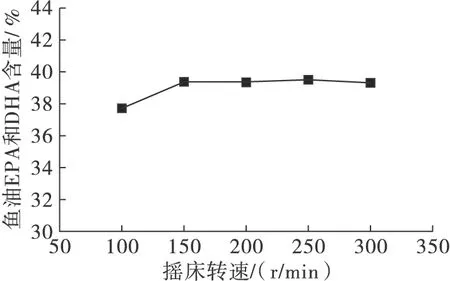
图4 摇床转速对酶催化酯酯交换反应的影响
由图4可知,当摇床转速从100 r/min上升到150 r/min 时,甘油酯型鱼油EPA和DHA含量有所增加,说明增大摇床转速对体系的传质传热起到了促进作用,摇床转速从150 r/min增加到300 r/min的过程中,甘油酯型鱼油EPA和DHA含量无明显变化。可能是体系的传质阻力几乎消失,从节省机械能耗方面考虑选择150 r/min为后续试验的摇床转速。酶催化酯酯交换反应的所需转速较低,其原因可能是甘油酯型鱼油和乙酯型鱼油具有良好的溶解性,底物的传质比较容易。
2.5 酶催化酯酯交换的反应时间曲线
在优化后的条件下(甘油酯型鱼油与乙酯型鱼油摩尔比1∶3,酶添加量14%,反应温度70℃,摇床转速150 r/min)进行酶催化酯酯交换反应,定时取样气相色谱检测产物中乙酯型鱼油EPA和DHA含量,计算产物甘油酯型鱼油EPA和DHA含量,绘制反应时间曲线,结果如图5所示。
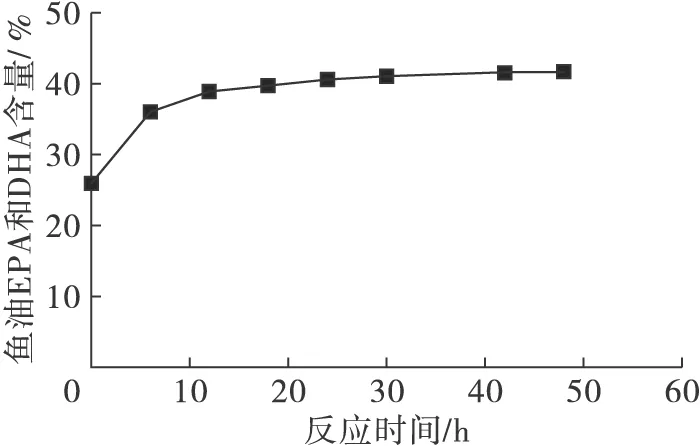
图5 酶催化酯酯交换的反应时间曲线
由图5可知,在优化条件下反应0~12 h时间范围,甘油酯型鱼油EPA和DHA含量迅速增加,12~18 h时间范围仍维持一定的反应速度。反应时间为18 h产物甘油酯型鱼油EPA和DHA含量为39.72%,18~30 h时间范围反应缓慢进行,甘油酯型鱼油EPA和DHA含量到达41.13%,30 h以后反应趋于平衡,甘油酯型鱼油EPA和DHA含量几乎不变,整个反应过程中EPA和DHA含量的最大值为41.78%(48 h),与原料甘油酯型鱼油相比,产物甘油酯型鱼油中EPA和DHA含量有明显提高。
2.6 酶的重复使用情况
在上述优化条件下,酶催化反应12 h,当反应结束后,直接离心回收米曲霉菌丝体,用少量丙酮冲洗,除去菌体上残留的底物和产物,进行10批次重复反应。气相色谱检测产物中乙酯型鱼油EPA和DHA含量,计算产物甘油酯型鱼油EPA和DHA含量,结果如图6所示。
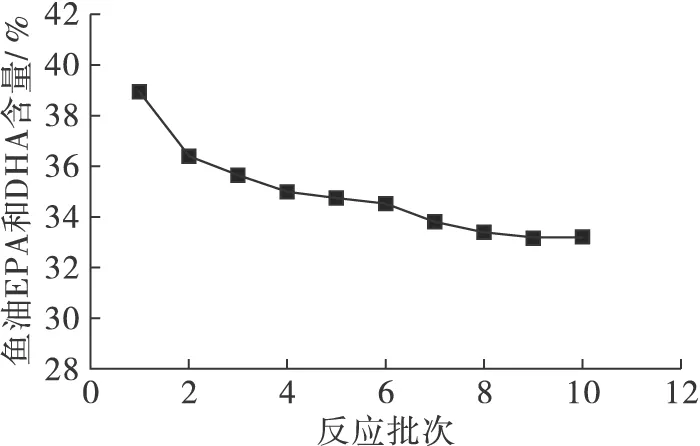
图6 酶的重复使用情况
由图6可知,第1批反应12 h甘油酯型鱼油EPA和DHA含量为38.84%,米曲霉菌丝体重复使用6次,甘油酯型鱼油EPA和DHA含量为34.51%。米曲霉菌丝体重复使用10次,甘油酯型鱼油EPA和DHA含量为33.2%,高于进口甘油酯型鱼油EPA和DHA含量30%的水平。重复批次反应过程中甘油酯型鱼油EPA和DHA含量逐渐降低,其原因可能是长时间处于较高温度使酶变性失活,或者是洗涤步骤造成细胞的脂肪酶蛋白流失。总体而言,米曲霉WZ007菌丝体具有较好的操作稳定性,可以重复使用,将大大降低其应用成本。
3 结 论
利用米曲霉WZ007菌丝体脂肪酶催化乙酯型鱼油(EPA和DHA含量47.5%)和甘油酯型鱼油(EPA和DHA含量26.0%)酯酯交换反应,重点考察了底物摩尔比、反应温度、酶添加量和摇床转速等因素对反应的影响。试验得到了优化的工艺条件:甘油酯型鱼油与乙酯型鱼油摩尔比1∶3,酶添加量为底物总质量的14%,反应温度70℃,摇床转速150 r/min。在优化的条件下,酶催化反应18 h,产物甘油酯型鱼油EPA和DHA含量可达到39.72%,反应48 h,产物甘油酯型鱼油EPA和DHA含量为41.78%。在优化条件下,米曲霉WZ007菌丝体重复使用6次,产物甘油酯型鱼油EPA和DHA含量仍保持在34.51%。试验结果表明,米曲霉WZ007催化制备高含量EPA和DHA甘油酯型鱼油产品具有较强的工业化应用潜力。
[1] 邓琳芬. 米曲霉FS-1脂肪酶发酵优化、分离纯化与酶学特性的研究[D]. 福州:福建师范大学, 2011.
[2] 任丽虹, 周应揆. 脂肪酶产生菌的筛选及一株黑曲霉产脂肪酶最适条件研究[J]. 工业微生物, 1996, 26(1):23-26.
[3] CARRIERE F, GARGOURI Y, MOREAU H, et al. Gastric lipases: cellular, biochemical and kinetic aspects lipases: their structures, biochemistry and application[M]. Oxford: Cambridge University Press, 1994.
[4] JAKAB G, MANRIQUE A, ZIMMERLI L, et al. Molecular characterization of a novel lipase-likepathogeninducible gene family ofArabidopsis[J]. Plant Physiol, 2003, 132(4): 2230-2239.
[5] 谈重芳, 王雁萍, 陈林海, 等. 微生物脂肪酶在工业中的应用及研究进展[J]. 食品工业科技, 2006, 27(7): 193-195.
[6] 曾远平, 刘耘, 杨继国. 鱼油中EPA和DHA的富集方法及研究进展[J]. 现代食品科技, 2006, 22(1):160-163.
[7] ROBLES-MEDINA A, GONZALEZ-MORENO P A, ESTEBAN-CERDAN L, et al. Biocatalysis: towards ever greener biodiesel production[J]. Biotechnol Adv, 2009, 27(4): 398-408.
[8] 张华伟, 诸燕, 范琛, 等. 酶解法提取鳀鱼油的工艺研究[J]. 粮油食品科技, 2010, 18(1):27-30.
[9] 郭正霞, 孙兆敏, 张芹, 等. 酶法催化乙酯甘油酯酯交换制备富含EPA和DHA的甘油酯[J]. 食品工业科技, 2012(20):176-179.
[10] 宋诗军, 夏松养, 林晓坪, 等. 酶法制备高含量EPA、DHA甘油酯[J]. 农业机械, 2013(11):47-51.
[11] 李金章, 王玉明, 薛长湖, 等. 脂肪酶催化乙酯甘油酯酯交换制备富含EPA和DHA的甘油三酯[J]. 中国油脂, 2011, 36(1):13-16.
[12] 王卫飞, 马永钧, 范海星, 等. 酶法合成富含DHA、EPA 甘油三酯的研究[J]. 中国油脂, 2011, 36(2): 5-8.
PreparationofhighcontentEPA/DHAglyceridesfromtransesterificationoffishoilcatalyzedbyAspergillusoryzaelipase
ZHENG Jianyong1,2,ZHANG Shizi1,WANG Shengfan2, LI Jun1,WANG Zhao1
(1.Key Laboratory of Bioorganic Synthesis of Zhejiang Province, College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China; 2.Xinchang Pharmaceutical Factory, Zhejiang Medicine Co., Ltd., Xinchang 312500, Zhejiang, China)
The preparation of high content EPA/DHA glycerides form transesterification of ethyl ester-type fish oil and glyceride-type fish oil catalyzed byAspergillusoryzaelipase was studied. The effects of molar ratio of substrate, reaction temperature, enzyme dosage and rotation speed on the reaction were investigated. The optimal enzymatic transesterification conditions were obtained as follows: molar ratio of glyceride-type fish oil to ethyl ester-type fish oil 1∶3, enzyme dosage 14%, reaction temperature 70℃ and rotation speed 150 r/min. Under the optimal conditions, the content of EPA and DHA in the glyceride-type fish oil product could reach 39.72% after reaction for 18 h. WhenAspergillusoryzaeWZ007 mycelium was reused for six batches, the content of EPA and DHA in the glyceride-type fish oil product kept above 34.51% in every batch.
lipase; fish oil; EPA; DHA; transesterification;Aspergillusoryzae
2016-10-12;
:2017-02-24
国家自然科学青年基金(31600639);中国博士后科学基金(164936)
郑建永(1982),男,高级工程师,博士,研究方向为酶工程及油脂加工(E-mail) zhengjy@126.com。
汪 钊,教授(E-mail)hzwangzhao@163.com。
TS221;TQ644.3
:A
:1003-7969(2017)07-0111-04
