大豆分离蛋白肽钙螯合物的制备及表征
2017-09-16王小林孔祥珍华欲飞张彩猛陈业明
王小林,孔祥珍,华欲飞,张彩猛,陈业明
(江南大学 食品学院,江苏 无锡214122)
大豆分离蛋白肽钙螯合物的制备及表征
王小林,孔祥珍,华欲飞,张彩猛,陈业明
(江南大学 食品学院,江苏 无锡214122)
研究了酶解时间和酸法脱酰胺改性对脱植酸大豆分离蛋白肽钙离子螯合能力的影响,并对螯合物的结构特性及营养特性进行表征。结果表明:酶解240 min的肽有较好的钙结合量(57.85 mg/g),螯合物得率为28.43%,脱酰胺后钙结合量和螯合物得率分别增加到75.37 mg/g、34.55%;氨基酸分析结果表明酸性氨基酸是参与螯合物形成的重要氨基酸;相对分子质量分布实验结果说明钙离子更倾向于结合相对分子质量大于等于1 000的肽段,螯合物得率高,但相对分子质量小于等于500的肽段是获得更高钙结合量螯合物的重要肽源;红外光谱分析表明钙结合后引起肽段结构的变化,肽链羧基中的O及氨基中的N是主要配位原子;体外消化吸收模拟实验制备的肽钙螯合物有较好的胃胰酶耐受性,经消化后肽段相对分子质量几乎没有变化,钙保留率稳定在87%左右,生物利用率达81.81%。
肽钙螯合物;酶解;酸法脱酰胺;表征
钙是人体骨骼生长和生理调节的一种必需微量矿物元素,对神经调节、肌肉收缩、有丝分裂、血液凝固等发挥着重要的作用[1]。钙补充剂产品的发展经过了3次的革新,第一代产品是无机钙盐,但膳食中的植酸盐、草酸、纤维素、藻酸钠、糖醛酸、酪蛋白会降低人体对无机钙盐的吸收利用度,且溶解性差[2];第二代产品主要是有机酸钙盐,有较好的溶解性,但存在含钙量低,易溶失以及价格高等缺点[3];第三代产品即有机钙,主要包括氨基酸螯合钙与多肽螯合钙,研究表明多肽螯合钙独特的螯合体制及转运体制使其较氨基酸螯合钙能够更易且更快地被吸收[4]。
大豆分离蛋白在必需氨基酸组成上与动物蛋白不分伯仲,是一种全价蛋白质,对心血管疾病、骨质疏松症、更年期综合症有很好的预防及改善作用[5]。大豆分离蛋白经过酶解作用会释放大量的活性肽,且氨基酸及其营养价值几乎完全保留,所以具有更优的功能特性[6]。
国内外对大豆分离蛋白肽钙螯合物的研究虽有报道,但主要集中在低水解度的酶解物,即较高的相对分子质量肽上。本文通过碱性蛋白酶(Alcalase)酶解获得水解度较高的脱植酸大豆分离蛋白肽,乙醇沉淀法制备钙螯合物,并对螯合物的组成结构全面分析。此外,本研究提供的磷酸盐缓冲液(PBS)预处理方案为以后的螯合物研究领域提供了更为可靠的方法基础。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
低温脱脂豆粕:山东禹王集团;植酸钠:罗定市宝日植酸钠有限公司;植酸酶(45 000 U/g):山东潍坊苏柯汉生物技术有限公司;胆酸盐:Sigma-Aldrich;碱性蛋白酶(Alcalase):诺维信(中国)生物技术有限公司。
氢氧化钠、盐酸、氯化钙、乙醇、硝酸、溴化钾、磷酸氢二钠、磷酸二氢钠,分析纯;三羟甲基氨甲烷(Tris)、胰蛋白酶、胃蛋白酶,生物试剂。
1.1.2 仪器与设备
K9840自动凯氏定氮仪;磁力搅拌器;Himac CR21GⅡ型冷冻离心机:日本Hitachi公司;LGJ-18型冷冻干燥机;UV-1500型紫外可见分光光度计;HH-601超级恒温水浴箱;SHA-2A冷冻水浴恒温振荡器;TDZ5-WS台式低速离心机;烘箱;AR224CN电子天平;箱式电阻炉;AA-240原子吸收分光光度计:美国瓦里安公司;D-2000 Elite高效液相色谱仪:日本Hitachi公司;DELTA320 pH计:Mettler-Toledo仪器有限公司;Nicolet Nexus 470傅里叶红外光谱仪:美国Nicolet公司;835-50型氨基酸自动分析仪:日本Hitachi公司;UV-2450紫外可见分光光度计:日本岛津公司。
1.2 实验方法
1.2.1 脱植酸大豆分离蛋白的提取
豆粕与水按料液比1∶10混合,调节溶液pH 7.0于25℃下搅拌1 h。经纱布过滤后离心(7 500 r/min,4℃,30 min)。取上清液于烧杯中,以40 U/g(以豆粕的质量计)加入植酸酶酶解(pH 5.0,25℃)1 h。酶解完成后,迅速调节pH 4.5,酸沉1 h,离心后弃上清,水洗沉淀并于pH 7.0复溶,离心,取上清液冻干,即得到大豆分离蛋白。
植酸含量的测定参考Wang等[7]的方法。脱植酸后,大豆分离蛋白中植酸含量由20.02 mg/g下降到3.13 mg/g。
1.2.2 大豆分离蛋白肽的制备
蛋白质含量5%,酶添加量2%,用碱性蛋白酶Alcalase进行酶解(pH 9.0、60℃),通过沸水浴10 min灭酶,离心后取上清液冻干,得到大豆分离蛋白肽。
1.2.3 水解度及蛋白质回收率的测定
通过pH-stat法[8]测定水解度。
通过凯氏定氮法测定大豆分离蛋白中的蛋白质含量A1及不同酶解时间得到的大豆分离蛋白肽中的蛋白质含量A2,并分别记录酶解所用的大豆分离蛋白的质量M1以及得到的大豆分离蛋白肽的质量M2。蛋白质回收率的计算公式如下:
1.2.4 酸法脱酰胺改性[9-10]
以0.3mol/L盐酸为溶剂,大豆分离蛋白肽含量为5%,65℃反应5h,反应过程中密封以防水分蒸发。
1.2.5 肽钙螯合物的制备
称量0.5g大豆分离蛋白肽,加入25mL20mmol/LTris-盐酸(pH7.8)缓冲液,按照大豆分离蛋白肽中每克蛋白质加入1.25mmol的钙的比例,加入0.25mol/L氯化钙溶液,混匀。在冷冻水浴恒温振荡器中40℃下反应1h。离心(4 000r/min,10min),按上清液和无水乙醇的体积比1∶6加入无水乙醇,静置,离心,沉淀即螯合物,于50℃烘干。根据GB/T5009.92—2003,通过干法消解以及原子吸收分光光度法测定肽的钙结合量。螯合物得率及钙螯合率按下式计算:
螯合物得率=螯合物质量/(加入的大豆分离蛋白肽质量×蛋白质含量+加入的钙质量)×100%

1.2.6 氨基酸组成测定
采用OPA FMOC柱前衍生,通过氨基酸自动分析仪进行测定。称取约0.1 g大豆分离蛋白肽或肽钙螯合物于水解管内,加入8 mL、6 mol/L HCl溶液,混匀后放于110℃的烘箱内消解22 h。取出冷却,将消解液转移到25 mL容量瓶中,用10 mol/L氢氧化钠溶液中和,并用水定容至刻度。采用双层滤纸过滤,取1 mL滤液离心(10 000 r/min,10 min),取上清液进行测定。
保留比指螯合物中相应的氨基酸含量与大豆分离蛋白肽原料中氨基酸含量的比值。
1.2.7 PBS脱钙方法
通过PBS(0.2 mol/L,pH 8.0)对肽钙螯合物进行脱钙,脱钙率约达99%,N保留率可达100%。
1.2.8 相对分子质量分布测定
采用凝胶渗透色谱法(GPC)分别测定了大豆分离蛋白肽及肽钙螯合物经PBS脱钙后得到的螯合肽的相对分子质量分布。
色谱条件:TSK-gel 2000 SWXL凝胶柱(7.8 mm×300 mm)经流动相A(纯水)及流动相B(乙腈、水、三氟乙酸的体积比为45∶55∶0.1)平衡,样品质量浓度5 mg/mL,检测波长214 nm,柱温30℃,流速0.5 mL/min。
1.2.9 傅里叶红外光谱分析[11]
将含约1%样品的KBr粉末于玛瑙研钵中磨细,压片,采用傅里叶红外光谱仪对薄片扫描,波数范围4 000~400 cm-1,扫描次数32次,分辨率4 cm-1。分别测定PBS脱钙后得到的螯合肽以及肽钙螯合物的红外光谱。
1.2.10 体外消化吸收模拟实验
参考Miller等[12]的方法并稍加调整。将0.5 g样品溶于10 mL水中,调节温度37℃,用1 mol/L盐酸调节pH 2.0,胃蛋白酶加入量为2%,消化到一定时间,用1 mol/L氢氧化钠调节溶液pH 7.5,加入4%胰蛋白酶进行消化;通过8 000 Da透析袋模拟小肠的吸收作用。钙保留率及钙生物利用率按下式计算:

2 结果与讨论
2.1 大豆分离蛋白水解度及蛋白质回收率
分批制备了酶解时间分别控制在20、45、90、150、240、360 min的肽原料,并测定了其水解度及蛋白质回收率,结果见表1。

表1 不同酶解时间下大豆分离蛋白水解度及蛋白质回收率
由表1可知,随着酶解时间的延长,水解度增大,可溶性蛋白质含量增加,所以蛋白质回收率也随之增加。
2.2 大豆分离蛋白最适酶解时间的选择
图1A、B为不同酶解时间的钙结合量及螯合物得率。图1C为不同酶解时间的钙螯合率,反映金属离子的利用程度。
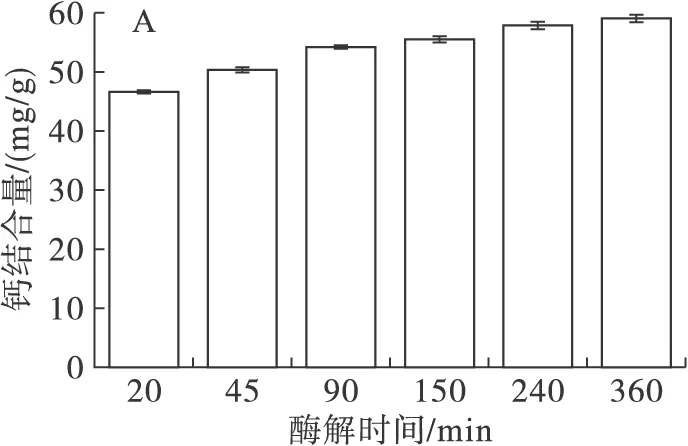


图1 不同酶解时间的钙结合量(A)、螯合物得率(B)及钙螯合率(C)
由图1A可知,钙结合量随着酶解时间的延长而增加,即随着水解度的增大而增加。由图1B可知,螯合物得率随着酶解时间的延长整体呈下降趋势。由图1C可知,酶解20、240、360 min有相对较高的钙螯合率。由于酶解20 min蛋白质回收率仅71.23%,且钙结合量最低;而酶解240 min以及360 min钙结合量较高,兼顾时间效益,选取240 min为最佳酶解时间。
2.3 酸法脱酰胺改性对肽钙螯合能力的影响
酸法脱酰胺是一种简单有效的脱酰胺方法,通过提供H+打断—NH2键,释放氨气,将Asn、Gln转化为Asp、Glu。以上述获得的酶解240 min的肽为原料,研究了酸法脱酰胺对其螯合物得率和钙结合量的影响,结果见表2。

表2 脱酰胺改性对螯合能力的影响
通过微量弥撒皿法[13]测得脱酰胺率为64.33%。由表2可知,酶解240 min的肽脱酰胺后钙结合量增加了30%,螯合物得率增加约22%,说明酸性氨基酸是影响螯合钙含量的重要因素。包小兰等[14]研究发现脱酰胺改性可以提高由Protease M制备大豆蛋白酶解物的可溶性钙的结合量,并通过增加羧基基团提高肽的钙结合量。所以选取酶解240 min脱酰胺肽为后续实验的原料并对其制备的螯合物进行表征。
2.4 大豆分离蛋白肽及肽钙螯合物的氨基酸组成
有研究[15]表明,大豆蛋白肽的钙结合量与螯合物中的酸性氨基酸含量呈正相关,相关系数达0.820 4,但其只测定了螯合物的氨基酸组成,有的研究[8]只对肽的氨基酸组成进行测定。本实验对螯合前后的肽段氨基酸组成进行对比,结果见表3。

表3 大豆分离蛋白肽及肽钙螯合物的氨基酸组成 %
由表3可知,肽钙螯合物中Asp、Glu共占54.17%,比原料肽增加了56%,说明酸性氨基酸对螯合钙的重要作用;此外,His、Gly、Arg、Cys、Lys、Pro残基也是参与肽钙螯合物形成的重要氨基酸残基,其中Gly、Arg、Lys、Pro在肽钙螯合物中占有较大比例以及螯合后的保留比较高,His、Cys虽然占比较少,但保留比却很高,尤其Cys的保留比最高。说明富含上述氨基酸的肽段更易于螯合,一方面可能是由于侧链基团R可以提供更多的配位原子,另一方面也可能是对肽段结构的影响,使得配体暴露,促进螯合。
2.5 大豆分离蛋白肽及螯合肽的相对分子质量分布(见表4)

表4 大豆分离蛋白肽及螯合肽的相对分子质量分布 %
由表4可知,螯合肽中,Mr大于等于1 000的肽段所占的比例增加了3倍左右,Mr小于等于500的肽段所占的比例减少了约一半,Mr 500~1 000的比例可认为没有变化。说明Mr大于等于1 000的肽段较Mr小于等于500的肽段更易参与螯合物的形成,结合酶解时间对肽钙结合量的影响结果,可推测Mr小于等于500的肽是制备高钙含量螯合物主要肽组分。Huang等[16]通过超滤的方法对虾蛋白酶解物进行分离,发现最低相对分子质量的肽组分(Mr≤500)显示了最高的钙结合能力。Liu等[8]将通过Alcalase 酶解获得的小麦胚芽蛋白肽通过超滤分离后,发现Mr在3 000~5 000范围的肽组分有最佳的钙结合量,这些差异主要由于蛋白质的来源不同。
2.6 螯合肽及肽钙螯合物的红外光谱(见图2)

图2 螯合肽及肽钙螯合物的红外光谱图
2.7 体外消化吸收模拟实验
相对于体内消化评价及临床评价,体外消化法方便、耗资少。肽钙螯合物在胃胰酶消化后的相对分子质量变化见图3,胃胰酶消化不同时间点的钙保留率见表5。
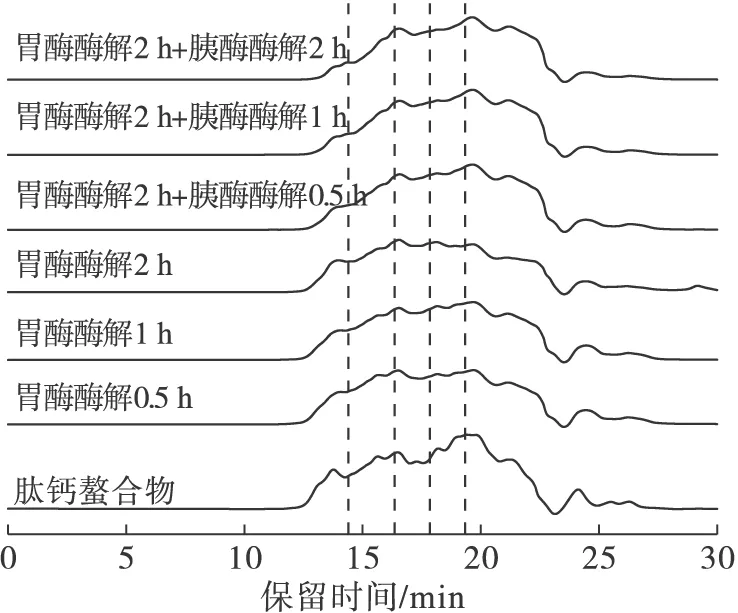
图3 肽钙螯合物在胃胰酶消化后的相对分子质量变化
由图3可知,在胃胰酶消化的不同时段,肽钙螯合物中肽段的相对分子质量变化甚微。由表5可知,钙保留率也稳定在87%左右;通过模拟小肠处的吸收测得钙的生物利用率可达81.81%,说明了肽钙螯合物有较好的耐胃胰酶稳定性及吸收特性,主要原因可能是肽钙螯合物中的肽段本身经过碱性蛋白酶酶解后,相对分子质量小,胃胰酶的酶切位点少。

表5 胃胰酶消化不同时间点的钙保留率
3 结 论
研究了酶解时间和酸法脱酰胺改性对脱植酸大豆分离蛋白肽钙离子螯合能力的影响,并对螯合物的结构特性及营养特性进行表征。脱酰胺改性提高了肽的钙结合量和螯合物得率。水解度、肽段的氨基酸组成以及相对分子质量都会对螯合作用产生影响。酸性氨基酸及相对分子质量小于等于500的小分子肽对制备高钙含量的肽钙螯合物有重要作用。肽钙螯合物有较好的消化吸收特性,且N、O原子是参与肽钙螯合物形成的主要配位原子。
[1] MILLER G D, JARVIS J K, MCBEAN L D. The importance of meeting calcium needs with foods[J]. J Am Coll Nutr, 2001, 20(2): 168S-185S.
[2] 杨燊, 邓尚贵, 秦小明. 低值鱼蛋白多肽-钙螯合物的制备和抗氧化、抗菌活性研究[J]. 食品科学, 2008, 29(1): 201-206.
[3] 付文雯, 马美湖, 蔡朝霞. 牛骨蛋白酶解制取肽钙的研究进展[J]. 食品与发酵科技, 2009, 45(1): 1-5.
[4] HARA H, FUNABIKI R, IWATA M, et al. Protal absorption of small peptides in rats under undrestraied conditions[J]. J Nutrigenet Nutrige, 1984, 114: 1122-1129.
[5] 刘丽. 大豆分离蛋白冰淇淋的研制及其功能特性的研究[D]. 哈尔滨: 东北农业大学, 2013.
[6] 刘海军, 乐银超, 邵伟,等. 生物活性肽研究进展[J]. 中国酿造, 2010, 29(5): 5-8.
[7] WANG H J, CHEN Y M, HUA Y F, et al. Effect of phytase-assisted processing method on physicochemical and functional properties of soy protein isolate[J]. J Agric Food Chem, 2014, 62(45): 10989-10997.
[8] LIU F R, WANG L, WANG R, et al. Calcium-binding capacity of wheat germ protein hydrolysate and characterization of peptide-calcium complex[J]. J Agric Food Chem, 2013, 61(31): 7537-7544.
[9] 孔祥珍, 周慧明. 小麦面筋蛋白去酰胺改性的研究[J]. 食品科学, 2003, 24(12): 47-49.
[10] 郑建冰, 王立, 易翠平, 等. 大米蛋白酸法脱酰胺改性及对蛋白性质的影响[J]. 食品工业科技, 2007(2): 102-108.
[11] ZHAO L N, HUANG Q M, HUANG S L, et al. Novel peptide with a special calcium-binding capacity from whey protein hydrolysate and the possible chelating mode[J]. J Agric Food Chem, 2014, 62(42): 10274-10282.
[12] MILLER D D,SCHRICKERB R,RASMUSSEN R R,et al. An in vitro method for estimation of iron availability from meals[J]. Am J Clin Nutr,1981,34(10): 2248-2256.
[13] KATO A, TANAKA A, MATSUSOMI N, et al. Deamidation of food proteins by protease in alkaline pH[J]. J Agric Food Chem, 1987, 35(2): 224-227.
[14] 包小兰, 郭顺堂, 焉华娟, 等. 脱酰胺化对大豆蛋白水解物可溶性钙结合量的影响[J]. 农产品加工(学刊), 2006(8): 63-66.
[15] BAO X L, LÜ Y, YANG B C, et al. A study of the soluble complexes formed during calcium binding by soybean protein hydrolysates[J]. J Food Sci, 2008, 73(3): C117-C121.
[16] HUANG G R, REN L, JIANG J X. Purification of a histidine-containing peptide with calcium binding activity from shrimp processing byproducts hydrolysate[J]. Eur Food Res Technol, 2011, 232(2): 281-287.
Preparationandcharacterizationofsoybeanproteinisolatepeptide-calciumchelate
WANG Xiaolin,KONG Xiangzhen,HUA Yufei,ZHANG Caimeng,CHEN Yeming
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China)
The effects of enzymolysis time and acidic deamidation modification on the calcium-binding capacity of phytate degraded soybean protein isolate peptide were studied, and the structural and nutritional properties of peptide-calcium chelate were characterized. The results showed that when enzymolysis time was 240 min, the amount of bound calcium was higher (57.85 mg/g) and the chelate yield was 28.43%. After acidic deamidation, the amount of bound calcium and chelate yield increased to 75.37 mg/g and 34.55% respectively. Amino acid analysis demonstrated that acidic amino acid made the most contribution to chelation. The results ofMr distribution experiment indicated that peptide withMr≥1 000 showed a better chelation effect with a higher chelate yield, while peptides withMr≤500 were the main peptides when making chelation with high amount of bound calcium. Fourier transform infrared spectra expressed that oxygen atom on the carboxyl group and nitrogen atom on the amino group were primary coordination atoms, while peptide structure changed a lot. In vitro digestion and absorption simulation experiment indicated that peptide-calcium chelate had a better tolerance to pepsin and pancreatin, and theMr of the peptide almost had no change after digestion, with calcium retention rate about 87% and bioavailability up to 81.81%.
peptide-calcium chelate; enzymolysis; acidic deamidation; characterization
2016-11-24;
:2017-03-27
国家自然科学基金(31201380)
王小林(1990),女,硕士,研究方向为油脂与植物蛋白(E-mail)390084217@qq.com。
孔祥珍,副教授,博士(E-mail)xzkong@jiangnan.edu.cn。
TS201.2;TS202.3
:A
:1003-7969(2017)07-0050-05
