多西他赛用于三阴性乳腺癌的药代动力学及药效学研究
2017-09-15毛英杰
毛英杰,,
(1.包头医学院,内蒙古 包头 014010;2.包头市肿瘤医院,内蒙古 包头 014030)
多西他赛用于三阴性乳腺癌的药代动力学及药效学研究
毛英杰1,王亚兰2,张萱2
(1.包头医学院,内蒙古 包头 014010;2.包头市肿瘤医院,内蒙古 包头 014030)
目的探讨三阴性乳腺癌患者应用多西赛他赛的药代动力学参数与疗效、不良反应的相关性。方法对接受多西他赛(75 mg·m-2)联合希罗达(1 250 mg·m-2)方案治疗的20例Ⅳ期三阴性乳腺癌患者进行多西他赛有限样本血药浓度检测,计算出血药浓度曲线下面积(AUC)和清除率(CL),并分析两者与疗效和不良反应的相关性。结果白细胞减少组、肝功能损伤组、疾病控制组的AUC分别高于无白细胞减少组、无肝功能损伤组、疾病进展组;白细胞减少组、肝功能损伤组、疾病控制组的CL分别低于无白细胞减少组、无肝功能损伤组和疾病进展组。但仅有无白细胞减少组AUC比较差异有统计学意义(P<0.05)。结论多西他赛用药过程中进行血药浓度监测,可以达到个体化用药的目的,有利于提高疗效,减轻不良反应。
多西他赛;三阴性乳腺癌;曲线下面积;清除率;疗效;不良反应
乳腺癌是女性最常见的恶性肿瘤之一。在欧美国家,乳腺癌占女性恶性肿瘤的25%~30%,我国虽然属于乳腺癌的低发国家,但近10余年来,发病率也逐年上升,同时我国乳腺癌发病年龄相对年轻,中位发病年龄为45~50岁。随着乳腺癌的普查及人们健康意识的提高,我国乳腺癌早发现、早诊断率得到了明显的提高。但是后期很多患者仍旧出现复发转移。多西他赛是晚期复发转移性乳腺癌最常用的化疗药物之一,由于其有效治疗浓度范围狭窄,个体差异较大,因此,通过观察多西他赛用于晚期乳腺癌患者的药理学参数血药浓度曲线下面积(area under the curve,AUC)和清除率(clearance,CL)与疗效和不良反应的相关性,为多西他赛临床个体化用药提供理论依据。本研究欲通过多西他赛(75 mg·m-2)+希罗达(1250 mg·m-2)方案治疗Ⅳ期三阴性乳腺癌患者的研究,探讨多西他赛在三阴性乳腺癌患者体内的药物代谢动力学特征,并探讨血液学毒性、肝脏毒性和治疗效果与AUC和CL之间的相关性,为临床个体化治疗提供理论依据。
1 资料与方法
1.1一般资料入组20例女性Ⅳ期三阴性乳腺癌患者进行多西他赛血药浓度检测,年龄40~60岁,ECOG评分≤1分。所有患者三阴性乳腺癌的诊断均经过组织学检查证实为浸润性导管癌,分子分型均为三阴性乳腺癌,术后辅助化疗均未应用多西他赛,并且后期出现复发转移,分期为Ⅳ期(内脏转移),以最大程度排除内分泌、曲妥珠单抗、多西他赛耐药等因素对研究结果准确性的影响;多西他赛采用3周给药方案;其他合格标准包括预期寿命≥3个月,骨髓功能储备良好(血常规各指标正常),肝、肾功能各主要指标均在正常范围内。所有入组此研究的患者均书面签署知情同意书。
1.2方法多西他赛溶于250 mL质量分数0.9% NaCl溶液中,所有输液均在1 h左右结束,输注多西他赛前常规应用地塞米松抗过敏减少化疗不良反应,输注期间心电监测血压和脉博。每例患者进行4~6周期的化疗并留取血样,分别于多西他赛输注结束前5 min、结束后45 min采集静脉血2 mL置于肝素管内,混匀,在3000 r·min-1的低温冷冻离心机中离心10 min,采取上清液,2~8 ℃储存,12 h内分析结果。采用由美国Saladax公司开发的体外免疫诊断试剂盒,对血浆样本进行多西他赛浓度的检测而得出血药浓度结果。我们主要研究的药物动力学参数包括:AUC、CL。AUC和CL可以通过贝叶斯分析使用NONMEM®很好的估计[1]。
将20例患者根据有无白细胞减少分为白细胞减少组(白细胞<4×109·L-1)、无白细胞减少组(白细胞≥4×109·L-1);按有无肝功能损伤分为肝功能损伤组、无肝功能损伤组;根据RECIST疗效评价标准将结果分为疾病控制组(包括CR+PR+SD)、疾病进展组(PD),比较2组主要药代动力学参数的差异。将使多西他赛联合化疗后的白细胞减少的百分率作为衡量患者血液学毒性的指标。肝功能损伤程度以各种肝功能指标[以谷丙转氨酶(ALT)和总胆红素(TBIL)为主]中升高倍数最高者表示。并记录治疗效果和不良反应。

2 结果
2.120例患者的药代动力学参数20例患者主要研究的药代动力学参数AUC和CL差异都较大:AUC 1.36~5.28(2.73±0.99)mg·L-2·h-1,变异系数为36.24%;CL16.05~34.40(26.72±5.15)L·h-1,变异系数19.28%。
2.2药代动力学参数与白细胞减少的关系白细胞减少是多西他赛最常见的不良反应。所有试验的20例患者用药后都出现了不同程度白细胞减少,但是只有8例发生粒细胞减少症,粒细胞集落刺激因子对症治疗后均恢复正常。对2组患者的主要药代动力学参数统计学分析结果显示:白细胞减少组AUC高于无白细胞减少组,白细胞减少组CL低于无白细胞减少组。但仅有无白细胞减少组AUC比较差异有统计学意义(P<0.05)。见表1。

表1 药代动力学参数与白细胞减少的关系
2.3药代动力学参数与肝功能损伤的关系有5例患者用药后出现ALT和TBIL升高,即肝功能损伤。对2组患者的主要药代动力学参数统计学分析结果显示:肝功能损伤组的AUC高于无肝功能损伤组,肝功能损伤组CL低于无肝功能损伤组,但差异均无统计学意义(P>0.05)。见表2。
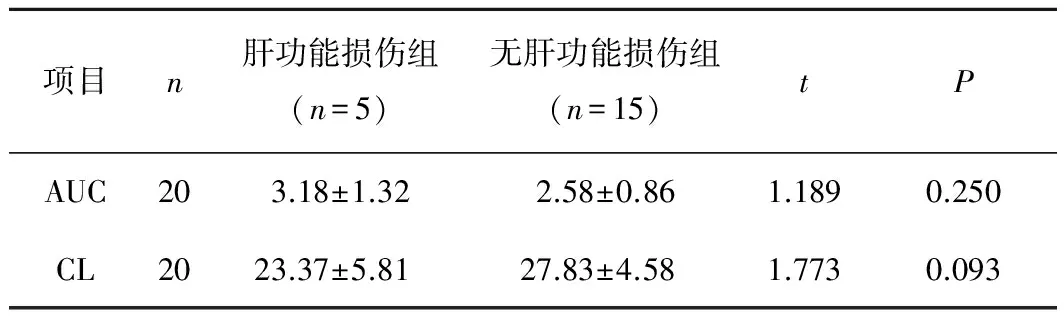
表2 药代动力学参数与肝功能损伤的关系
2.3药代动力学参数与疗效的关系对20例患者进行药代动力学-药效学研究,按RECIST疗效评价标准,CR 0例,PR 8例,SD 8例,PD 4例,疾病控制率为80%。对2组患者的主要药代动力学参数统计学分析结果显示:疾病控制组的AUC高于疾病进展组,疾病控制组的CL低于疾病进展组,但差异均无统计学意义(P>0.05)。见表3。
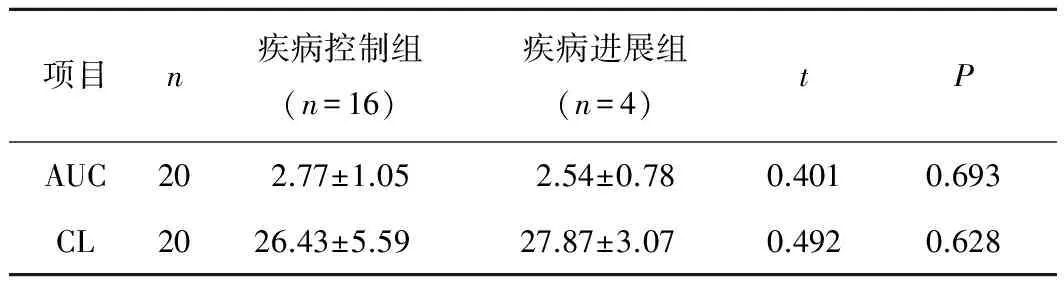
表3 药代动力学参数与疗效的关系
2.4多西他赛的其他不良反应20例患者中,除上述常见的不良反应外,其他不良反应有脱发(45%)、腹泻(33%)、腹胀(30%)、手足综合征(25%)、四肢肌肉酸胀(15%)、黏膜炎(24%),大多为Ⅰ、Ⅱ度,经对症处理后症状可缓解。所有入组患者均未出现过敏反应。
3 讨论
血液毒性是多西他赛主要的剂量限制性毒性。国外已有大量证据证实了多西他赛AUC与其血液毒性的相关性[2-3]。Bruno等[4]对640例接受多西他赛静脉滴注的患者(剂量 75 mg·m-2或 100 mg·m-2,1 h滴注)的药代数据统计分析,发现了多西他赛的AUC与其骨髓抑制(IV度中性粒细胞减少以及发热中性粒细胞减少)具备统计相关性。Goh等[5]更早的研究也证明了在亚裔患者中多西他赛的AUC与中性粒细胞绝对数量减少的显著具备统计相关性。而且在不良反应(尤其是严重血液学毒性)和疗效方面具有潜在的和不可预测的个体差异。依据体表面积而制定的给药剂量由于患者个体差异致使其药代动力学表征AUC差距最高可达到7倍,总体CL差距最高可达到10倍。此外,与非亚洲临床研究相比较,多西他赛导致Ⅲ、Ⅳ度中性粒细胞减少更加频繁在亚洲临床研究中观察到[6]。通过药物浓度检测已成功减少了多西他赛暴露的个体变异[7]。然而,多西他赛不同种族敏感性不同的真正的原因尚未阐明[8]。现在已有很多临床数据证明患者药理上个体间以及自身差异是引起化疗药物不良反应过高甚至治疗失败的主要原因[9]。这种在不良反应和疗效方面的个体差异可能部分与药代动力学参数有关;特别是主要药代动力学参数AUC和CL[1]。药代动力学参数的变化可能导致部分患者的治疗不足而错过最佳治疗时期或由于过度治疗导致不可接受的严重不良反应。近年来,随着肿瘤发病率的不断增高,如何在保证抗肿瘤药物疗效的同时将不良反应降至最低成为人们的研究热点。
国外对多西他赛药代动力学的研究为我们安全、合理地利用该药物提供了一定的理论基础。为了验证多西他赛的药代动力学,传统上采用密集的采样策略,要求药代动力学参数最准确的估计(例如AUC和CL)。然而,这也意味着给患者带来了沉重的负担和不便。Baille等[10]研究发现,当至少采取2个样品时,AUC和CL可以被很好的评估。因此,患者的负担得到了极大的减少,也使得我们的研究能够很好实施。但是亚洲临床研究也与非亚洲研究表现出了差异;这些差异可能由于某些未知遗传因素、多西他赛的代谢差异、不同基线数量的白细胞导致。而且这些研究较多的集中在国外,国内相关研究还比较缺乏,药物在体内的代谢过程会因种族差异、药物相互作用、不同病种及遗传因素等许多因素的差异而有所不同。因此,对多西他赛在中国人群中的药代动力学和药效学进行进一步研究,具有十分重要的意义。我们的研究也确实证实了AUC、CL与疗效和不良反应的相关性。
本文结果显示,患者AUC和CL差异都较大,AUC变异系数可达36.24%,CL变异系数为19.28%;白细胞减少组、肝功能损伤组和疾病控制组AUC分别高于无白细胞减少组、无肝功能损伤组和疾病进展组;并且白细胞减少组、肝功能损伤组、疾病控制组的CL分别低于无白细胞减少组、无肝功能损伤组和疾病进展组。但只有AUC与白细胞减少有统计学相关性,这可能是由样本数量有限造成的;另一方面,化疗药物的联合应用,辅助药物的应用,在某种程度上干扰了化疗药物对白细胞的作用,影响实验数据的准确性。通过此研究,我们仍得出了与国外研究一致的结论。我们可以将多西他赛AUC和CL作为观察治疗疗效和不良反应的指标。
由于医学伦理学的限制,我们的研究是在不干扰患者正常临床治疗并且在患者知情同意的前提下进行的,所以导致样本量有限,并且,治疗过程中其他药物的干扰难以排除,结果不尽人意。因此,需要我们进一步扩大样本、进行多中心研究,开展多西他赛群体药代动力学和药效学的研究,以获得更加真实可靠的数据,从而更加合理指导临床用药。
[1] ENGELS FK,LOOS WJ,VAN DER BOL JM,et al.Therapeutic drug monitoring for the individualization of docetaxel dosing: a randomized pharmacokinetic study[J].Clin Cancer Res,2011,17(2):353-362.
[2] BRUNO R,HILLE D,RIVA A,et al.Population pharmacokinetics/pharmacodynamics of docetaxel in phase Ⅱ studies in patients with cancer[J].J Clin Oncol,1998,16(1):187-196.
[3] ROSING H,LUSTIG V,VAN WARMERDAM LJ,et al.Pharmacokinetics and metabolism of docetaxel administered as a 1-h intravenous infusion[J].Cancer Chemother Pharmacol,2000,45(3):213-218.
[4] BRUNO R,VIVIER N,VEYRAT-FOLLET C,et al.Population pharmacokinetics and pharmacokinetic-pharmacodynamic relationships for docetaxel[J].Invest New Drugs,2001,19(2):163-169.
[5] GOH BC,LEE SC,WANG LZ,et al.Explaining interindividual variability of docetaxel pharmacokinetics and pharmacodynamics in Asians through phenotyping and genotyping strategies[J].J Clin Oncol,2002,20(17):3683-3690.
[6] YANO R,KONNO A,WATANABE K,et al.Pharmacoethnicity of docetaxel-induced severe neutropenia: integrated analysis of published phase Ⅱ and Ⅲ trials[J].Int J Clin Oncol,2013,18(1):96-104.
[7] CLINE DJ,ZHANG H,LUNDELL GD,et al.Development and evaluation of a nanoparticle-based immunoassay for determining paclitaxel concentrations on routine clinical analyzers[J].Ther Drug Monit,2013,35(6):809-815.
[8] KENMOTSU H,TANIGAWARA Y.Pharmacokinetics,dynamics and toxicity of docetaxel: Why the Japanese dose differs from the Western dose[J].Cancer Sci,2015,106(5):497-504.
[9] GAMBACORTI-PASSERINI C,ZUCCHETTI M,RUSSO D,et al.Alpha1 acid glycoprotein binds to imatinib(STI571) and substantially alters its pharmacokinetics in chronic myeloid leukemia patients[J].Clin Cancer Res,2003,9(2):625-632.
[10]BAILLE P,BRUNO R,SCHELLENS JH,et al.Optimal sampling strategies for bayesian estimation of docetaxel(Taxotere) clearance[J].Clin Cancer Res,1997,3(9):1535-1538.
PharmacokineticsandPharmacodynamicsofDocetaxelinthePatientswithBreastCancer
MAO Yingjie1,WANG Yalan2,ZHANG Xuan2
(1.BaotouMedicalCollege,Baotou014010,China; 2.BaotouCityTumorHospital,Baotou014030,China)
ObjectiveTo evaluate the correlation between pharmacokinetic parameters and efficacy or toxicities of docetaxel in the patients with breast cancer.MethodsTwenty patients with stage Ⅳ triple negative breast cancer were treated with docetaxel+ xeloda in order to detect blood drug concentration,and the area under the curve of blood concentration of docetaxel(AUC) and clearance(CL),and the correlation with efficacy and toxicities were compared.A limited sampling strategy w as used in this study.ResultsAUC in the leucopenia group,the liver damage group and the disease control group was higher than those in the no leukopenia group,the liver damage group and the no disease control group.CL in the leukopenia group,liver damage group and the disease control group was lower than those in the no leukopenia group,the liver damage group and the no disease control group.There was statistical difference in the AUC between the leucopenia group and the no leucopenia group(P<0.05).ConclusionIn order to improve the curative effect,reduce drugs,it is necessary for to conduct blood drug concentration monitoring in clinical work,achieving the purpose of individualized medication.
docetaxel; breast cancer; area under the curve; clearance; effect; toxicities
毛英杰(1988-),男,硕士,主要从事肿瘤的个体化治疗工作。E-mail: 562695027@qq.com
王亚兰(1966-),女,教授,主任医师,硕士生导师,主要从事乳腺肿瘤、恶性淋巴瘤的规范化治疗工作。 E-mail:wylnmgbt2@163.com
10.3969/j.issn.1673-5412.2017.04.015
R737.9;R730.53
A
1673-5412(2017)04-0319-04
2016-07-23)
