基于Luminol的发光体系检测元胡中延胡索乙素
2017-09-12蔡艳妮朱海萍杨培君
蔡艳妮, 朱海萍, 苏 莹, 杨培君
(1.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000;2.陕西理工大学 陕西省资源生物重点实验室, 陕西 汉中 723000; 3.山东省东明县第一中学, 山东 东明 274500)
基于Luminol的发光体系检测元胡中延胡索乙素
蔡艳妮1,2, 朱海萍3, 苏 莹1,2, 杨培君1,2
(1.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000;2.陕西理工大学 陕西省资源生物重点实验室, 陕西 汉中 723000; 3.山东省东明县第一中学, 山东 东明 274500)
Luminol-KMnO4-OH-、Luminol-NaIO4和KMnO4-Luminol-H+发光体系在碱性或酸性条件下能产生化学发光,加入延胡索乙素后可抑制体系的发光强度,据此建立了流动注射-化学发光检测元胡中延胡索乙素的分析方法,同时开展了方法验证和干扰试验,并对3种体系分别进行了流路及条件优化。在优化条件下,Luminol-KMnO4-OH-、Luminol-NaIO4和KMnO4-Luminol-H+体系的相对发光强度分别与延胡索乙素浓度在一定范围内呈良好线性关系。试验结果表明,方法的检出限分别为0.029 66 μg/mL、0.008 69 μg/mL、0.041 38 μg/mL,平均回收率≥97.66%;检测样品中延胡索乙素平均得率分别为0.0618%、0.0612%、0.0611%。所构建的3种化学发光体系的线性检测范围宽、检出限低、精密度好,研究结果可用于中药材元胡的品质分析与质量检测。
延胡索; 延胡索乙素; Luminol; 化学发光; 分析检测
中药材延胡索,又名元胡,为罂粟科紫蓳属植物延胡索(CorydalisyanhusuoW. T. Wang)的干燥块茎[1],主产于浙江东阳、磐安、缙云,江苏海门、南通,陕西汉中,重庆、安徽部分地区也有种植。当前,汉中已成为全国三大元胡产区之首。延胡索含多种生物碱,为主要药效物质基础;延胡索乙素的镇痛作用最强,延胡索甲素、丑素次之[2]。据报道[2-4],延胡索乙素具有麻醉镇痛、降压、抗心律失常、抗炎及抗肿瘤等作用,是中医临床常用药物之一。目前,延胡索生物碱的测定方法主要有高效液相色谱法(High Performance Liquid Chromatography,HPLC)[5-7]和紫外分光光度法(UV法)[8],此外还有薄层扫描法[9-10]和毛细管电泳法[11]等。流动注射-化学发光(CL-FIA)近年来已应用于药品成分检测[12-14]、植物活性成分分析[15-16]等,化学发光分析检测延胡索生物碱的研究也有报道[17-18]。
本试验研究基于鲁米诺(Luminol)构建了3种化学发光体系,对延胡索乙素开展分析检测,以期建立中药材元胡中延胡索乙素的流动注射-化学发光检测方法。
1 试验材料与方法
1.1 试验材料
供试材料于2014年5—6月采自陕西省城固县南乐元胡种植基地,选统货块茎,清洗,切片,60 ℃干燥,粉碎,过筛(孔径0.45 mm),备用。
1.2 试剂与仪器
延胡索乙素标准品,YA0809YA13,纯度≥98%,上海源叶生物科技有限公司;Luminol,生物试剂,上海金穗生物科技有限公司;乙腈、甲醇为色谱纯;NaOH、KMnO4、NaIO4、Na2CO3、NaHCO3、H2SO4、H3PO4、HNO3以及乙醚、乙醇、乙酸、氯仿等试剂均为分析纯,水为超纯水。
IFFM-E型流动注射化学发光分析仪和IFFM-A型多功能化学发光检测器,西安瑞迈分析仪器有限公司;KQ-300DE超声波清洗器,昆山市超声仪器有限公司;RV10旋转蒸发仪,德国IKA公司;MS105DU电子天平,d=0.01 mg,梅特勒-托利多仪器(上海)有限公司;UPH-Ⅱ-40超纯水机,成都超纯科技有限公司。
1.3 试验方法
1.3.1 主要试剂溶液
延胡索乙素标准溶液:准确称取延胡索乙素标准品1.78 mg,甲醇溶解,纯水定容至50 mL容量瓶,得到质量浓度为0.0356 mg/mL的标准溶液,置冰箱4 ℃保存,备用。
鲁米诺储备液(6.1×10-4mol/L):精确称取0.0108 g Luminol于100 mL容量瓶中,1.0 mol/L的Na2CO3溶解,定容后转移至棕色试剂瓶中,置冰箱4 ℃保存,7 d后备用。
其他储备液:KMnO4(1.0×10-2mol/L),NaIO4(1.0×10-2mol/L),Na2CO3(1.0 mol/L),NaOH(1.0 mol/L),NaHCO3(1.0 mol/L)储备液等现用现配。
1.3.2 供试样品液制备
称取元胡样品干燥粉末5.0 g,乙醚脱脂后加入体积分数为50%的乙醇50.0 mL,利用超声提取45 min(120 W,40 kHz),重复3次,过滤,蒸干滤液;用体积分数为5%的冰乙酸50.0 mL使其溶解,经氯仿-甲醇(V氯仿︰V甲醇=40︰1,pH=9)萃取,滤过萃取液,蒸干;用20.0mL甲醇溶解,调样品溶液pH=9~10;D-101型大孔树脂分离样品溶液,体积分数为70%的乙醇洗脱(流速1.0mL/min,流脱液用量100.0mL),浓缩,于25mL容量瓶中甲醇定容,备用。
1.3.3 延胡索乙素CL-FIA分析检测设计
准确移取延胡索乙素标准品溶液5.0mL,于50mL容量瓶纯水定容,然后再按一定梯度取量稀释。3种体系标准曲线的延胡索乙素标品梯度溶液浓度见表1。

表1 延胡索乙素标准品梯度溶液浓度
参考方肇伦[19]FIA流程图,开启蠕动泵,仪器预热约30 min,经试验考察,选择相对应溶液泵入流通池中,待基线稳定后进标样。流动注射化学发光分析仪检测产生的化学发光信号,Remex软件处理,电脑记录数据。以空白体系的发光强度与加入延胡索乙素标准溶液后的发光强度差值ΔI为纵坐标,延胡索乙素标准溶液浓度为横坐标,建立标准曲线。
取1.0 mL供试样品溶液,于100 mL容量瓶中纯水定容;取其稀释液2.5 mL,置250 mL容量瓶纯水定容;取最终稀释后的供试样品溶液按上述条件进行检测,计算样品溶液中延胡索乙素得率。
1.3.4 方法学考察
检出限试验:依据国际纯粹与应用化学联合会(IUPAC)的建议,在优化的条件下,对已知浓度的标准溶液连续进样11次,计算标准偏差σ,以3σ和标准曲线斜率的比值作为检出限。
精密度试验:在优化的条件下,平行检测已知浓度的延胡索乙素标准品溶液11次,计算RSD。
加样回收率试验:取一定量已知浓度的样品溶液,适量加入已知浓度延胡索乙素标准溶液,按1.3.3节设计检测其发光强度,计算加样回收率。
2 试验结果
2.1 化学发光动力学曲线及化学发光条件的优化
2.1.1 流路及仪器参数的选择
考察不同流路对化学发光强度的影响,3种体系所选择的主泵、副泵采样管的注入溶液有一定差异,调试直至体系的发光强度最大,且信号稳定。此外,泵流速、负高压对体系化学发光强度也有影响,试验确定适宜的主副泵流速分别为1.34~4.02 mL/min和2.01~5.36 mL/min;选择的负高压为500~800 V,增益为1。
2.1.2 化学发光动力学曲线
化学发光动力学曲线表明,试验所建的Luminol-KMnO4-OH-体系的化学发光强度大约在1.85 s时达到最大值,约7.15 s时衰减到极限(图1a,A);以延胡索乙素溶液替换超纯水,化学发光强度减弱(图1a,B)。Luminol-NaIO4体系的化学发光约1.8 s后达到最大值,约6.7 s时衰减到极限(图1b,A);该反应体系中加入延胡索乙素后,化学发光信号明显减弱(图1b,B)。KMnO4-Luminol-H+体系的化学发光强度大约在2.55 s时达到最大值,约6.0 s衰减到极限(图1c,A);用延胡索乙素溶液替换超纯水后,化学发光强度有减弱(图1c,B)。
2.1.3 试验条件的选择
(1)介质及其浓度的选择
分别以浓度1.0 mol/L的NaOH、Na2CO3、NaHCO3及HNO3、H3PO4、HCl、H2SO4溶液为反应介质,考察不同介质对Luminol-KMnO4-OH-体系、Luminol-NaIO4体系及KMnO4-Luminol-H+体系化学发光强度的影响,确定了3种体系的适宜介质分别为NaOH、NaOH及H2SO4溶液。为达到发光体系化学发光强度最大,不同体系对应的介质及浓度表现出的差异如图2所示。在0.01~2.0 mol/L范围内,随介质浓度的增大,3种发光体系化学发光强度均先增大,后减弱。筛选的用于3种体系的反应介质及其浓度见表2。
(2)Luminol浓度的选择
分别考察了Luminol浓度在1.0×10-6~6.0×10-6mol/L、1.0×10-6~1.0×10-4mol/L、2.0×10-5~1.0×10-4mol/L范围内对3种体系化学发光强度的影响,试验结果显示,随着Luminol浓度增大,体系的发光强度增强,当浓度达到一定值时发光强度不再增强且峰形较好,然而再增加Luminol浓度,各体系发光强度均减弱,如图3所示。3种体系选择的Luminol浓度见表2。
(3)氧化剂浓度的选择
氧化剂浓度选择在1.0×10-5~1.5×10-4mol/L、5.0×10-4~3.0×10-3mol/L、2.0×10-4~2.0×10-3mol/L范围内,分别考察体系组分KMnO4、NaIO4和KMnO4溶液浓度对发光强度的影响。图4所示的试验结果表明,随所选氧化剂浓度的增加,对应体系的发光强度先增强,后减弱(图4)。筛选的3种体系的氧化剂浓度见表2。

表2 3种体系的试验条件优化结果
2.2 标准曲线、精密度和检出限
2.2.1 标准曲线的建立
参照表1按1.3.3节的方法,配制延胡索乙素标准品梯度溶液,在优化的试验条件下测定,建立标准曲线。
结果显示,在Luminol-KMnO4-OH-体系中,延胡索乙素浓度在0.056 96~0.284 80 μg/mL范围内与发光强度线性关系良好(图5a),线性方程为ΔI=5381c+389.1(R2=0.9986);对Luminol-NaIO4体系而言,延胡索乙素浓度在0.011 392~0.034 176 μg/mL范围内与发光强度线性关系良好(图5b),线性方程ΔI=3335.7c+456.2(R2=0.9959);而在KMnO4-Luminol-H+体系中,延胡索乙素浓度在0.113 92~0.341 76 μg/mL范围内与发光强度呈线性关系(图5c),线性方程ΔI=161.52c-6.4(R2=0.9944)。

图1 化学发光动力学曲线 图2 不同介质及浓度对体系发光强度的影响
2.2.2 精密度和检出限试验
分别采用Luminol-KMnO4-OH-、Luminol-NaIO4和KMnO4-Luminol-H+体系,对应0.056 96 μg/mL、0.011 392 μg/mL和0.113 92 μg/mL的延胡索乙素标准品溶液平行检测11次,计算得RSD分别为2.19%、1.30%和1.39%。结果表明,仪器精密度良好。
根据IUPAC的建议计算,Luminol-KMnO4-OH-体系的检出限为0.029 66 μg/mL,Luminol-NaIO4体系检出限为0.008 69 μg/mL,而KMnO4-Luminol-H+体系的检出限为0.041 38 μg/mL。
2.3 干扰试验
为评价Luminol-KMnO4-OH-、Luminol-NaIO4和KMnO4-Luminol-H+体系的选择性,以发光强度相对误差的绝对值≤5%计,考察主要可存在组分[15-17],在优化的条件下,分别以0.170 88 μg/mL、0.011 39 μg/mL和0.113 92 μg/mL的延胡索乙素标准品溶液开展干扰试验。结果表明,其可存在因子均未超出允许量,说明所建立的3种发光检测体系的抗干扰性好。

图3 Luminol浓度对不同体系发光强度的影响 图4 氧化剂及浓度对体系发光强度的影响
2.4 样品分析
按照绘制标准曲线的方法检测样品,将测定值代入对应体系的线性回归方程中,计算供试样品的浓度及得率,以构建的3种体系检测延胡索乙素的分析结果见表3。

表3 样品中延胡索乙素CL-FIA分析结果(n=3)
因样品中延胡索乙素含量相对较低,属于痕量水平,故本试验对3种体系进行回收率试验时均采用加样回收方法。按1.3.4节的方法,在优化的条件下,采用所构建的3种检测体系测定供试溶液(n=9),并计算加样回收率,其结果见表4。
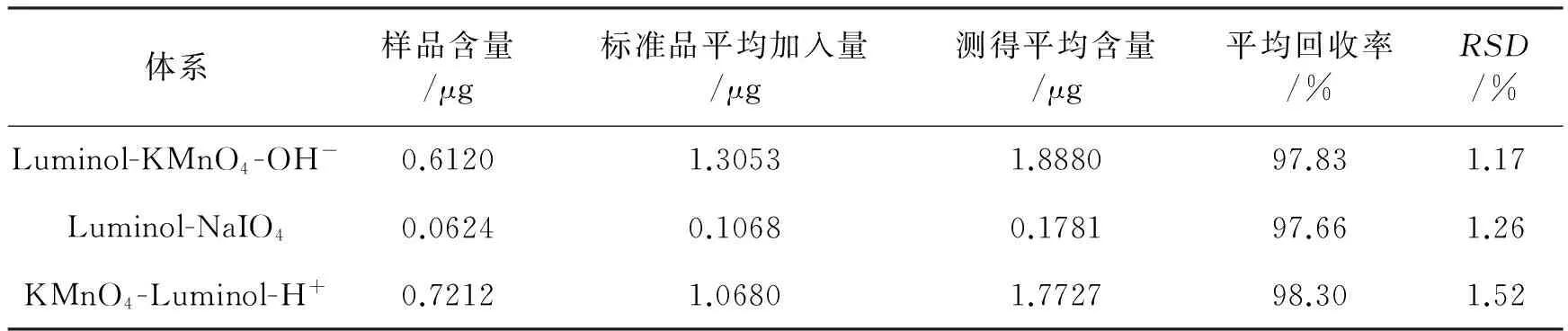
表4 回收率试验结果(n=9)
3 分析与讨论

图5 3种体系的延胡索乙素标准曲线
试验研究表明,Luminol-KMnO4-OH-、Luminol-NaIO4和KMnO4-Luminol-H+体系,在酸性或碱性条件下产生化学发光,延胡索乙素有抑制此发光强度的效应,从而建立了3种化学发光体系分析检测延胡索乙素的流动注射-化学发光方法;在优化的条件下,3种体系的相对发光强度与延胡索乙素浓度在一定范围内呈良好线性关系。结果显示,所构建的3种化学发光体系线性检测范围宽、检出限低、精密度好,可用于分析检测元胡中的延胡索乙素。
目前,HPLC是分析检测延胡索或制剂中延胡索乙素的主要方法。有报道,采用RP-HPLC建立了测定消痛灵中延胡索乙素含量的方法[20]。关于延胡索生物碱的化学发光分析检测研究也有报道,李丽清等[18]研究了高锰酸钾-硫代硫酸钠-延胡索乙素化学发光体系,建立了化学发光测定延胡索乙素含量的方法;朱海萍等[17]基于Rhodamine B化学发光剂,建立了Ce4+-Rhodamine B体系分析检测中药材延胡索生物碱的CL-FIA方法;同时开展CL-FIA与HPLC检测结果比对,结果显示CL-FIA的精确性略低于HPLC。目前,关于以Luminol构建的不同化学发光体系用于环境检测[21]、食品饮料检测[22],药物成分[12-23]、维生素[24-25]、生物样品[26]、生物碱[16]等分析检测也有报道,且Luminol-KMnO4体系大多数反应是在碱性介质中进行[23,25]。史红艳等[15]研究发现,黄酮类化合物对Luminol-H2O2-Cu2+体系的化学发光强度有抑制作用,建立了CL-FIA分析检测苏铁叶黄酮类化合物的方法,并指出CL-FIA的精确性略高于UV。马明阳[25]研究报道,在碱性条件,维生素B12对Luminol-KMnO4体系的化学发光强度有显著的抑制作用,基于此建立了化学发光测定维生素B12的方法,其线性范围为7.4×10-8~7.4×10-6mol/L,检测限为2.0×10-8mol/L,获得满意的结果。
本试验基于Luminol构建的3种化学发光体系,所测定元胡中延胡索乙素的含量与前人采用HPLC测定的结果[5-6]相近,且所构建的方法具有快捷、灵敏、成本低等优点,为中药材元胡的品质分析与质量监控提供了另一途径。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:139-140.
[2] 鲁春梅,张春森,姜立勇.延胡索化学成分及药理作用研究进展[J].中国现代药物应用,2011,5(15):126-127.
[3] LAI C K,CHAN A Y.Tetrahydropalmatine poisoning:diagnoses of nine adult overdoses based on toxicology screens by HPLC with diode-array detection and gas chromatography-mass spectrometry[J].Clinical Chemistry,1999,45(2):229-236.
[4] 李玉山.延胡索乙素的制备工艺及药理作用研究进展[J].解放军药学学报,2013,29(5):480-483.
[5] 张静,周浓,祁俊生,等.HPLC同时测定不同产地延胡索中的6种生物碱[J].华西药学杂志,2016,31(4):415-419.
[6] 周军辉,李思峰,王答祺,等.HPLC测定汉中产延胡索药材中延胡索乙素的含量[J].中成药,2006,28(11):1644-1645.
[7] 朱才庆,吴迪,李艳,等.高效液相色谱法测定复方元胡止痛胶囊中延胡索乙素的含量[J].时珍国医国药,2008,19(7):1727-1729.
[8] 王捷,刘宗河,焦爱军,等.紫外分光光度法测定复方金蒲片中延胡索乙素含量[J].广西医学,2004,26(12):1770-1772.
[9] 杜华霜,刘元瑞,裴艳萍,等.薄层扫描法测定尿路通片中延胡索乙素含量[J].中成药,2006,28(11):1711-1712.
[10] 刘新,林於,陈云,等.中成药中延胡索乙素薄层扫描法系统研究[J].中成药,2004,26(1):19-23.
[11] 邹薇,张鹤,孟宪生,等.毛细管电泳法测定延胡索中2种生物碱含量电泳条件优化研究[J].中国实验方剂学杂志,2012,18(2):59-62.
[12] 薛冰纯,王滔,刘二保.流动注射化学发光法在药物分析中的应用[J].光谱学与光谱分析,2006,26(5):816-820.
[13] SIERRA-RODERO M,M FERNNDEZ-ROMERO J,GMEZ-HENS A.Determination of aminoglycoside antibiotics using an on-chip microfluidic device with chemiluminescence detection[J].Microchim Acta,2012,179:185-192.
[14] 何云,翟倩,葛闯,等.流动注射化学发光法测定盐酸米诺环素[J].分析试验室,2014,33(12):1463-1465.
[15] 史红艳,朱海萍,屈亚娟,等.流动注射-化学发光法分析苏铁叶黄酮类化合物的研究[J].中药材,2015,38(3):481-484.
[16] 朱海萍.流动注射-化学发光法分析延胡索生物碱的应用研究[D].汉中:陕西理工大学,2016.
[17] 朱海萍,史红艳,王仕宝,等.流动注射-化学发光法分析延胡索总生物碱[J].中国现代中药,2016,18(2):143-147.
[18] 李丽清,周艳梅,封满良,等.高锰酸钾-硫代硫酸钠-延胡索乙素化学发光体系的研究[J].山东大学学报(自然科学版),2002,37(1):78-80.
[19] 方肇伦.流动注射分析方法[M].北京:科学出版社,1999:45-49.
[20] 汪军,姚闽.RP-HPLC法测定消痛灵中延胡索乙素含量的方法研究[J].实用中西医结合临床,2014,14(12):84-85.
[21] 张立科,卫世乾.流动注射-鲁米诺-铁氰化钾化学发光体系测定环境水体中痕量2,4-二氯苯酚[J].河南师范大学学报(自然科学版),2014,42(3):75-78.
[22] 周敏,燕廷,滕久委,等.流动注射溴化钾-鲁米诺-过氧化氢化学发光体系检测饮用水中铬(CrⅢ)[J].食品与发酵工业,2011,37(2):172-175.
[23] 白瑞霞,宋素异.鲁米诺-高锰酸钾化学发光法测定芦丁片中芦丁的含量[J].中国药房,2013,24(5):460-462.
[24] 李起云,李红.Luminol-Cu(Ⅱ)体系流动注射化学发光法测定维生素B2[J].光谱实验室,2011,28(4):1986-1988.
[25] 马明阳.鲁米诺-高碘酸钾化学发光体系测定维生素B12[J].南京医科大学学报(自然科学版),2014,34(8):1146-1148.
[26] 冯婷,胡玉雯,李攻科.鲁米诺-铁氰化钾化学发光体系快速分析生物样品中莱克多巴胺[J].光谱学与光谱分析,2012,32(1):74-77.
[责任编辑:魏 强]
Determination of tetrahydropalmatine inCorydalisyanhusuoby chemiluminescence systems based on Luminol
CAI Yan-ni1,2, ZHU Hai-ping3, SU Ying1,2, YANG Pei-jun1,2
(1.College of Bioscience and Engineering, Shaanxi University of Technology, Hanzhong 723000, China; 2.Shaanxi Province Key Laboratory of Bio-Resources, Shaanxi University of Technology, Hanzhong 723000, China; 3.Dongming No.1 Senior of School, Dongming 274500, China)
The three chemiluminescence(CL) systems, including Luminol-KMnO4-OH-, Luminol-NaIO4and KMnO4-Luminol-H+, can produce obvious CL reaction in the alkaline or acidic medium, while the tetrahydropalmatine can inhibit those CL signal of these systems. Based on that, a method was established for detecting the tetrahydropalmatine inCorydalisyanhusuoby chemiluminescence-flow injection analysis (CL-FIA), carried out the method validation and interference test, and 3 kinds of systems had conducted flow and parameter optimization. Under the optimized test conditions, the concentration of tetrahydropalmatin was showing a good linear relationship with the relative luminous intensity in three systems. Above all, detection limit of three systems was 0.029 66 μg/mL, 0.008 69 μg/mL and 0.041 38 μg/mL respectively, and the average rate of recovery was over 97.66%. The average extraction ratio of tetrahydropalmatine in the detecting samples with those three systems was 0.0618%, 0.0612% and 0.0611%, respectively. Based on those results, it was concluded that the established method was showing the wide linear detection range, low detection limit and high precision, and the results can be used to quality analysis ofCorydalisyanhusuo, and detecting tetrahydropalmatine practically inCorydalisyanhusuo.
Corydalisyanhusuo; tetrahydropalmatine; luminol; chemiluminescence; determination
2096-3998(2017)04-0067-08
2017-02-16
2017-04-27
陕西省科技统筹创新工程计划项目(2015KTTSSF01-02);陕西省教育厅科研计划项目(12JS026)
蔡艳妮(1990—),女,陕西省宝鸡市人,陕西理工大学硕士研究生,主要研究方向为植物天然产物;[通信作者]杨培君(1960—),男,陕西省洋县人,陕西理工大学教授,硕士生导师,主要研究方向为植物天然产物。
O657.3
A
