盐度和温度对不同规格虎斑乌贼幼体的耗氧率、排氨率和窒息点的影响
2017-09-12王鹏帅蒋霞敏韩庆喜江茂旺彭瑞冰
王鹏帅 蒋霞敏 韩庆喜 江茂旺 阮 鹏 彭瑞冰
(宁波大学海洋学院, 宁波 315211)
盐度和温度对不同规格虎斑乌贼幼体的耗氧率、排氨率和窒息点的影响
王鹏帅 蒋霞敏 韩庆喜 江茂旺 阮 鹏 彭瑞冰
(宁波大学海洋学院, 宁波 315211)
为探究体重、盐度和温度对不同规格的虎斑乌贼(Sepia pharaonis)幼体耗氧率、排氨率以及其窒息点的影响。采用单因子试验设计和密闭静水法, 对不同体重下(0.212、0.385、0.476、0.597、0.754和0.946 g)虎斑乌贼幼体的耗氧率和排氨率, 以及不同体重(0.476、0.673、1.341、3.873和4.205 g)幼体的窒息点进行了测定, 同时研究了不同盐度(19‰、22‰、25‰、28‰和31‰)和温度(18、21、24、27和30℃)对不同规格[A: 体重(0.366±0.042) g, B: 体重(0.556±0.038) g, C: 体重(0.844±0.051) g]的虎斑乌贼幼体耗氧率(RO)和排氨率(RN)的影响。结果表明: (1)虎斑乌贼幼体体重对耗氧率和排氨率均影响显著(P<0.05)。随着幼体体重的增长,耗氧率和排氨率显著下降, 个体越小耗氧率和排氨率越大; (2)盐度对幼体的耗氧率和排氨率有显著影响(P<0.05), 均随着盐度的增加呈先下降后上升的趋势, 其中, A规格和B规格的幼体在盐度25‰时, 耗氧率和排氨率显著低于盐度19‰、22‰和31‰时的3个试验组(P<0.05), 而与盐度28‰时无显著差异(P>0.05); C规格幼体的耗氧率在盐度28‰时显著低于盐度19‰组(P<0.05), 而排氨率在盐度25‰时显著低于盐度19‰和31‰两组(P<0.05)。盐度对A规格幼体的氧氮比(O/N)值有显著影响(P<0.05), 而对B规格和C规格的幼体无显著影响(P>0.05)。(3)温度对不同规格幼体的耗氧率和排氨率有显著影响(P<0.05), 均随温度的增长, 呈先上升后下降的趋势。其中, A规格和C规格幼体的耗氧率在27℃时, 显著高于18和30℃两组(P<0.05), B规格的在水温24℃时显著高于18和30℃(P<0.05); A规格和B规格幼体的排氨率分别在24和27℃时, 显著高于其他温度组(P<0.05), C规格的在温度27℃时, 显著高于18和30℃两组(P<0.05); 温度对A规格幼体的O/N值有显著影响(P<0.05), 而对B规格和C规格的幼体无显著影响(P>0.05)。(4)虎斑乌贼幼体的窒息点为0.84—1.62 mg/L, 随着体重的增加而逐渐降低。
虎斑乌贼; 盐度; 温度; 耗氧率; 排氨率; 窒息点
呼吸和排泄是反映动物体内生理代谢活动的主要标志, 可以直接或间接的反映体内新陈代谢的规律、生理或生存状况[1,2], 尤其窒息点, 是水生动物对水体低氧耐受能力的重要参数, 不仅在生理和阶段发育方面的研究有着重要的意义, 而且在养殖学上也有重要的理论和应用价值[3]。通过对水生动物呼吸生理的研究, 了解在不同生态环境下对溶解氧的要求, 可为实际生产应用提供理论参考。
虎斑乌贼(Sepia pharaonis)隶属乌贼目乌贼科(Sepiidae)、乌贼属(Sepia), 主要分布在我国东海和南海, 由于其不仅个体大、味道鲜美、营养丰富,有较高的经济价值, 而且具有饵料转化率高、生长快等优点, 成为了一种极具养殖前景的经济头足类。然而, 作为海水养殖种类, 外界环境因素的变化是影响其呼吸代谢、生长发育和免疫防御的主要环境因子[4,5]。在养殖过程中, 往往会由于强降雨、台风等自然因素, 导致海水盐度及温度的变化,进而会引起乌贼的应急反应, 出现喷墨、大量死亡等现象, 制约着乌贼养殖规模化的发展进程。
对于水生动物来说, 外部和内部因素均会对生理代谢产生影响, 水温、盐度和体重是影响其呼吸代谢的重要因素。国内外有关鱼类[3,6—8]、双壳类[9—11]、腹足类[4,12,13]和头足类[14—16]等在呼吸排泄方面已进行了大量的研究, 而目前有关虎斑乌贼的研究则主要集中在繁殖[17,18]、氨基酸表达[19]、胚胎耗氧率[20]、不同培养时期壳层变化[21]、胚胎及幼体的毒理性[22,23]以及耐受性[24,25]等方面的研究,而对虎斑乌贼幼体呼吸代谢方面的研究尚未见有报道。本文就虎斑乌贼幼体的耗氧率、排氨率和窒息点进行研究, 旨在了解不同盐度、温度以及不同规格下虎斑乌贼幼体的生理反应机制, 为其人工繁育、运输和规模化养殖提供理论参考。
1 材料与方法
1.1 试验材料
试验于2016年5—7月在宁波市象山来发育苗厂进行, 虎斑乌贼幼体为本课题组室内人工育苗所得。试验用水取自当地象山港海域, 经暗沉淀、沙滤、筛绢网袋过滤的自然海水, 盐度(24±0.6)‰, 水温(23±0.5)℃, pH 8.2±0.3。
1.2 试验方法
不同体重虎斑乌贼幼体的耗氧率和排氨率的试验 采用单因子试验方法对不同体重(0.212、0.385、0.476、0.597、0.754和0.946 g)的虎斑乌贼幼体进行耗氧率和排氨率的试验, 试验方法参考栗志民等[1]测定华贵栉孔扇贝(Chlamys nobilis)耗氧率和排氨率的装置并稍加改进。试验前停食24h,采用密闭静水法, 以500 mL三角烧瓶为呼吸室, 根据预实验每瓶放置5只乌贼幼体, 加入自然过滤海水(盐度24‰)后立即用液体石蜡密封, 记录时间, 每组设置3平行和1个空白对照瓶(不放乌贼)。呼吸室均浸没于恒温的水浴泡沫箱(水温23℃)中, 为了避免阳光直射, 试验装置置于双层遮阳网下, 待试验持续2h后立即用虹吸法取水样。
盐度对不同规格虎斑乌贼幼体耗氧率和排氨率影响的试验 虎斑乌贼幼体按照体重分为A规格、B规格和C规格3组(表 1)。设置盐度19‰、22‰、25‰、28‰和31‰五个梯度, 采用添加淡水和海盐的方式调节暂养和试验所用海水的盐度, 每天升降盐度为2‰, 达到预定盐度后, 再适应2d开始试验, 试验前停食24h, 水温(23±0.5)℃, pH 8.2± 0.3。其他条件同上。
温度对不同规格虎斑乌贼幼体耗氧率和排氨率的试验 设置温度18、21、24、27和30℃五个梯度, 采用冰袋降温和电热棒加热的方式调节暂养和试验所用海水的温度, 每天升降温度不超过2℃, 达到预定水温后, 再适应2d开始试验, 试验前停食24h, 盐度(24±0.6)‰, pH 8.2±0.3。其他条件同上。
窒息点试验 窒息点试验装置同封闭静水法测定耗氧率的装置相同。将不同体重大小(0.476、0.673、1.341、3.873和4.205 g)的虎斑乌贼幼体放入呼吸室中, 立即用液体石蜡密封, 每瓶1只, 每组设置3平行, 其他条件同上。当试验的虎斑乌贼幼体停止游动, 身体上浮, 触腕下垂, 有墨汁微微流出时, 立即用虹吸法取水样。
1.3 数据收集方法
采用Winkler碘量法测定水样溶解氧(DO)含量,次溴酸钠氧化法测定水样含量。在试验结束后测定生物学数据, 精确测量虎斑乌贼幼体的胴长、胴宽和体重。
1.4 计算方法
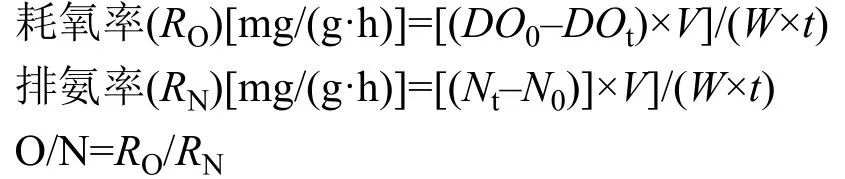
式中, DO0和DOt分别为试验结束时, 空白对照瓶、试验瓶水样溶解氧的含量(mg/L); N0和Nt分别为试验结束时, 空白对照瓶、试验瓶水样的含量(mg/L); V为呼吸瓶中水的体积(L); W为虎斑乌贼幼体体重(g); t为试验持续时间(h)。

表 1 虎斑乌贼幼体生物学数据Tab. 1 Biological characteristics of juvenile S. pharaonis
1.5 数据处理
试验数据以平均值±标准差(Mean±SD)表示,采用SPSS 17.0统计软件进行单因素方差分析, 若差异性显著, 做Duncan’s多重比较, 以P<0.05表示差异显著。
2 结果
2.1 虎斑乌贼幼体体重与耗氧率和排氨率的关系
由图 1可以看出, 在相同的环境条件下, 虎斑乌贼幼体体重对耗氧率和排氨率均影响显著(P<0.05)。随着乌贼幼体体重的增长, 耗氧率和排氨率均显著下降(P<0.05), 体重与耗氧率之间呈幂函数关系, 其方程为Y1=0.3552x–0.7175(R2=0.9395), 体重与排氨率之间也呈幂函数关系, 其方程为Y2=0.0152x–0.7231(R2=0.9328), 其中式中, Y1、Y2分别为耗氧率和排氨率, x为体重。
2.2 盐度对不同规格的虎斑乌贼幼体耗氧率、排氨率和O/N的影响
从表 2可以看出, 盐度对不同规格虎斑乌贼幼体的耗氧率有显著影响(P<0.05), 均随盐度的升高,呈先下降后上升的趋势。其中, A规格和B规格幼体的耗氧率均在盐度25‰时, 达到最小值[0.617和0.424 mg/(g·h)], 除与盐度28‰组无显著差异(P>0.05)外, 显著低于其他3组(P<0.05); C规格在盐度28‰时, 达到最小值 [0.352 mg/(g·h)], 与盐度19‰时有显著差异(P<0.05), 与其他4组无显著差异(P>0.05); 不同盐度对不同规格虎斑乌贼幼体的排氨率也有显著影响(P<0.05), 均随盐度的升高, 呈先下降后上升的趋势, 其中, A规格幼体的排氨率在盐度25‰时达最小值[0.025 mg/(g·h)], 除与盐度28‰组无显著差异(P>0.05)外, 显著低于盐度其他3组(P<0.05); B规格在盐度28‰时, 为最小值[0.021 mg/(g·h)], 除与盐度25‰组无显著差异(P>0.05)外, 显著低于其他3组(P<0.05), C规格在盐度25‰时, 为最小值[0.018 mg/(g·h)], 与盐度为22‰和28‰无显著差异(P>0.05), 与其他组有显著差异(P<0.05)。
虎斑乌贼幼体的O/N为18.373—25.177, 其中,不同规格的幼体在同一盐度水平下O/N之间有显著性差异(P>0.05)。而在不同盐度水平下, A规格幼体O/N在盐度为22‰时最大(25.177±1.569), 与盐度19‰组差异显著(P<0.05), 与其他3组无显著性差异(P>0.05); B规格和C规格幼体O/N在各试验组之间均无显著性差异(P>0.05)(表 3)。

图 1 虎斑乌贼幼体体重与耗氧率和排氨率的关系
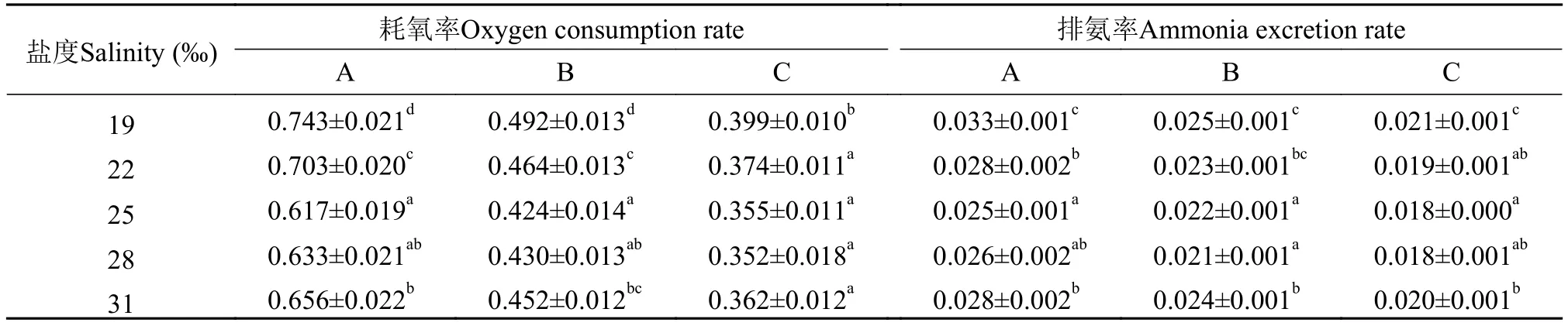
表 2 盐度对不同规格虎斑乌贼幼体耗氧率和排氨率的影响Tab. 2 Effects of different salinity on the rate of oxygen consumption rate and ammonia excretion of juvenile S. pharaonis
2.3 温度对不同规格的虎斑乌贼幼体耗氧率、排氨率和O/N的影响
从表 4可以看出, 温度对不同规格虎斑乌贼幼体的耗氧率有显著影响(P<0.05), 均随温度的升高,呈先上升后下降的趋势。其中, A规格和C规格幼体的耗氧率均在水温27℃时达到最大值[0.654 和0.404 mg/(g·h)], 除与水温24℃组无显著差异(P>0.05)外, 显著高于水温18℃和30℃两组(P<0.05),而B规格在水温24℃时达到最大值[0.457 mg/(g·h)],除与27℃无显著差异(P>0.05), 与其他组差异显著(P<0.05); 温度对不同规格虎斑乌贼幼体的排氨率也有显著影响(P<0.05), 均随温度的升高, 呈先上升后下降的趋势, 其中, A规格幼体的排氨率在温度24℃时达最大值[0.028 mg/(g·h)], 除与温度27℃无显著差异(P>0.05)外, 显著高于其他3组(P<0.05), B规格在水温27℃时达最大值[0.022 mg/(g·h)], 与24℃无显著性差异(P>0.05), 与温度其他3组间差异显著(P<0.05), C规格在温度27℃时达最大值[0.019 mg/ (g·h)], 与温度为21℃和24℃无显著差异(P>0.05),与其他两组差异显著(P<0.05)。
虎斑乌贼幼体的O/N为19.550—30.771, 其中,不同规格的幼体在同一温度水平下O/N之间有显著性差异(P>0.05)。而在不同温度水平下, A规格幼体O/N在温度为18℃时最大(30.771±3.672), 与温度24℃和30℃组差异显著(P<0.05), 与其他2组无显著差异(P>0.05); B规格和C规格幼体O/N在各温度试验组之间均无显著性差异(P>0.05)(表 5)。
2.4 虎斑乌贼幼体的窒息点
由图 4可以看出, 不同体重(0.476—4.205 g)的虎斑乌贼幼体的窒息点为0.84—1.62 mg/L, 平均为1.24 mg/L。体重较小的乌贼窒息点较高, 且随着体重的增加而逐渐降低。

表 3 不同规格虎斑乌贼幼体在不同盐度下的氧氮比(O/N)Tab. 3 O/N ratios of different size juvenile S. pharaonis of at different salinity levels

表 4 温度对不同规格虎斑乌贼幼体耗氧率和排氨率的影响Tab. 4 Effects of temperature on the rate of oxygen consumption and ammonia excretion of juvenile S. pharaonis

表 5 不同规格虎斑乌贼幼体在不同温度下的氧氮比(O/N)Tab. 5 O/N rations of different size juvenile S. pharaonis of under different temperature

图 2 虎斑乌贼幼体体重与窒息点的关系
3 讨论
3.1 体重对虎斑乌贼幼体耗氧率和排氨率的影响
体重是影响水生生物体耗氧率和排氨率的重要因素之一[6]。国内外学者对耗氧率和排氨率与体重之间的关系进行了较多的研究, 证实耗氧率和排氨率与体重之间一般呈幂函数关系: Y=aW–b, 即随着体重的增加, 耗氧率和排氨率下降, 其中, a值表示单位体重的耗氧率或排氨率, 系数变化较大, 这不仅与物种的特异性有关, 还与测定耗氧率和排氨率时的温度、盐度等环境因素以及所采用的计算体重方式不同有关, b值表示体质量指数, 一般认为变化较小[1,12]。本试验采用虎斑乌贼幼体湿重建立耗氧率和排氨率的回归关系, 结果均呈负相关幂函数关系, 即随着乌贼幼体体重的增长, 耗氧率和排氨率均减小, 这与曼氏无针乌贼(Sepia maindrona)[16]、企鹅珍珠贝(Pteria penguin)[11]、华贵栉孔扇贝(Chlamys nobilis)[1]、泥螺(Bullacta exarata)[13]等研究结果相似。张中英等[26]研究认为, 水生动物在个体较小时, 生长速度相对较快, 需要摄食更多的营养物质, 呼吸、排泄和消化等系统循环速度也相对加快, 代谢水平相对于单位体重来说就高, 因此, 个体较小的幼体耗氧率和排氨率就反而较高。而姜祖辉等[27]认为, 可能是水生动物生长过程中, 直接维持生命的肾、肝等组织的新陈代谢要高于非直接维持生命活动的组织, 如肌肉和脂肪等。随着动物个体的增长, 这2种组织的比率也随之变化, 肝、肾组织的比率逐渐减小, 而肌肉、脂肪等组织逐渐积累, 从而造成了随着个体体重的逐渐增大, 单位体重上的耗氧率和排氨率却减小的现象。
3.2 盐度对虎斑乌贼幼体耗氧率和排氨率的影响
盐度是水体中重要的环境因子, 对水生动物的生理代谢有显著的影响[4,5], 有些学者认为, 水生动物的标准代谢由两部分组成, 一是组织的修复和更新所需要的能量; 二是维持机体内环境稳定所消耗的能量[28,29]。在盐度对水生动物耗氧率的影响方面, 有2种观点, 一种观点认为, 在一定的盐度范围内, 耗氧率和排氨率均随着盐度的升高呈先上升后下降的趋势[30]; 另一种观点认为, 在适宜的盐度范围内耗氧率和排氨率最低, 高于或低于这个范围,耗氧率和排氨率均会上升, 水体盐度对水生动物机体存在一个等渗点, 在等渗点时的能量消耗最少,生长最快, 在偏离这个等渗点时, 为了维持渗透平衡势必会消耗大量的能量保持机体内环境的稳定,耗氧率最高[31]。本试验发现, 3种规格的虎斑乌贼幼体耗氧率和排氨率均随盐度的升高呈先下降后上升的趋势, 其最低点均出现在盐度为25‰或28‰两组, 这与关健等[32]对半滑舌鳎(Cynoglossus semilaevis)幼鱼、王春琳等[16]对曼氏无针乌贼和张媛等[33]对橄榄蚶(Estellarca olivacea)的研究结果相近。而与吴文广等[13]对泥螺、唐保军等[34]对黄边糙鸟蛤(Trachycardium flavum)、刘建勇等[12]对方斑东风螺(Babylonia areolate)等的研究结果却不太一致, 贝类的耗氧率和排氨率均随着盐度的上升呈先上升后下降的趋势, 这可能与水生动物对水体盐度的调节能力和所生长的环境有关, 虎斑乌贼幼体最适宜生长的盐度是25‰—27‰[35]。因此, 在虎斑乌贼养殖过程中, 应保持盐度在其适宜的范围内变化, 尤其要注意强降雨或台风天气等造成的水体盐度大幅度变化。
3.3 温度对虎斑乌贼幼体耗氧率和排氨率的影响
温度是引起水生无脊椎动物生理活动变化的重要因素之一[36], 有研究[37]表明, 水生无脊椎动物的耗氧率会随着温度的升高而增加, 当超过这个范围, 生理功能会出现异常, 耗氧率反而下降, 原因是随着温度的升高, 水生动物体内的氧化酶活性得到增强, 从而使其生物体内的生化反应速率、呼吸速率逐渐加强, 导致需氧量的增加, 然而一旦超过了适宜的温度范围, 体内的酶活性将会受到抑制, 导致生物体内的生理代谢功能出现紊乱, 耗氧率就会出现下降的趋势[38,39]。本次试验发现, 温度对虎斑乌贼幼体的耗氧率和排氨率有显著影响, 在水温18—27℃内, 3种规格的虎斑乌贼幼体的耗氧率和排氨率均随着温度的升高而升高, 其最高点均出现在温度为24℃或27℃两组, 30℃时, 耗氧率和排氨率已开始出现明显的下降趋势, 说明30℃可能已经超过了虎斑乌贼幼体适温范围, 以致体内酶活力下降, 新陈代谢变慢, 从而对虎斑乌贼幼体的呼吸代谢产生了抑制作用, 引起了耗氧率和排氨率的下降,这与温度对香螺(Naptunea cumingii)幼螺[40]、甲虫螺(Cantharus cecillei)[41]、华贵栉孔扇贝[1]等耗氧率和排氨率的研究结果相似, 同样, 与乐可鑫等[35]得出的虎斑乌贼幼体最适宜生长温度为24—27℃也相符。因此, 在实际养殖过程中, 要注意使水温在适宜的范围内变化, 保证其正常的生理代谢活动。
3.4 盐度、温度对虎斑乌贼幼体O/N的影响
O/N是表示动物呼吸底物的重要参数, 是生物体内蛋白质与脂肪和碳水化合物分解代谢的比率,可作为生物对环境压力适应的一个指标[42]。O/N值大, 表明动物消耗的能量大多由脂肪或糖类代谢提供, 较少由蛋白质代谢提供[26], Mayzalld等[43—45]的研究提出, 如果生物体代谢由蛋白质氧化分解供能占主导地位, 氧氮比值在3—16; 如果以蛋白质和脂肪混合代谢供能为主, 氧氮比值在16—60; 如果由脂肪或碳水化合物为主导供能, 氧氮比值将会大于60, 因此, 通过O/N可以估计动物代谢中能源物质的化学本质。本试验结果表明, 在盐度19‰—31‰,温度18—30℃内, 虎斑乌贼幼体的O/N值范围在18.373—30.771, 表明虎斑乌贼幼体在各试验盐度和温度条件下, 呼吸代谢均主要由蛋白质和脂肪混合供能。其中, 盐度试验发现, A规格虎斑乌贼幼体呼吸代谢的O/N值在盐度22‰时, 显著高于盐度19‰时, 而与其他3个试验组无显著差异(P>0.05), B规格和C规格的O/N值在各试验组间均无显著性差异(P>0.05), 但分别在盐度22‰和25‰时有最大值; 温度试验发现, A规格虎斑乌贼幼体的氧氮比在温度为18℃时显著高于24℃和30℃(P<0.05), B规格和C规格的氧氮比在各试验组之间均无显著性差异(P>0.05)。由此可见, 对于虎斑乌贼幼体呼吸代谢底物来说, 体重较小的幼体受盐度和温度变化的影响要大于体重较大的幼体。
3.5 虎斑乌贼幼体的窒息点
研究虎斑乌贼的窒息点, 了解虎斑乌贼对水体溶解氧的最低需求量, 在养殖生产和长途运输的实际应用中是非常重要的。试验结果表明, 在自然养殖条件(盐度24‰, 水温23℃, pH 8.2)下, 虎斑乌贼幼体的窒息点随体重的增加呈下降的趋势, 即个体较大的乌贼对水体的低溶氧耐受能力更强, 但同时由于个体较大的乌贼对水体的溶氧消耗较快, 呼吸室中的溶氧含量快速下降, 在较短的时间里就达到了乌贼的窒息点, 因此, 大个体的虎斑乌贼幼体致死时间要明显低于小个体的, 这与王春琳等[16]对曼氏无针乌贼的研究结果一致。因而, 在虎斑乌贼的养殖过程中, 尤其是后期个体较大时, 要合理控制养殖密度、大小规格和充足的气体供应, 保证养殖水体中的足够溶氧量。
[1]Li Z M, Liu Z G, Xie L, et al. Effect of body weight and temperature on oxygen consumption and ammonia-N excretion rates of Chlamys nobilis [J]. Oceanologia et Limnologia Sinica, 2010, 41(1): 99—105 [栗志民, 刘志刚,谢丽, 等. 体重和温度对华贵栉孔扇贝耗氧率和排氨率的影响. 海洋与湖沼, 2010, 41(1): 99—105]
[2]Chen S B, Chen W X, Fan Z T. Advances in metabolic fish breathe [J]. Chinese Journal of Fisheries, 2004, 17(1): 82—89 [陈松波, 陈伟兴, 范兆廷. 鱼类呼吸代谢研究进展. 水产学杂志, 2004, 17(1): 82—89]
[3]Sun B Z, Huang H, Cao W X, et al. Studies on the oxygen consumption rate and asphyxiate point of Megalobrama pellegrini and Coreius guichcnoti [J]. Acta Hydrobiologica Sinica, 2010, 34(1): 88—93 [孙宝柱, 黄浩, 曹文宣, 等. 厚颌鲂和圆口铜鱼耗氧率与窒息点的测定.水生生物学报, 2010, 34(1): 88—93]
[4]Luo J, Liu C W, Li F, et al. Effects of salinity and body weight on consumption rate and ammonia excretion rate of Hemifusus tuba (Gmelin) [J]. Marine Sciences, 2008, 32(5): 46—50 [罗杰, 刘楚吴, 李锋, 等. 盐度及规格对管角螺耗氧率和排氨率的影响. 海洋科学, 2008, 32(5): 46—50]
[5]You Z J, Xu S L, Bian P J, et al. The effects of sea water temperature and salinity on the growth and survival of Tegillarca granosa larvae and juveniles [J]. Acta Oceanologica Sinica, 2001, 23(6): 108—113 [尤仲杰, 徐善良,边平江, 等. 海水温度和盐度对泥蚶幼虫和稚贝生长及存活的影响. 海洋学报, 2001, 23(6): 108—113]
[6]Wang G, Li J E, Qu Y J, et al. Oxygen consumption and ammonia excretion of the juvenile Trachinoms ovatus [J]. Chinese Journal of Zoology, 2010, 45(3): 116—121 [王刚, 李加儿, 区又君, 等. 卵形鲳鲹幼鱼耗氧率和排氨率的初步研究. 动物学杂志, 2010, 45(3): 116—121]
[7]Cao Z D, Fu S J. The effect of exhaustive exercise training and fasting on post-exercise oxygen consumption rate in southern catfish (Silurus meridionalis Chen) [J]. Acta Hydrobiologica Sinica, 2009, 33(5): 837—843
[8]Qiu C G, Xu S L, Lin S Z, et al. Oxygen consumption and ammonia excretion rates of juvenile Sebastiscus marmoratus under different temperature treatments [J]. Journal of Applied Oceanography, 2014, 33(1): 84—89 [邱成功, 徐善良, 林少珍, 等. 不同温度条件下褐菖鲉幼鱼的耗氧率和排氨率. 应用海洋学学报, 2014, 33(1): 84—89]
[9]Saucedo P E, Ocampo L, Monteforte M, et al. Effect of temperature on oxygen consumption and ammonia excretion in the Calafia mother-of-pearl oyster, Pinctadamazatlanica (Hanley, 1856) [J]. Aquaculture, 2004, 229(1—4): 377—387
[10]Meng X P, Dong Z G, Cheng H L, et al. Oxygen consumption and ammonia-N excretion rates of Coelomactra antiquate [J]. Chinese Journal of Applied Ecology, 2005, 16(12): 2435—2438 [孟学平, 董志国, 程汉良, 等. 西施舌的耗氧率与排氨率研究. 应用生态学报, 2005, 16(12): 2435—2438]
[11]Li Z M, Liu Z G, Xie L, et al. Oxygen consumption and ammonia-N excretion rates of Pteria penguin [J]. Acta Oceanologica Sinica, 2009, 31(6): 129—135 [栗志民, 刘志刚, 谢丽, 等. 企鹅珍珠贝耗氧率和排氨率的研究. 海洋学报, 2009, 31(6): 129—135]
[12]Liu J Y, Shao J, Zhuo J H. Effect of salinity on respiration and excretion of Babylonia areolata [J]. Journal of Tropical Oceanography, 2005, 24(4): 35—40 [刘建勇,绍杰, 卓健辉. 盐度对方斑东风螺耗氧率和排氨率的影响. 热带海洋学报, 2005, 24(4): 35—40]
[13]Wu W G, Zhang J H, Fang J G, et al. Effects of salinity on oxygen consumption and ammonia excretion rate of different sizes of Bullacta exarata [J]. Chinese Journal of Ecology, 2013, 32(9): 2457—2461 [吴文广, 张继红, 方建光, 等. 盐度对不同规格泥螺耗氧率和排氨率的影响.生态学杂志, 2013, 32(9): 2457—2461]
[14]Jesus C V, Benjamin G G. Influence of body weight and temperature on postprandial oxygen consumption of common octopus (Octopus vulgaris) [J]. Aquaculture, 2004, 233(1-4): 599—613
[15]Katsanevakis S, Stephanopoulou S, Miliou H, et al. Oxygen consumption and ammonia excretion of Octopus vullgaris (Cephalopoda) in relation to body mass and temperature [J]. Marine Biology, 2005, 146(4): 725—732
[16]Wang C L, Wu D H, Dong T Y, et al. Oxygen consumption rate and effects of hypoxia stress on enzyme activities of Sepiella maindrona [J]. Chinese Journal of Applied Ecology, 2008, 19(11): 2420—2427 [王春琳, 吴丹华, 董天野, 等. 曼氏无针乌贼耗氧率及溶氧胁迫对其体内酶活力的影响. 应用生态学报, 2008, 19(11): 2420—2427]
[17]Minton J W, Walsh L S, Lee P G, et al. First multi-generation culture of the tropical cuttlefish Sepia pharaonis Ehrenberg, 1831 [J]. Aquaculture International, 2001, 9(5): 375—392
[18]Gabr H R, Hanlon R T, Hanafy M H, et al. Maturation, fecundity and seasonality of reproduction of two commercially valuable cuttlefish, Sepia pharaonis and S. dollfusi, in the Suez Canal [J]. Fisheries Research, 1998, 36(2/3): 99—115
[19]Lee Y H, Chang Y C, Yan H Y, et al. Early visual experience of background contrast affects the expression of NMDA-like glutamate receptors in the optic lobe of cuttlefish, Sepia pharaonis [J]. Journal of Experimental Marine Biology and Ecology, 2013, 447(3): 86—92
[20]Wang P S, Jiang X M, Ruan P, et al. Oxygen consumption rate of Sepia pharaonis embryos [J]. Chinese Journal of Applied Ecology, 2016, 27(7): 2357—2362 [王鹏帅, 蒋霞敏, 阮鹏, 等. 虎斑乌贼的胚胎耗氧率. 应用生态学报, 2016, 27(7): 2357—2362]
[21]Chung M T, Wang C H. Age validation of the growth lamellae in the cuttlebone from cultured Sepia pharaonis at different stages [J]. Journal of Experimental Marine Biology and Ecology, 2013, 447(9): 132—137
[22]Tan Y S, Liu J Y, Xu B X. Acute toxicity tests of potassium permanganate on activity of embryos and larval of Sepia pharaonis [J]. Aquiculture, 2011, 32(1): 12—15 [谭永胜,刘建勇,徐彬晓. 高锰酸钾对虎斑乌贼胚胎和幼体的毒性研究. 水产养殖, 2011, 32(1): 12—15]
[23]Xu B X, Liu J Y, Tan Y S. Acute toxicity tests of formaldehyde on activity of embryos and larval of Sepia pharaonis [J]. Transactions of Oceanology Limnology, 2011(2): 86—90 [徐彬晓, 刘建勇, 谭永胜. 甲醛对虎斑乌贼受精卵和幼体的毒性试验. 海洋湖沼通报, 2011(2): 86—90]
[24]Huang J S, Chen G, Zhang J D, et al. Effects of salinity on fertilized egg hatch and survival activity index of the larvae of Sepia pharaonis [J]. Journal of Guangdong Ocean University, 2012, 32(1): 35—38 [黄建盛, 陈刚, 张健东, 等. 盐度对虎斑乌贼(Sepia pharaonis)受精卵孵化及幼体活力的影响. 广东海洋大学学报, 2012, 32(1): 35—38]
[25]Le K X, Jiang X M, Peng R B, et al. Effects of four ecological factors on the growth and survival of Sepia pharaonis larvae [J]. Journal of Biology, 2014, 31(4): 33—37 [乐可鑫, 蒋霞敏, 彭瑞冰, 等. 4种生态因子对虎斑乌贼幼体生长与存活的影响. 生物学杂志, 2014, 31(4): 33—37]
[26]Zhang Z Y, Hu M, Wu F H. Preliminary study of the oxygen consumption of Tilapia nilotica [J]. Journal of Fisheries of China, 1982, 6(4): 367—378 [张中英, 胡枚, 吴福煌. 尼罗罗非鱼耗氧率的初步研究. 水产学报, 1982, 6(4): 367—378]
[27]Jiang Z H, Wang J, Tang Q S. Effects of temperature, body weight and feeding state on oxygen consumption rate and ammonia excretion rate of short-necked clam (Ruditapes philippinarum) [J]. Marine Fisheries Research, 1999, 20(1): 40—44 [姜祖辉, 王俊, 唐启升. 菲律宾蛤仔生理生态学研究. 海洋水产研究, 1999, 20(1): 40—44]
[28]silva C D D, Premawansa S, Keembiyahetty C N. Oxygen consumption in Oreochromis niloticus (L.) in relation to development, salinity, temperature and time of day [J]. Journal of Fish Biology, 1986, 29: 267—277
[29]Farmer G J, Beamish F W H, Farmer G J, et al. Oxygen consumption of Tilapia nilotica in relation to swimming speed and salinity [J]. Journal of the Fisheries Research Board of Canada, 1969, 26(11): 2807—2821
[30]Farmer L, Reeve M R. Role of the free amino acid pool of the copepod Acartia tonsa in adjustment to salinity change [J]. Marine Biology, 1978, 48(4): 311—316
[31]Navarro J M. The effects of salinity on the physiological ecology of Choromytilus chorus [J]. Journal of Experimental Marine Biology & Ecology, 1988, 122(1): 19—33
[32]Guan J, Liu X Z, Ma X K, et al. Study on the oxygen consumption rate and asphyxiation of Cynoglossus semilaevis Gunther larvae [J]. Marine Fisheries Research, 2006, 27(2): 81—87 [关健, 柳学周, 马学坤, 等. 半滑舌鳎幼鱼耗氧率和窒息点的研究. 海洋水产研究, 2006, 27(2): 81—87]
[33]Zhang Y, Fang J G, Mao Y Z, et al. Effects of temperature and salinity on oxygen consumption rate and ammonia excretion rate of clam Estellarca olivacea [J]. Journal of Fishery Sciences of China, 2007, 14(4): 690—694 [张媛, 方建光, 毛玉泽, 等. 温度和盐度对橄榄蚶耗氧率和排氨率的影响. 中国水产科学, 2007, 14(4): 690—694]
[34]Tang B J, Yan W G, Wang H, et al. Effects of salinity on oxygen consumption and ammonia-N excretion rate of different size of Trachycardium flavum [J]. Marin Fisheries, 2010, 31(1): 30—34 [唐保军, 闫文罡, 王慧, 等. 盐度对不同规格黄边糙鸟蛤呼吸排泄的影响. 海洋渔业, 2010, 31(1): 30—34]
[35]Le K X, Jiang X M, Wang Y, et al. Salinity effects on growth and enzyme activity of juvenile Sepia pharaonis [J]. Journal of Tropical Oceanography, 2015, 34(6): 64—72 [乐可鑫, 蒋霞敏, 汪元, 等. 盐度对虎斑乌贼幼体生长与酶活的影响. 热带海洋学报, 2015, 34(6): 64—72]
[36]Yin S W, Zhou G J, Liu Y. Effect of different ecological factors on ricefield eel (Monopterus allbus) hatching rate [J]. Chinese Journal of Applied Ecology, 2004, 15(4): 734—736 [尹绍武, 周工建, 刘筠. 不同生态因子对黄鳝受精卵孵化率的影响. 应用生态学报, 2004, 15(4): 734—736]
[37]Wang J, Jiang Z H, Tang Q S. Oxygen consumption and ammonia-N rates of Chlamys farreri [J]. Chinese Journal of Applied Ecology, 2002, 13(9): 1157—1160 [王俊, 姜祖辉, 唐启升. 栉孔扇贝耗氧率和排氨率的研究. 应用生态学报, 2002, 13(9): 1157—1160]
[38]Wang G, Li J E, Qu Y J, et al. Influence of environmental factors on oxygen consumption and ammonia excretion of juvenile Trachinotus ovatus [J]. Chinese Journal of Zoology, 2011, 46(6): 80—87 [王刚, 李加儿, 区又君,等. 环境因子对卵形鲳鲹幼鱼耗氧率和排氨率的影响.动物学杂志, 2011, 46(6): 80—87]
[39]Wang Y B, Sun Z, Yu F P, et al. Effects of temperature on oxygen consumption rate and ammonia excretion rate of Acanthopagrus schlegeli [J]. Marine Fisheries, 2007, 29(4): 375—379 [王跃斌, 孙忠, 余方平, 等. 温度对黑鳍棘鲷耗氧率和排氨率的影响. 海洋渔业, 2007, 29(4): 375—379]
[40]Zhang X F, Yang D Z, Zhou Y B, et al. Impacts of temperature and salinity on oxygen consumption rate and ammonia excretion rate in juvenile whelk Neptunea cumingii [J]. Journal of Dalian Ocean University, 2014, 29(3): 251—255 [张旭峰, 杨大佐, 周一兵, 等. 盐度、温度对香螺幼螺耗氧率和排氨率的影响. 大连海洋大学学报, 2014, 29(3): 251—255]
[41]Wu W G, Zhang J H, Gao Z K, et al. Effects of temperature and salinity on oxygen consumption and ammonia excretion rate of whelk Cantharus cecillei with different sizes [J]. Progress in Fishery Sciences, 2016, 37(2): 134—138 [吴文广, 张继红, 高振锟, 等. 温度和盐度对不同规格甲虫螺耗氧率和排氨率的影响. 渔业科学进展, 2016, 37(2): 134—138]
[42]Winddows J. Combined effect of body size, food concentration and season on the physiology of Mytilus edulis [J]. Journal of the Marine Biological Association of the United Kingdom, 1978, 58: 109—124
[43]Mayzaud P, Conover R. O:N atomic rations as a tool to describe zooplankton metabolism [J]. Marine Ecology Progress Series Oldendorf, 1988, 45(3): 289—302
[44]Tseng Y C, Hwang P P. Some insights into energy metabolism for osmoregulation in fish [J]. Comparative Biochemistry & Physiology Part C: Toxicology & Pharmacology, 2008, 148(4): 419—429
[45]Zheng Z, Jin C, Li M, et al. Effects of temperature and salinity on oxygen consumption and ammonia excretion of juvenile miiuy croaker, Miichthys miiuy (Basilewsky) [J]. Aquaculture International, 2008, 16(6): 581—589
EFFECTS OF SALINITY AND TEMPERATURE ON THE OXYGEN CONSUMPTION, AMMONIA EXCRETION RATES AND SUFFOCATION THRESHOLD OF DIFFERENT SIZES OF JUVENILE SEPIA PHARAONIS
WANG Peng-Shuai, JIANG Xia-Min, HAN Qing-Xi, JIANG Mao-Wang, RUAN Peng and PENG Rui-Bing
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
This research was conducted to explore the effects of body weight, salinity and temperature on oxygen consumption rates (OR), ammonia excretion rates (NR) and the suffocation threshold of juvenile Sepia pharaonis. The relationship between OR and NR of juvenile S. pharaonis and body weights (0.212, 0.385, 0.476, 0.597, 0.754, 0.946 g), suffocation threshold and body weights (0.476, 0.673, 1.341, 3.873, 4.205 g) were studied. Meanwhile, the effects of various salinities (19, 22, 25, 28, 31), and temperature (18, 21, 24, 27, 30℃) for three sizes of cuttlefish (A: body weight 0.366±0.042 g, B: body weight 0.556±0.038 g, C: body weight 0.844±0.051 g) were revealed by using singlefactor design and sealed hydrostatic method. The results were as follows: 1) body weights of juvenile S. pharaonis showed a significant effect on OR and NR (P<0.05), which decreased significantly with the increase of body weights. 2) Salinity had significant effects on the OR and NR (P<0.05), all of which were reduced with the increase of salinity, and then rose. For sizes A and B, the OR and NR of juvenile S. pharanis at salinity 25 were significantly lower than that at salinity 19, 22 and 31 (P<0.05), with the exception of salinity 28 (P>0.05). For size C, the OR of juvenile S. pharanis was significantly lower at salinity 28 than that at salinity 19 (P<0.05). Meanwhile, the NR was significantly lower at salinity 25 than at salinity 19 and 31 (P<0.05). The salinity had significant effects on O/N of juvenile S. pharaonis for size A (P<0.05), but not for sizes B and C (P>0.05). 3) The temperature had significant effects on the OR and NR (P<0.05), both of which were elevated with the increase of temperature, and then decreased. For sizes A and C, the OR of juvenile S. pharanis were significantly higher at 27℃ than at 18℃ and 30℃ (P<0.05). For size B, the OR of juvenile S. pharanis were significantly higher at 24℃ than at 18℃ and 30℃ (P<0.05). For sizes A and B, the of juvenile S. pharanis were significantly higher at 24℃ and 27℃ than at other temperatures (P<0.05). For size C, the NR of juvenile S. pharanis were significantly higher at 27℃ than at 18℃ and 30℃ (P<0.05). The temperature had significant effects on O/N of juvenile S. pharaonis of size A (P<0.05), but not of sizes B and C (P>0.05). 4) The suffocation threshold of juvenile S. pharaonis was 0.84—1.62 mg/L, which decreased with increasing body weights.
Sepia pharaonis; Salinity; Temperature; Oxygen consumption rate; Ammonia excretion rate; Suffocation threshold
Q493
A
1000-3207(2017)05-1027-09
10.7541/2017.128
2016-08-03;
2017-04-15
宁波市重大专项(2014C11001); 浙江省海洋与渔业项目(浙海渔计2013[82]号)资助 [Supported by the Major Agriculture Project of Ningbo City, Zhejiang Province, China (2014C11001); the Ocean and Fishery Project of Zhejiang Province, China (Zhejiang Marine Fishery Program, 2013[82])]
王鹏帅(1989—), 男, 河南林州人; 硕士研究生; 主要研究方向为海洋生物分子育种与健康养殖。E-mail: wang_pengshuai @126.com
蒋霞敏, 教授, 博士生导师; E-mail: jiangxiamin@nbu.edu.cn
猜你喜欢
杂志排行
水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE
