超声诊断胎儿侧脑室扩张合并畸形及其与染色体异常的关系
2017-09-11黄苑铭
黄苑铭
黄冬平 HUANG Dongping
钟 伟 ZHONG Wei
江 玮 JIANG Wei
陈 燕 CHEN Yan
陈以荣 CHEN Yirong
超声诊断胎儿侧脑室扩张合并畸形及其与染色体异常的关系
黄苑铭HUANG Yuanming
黄冬平HUANG Dongping
钟 伟ZHONG Wei
江 玮JIANG Wei
陈 燕CHEN Yan
陈以荣CHEN Yirong
目的探讨胎儿侧脑室扩张合并畸形及其与染色体异常的关系,为临床咨询提供参考。资料与方法回顾性分析150例经超声诊断为侧脑室扩张胎儿的超声图像、染色体核型分析及高分辨微阵列比较基因组杂交技术(aCGH)结果。结果150例侧脑室扩张胎儿中,孤立性侧脑室扩张81例,合并胎儿超声软指标30例,合并其他中枢神经系统畸形22例,合并其他畸形17例。以上4组染色体核型分析中,异常核型13例,aCGH异常15例。各组染色体异常及aCGH检出率差异有统计学意义(P<0.05),其中超声软指标组染色体及aCGH异常率显著高于单纯性侧脑室扩张组(P<0.05),其余各组两两比较差异均无统计学意义(P>0.05)。结论产前超声发现侧脑室扩张应仔细检查胎儿各系统。合并胎儿超声软指标或其他结构畸形时,染色体异常的几率明显增加;孤立性侧脑室扩张也需排除染色体异常并定期超声随访。
侧脑室;扩张,病理性;超声检查,产前;染色体畸变;微阵列分析;核酸杂交;胎儿
产前超声检查可分辨出侧脑室并测量其后角宽度[1]。研究表明,侧脑室扩张与染色体或基因异常、脑部出血及宫内感染有关[2]。因此,侧脑室被认为是超声观察胎儿情况的一个常规指标。检测染色体异常的主要方法是G显带核型分析,但该法对于细微的染色体结构异常(5 Mb以下)无法识别。微阵列比较基因组杂交技术(Array CGH,aCGH)的出现解决了这一难题。该方法除对已知染色体重排异常进行精细定位外,还可发现大量未知并导致异常表型的染色体微缺失与微重复[3]。本文通过对胎儿侧脑室扩张合并畸形的观察,分析其与染色体异常的关系,为孕妇是否终止妊娠或胎儿分娩后治疗提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2014年1月1日-2015年12月31日在广东省妇幼保健院行产前超声检查诊断为胎儿侧脑室扩张,并行介入性产前诊断染色体核型分析及aCGH检查的产妇150例。诊断胎儿侧脑室扩张孕周18~30周,平均(24.5±3.4)周,侧脑室宽度10~20 mm,平均(11.5±0.7)mm。男性胎儿98例、女性胎儿52例,单侧侧脑室扩张40例,双侧侧脑室扩张46例,孤立性侧脑室扩张81例,侧脑室扩张合并胎儿超声软指标30例,合并其他中枢神经系统畸形22例,合并其他畸形17例;染色体核型中,异常核型13例,aCGH阳性结果15例。因双胎妊娠胎儿姿势局限,有可能难以获取侧脑室测量的标准平面,从而造成测量误差,故将其排除。
1.2 仪器与方法 应用GE Kretz Voluson E8型彩色多普勒超声诊断仪,四维经腹部探头,频率4~8 MHz。借助van den Hof等[4]提出在标准测量平面对侧脑室进行测量。如果不能获取该平面,也可以通过在侧脑室的冠状面观察[5]。经过脉络丛球部后缘测量侧脑室外侧壁和内侧壁之间的垂直距离(图1);并采用系统性超声筛查胎儿各系统结构。
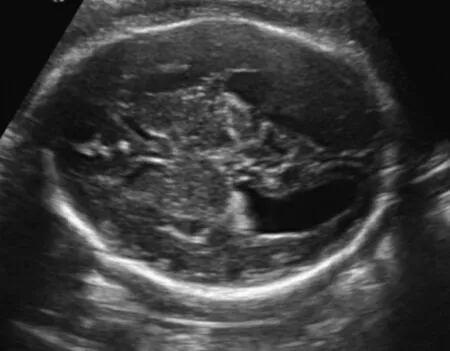
图1 女,28岁,经腹二维超声显示30周+胎儿侧脑室扩张(白色线条所示为侧脑室后角宽度测量)
1.2.1 侧脑室扩张情况分组 超声检测到胎儿一侧或双侧侧脑室≥10 mm即诊断为侧脑室扩张。根据胎儿侧脑室宽度分为轻度组(10.0~12.0 mm)、中度组(12.1~15.0 mm)和重度组(>15.0 mm)[6];根据单侧或双侧侧脑室≥10 mm分为单侧侧脑室扩张组和双侧侧脑室扩张组。对于侧脑室扩张轻度组、中度组的胎儿,每2~3周超声复查胎儿情况,记录双侧侧脑室宽度;对于重度侧脑室扩张及轻度、中度侧脑室扩张合并神经系统或其他畸形的胎儿,部分行终止妊娠术,故不纳入超声复查范畴。侧脑室经超声复查后,其宽度<10 mm定义为正常;宽度减少>0.5 mm定义为好转;其宽度变化在0.5 mm以内者定义为稳定;其宽度增加0.5 mm以上者定义为进展。
1.2.2 合并其他异常分组 根据胎儿合并其他异常情况分为孤立性侧脑室扩张组、侧脑室扩张合并胎儿超声软指标组、侧脑室扩张合并其他中枢神经系统畸形组、侧脑室扩张合并其他畸形组。各组病例分布见表1。中孕期常用于筛查胎儿超声软指标包括颈部皮肤皱褶增厚(nuchal fold thickness,NF)、心内强回声灶、肠管强回声、肾盂分离、脉络丛囊肿、单脐动脉和后颅窝池增宽。用于全面分析的胎儿超声软指标包括鼻骨缺失、短股骨、短肱骨和第5指弯曲[4]。侧脑室扩张合并其他畸形指合并除神经系统在外的其他结构异常。
1.2.3 介入性产前诊断 根据胎儿孕周选择羊膜腔或脐静脉穿刺术,抽取样本进行G显带染色体核型分析及aCGH检查。
1.3 统计学方法 采用SPSS 13.0软件。计量资料以±s表示;计数资料以n(%)表示,组间比较采用χ2检验或Fisher确切概率法,P<0.05表示差异有统计学意义。
2 结果
2.1 胎儿侧脑室扩张情况以及合并超声异常与染色体及aCGH异常的关系 各组染色体异常检出率差异有统计学意义(P<0.05)。其中胎儿超声软指标组染色体异常率显著高于单纯性侧脑室扩张组,差异有统计学意义(P<0.05),其余各组两两比较差异均无统计学意义(P>0.05)。各组aCGH异常检出率差异有统计学意义(P<0.05),其中胎儿超声软指标组染色体异常率显著高于单纯性侧脑室扩张组,差异有统计学意义(P<0.05),其余各组间两两比较差异均无统计学意义(P>0.05)。G显带与aCGH总检出率差异无统计学意义(P>0.05),各组G显带与aCGH检出率差异亦无统计学意义(P>0.05)。见表2。
在侧脑室双侧扩张组和单侧扩张组中,aCGH异常率差异无统计学意义(χ2=0.21,P>0.05);按侧脑室扩张类型进行分类,G显带与aCGH检出率差异亦无统计学意义(χ2=0.012,P>0.05)。在侧脑室轻度扩张、中度扩张组和重度扩张组,染色体异常率差异无统计学意义(P>0.05),aCGH异常率差异亦无统计学意义(P>0.05)。见表 2。

表1 胎儿侧脑室扩张以及合并其他异常分布[n(%)]
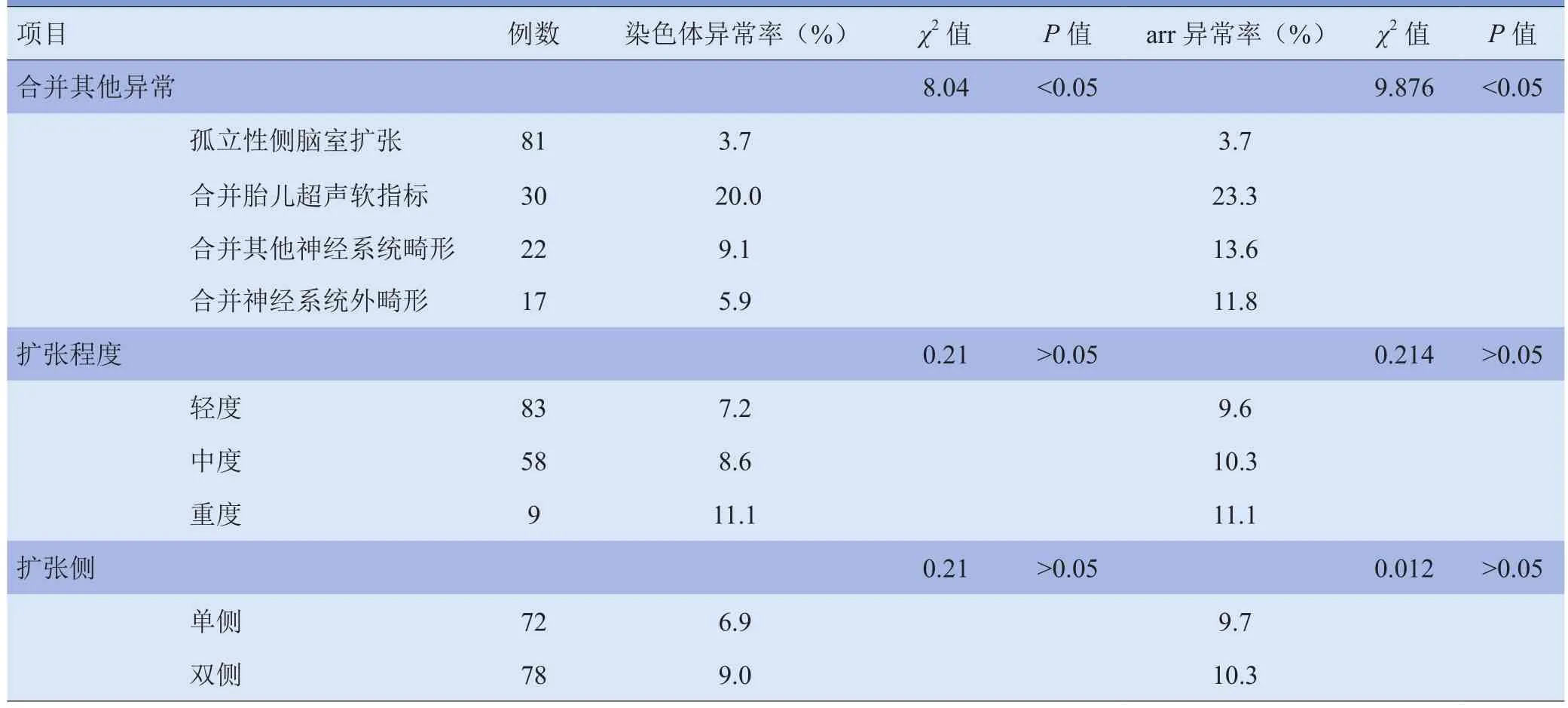
表2 染色体和aCGH异常率和胎儿侧脑室扩张程度的关系
2.2 胎儿侧脑室扩张轻度及中度组超声随访结果胎儿侧脑室扩张轻度及中度组中,侧脑室扩张随访结果情况见表3。侧脑室扩张轻度组与中度组的转归情况差异有统计学意义(χ2=10.12,P<0.01)。在侧脑室扩张转归情况中,侧脑室扩张轻度组恢复正常率(50.0%)高于侧脑室扩张中度组(17.2%);轻度及中度孤立性侧脑室扩张组与轻度及中度侧脑室扩张合并胎儿超声软指标组的转归情况差异有统计学意义(χ2=30.72,P<0.001),轻度及中度孤立性侧脑室扩张组恢复正常率(60.0%)高于轻度及中度侧脑室扩张合并胎儿超声软指标组(11.9%)。
2.3 染色体和(或)aCGH异常胎儿的超声异常情况150例胎儿侧脑室扩张病例中,15例合并染色体和(或)aCGH异常,其中超声发现其他胎儿结构异常14例。未发现病例染色体G显带正常而aCGH异常。超声发现胎儿结构异常包括胎儿超声软指标、神经、消化、循环、骨骼、泌尿等系统和胎儿附属物等异常,见表4。其中1例染色体G显带结果见图2。
3 讨论
胎儿侧脑室扩张是胎儿超声软指标之一,其宽度在整个孕程中基本恒定,范围为7.0~8.2 mm,10 mm被认为是正常上限[7]。脑脊液主要由侧脑室的脉络丛产生,脑脊液经室间孔流入第三脑室,再经中脑导水管流入第四脑室。各脑室脉络丛产生的脑脊液均汇至第四脑室,并经第四脑室的正中孔和外侧孔流入脑和脊髓的蛛网膜下腔。最后经矢状窦旁的蛛网膜颗粒将脑脊液回渗到上矢状窦,使脑脊液回流至静脉系统。
3.1 胎儿侧脑室扩张与解剖结构异常的关系 胎儿侧脑室扩张除与脑脊液的产生与吸收平衡失调关系密切以外,还与一些先天性异常相关。按照发生时间先后可分为先天性和后天获得性;按照脑脊液循环通畅与否可分为梗阻性和非梗阻性。先天性梗阻性疾病包括中枢神经系统疾病,如Dandy-Walker畸形和Arnold-Chiari II型畸形;神经元增殖障碍(巨脑回、小头畸型),移行障碍(脑裂畸形、无脑回),胼胝体发育不良,器官失调(全前脑)。后天获得非梗阻性疾病如脉络丛乳头状瘤,脑脊液生成过多;后天获得梗阻性疾病包括颅内感染性疾病,如弓形体病、巨细胞病毒;脑部肿瘤或孕妇凝血功能障碍导致胎儿颅内出血等[7]。有学者认为胎儿神经系统发育延迟与侧脑室扩张呈正相关,产前侧脑室扩张是早期大脑皮质发生改变的结构性标志[8-9]。另有学者认为血管损伤或颅内感染所产生的“碎屑”脱落至脑脊液循环系统引起阻塞[10]。本研究中,胎儿侧脑室扩张合并其他中枢神经系统异常共22例,占14.6%(22/150);合并其他畸形17例,占11.3%(17/150)。在侧脑室扩张轻、中、重度组中,合并其他神经系统异常率分别是12.0%、15.5%、33.0%,合并其他畸形率分别是9.6%、12.0%、22.0%。侧脑室扩张合并其他神经系统畸形发生率高于合并其他畸形。侧脑室扩张程度越严重,伴随其他神经系统畸形及其他畸形的发生率越高,与既往研究结果相似[5];但本研究尚未对胎儿侧脑室扩张合并具体的其他中枢神经系统异常成因做出分析。

表3 超声随访胎儿侧脑室扩张轻、中度转归情况比较[n(%)]
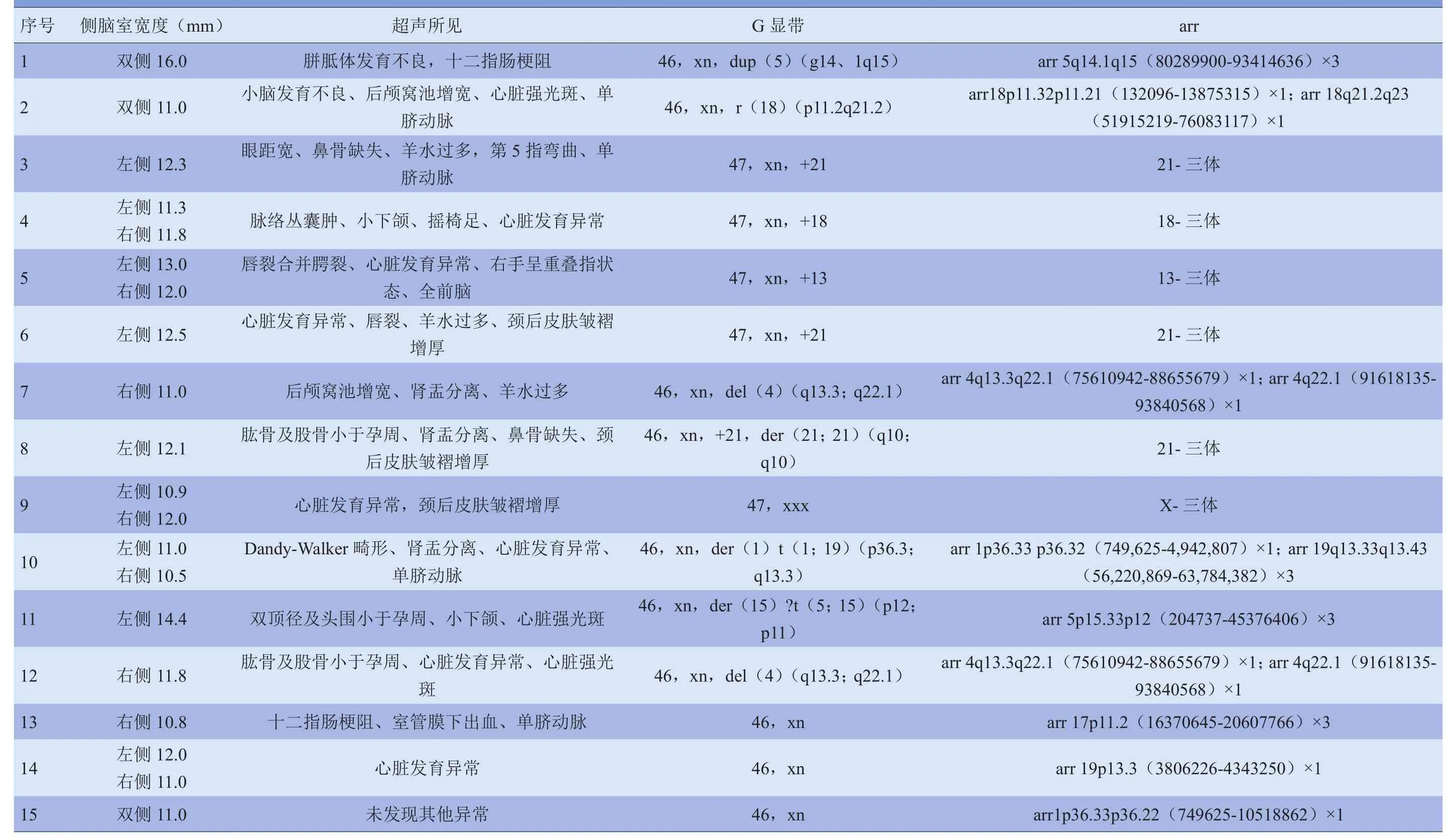
表4胎儿染色体和(或)aCGH异常的超声表现
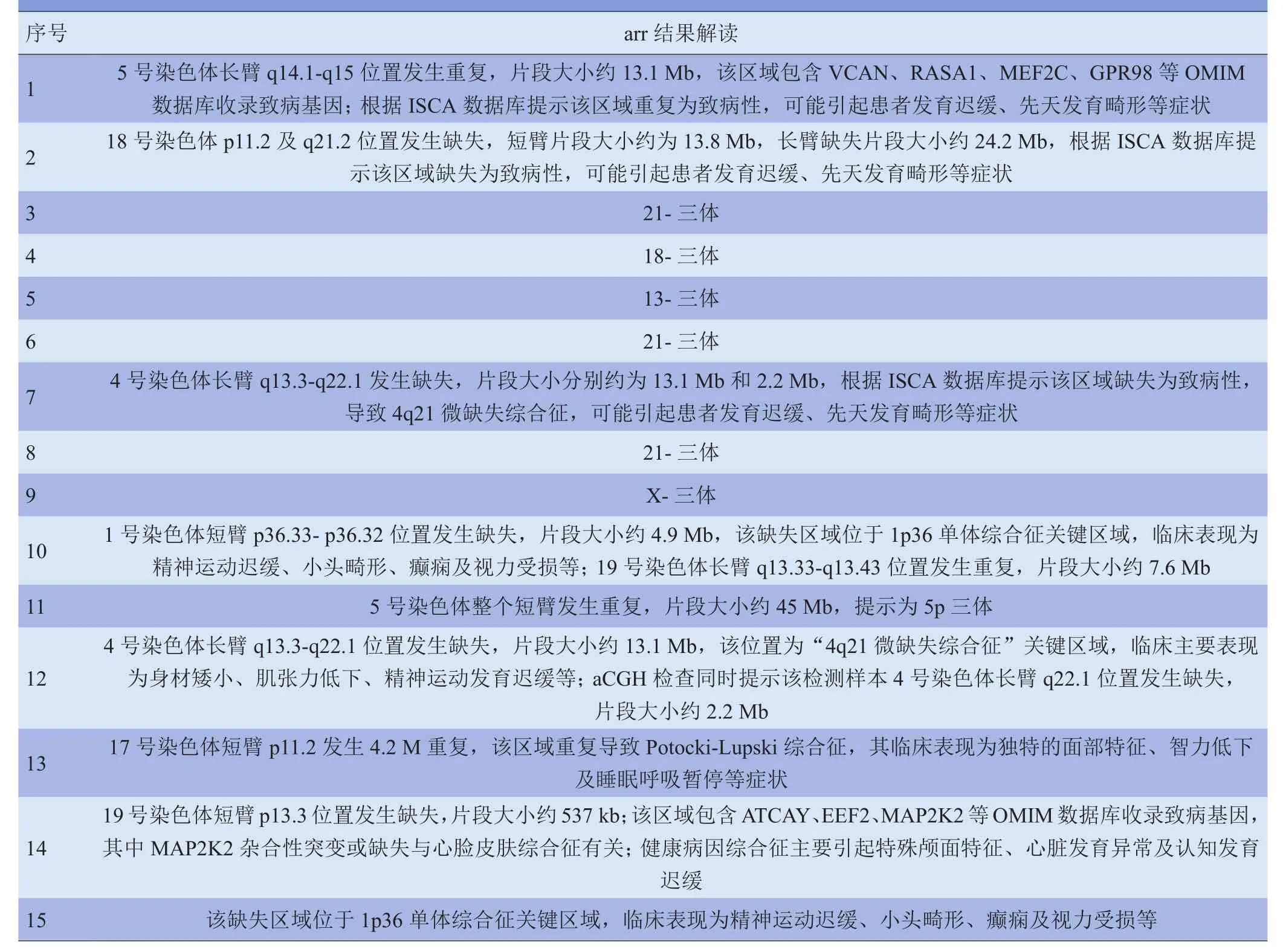
续表
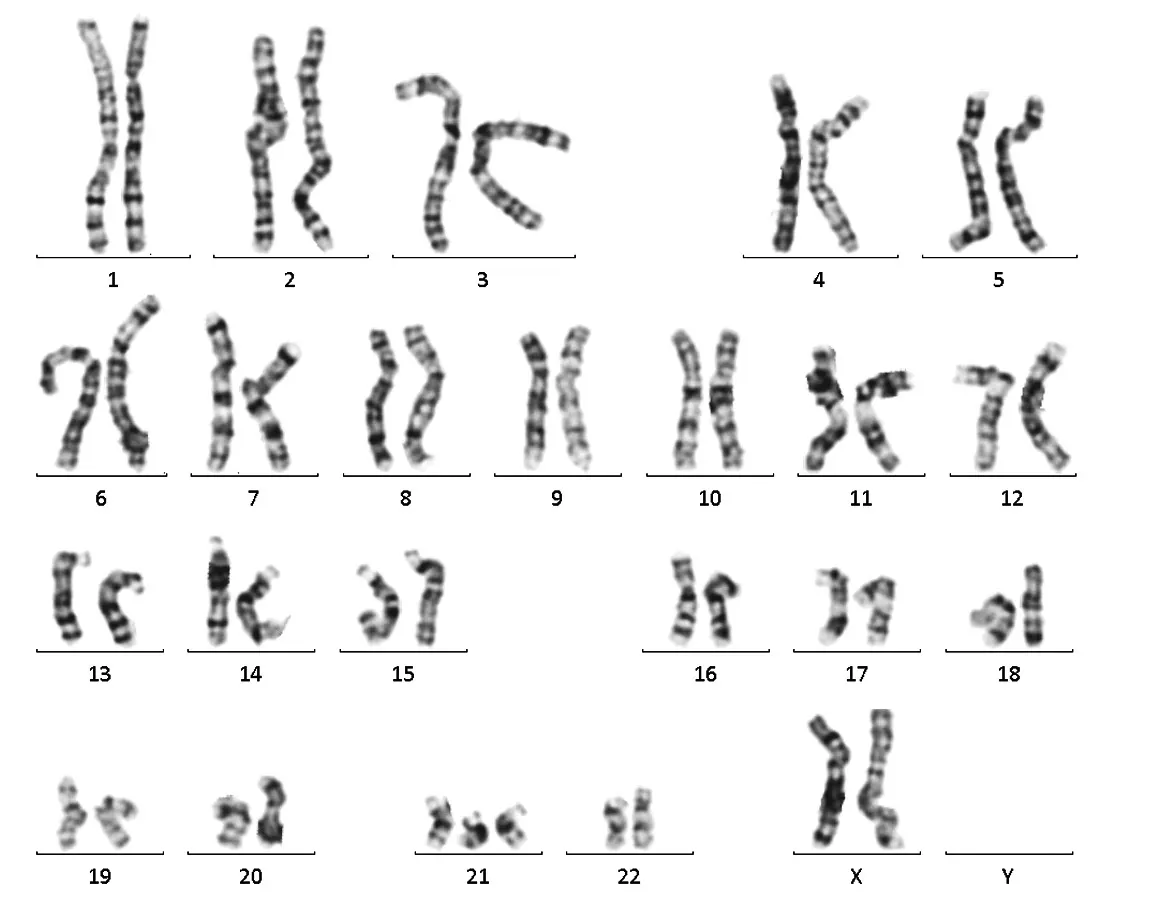
图2 胎儿染色体G显带结果为46,xn,+21
3.2 胎儿侧脑室扩张合并其他胎儿超声软指标染色体异常风险提高 胎儿超声软指标指胎儿正常结构的变异,不同于结构畸形,一般无临床意义,但是与染色体异常有一定的关联,可用于筛查胎儿染色体非整倍体[11]。单一软指标对于胎儿染色体异常检出意义不大,但出现在高龄孕妇中或同时出现多个软指标,即应高度怀疑胎儿染色体异常的可能。大多胎儿超声软指标有对应的似然比(likelihood ratio,LR)。尽管出现较低LR的胎儿超声软指标不增加染色体异常的风险,但也不能进一步降低染色体异常的风险[12]。目前公认NF和鼻骨缺失与21-三体综合征密切相关。NF和鼻骨缺失在21-三体综合征中的LR分别高达17和51[4]。本研究中3例除侧脑室中度扩张合并多发胎儿超声软指标,高度提示染色体异常的可能,产前诊断脐静脉穿刺证实为21-三体。各组染色体异常检出率差异有统计学意义,胎儿超声软指标组在各组中染色体及aCGH异常检出率最高,与文献报道接近[13]。
3.3 胎儿侧脑室扩张与染色体及aCGH异常的关系当侧脑室扩张合并结构畸形时,胎儿染色体异常的几率将大幅提高(>15%),这可能与染色体异常时中脑胶质增生、中脑导水管狭窄和隔膜有关[14]。相反,孤立性的侧脑室扩张则胎儿罹患染色体异常的几率相对较低[15]。本研究中,孤立性侧脑室扩张组发生染色体异常的几率最低(3.7%);既往文献轻度组、中度组孤立性侧脑室扩张染色体异常的几率有较大差异,故仍需警惕染色体异常的风险[16]。另有研究指出,严重的胎儿侧脑室扩张(>15 mm),其发生染色体异常的几率低于轻度组、中度组侧脑室扩张的胎儿[14]。本研究中轻度组、中度组及重度组侧脑室扩张发生染色体异常,分别占组内7.2%、8.6%、11.1%;aCGH异常分别占组内9.6%、10.3%、11.1%。即使单侧侧脑室扩张也不能忽略胎儿染色体异常的可能,重度侧脑室扩张组的染色体异常检出率高于轻度组、中度组侧脑室,不同于文献报道,可能与重度侧脑室扩张组样本量较小有关[14]。150例胎儿侧脑室扩张,检出染色体异常12例,aCGH异常13例,其中21-三体3例,18-三体1例。21-三体中超声检出以胎儿超声软指标为主,仅1例合并心脏发育异常。胎儿侧脑室扩张可增加胎儿染色体异常的风险,尤其是21-三体综合征。胎儿侧脑室作为一个在21-三体独立的胎儿超声软指标,其LR为9。本研究发现3例aCGH异常的胎儿,染色体G显带结合aCGH检查具有重要意义。
3.4 胎儿侧脑室扩张过程 轻度及中度孤立性侧脑室扩张在宫内恢复至正常的百分比为50%,高于轻度及中度侧脑室扩张合并胎儿超声软指标17.2%。孤立性轻度侧脑室扩张有“自愈”倾向,而侧脑室扩张合并胎儿超声软指标异常组的“自愈”倾向则大大减少。可见侧脑室扩张合并胎儿超声软指标提示胎儿在宫内的不良结局。轻度、中度侧脑室扩张发展为重度扩张并不常见;一旦成为重度侧脑室扩张,提示胎儿预后不良[17]。Goldstein等[17]对30例侧脑室扩张的胎儿连续超声随访,发现1/3的胎儿侧脑室扩张恢复至正常。这一现象可能与脑脊液短暂的生成过多或吸收延迟有关[18]。本研究中胎儿侧脑室扩张恢复正常范围共44例,占总例数的29.3%,接近文献报道[18]。
3.5 胎儿侧脑室扩张与性别、单/双侧关系 既往研究表明,侧脑室扩张更容易发生于男性胎儿[19]。Nadel等[20]对42例侧脑室扩张的胎儿研究发现男女比例为2∶1。本研究男女比例为1.88∶1,与既往研究大致相符。150例胎儿侧脑室扩张,双侧、单侧比例为1.24∶1,双侧较单侧侧脑室扩张常见。
产前超声易于对胎儿侧脑室进行测量。然而,对于轻度、中度胎儿侧脑室扩张,产科医师却很难在产前咨询中给予孕妇及其家属一个明确的终止妊娠提示。胎儿侧脑室扩张作为一个独立的危险因素,一旦产前超声诊断,无论单、双侧及扩张严重程度,均应告知孕妇及其家属胎儿侧脑室扩张的风险所在;且侧脑室扩张的程度越重,合并胎儿超声软指标或畸形越多,提示胎儿发生不良结局的几率越高。产科医师在排除孕妇自身因素,如感染弓形虫、巨细胞病毒和凝血功能障碍等导致胎儿侧脑室扩张外,还应建议胎儿进行染色体检查以确诊胎儿是否存在染色体异常。总之,胎儿侧脑室扩张还需要后续大样本研究以明确其发病机制、预后及最佳处理策略。
[1] Salomon LJ, Al fi revic Z, Berghella V, et al. Practice guidelines for performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol, 2011, 37(1): 116-126.
[2] Loureiro T, Ushakov F, Maiz N, et al. Lateral ventricles in fetuses with aneuploidies at 11-13 weeks' gestation. Ultrasound Obstet Gynecol, 2012, 40(3): 282-287.
[3] 傅启华, 郑昭璟. 基于染色体芯片分析的产前诊断. 中华检验医学杂志, 2013, 36(1): 6-9.
[4] Van den Hof MC, Wilson RD. Fetal Soft markers in obstetric ultrasound. J Obstet Gynaecol Can, 2005, 27(6): 592-612.
[5] Gaglioti P, Oberto M, Todros T. The significance of fetal ventriculomegaly: etiology, short-and long-term outcomes.Prenat Diagn, 2009, 29(4): 381-388.
[6] Melchiorre K, Bhide A, Gika AD, et al. Counseling in isolated mild fetal ventriculomegaly. Ultrasound Obstet Gynecol, 2009,34(2): 212-224.
[7] Cardoza JD, Goldstein RB, Filly RA. Exclusion of fetal ventriculomegaly with a single measurement: the width of the lateral ventricular atrium. Radiology, 1988, 169(3): 711-714.
[8] Weichert J, Hartge D, Krapp M, et al. Prevalence, characteristics and perinatal outcome of fetal ventriculomegaly in 29, 000 pregnancies followed at a single institution. Fetal Diagn Ther, 2010, 27(3): 142-148.
[9] 袁美贞, 严英榴, 任芸芸, 等. 产前超声诊断胎儿侧脑室增宽及合并畸形. 中国医学影像技术, 2011, 27(10): 2095-2097.
[10] Lategan B, Chodirker BN, Del Bigio MR. Fetal hydrocephalus caused by cryptic intraventricular hemorrhage. Brain Pathol,2010, 20(2): 391-398.
[11] Peter W. Callen. 妇产科超声学. 常才, 戴晴, 谢晓燕, 译.北京: 人民卫生出版社, 2010: 59.
[12] 商梅娇, 周祎, 鲁云涯, 等. 122例胎儿肾盂扩张与染色体非整倍体的关联性分析. 中山大学学报:医学科学版,2013, 34(1): 99-103.
[13] Gezer C, Ekin A, Ozeren M, et al. Chromosome abnormality incidence in fetuses with cerebral ventriculomegaly. J Obstet Gynaecol, 2014, 34(5): 387-391.
[14] Gaglioti P, Danelon D, Bontempo S, et al. Fetal cerebral ventriculomegaly: outcome in 176 cases. Ultrasound Obstet Gynecol, 2005, 25(4): 372-377.
[15] Mercier A, Eurin D, Mercier PY, et al. Isolated mild fetal cerebral ventriculomegaly: a retrospective analysis of 26 cases.Prenat Diagn, 2001, 21(7): 589-595.
[16] Graham E, Duhl A, Ural S, et al. The degree of antenatal ventriculomegaly is related to pediatric neurological morbidity.J Matern Fetal Med, 2001, 10(4): 258-263.
[17] Goldstein I, Copel JA, Makhoul IR. Mild cerebral ventriculomegaly in fetuses: characteristics and outcome. Fetal Diagn Ther, 2005, 20(4): 281-284.
[18] Hidaka N, Ishii K, Kanazawa R, et al. Perinatal characteristics of fetuses with borderline ventriculomegaly detected by routine ultrasonographic screening of low-risk populations. J Obstet Gynaecol Res, 2014, 40(4): 1030-1036.
[19] Vestergaard EM, Christensen R, Petersen OB, et al. Prenatal diagnosis: array comparative genomic hybridization in fetuses with abnormal sonographic findings. Acta Obstet Gynecol Scand, 2013, 92(7): 762-768.
[20] Nadel AS, Benacerraf BR. Lateral ventricular atrium: larger in male than female fetuses. Int J Gynaecol Obstet, 1995, 51(2): 123-126.
(本文编辑 闻 浩)
Fetal Lateral Ventricular Dilatation Complicated with Malformation Diagnosed by Ultrasound and Its Relationship with Chromosome Abnormalities
PurposeTo investigate the relationship between fetal lateral ventricle dilatation complicated with malformation and chromosome abnormalities, so as to provide reference for clinical consultation.Materials and MethodsThe ultrasound images,karyotype analysis and high resolution microarray comparative genomic hybridization(aCGH) results of 150 fetuses with lateral ventricular dilatation diagnosed by ultrasound were analyzed retrospectively.ResultsAmong 150 lateral ventricular dilatation fetuses,81 cases were isolated lateral ventricle dilatation, 30 cases were found complicated with fetal ultrasound soft index, 22 cases with other CNS malformations and 17 cases with other malformations. Karyotype analysis of the above 4 groups showed 13 cases of abnormal karyotypes and 15 cases of aCGH abnormalities. There was statistical signi fi cant difference(P<0.05) in each group of abnormal chromosome and aCGH detection rate, in which the softer marker's group had a signi fi cantly higher rate than the isolated ventriculomegaly's group in abnormal chromosome and aCGH (P<0.05). There was no statistical signi fi cant difference in any other groups (P>0.05).ConclusionFetal systems should be carefully examined when prenatal ultrasound reveals lateral ventricular dilatation. The probability of abnormal chromosome increases signi fi cantly when complicated with fetal ultrasound soft index or other structural abnormalities. Chromosomal abnormalities need to be excluded and regular ultrasound follow-up is necessary in fetuses with isolated lateral ventricles.
Lateral ventricles; Dilatation, pathologic; Ultrasonography, prenatal;Chromosome aberrations; Microarray analysis; Nucleic acid hybridization; Fetus
广东省妇幼保健院超声诊断科 广东广州510010
黄冬平
Department of Ultrasound, Guangdong Women and Children's Hospital, Guangzhou 510010,China
Address Correspondence to:HUANG Dongping
E-mail: hdpaaa@126.com
广东省科技厅计划项目(2016ZC0187)。
R445.1;R715
2016-12-31
2017-03-21
中国医学影像学杂志
2017年 第25卷 第8期:617-622,624
Chinese Journal of Medical Imaging 2017 Volume 25 (8): 617-622, 624
10.3969/j.issn.1005-5185.2017.08.015
