广山药总DNA提取方法的比较
2017-09-08高慧新包道健
高慧新 包道健 田 慧
广西中医药大学,广西 南宁 530200
广山药总DNA提取方法的比较
高慧新 包道健 田 慧*
广西中医药大学,广西 南宁 530200
目的:建立一种稳定高效获得广山药总DNA基因组的提取方法,为同科属及同类植物总DNA提取提供参考依据,便于应用分子生物学进行鉴定。方法:通过采用试剂盒法、改良CTAB法和SDS法对广山药的新鲜叶子、新鲜块茎、干燥块茎和新鲜嫩茎进行DNA提取,在进行琼脂糖凝胶电泳和紫外分光光度法进行纯度检测。结果:3种方法均可以从不同的提取部位中提取到基因组DNA,但通过天根新型植物DNA提取试剂盒提取到的DNA纯度最高,CTAB法次之,SDS法最差。结论:利用市售总DNA提取试剂盒提取DNA,方法简便高效,所提DNA效果好。
广山药;DNA提取;试剂盒;CTAB;SDS
广山药来源于薯蓣科薯蓣属植物褐苞薯蓣DioscoreapersimilisPrain et Burkill[1],又名广西淮山,野生于海拔100~1950m的山坡、路旁、山谷杂木或灌丛中。我国南方各地也均有栽培,主产于广西桂平、玉林、灵山、陆川、平南等[2]。褐苞薯蓣以根茎入药,中医用其补脾养胃、生津益肺、补肾涩精;壮医用其“调谷道”气道水道,补肺肾[1]。褐苞薯蓣在广西、福建、海南等地被作为药用与食用的山药习用品由来已久[3]。褐苞薯蓣是重要的药用植物资源,近年来,其以产量大、适应力强等优点,占据了药材和食品市场的重要部分,充分说明了对其研究的必要性。
DNA分子标记技术是近年来应用在中草药研究中的新技术,为中草药基因图谱建立、遗传多样性评估、分子标记辅助育种等研究提供了有价值的工具[4]。DNA提取是开展中药材DNA分子标记研究的首要环节,实验运用新型试剂盒法、CTAB法、SDS法,旨在避免大量的溶剂制备、方法和操作步骤的精简及提高DNA质量,寻找一种能够得到相对高产量、高纯度的褐苞薯蓣总DNA的方法,对类似形态植物DNA 提取具有十分重要的意义,为后续褐苞薯蓣分子生物学研究奠定基础。
1 仪器与材料
1.1 材料 广山药的新鲜叶子、新鲜根茎、新鲜嫩茎均采自广西中医药大学仙葫校区,切取部分新鲜块茎55℃烘干获得干燥根茎。所采实验材料经广西中医药大学药用植物教研室梁子宁副教授鉴定为薯蓣科薯蓣属植物褐苞薯蓣Dioscorea persimilis Prain et Burkill。
1.2 试剂 新型植物总DNA提取试剂盒(天根生化科技(北京)有限公司,生产批号:Q5118),CTAB(生产批号:0504A16),10%SDS(索莱宝,生产批号:20170328),琼脂糖(西班牙,生产批号:111860),GelRed核酸染料(美国,生产批号:15G0611),Marker D2000(天根生化科技(北京)有限公司,生产批号:Q5317),6×DNA loading buffer(索莱宝,生产批号:20160310), 其他所用试剂均为国产分析纯。
1.3 仪器 Eppendorf移液枪(德国);电热鼓风干燥箱(上海恒一);HWS-24电热恒温水浴锅(上海齐欣);BSA224S电子天平(北京赛多利斯);XW-80A旋涡混合器(上海沪西);UV-1780紫外分光光度计(日本岛津);BIO-RAD电泳仪;BIO-RAD(Gel Doc XR+)凝胶成像系统。
2 方法
2.1 总DNA的提取
2.1.1 新型试剂盒法 按照试剂盒的操作步骤对各个部位进行总DNA的提取。
2.1.2 CTAB法 参照文献[5-6]方法并进行改良,具体操作步骤为:①取实验材料适量,除去表面污染,加液氮快速研磨至粉末状;②将适量粉末转移至65℃水浴预热好的盛有800μLCTAB和12μLβ-巯基乙醇混合液的离心管中,旋涡混匀;③继续在65℃水浴1.5h(期间颠倒混匀数次);④从水浴中取出离心管,静置冷却至室温,加入等体积的苯酚和氯仿,漩涡混匀,静置5min,12000r/min离心15min;⑤吸取上清液转移至新的离心管中,加入等体积的氯仿:异戊醇(24∶1),漩涡混匀,静置5min, 12000r/min离心15min;⑥重复操作⑤;⑦取上清液转移至新的离心管,加入等体积预冷的异丙醇,-20℃放置1h;⑧10000r/mim离心15min,弃上清液;⑨用75%的乙醇洗涤沉淀2次,10000r/min离心5min,弃乙醇;⑩将沉淀在室温环境下晾干(应避免污染),向离心管中加入200μL TE或ddH2O定容,-20℃保存备用。2.1.3 SDS法 参照文献[7-8]并做适当调整,具体操作步骤如下:①取实验材料适量,除去表面污染,加液氮快速研磨至粉末状;②取适量粉末至65℃预热好的盛有600μL CTAB提取缓冲液[100mMTris-HC1(pH8.0)50mM EDTA,0.5MNaC1,2%(w/v)PVP,用前加β-巯基乙醇至终浓度为2%]和1000μL 10%SDS的混合液中,旋涡混匀,继续65℃水浴30min(期间颠倒混匀2~3次);③将离心管从水浴中取出,静置冷却至室温,12000r/min离心15min,将上清液转移至另一新的离心管中;④向离心管中加入等体积的苯酚和氯仿,旋涡混匀,静置5min,12000r/min离心15min,取上清液至新的离心管中;⑤向离心管中加入等体积的苯酚和氯仿∶异戊醇(24∶1),旋涡混匀,静置5min,12000r/min离心15min,转移上清液至新的离心管中;⑥加入等体积的异丙醇,上下颠倒使其混匀,静置待絮状沉淀出现;⑦12000r/min离心5min,弃去上清液,用75%乙醇洗涤沉淀2次,10000r/min离心5min;⑧将沉淀置室温晾干(应注意避免污染),加入200μL TE或ddH2O溶解沉淀,置-20℃保存备用。
2.2 总DNA纯度的检测2.2.1 琼脂糖凝胶电泳检测 取所提取的DNA 7μL与适量6×DNA loading buffer混合,点样于浓度为1%的琼脂糖凝胶中,100V电压下电泳30min,用凝胶成像系统观察并记录图像。
2.2.2 紫外分光光度法检测 将提取得到的模板DNA做20倍稀释(模板DNA50μL稀释至1mL)后,用UV1780紫外分光光度计分别测定其在260 nm和280nm处的吸光度A260和A280,以A260/A280的比值检测其纯度和浓度。
3 结果
3.1 DNA琼脂糖凝胶电泳图谱 新鲜叶子和嫩茎的DNA条带均比较明亮,新鲜根茎和干燥根茎的条带不明显。新型试剂盒法所提DNA没有拖尾现象,不存在杂质。CTAB法和SDS法所提DNA条带均存在严重拖尾现象,说明DNA发生了降解,这可能与两种方法提取时间过长有关;从图中结果可以很明显看出,CTAB法和SDS法存在蛋白质和RNA杂质,SDS法杂质较CTAB法多。见图1。

3.2 紫外分光光度法检测 新型试剂盒法所提DNA的A260/A280的值均在1.8-2.0之间,说明DNA比较纯;CTAB和SDS法所提DNA的A260/A280的值,有的大于2.0,有的小于1.8,说明DNA中有RNA和蛋白质残留,这与凝胶电泳的结果是一致的。从浓度相比,新型试剂盒法的浓度最高,CTAB和SDS法浓度偏低。见表1。
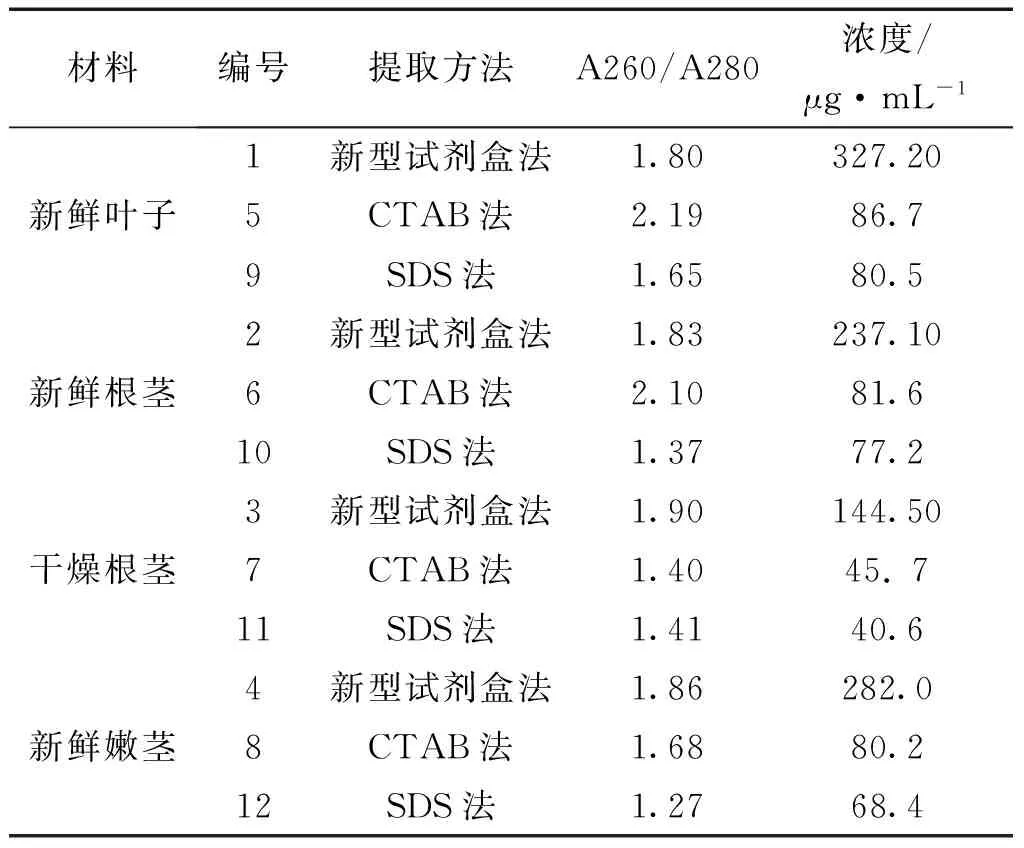
表1 3种方法提取DNA检测结果
4 讨论
植物药材除了具有细胞壁外,还存在大量的多糖、脂质、色素和酚类等物质,因此在植物DNA的提取和纯化时,解聚核蛋白、去除蛋白质、酚类和多糖等物质是很重要的一步,故用不同的方法提取植物DNA效果是不一样的。实验中使用的CTAB法和SDS法都是比较传统的提取DNA的方法,CTAB和SDS都是去污剂,都是通过裂解植物细胞,将蛋白质沉淀于有机试剂中,而核酸溶解于水相,再利用有机试剂多次抽提,从而达到去除蛋白质、多糖等物质,得到较纯DNA的目的。新型试剂盒法是分子生物学发展的必然产物,试剂盒中的吸附柱有特殊的吸附膜,可以吸附DNA,经简单的洗涤去除杂质就可获得相对高纯度的DNA。三种方法相比较,新型试剂盒法获得的DNA纯度和浓度高,实验操作简便,提取时间短,避免了有机试剂的配置,降低了有机试剂对实验人员的安全隐患,符合高效稳定获取广山药DNA的要求。
查阅文献[9-11]可知,广山药中富含淀粉、蛋白质、氨基酸、多糖及矿物质等生物活性物质,是其营养价值和生物活性的物质基础。从实验结果中可知,CTAB法和SDS法提取的DNA中,都存在RNA和蛋白质等杂质的残留,这可能与离心速率、试剂配置等有关,可以进一步优化实验方案,如加入Rnase酶、增加抽提次数等。
根据不同方法对广山药总DNA提取的检测结果,比较得出相对适合广山药总DNA提取的方法,便于利用分子标记方法对广山药进行鉴定。采用新型植物DNA提取试剂盒法提取的DNA纯度和浓度都比其他两种方法好。但在提取时也应注意:在漂洗吸附柱时,加入漂洗液后可静置1 min 后再进行离心,这样可以提高DNA的质量;实验中必须要保证吸附材料是彻底晾干的,这样可以避免漂洗液中的乙醇影响后续的反应(如PCR等)。
[1]广西壮族自治区食品药品监督管理局.广西壮族自治区壮药质量标准(第一卷)[M].南宁:广西科技出版社,2008:43.
[2]邓家刚,韦松基.广西道地药材[M].北京:中国中医药出版社,2007:15.
[3]高慧新,周敏,田慧,等.广山药的现代研究概况[J].解放军药学学报,2017,33 (1):72-74.
[4]任梦云,陈彦君,张盾,等.ISSR标记技术在药用植物资源中的研究进展及应用[J].生物技术通报,2017,10(4):63-69.
[5]张馨元,赵超越,侯和胜,等.四种中药材DNA提取方法的比较[J].中国生化药物杂志,2015,35(7):17-21.
[6]于静,盛萍,张帆,等.市售鹿茸片基因组DNA提取方法的比较[J].时珍国医国药,2016,27(4):880-882.
[7] 王淼,谭莹,张丽华.中药材贝母DNA不同提取方法的比较[J].北华大学学报(自然科学版),2011,12(6):662-665.
[8]杜向红,杜云锋,李喜凤.中药蒲公英基因组总DNA提取方法研究[J].中华实用诊断与治疗杂志,2012,26(1):15-17.
[9]宋君柳.山药品种资源及化学成分研究进展[J].长江蔬菜,2009(6):1-5.
[10]李艳英,甘秀芹,韦本辉,等.64份淮山种质资源品质性状分析[J].植物遗传资源学报,2016,17(2):246-251.
[11]陈杰桃,黄万坚,穆青.三种山药药理活性成分及其矿物元素分析[J].食品工业科技,2017,38(7):352-355.
Comparison of Total DNA Extraction Methods ofDioscoreapersimilisPrain et Burkill
GAO Huixin BAO Daojian TIAN Hui*
Guangxi University of Chinese Traditional Medicine, Nanning 530200,China
Objective To establish a stable and efficient method for the extraction of total DNA genome ofDioscoreapersimilisPrain et Burkill,and to lay the foundation for the extraction of total DNA of similar Chinese medicine, which is convenient for the identification of molecular biology. Methods DNA was extracted from fresh leaves, fresh tubers, dried tubers and fresh stems by using the Kit, modified CTAB method and SDS method, and subjected to agarose gel electrophoresis and ultraviolet spectrophotometry for purity detection. Results Three kinds of methods could extract genomic DNA from different extraction sites, but the DNA purity was the highest by the DNAsecure Plant Kit of TIANGEN,CTAB method followed, SDS method is the worst. Conclusion The method of extracting DNA from the DNAsecure Plant Kit is simple and efficient, and the effect of DNA is good.
Rhizoma Dioscorea;DNA Extraction; Kit; CTAB; SDS
广西中医药大学2015年度中药学优势学科建设课题(ZYX2015001);壮瑶药协同创新中心(桂教科研[2013]20号);广西壮瑶药重点实验室(桂科基字[2014]32号);广西重点学科壮药学(桂教科研[2013]16号);广西八桂学者中药创新理论与药效研究(J13162)。
高慧新(1993-),女,硕士研究生在读,研究方向为中药品种鉴定与质量评价。E-mail:2456658048@qq.com
田慧(1973-),女,硕士研究生,教授,硕士研究生导师,研究方向为中药品种鉴定与质量评价。E-mail:377244732@qq.com
R284.2
A
1007-8517(2017)16-0027-03
2017-06-14 编辑:程鹏飞)
