柠檬酸-沼气双发酵耦联系统中钠离子影响机制的探究及其去除
2017-09-03鲍家伟徐健苏先峰张宏建毛忠贵
鲍家伟,徐健,苏先峰,张宏建,毛忠贵
(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122)
柠檬酸-沼气双发酵耦联系统中钠离子影响机制的探究及其去除
鲍家伟,徐健,苏先峰,张宏建,毛忠贵
(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122)
为解决柠檬酸发酵过程中产生的废水问题,提出了柠檬酸-沼气双发酵耦联系统。在该系统中,柠檬酸发酵废水经中温厌氧消化和水资源化处理后作为配料水回用于下一批次柠檬酸发酵,从而实现废水零排放。厌氧消化出水中的主要抑制物质是Na+,在回用过程中其质量浓度最高达到1 000 mg/L,会严重抑制柠檬酸发酵。采用电渗析法对厌氧消化出水中的高浓度Na+进行去除,循环回用10批后,平均柠檬酸产量为142.4±2.1 g/L,达到去离子水发酵水平(141.5 g/L)。1 000 mg/L Na+会造成柠檬酸发酵前期培养基pH快速下降,黑曲霉细胞分泌的糖化酶和异麦芽糖酶活力降低,部分糊精和异麦芽糖不能有效水解,柠檬酸产量显著下降。在柠檬酸发酵开始时添加18 g/L CaCO3可以延缓发酵初期培养基pH的下降速率,促进部分糊精和异麦芽糖的水解,从而使可利用糖浓度增加,减轻高浓度 Na+对柠檬酸发酵的抑制作用。但是,CaCO3会造成发酵前期培养基pH较高,副产物草酸大量积累,柠檬酸产量为139.2 g/L,仍低于去离子水发酵水平。
柠檬酸;厌氧消化;碳酸钙;Na+;异麦芽糖酶;糖化酶
柠檬酸(2-羟基丙烷-1,2,3-三羧酸)是一种重要的有机酸,主要用于食品、医药和化学工业,并且在石油、建筑、陶瓷、铸造和纺织等工业领域中也有很广泛的应用[1-2]。目前,柠檬酸主要是以木薯和玉米淀粉为原料,黑曲霉为生产菌株进行液态深层发酵生产的[3-4]。在该生产模式下,会产生大量的发酵性废水。这些废水具有高化学需氧量(15 000~20 000 mg/L)和低pH值(4.5~4.8)等特点,不经过处理直接排放会对环境造成严重的危害[5-6]。现今,柠檬酸废水主要通过“厌氧-好氧”这一工艺进行处理,达到二级排放标准后排入附近水体[7]。厌氧消化单元在高浓度有机废水处理方面具有高效率、低能耗等优点,产生的沼气和厌氧污泥具有一定的经济效益[8];但好氧消化单元存在着设备占地广,投资及运行费用高等问题,是一个高能耗、纯投入的过程。随着国家工业废水排放标准的日益严格,如何高效处理柠檬酸废水成为制约当前柠檬酸行业健康发展的瓶颈[9]。
为解决上述问题,本实验室提出了“柠檬酸-沼气双发酵耦联系统”,如图1所示。黑曲霉以木薯和玉米淀粉为原料生产柠檬酸,经提取后发酵液中不能被黑曲霉利用的纤维素、果胶等物质以及黑曲霉本身的代谢副产物则通过中温厌氧消化转化成沼气;所得沼气经脱硫处理后通过热电联产技术转变为电和热;厌氧消化出水经过水资源化处理后,作为配料水回用到下一批次柠檬酸发酵过程中,从而解决柠檬酸废水排放问题并节约水资源[10]。
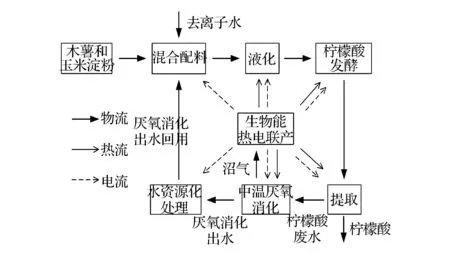
图1 柠檬酸-沼气双发酵耦联工艺流程图Fig.1 Flow chart of the integrated citric acid-methane fermentation process
厌氧消化出水中的主要抑制物质是Na+,在回用过程中其浓度最高可达到1 000 mg/L,会严重抑制柠檬酸发酵[11]。当培养基中添加的Na+浓度超过200 mg/L时,黑曲霉细胞分泌的异麦芽糖酶和糖化酶的活力开始受到抑制,残总糖浓度升高,柠檬酸产量显著下降[12]。本文采用电渗析法去除厌氧消化出水中的Na+,并对耦联系统的可行性进行验证。同时,考察了培养基中1 000 mg/L Na+对柠檬酸发酵的影响机理,并通过添加碳酸钙以消除高浓度Na+对柠檬酸发酵的抑制作用。
1 材料与方法
1.1材料
1.1.1 菌株与培养基
菌种:黑曲霉(Aspergillusniger)MZ-11,由本实验室保藏。
土豆葡萄糖琼脂(PDA)培养基(g/L):土豆200,葡萄糖20,MgSO41.5,KH2PO43,琼脂20,pH调至6.0,115 ℃条件下灭菌20 min。用于黑曲霉菌株的培养和保藏。
1.1.2 试剂
木薯:河南天冠企业集团有限公司提供;玉米:市售玉米粉;(NH4)2SO4、CaCO3、NaOH、Na2SO4:分析纯,国药集团化学试剂有限公司;液体耐高温α-淀粉酶(酶活力20 000 U/mL,最适温度为95~105 ℃,pH 5.5~6.0):无锡杰能科生物工程有限公司。
1.1.3 仪器与设备
5 L自控发酵罐(LiFlus GX),韩国生物反应器有限公司;SBA-40B型葡萄糖生物传感器,山东省科学院生物研究所;电渗析仪,上海大名教育仪器有限公司;组合摇床(HYL-C),太仓强乐实验设备有限公司;高效液相色谱仪(Ulti Mate 3000),美国Dionex公司;分析柱为美国Bio-Rad公司HPX-87 H型离子交换柱;示差折光检测器(RI-101),日本Shodex公司。
1.2实验方法
1.2.1 种子培养
种子培养基:将木薯粉碎并过40目筛,得到木薯粉(淀粉含量为68%~73%,直径约0.43 mm),按料水质量比1∶3.6加入去离子水混匀,用体积分数为30%的H2SO4或2 mol/L NaOH溶液调pH至6.0,加入10 U/g液化酶,沸水浴条件下保温2 h,液化结束冷却后用去离子水补充液化过程中蒸发的水分,pH调至5.5,加入质量浓度为1 g/L的(NH4)2SO4颗粒作为黑曲霉孢子萌发所需的氮源,按70 mL/L装液量分装至1 L锥形瓶中[13]。115 ℃,灭菌20 min。
种子培养方法:将黑曲霉孢子用无菌水洗下,制成浓度为6.0×106个/mL的孢子悬液,混匀后取10 mL孢子悬液接入含有70 mL无菌培养基的1 L锥形瓶中。(36±1)℃,200 r/min条件下,培养21 h。
1.2.2 柠檬酸发酵
发酵培养基:过40目筛的木薯粉和玉米粉(淀粉含量为65%~72%,直径约0.42 mm)按质量比4∶1混合,并按料水质量比1∶4.5加入工艺用水进行配料,液化操作同种子培养基,pH调至5.5,控制总糖浓度在160 g/L。摇瓶发酵按34 mL装液量分装至500 mL锥形瓶中,115 ℃,灭菌20 min。按体积比为15%的接种量接种,发酵条件为(37.5±1)℃、260 r/min,培养92 h。所有摇瓶实验重复3次。
5 L自控发酵罐发酵装液量为2 550 mL,添加适量的消泡剂,115 ℃,灭菌20 min。种子液按体积比为15%的接种量接种,循环水浴恒温装置保持72 h发酵过程,(37.5±1)℃,600 r/min,通气量为2 L/min。每隔4 h取样测定相关参数。
柠檬酸发酵前期pH的调控:在柠檬酸发酵初期(4~24 h)采用蠕动泵匀速自动流加,流速7.5 mL/h,流加的NaOH或H2SO4溶液浓度为2 mol/L,流加总体积为150 mL。在发酵初期将发酵培养基的初总糖浓度提高到170 g/L,以保证流加结束时初总糖浓度与不流加时的总糖浓度(160 g/L)一致。
1.2.3 中温厌氧消化处理条件
实验过程是在5 L上流式厌氧污泥床反应器中进行的,反应器温度控制在(35±1)℃,污泥接种量的体积比为30%,平均COD去除率达到(92.4±2.0)%,平均有机容积负荷和水力停留时间分别为(2.2±0.2) kg/(m3·d)和(8.7±0.9) d。
1.2.4 电渗析处理厌氧消化出水条件
厌氧消化出水在室温常压下进行电渗析处理。厌氧消化出水通过进料泵进入电渗析系统,将产生的浓水与进料水混合,以保证淡水的回收率;淡水则收集检测后回用到柠檬酸发酵。电渗析设备运行条件:电压15 V,进料水流速50 mL/min;每隔5 min记录1次系统电流,每隔10 min检测淡水的电导率和体积;淡水的回收率达到进料水的95%作为实验的终点,电渗析系统淡水的Na+浓度根据溶液的电导率获得[14]。
1.3分析方法
总糖测定:样品用质量分数为4%的HCl于沸水浴中水解2 h,冷却并调pH后通过SBA-40B型葡萄糖生物传感器测定[15]。
柠檬酸、葡萄糖和异麦芽糖含量测定:利用高效液相色谱仪进行检测,操作条件为:流动相5 mmol/L H2SO4,流速0.6 mL/min,进样量20 μL,柱温60 ℃。
异麦芽糖酶活力测定[16]:酶活定义为50 ℃,pH为4.5条件下每分钟消耗1 mg异麦芽糖所需的酶量为1个酶活单位,表示为U/mL。
糖化酶活力测定[17]:酶活定义为50 ℃,pH为4.5条件下每分钟生成1 μg葡萄糖所需的酶量为1个酶活单位,表示为U/mL。
2 结果与讨论
2.15L发酵罐循环过程中柠檬酸发酵参数变化
厌氧消化出水在回用过程中会严重抑制柠檬酸发酵,Na+是其中主要的抑制物质。将去离子水作为配料水进行第1批次的柠檬酸发酵,并作为空白对照组。产生的柠檬酸发酵废水经过中温厌氧消化系统和电渗析法处理后作为配料水回用。5 L发酵罐中循环实验一共进行了10批,发酵参数如图2所示。
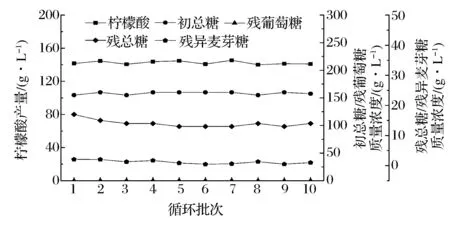
图2 循环过程中柠檬酸发酵参数变化Fig.2 Changes of citric acid fermentation parameters in different recycling batches
循环过程中(2~10批),平均柠檬酸产量为142.4±2.1 g/L,达到去离子水发酵水平(141.5 g/L)。同时,发酵结束时培养基中的葡萄糖基本被消耗完全,平均残总糖和残异麦芽糖质量浓度分别为13.7±0.7 g/L和1.1±0.5 g/L,都低于去离子水发酵水平(分别为17.0 g/L和2.1 g/L)。这表明,采用电渗析方法可以有效去除厌氧消化出水中的高浓度Na+,柠檬酸发酵达到空白对照水平。厌氧消化出水成分较复杂,其中含有色素以及钙镁离子等物质,这些物质会吸附或沉淀在电渗析膜表面,造成膜污染,导致处理效果下降[6]。之前的研究中钙镁离子可通过空气吹脱预处理得以去除,但空气吹脱处理成本较高[18];此外,采用电渗析法操作复杂同时产生大量二次废水,不适合大规模工业化应用。因此,需要寻找成本较低、操作简单的方法,消除厌氧消化出水中的高浓度Na+对柠檬酸发酵的抑制作用。
2.2Na+对柠檬酸发酵过程中培养基pH的影响
1 000 mg/L Na+对柠檬酸发酵过程中培养基pH的影响如图3所示。去离子水为配料水进行柠檬酸发酵时,培养基pH在发酵前24 h快速下降至3.0以下,之后缓慢下降至发酵结束。当培养基中含有1 000 mg/L Na+时,培养基pH在发酵过程中前24 h同样快速下降,但下降速率比去离子水发酵更快,pH最大差值达到0.5。

图3 Na+对柠檬酸发酵过程中培养基pH的影响Fig. 3 Effect of Na+ on medium pH in citric acid fermentation
2.2.1 不同pH对异麦芽糖酶和糖化酶活力的影响
考察了不同pH对柠檬酸发酵过程中黑曲霉细胞分泌的异麦芽糖酶和糖化酶活力的影响,结果如表1所示。
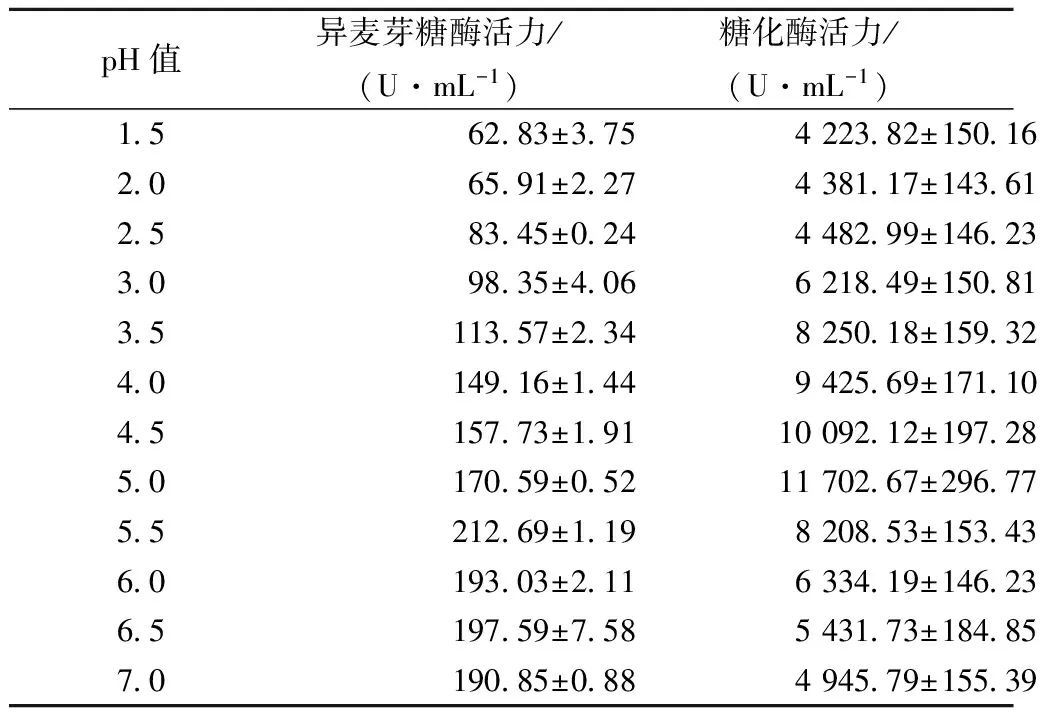
表1 pH对黑曲霉细胞分泌的异麦芽糖酶和糖化酶活力的影响
异麦芽糖酶和糖化酶的最适pH值分别为5.5和5.0,此时其活力达到最高,分别为212.69 U/mL和11 702.67 U/mL。随着pH逐渐下降,异麦芽糖酶和糖化酶的活力显著降低。结合图3和表1可知,可能是高浓度Na+的加入导致培养基pH快速下降,造成柠檬酸发酵过程中糖化酶和异麦芽糖酶活力受到抑制,部分糊精和异麦芽糖不能有效水解,从而柠檬酸产量下降。
2.2.2 流加硫酸溶液对柠檬酸发酵的影响
为验证上述推论,在去离子水发酵初期(4~24 h)流加2 mol/L H2SO4溶液,结果如图4所示。在去离子水发酵过程中,培养基pH在前24 h快速下降至3.0以下,之后下降速率变缓。流加2 mol/L H2SO4溶液,培养基pH同样快速下降,且下降趋势较空白对照的快,柠檬酸产量为117.3 g/L,较空白对照(141.5 g/L)低(图4 A和D)。同时,发酵结束时残总糖和残异麦芽糖质量浓度分别为35 g/L和13.3 g/L,与培养基中含有1 000 mg/L Na+时的发酵情况基本相同(图4 B和C)。综上所述,柠檬酸发酵过程中培养基pH下降过快,确实会导致糊精和异麦芽糖的水解受到抑制,柠檬酸产量大幅度下降。
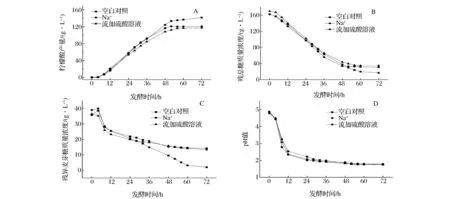
A- 柠檬酸产量;B - 残总糖质量浓度;C - 残异麦芽糖质量浓度;D - 残葡萄糖质量浓度图4 在去离子水发酵初期流加硫酸溶液对柠檬酸发酵的影响Fig.4 Effect of sulfuric acid feeding in early stage on citric acid fermentation using deionized water as cooking water
2.2.3 Na+存在条件下流加NaOH溶液对柠檬酸发酵的影响
为进一步验证上述推论,考察了1 000 mg/L Na+存在条件下,在发酵初期(4~24 h)流加2 mol/L NaOH溶液对柠檬酸发酵的影响,结果如图5所示。发酵液中含有1 000 mg/L Na+时,培养基pH在发酵前24 h下降较快;流加NaOH溶液后,培养基pH在发酵初期下降速率相对较缓慢,发酵结束柠檬酸产量达到140.3 g/L,接近空白对照(141.5 g/L)水平(图5A和E)。同时,残总糖和残异麦芽糖质量浓度分别为12 g/L和0.1 g/L,都低于空白对照(分别为17 g/L和1.9 g/L)水平(图5B和C)。此外,发酵结束时葡萄糖基本消耗完全(图5D)。这表明,在柠檬酸发酵初期流加NaOH溶液,延缓了培养基pH的下降速率,可以有效促进异麦芽糖和糊精的水解,总的可利用糖浓度上升,柠檬酸产量显著提高。对NaOH溶液流加过程中的糖浓度进行衡算,结果表明残总糖浓度显著下降,但柠檬酸产量并没有相应的增加。经检测发现在柠檬酸发酵前24 h草酰乙酸水解酶的活力较高,产生了3.7 g/L副产物草酸,较空白对照(0.97 g/L)高。这可能是因为流加NaOH溶液造成发酵初期培养基pH偏高,产生大量草酸。
综上所述,柠檬酸发酵过程中加入1 000 mg/L Na+会造成培养基pH快速下降,黑曲霉细胞分泌的异麦芽糖酶和糖化酶的活力受到影响,导致异麦芽糖和部分糊精不能有效水解,柠檬酸产量显著降低。在柠檬酸发酵初期(4~24 h)流加NaOH溶液能基本消除高浓度Na+对柠檬酸发酵的抑制作用,但是,流加NaOH溶液操作较复杂,需要消耗大量的无机试剂,成本较高。此外,该方法会引入大量的Na+,而Na+在循环过程中没有去除途径,因此会不断的积累,影响整个柠檬酸耦联系统的稳定性。
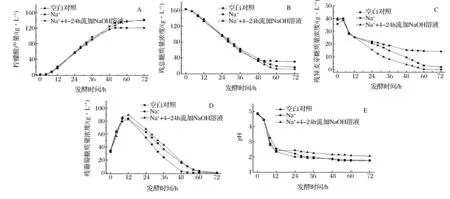
A-柠檬酸产量;B-残总糖质量浓度;C-残异麦芽糖质量浓度;D-残葡萄糖质量浓度;E-pH图5 Na+存在条件下在发酵初期流加NaOH溶液对柠檬酸发酵的影响Fig.5 Effect of sodium hydroxide solution feeding in early stage on citric acid fermentation when Na+ existed
2.3Na+存在条件下添加CaCO3对柠檬酸摇瓶发酵的影响
CaCO3是一种常见的、廉价化工原料,成本比NaOH低,且同样具有调节培养基pH的作用。柠檬酸发酵过程中采用CaCO3调控培养基的pH,引入的Ca2+可以在后期的钙盐法提取操作中与柠檬酸形成柠檬酸钙沉淀,从而被去除,因此不会在循环体系中大量积累,影响耦联系统的稳定性。
1 000 mg/L Na+存在条件下,添加不同质量浓度CaCO3对柠檬酸发酵的影响如图6所示。当培养基中含有1 000 mg/L Na+时,柠檬酸发酵受到严重抑制,柠檬酸产量仅为117.7 g/L。添加CaCO3的质量浓度小于16 g/L时,随着CaCO3添加量的增大,发酵结束时,柠檬酸产量逐渐提高,培养基pH逐渐上升,葡萄糖基本消耗完全,残总糖和残异麦芽糖浓度逐渐降低。CaCO3添加质量浓度大于20 g/L时,残总糖、残异麦芽糖和残葡萄糖浓度都逐渐上升,柠檬酸产量大幅度下降。当CaCO3添加质量浓度在16~20 g/L时,柠檬酸发酵效果较好,平均柠檬酸产量为139.3±0.1 g/L,较不添加CaCO3时的117.7 g/L提高了18.4%,接近去离子水(空白)发酵水平(141.0 g/L)。同时,平均残总糖质量浓度为12.8±0.8 g/L,较不添加CaCO3时的33.5 g/L低。此外,残异麦芽糖和残葡萄糖基本消耗完全。
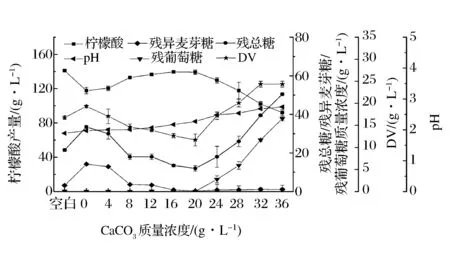
注:DV(Difference Value)为残总糖和残异麦芽糖的质量浓度之差图6 Na+存在条件下不同质量浓度CaCO3对柠檬酸发酵的影响Fig.6 Effect of different mass concentrations of calcium carbonate on citric acid fermentation when Na+ existed
培养基中含有1 000 mg/L Na+时,残总糖和残异麦芽糖质量浓度的差值(DV)为19.3 g/L,比空白对照(16.7 g/L)高,表明在柠檬酸发酵过程中除了异麦芽糖的水解受到抑制之外,部分糊精的水解也受到抑制。在柠檬酸发酵开始添加CaCO3的质量浓度低于16 g/L时,随着CaCO3浓度的增加,DV值大幅度下降,说明添加适量的CaCO3促进了培养基中部分糊精的水解。当CaCO3添加质量浓度达到16~20 g/L时,平均DV值为12.1±0.4 g/L,此时培养基中的糊精有效水解为可利用的糖,柠檬酸产量接近空白对照水平。当CaCO3添加质量浓度大于20 g/L时,发酵结束葡萄糖没有消耗完全,说明黑曲霉细胞活力受到影响,柠檬酸产量显著降低。
2.45L发酵罐中Na+存在条件下添加CaCO3对柠檬酸发酵的影响
为进一步分析CaCO3的作用,在5 L发酵罐中研究了1 000 mg/L Na+存在条件下,添加18 g/L CaCO3对柠檬酸发酵的影响,结果如图7所示。培养基中含有1 000 mg/L Na+时,培养基pH在发酵前24 h快速下降至3.0以下,之后缓慢下降直到发酵结束,柠檬酸产量为120.6 g/L,与空白对照相比降低了16.5%(图7 A)。同时,残总糖和残异麦芽糖质量浓度分别为31 g/L和14.1 g/L(图7 B和C)。柠檬酸发酵开始时添加18 g/LCaCO3,培养基pH在发酵前24 h下降速率变缓,并维持在5.68~2.28,之后其下降趋势与不添加CaCO3的一致(图7 E)。发酵结束柠檬酸产量达到139.2 g/L,与不添加CaCO3相比提高了15.4%,接近空白对照(140.5 g/L)。残异麦芽糖质量浓度为0.3 g/L,远低于空白对照的1.9 g/L,残葡萄糖基本消耗完全(图7 D)。对添加CaCO3发酵过程中的糖浓度进行衡算,结果表明残总糖浓度下降,但柠檬酸产量没有相应的增加;由于草酸会与CaCO3反应生成草酸钙沉淀,故检测不到草酸含量。经检测发现添加CaCO3发酵前24 h的草酰乙酸水解酶活力较空白水平高,说明产生了大量副产物草酸。
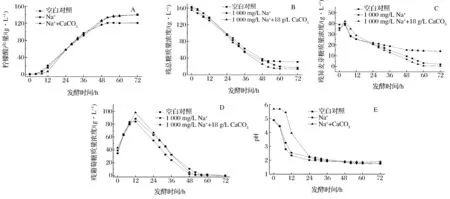
A-柠檬酸产量;B-残总糖质量浓度;C-残异麦芽糖质量浓度;D-残葡萄糖质量浓度;E-pH图7 Na+存在条件下添加18 g/L CaCO3对柠檬酸发酵的影响Fig.7 Effect of 18 g/L of calcium carbonate addition on citric acid fermentation when Na+ existed
综上可知,在1 000 mg/L Na+存在条件下,于柠檬酸发酵开始时添加适量的CaCO3能促进部分糊精和异麦芽糖的水解,总的可利用糖浓度增加,有效减轻了高浓度Na+对柠檬酸发酵的抑制作用,柠檬酸产量大幅度提高。但添加CaCO3会造成培养基中产生大量副产物草酸,降低了原料利用率。
3 结论
本实验室提出了“柠檬酸-沼气双发酵耦联系统”以解决柠檬酸发酵行业的废水排放问题。然而厌氧消化出水成分复杂,Na+是其中主要的抑制物质,若直接回用会严重抑制黑曲霉发酵,柠檬酸产量显著下降。本文采用电渗析法对厌氧消化出水中的高浓度Na+进行去除,循环回用10批后,平均柠檬酸产量达到去离子水发酵水平,验证了耦联系统是可行的。研究表明,高浓度Na+会造成发酵前期培养基pH快速下降,糖化酶和异麦芽糖酶活力受到抑制,导致部分糊精和异麦芽糖不能有效水解,最终造成柠檬酸产量显著降低。在柠檬酸发酵开始时添加CaCO3可以延缓发酵初期培养基pH的下降速率,但会造成培养基pH较高,使得草酰乙酸水解酶活力升高,导致副产物草酸大量积累,而柠檬酸产量仍低于去离子水发酵。因此,在后续的研究中可通过添加草酰乙酸水解酶抑制剂,或采用基因工程手段,对表达草酰乙酸水解酶的相关基因进行敲除,从而减少或消除草酸的产生,为实现耦联系统的工业化应用提供理论依据。
[1] DHILLON G S, BRAR S K, VERMA M, et al. Recent advances in citric acid bio-production and recovery[J]. Food & Bioprocess Technology, 2011, 4(4): 505-529.
[2] AMBATI P, AYYANNA C. Optimizing medium constituents and fermentation conditions for citric acid production from palmyra jaggery using response surface method[J]. World Journal of Microbiology & Biotechnology, 2001, 17(4): 331-335.
[3] DAROUNEH E, ALAVI A, VOSOUGHI M, et al. Citric acid production: Surface culture versus submerged culture[J]. African Journal of Microbiology Research, 2009, 3(9): 541-545.
[4] 孟佼, 周平平, 张建,等. 玉米秸秆水解液的黑曲霉发酵生产高浓度柠檬酸[J]. 华东理工大学学报(自然科学版), 2014, 40(6):681-683.
[5] LI C, YANG H, XIA X, et al. High efficient treatment of citric acid effluent byChlorellavulgaris, and potential biomass utilization[J]. Bioresource Technology, 2013, 127(127C): 248-255.
[6] Xu J, SU X F, BAO J W, et al. Cleaner production of citric acid by recycling its extraction wastewater treated with anaerobic digestion and electrodialysis in an integrated citric acid-methane production process[J]. Bioresource Technology, 2015, 189: 186-194.
[7] COLLERAN E, PENDER S, PHILPOTT U, et al. Full-scale and laboratory-scale anaerobic treatment of citric acid production wastewater[J]. Biodegradation, 1998, 9(3):233-245.
[8] 王柯. 酒精—沼气双发酵耦联生态系统的机理和关键技术研究[D]. 无锡:江南大学, 2014.
[9] ZHI X, YANG H, BERTHOLD S, et al. Potential improvement to a citric wastewater treatment plant using bio-hydrogen and a hybrid energy system[J]. Journal of Power Sources, 2010, 195(19): 6 945-6 953.
[10] XU J, CHEN Y Q, ZHANG H J, et al. Production of citric acid using its extraction wastewater treated by anaerobic digestion and ion exchange in an integrated citric acid-methane fermentation process[J]. Bioprocess & Biosystems Engineering, 2014, 37(8): 1 659-1 668.
[11] 陈阳秋, 徐健, 张宏建,等. 柠檬酸-沼气双发酵耦联工艺中钠离子的影响[J]. 安全与环境学报, 2016(5): 221-226.
[12] XU J, CHEN Y Q, ZHANG H J, et al. Establishment and assessment of an integrated citric acid-methane production process[J]. Bioresource Technology, 2015, 176: 121-128.
[13] ZHANG H J, ZHANG J H, XU J, et al. A novel recycling process using the treated citric acid wastewater as ingredients water for citric acid production[J]. Biochemical Engineering Journal, 2014, 90(5): 206-213.
[14] SADRZADEH M, GHADIMI A, MOHAMMADI T. Coupling a mathematical and a fuzzy logic-based model for prediction of zinc ions separation from wastewater using electrodialysis[J]. Chemical Engineering Journal, 2009, 151(1-3):262-274.
[15] 綦峰, 张宏建, 徐健,等. 柠檬酸厌氧出水回用技术初探[J]. 食品与发酵工业, 2013, 39(6):76-80.
[16] NAIR S U, SINGHAL R S, KAMAT M Y. Induction of pullulanase production inBacilluscereusFDTA-13[J]. Bioresource Technology, 2007, 98(4): 856-859.
[17] 孙继祥. 黑曲霉产糖化酶液态发酵条件研究[J]. 酿酒科技, 2011(10): 42-47.
[18] XU J, CHEN Y Q, ZHANG H J, et al. Optimization of the integrated citric acid-methane fermentation process by air stripping and glucoamylase addition[J]. Bioprocess & Biosystems Engineering, 2014, 38(3): 411-420.
Explorationofeffectofsodiumionsoncitricacidfermentationwithintegratedcitricacid-methanefermentationsystemanditsremoval
BAO Jia-wei,XU Jian, SU Xian-feng, ZHANG Hong-jian, MAO Zhong-gui*
(Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China)
To solve the potential extraction wastewater pollution in citric acid production, an integrated citric acid-methane fermentation system was proposed. In this system, the extraction wastewater was treated through mesophilic anaerobic digestion (AD) and then the anaerobic digestion effluent was further treated and recycled to make mash for the next batch of citric acid fermentation, thus the wastewater discharge was eliminated. Excessive Na+contained in AD effluent was confirmed to be the major inhibitor for citric acid fermentation and its concentration could accumulate to 1 000 mg/L in recycling. AD effluent was treated with electrodialysis system to remove sodium and then recycled to make mash for the next batch of the citric acid fermentation. The recycling was performed for 10 batches andthe average citric acid production was 142.4 ±2.1 g/L,which was comparable to that of the fermentation with tap water (141.5 g/L).Effect of high concentration of sodium on the citric acid fermentation was investigated and the results indicated that 1 000 mg/L Na+contained in citric acid fermentation could decline the medium pH sharply at initial stage, which decreased the activity of isomaltase and glucoamylase secreted byAspergillusniger, and influenced the breakdown of isomaltose and part of other dextrins, thus caused the decrease of citric acid production. 18 g/L calcium carbonate was added to medium at the start of the citric acid fermentation,the decline rate of the medium pH slowed down, which could promote the breakdown of isomaltose and part of other dextrins, and thus could increase available sugar concentration and relieve the inhibition caused by 1 000 mg/L Na+.However,as the medium pH maintained at the high level because of the calcium carbonate addition, part of available sugar was converted to by-product oxalic acid and the citric acid production was 139.2 g/L, which was still lower than that of the fermentation with tap water.
citric acid; anaerobic digestion; calcium carbonate; sodium ions; isomaltase; glucoamylase
10.13995/j.cnki.11-1802/ts.013727
硕士研究生(毛忠贵教授为通讯作者,E-mail: maozg@jiangnan.edu.cn)。
2016-12-14,改回日期:2017-02-20
