外周血中CEA和CA19-9的表达水平在进展期胃癌中的预后价值
2017-09-03薛英威
张 锡 陈 力 薛英威
外周血中CEA和CA19-9的表达水平在进展期胃癌中的预后价值
张 锡1陈 力2薛英威1
目的 探讨外周血中CEA和CA19-9的表达水平在进展期胃癌中的预后价值及进展期胃癌患者预后的影响因素。方法 选取2010年1月—2010年12月于哈尔滨医科大学附属肿瘤医院胃肠外科行R0根治术的进展期胃癌患者255例,根据CEA和CA19-9的表达水平分为A组(CEA<2.19 ng/mL且CA19-9<10.78 U/mL)、B组(CEA≥2.19 ng/mL或CA19-9≥10.78 U/mL)和C组(CEA≥2.19 ng/mL且CA19-9≥10.78 U/mL),比较三组进展期胃癌患者的临床病理资料和生存情况,并分析进展期胃癌患者预后的影响因素。结果 三组进展期胃癌患者间临床N分期、临床TNM分期和病理TNM分期的差异均具有统计学意义(P<0.05),三组进展期胃癌患者术后中位生存时间差异无统计学意义(P>0.05);术后1年、3年、5年生存率差异无统计学意义(P>0.05),但A组1年、3年、5年生存率高于B组和C组。影响胃癌预后的因素包括肿瘤分化程度、病理T分期、病理TNM分期、清扫淋巴结总数、清扫淋巴结阳性数、淋巴结转移情况。结论 CEA和CA19-9联合检测对进展期胃癌患者评估预后有一定的参考价值。
进展期胃癌;CEA;CA19-9;总生存时间
胃癌是全球常见的恶性肿瘤之一,也是我国常见的消化道肿瘤,病死率居全球恶性肿瘤第二位,严重危害人类身体健康[1]。由于早期胃癌患者大多无症状,来院就诊时多数已经处于中晚期,早期胃癌患者仅占10%左右,5年生存率约为10%~30%[2]。胃癌确诊的金标准是胃镜检查和病理活检,但由于是侵入性操作常常令患者难以耐受,并且反复检查,进而限制了其在国内的普查。因此,早期诊断和及时治疗是预测和改善胃癌预后最有效的手段。肿瘤标志物(Tumor markers,TMs)是指在肿瘤的发生和发展过程中,由肿瘤细胞合成、释放或与宿主细胞相互作用而产生的一类物质,可反应肿瘤的存在和发生[3]。它具有简单、便利、敏感、可重复性、非侵入性等特点,目前作为临床肿瘤检测的常用方法之一,可协助胃癌早期诊断进而对指导治疗、判断预后等具有重要的临床意义[4]。肿瘤标志物种类很多,单项的检测往往缺乏足够的敏感性和特异性[5]。本研究旨在探讨外周血肿瘤标志物癌胚抗原(Carcinoembryonic antigen,CEA)和糖类抗原19-9(Carbohydrate antigen 19-9,CA19-9)的表达水平评估进展期胃癌的预后价值,为临床治疗提供一定的参考依据,现将结果报道如下。
1 资料与方法
1.1 一般资料
选取2010年1月—2010年12月于哈尔滨医科大学附属肿瘤医院胃肠外科经病理确诊的进展期胃癌患者共计255例。所有患者术前均未接受放化疗、生物治疗、靶向治疗等,均行R0根治术,D2区域淋巴结清扫术。
1.2 采血方法
入院后常规采取次日空腹静脉血2~4 mL,送至检验科进行离心。离心条件:3 500 r/min,离心5 min,分离血清,进行检测。采用电化学发光法进行检测CEA和CA19-9。
1.3 临床分组方法
肿瘤标志物CEA和CA19-9正常范围值分别为0~5 ng/mL,0~37 U/mL。绘制ROC曲线,确定CEA和CA19-9的最佳临界值分别为2.19 ng/mL和10.78 U/mL。因此,CEA<2.19 ng/mL且CA19-9<10.78 U/mL为低表达水平,记为A组;CEA≥2.19 ng/mL或CA19-9≥10.78 U/mL为中表达水平,记为B组;CEA≥2.19 ng/mL且CA19-9≥10.78 U/mL为高表达水平,记为C组。
1.4 随访情况
随访情况根据NCCN指南进行:术后1~2年每3个月随访1次,术后2~5年每6个月随访1次,5年后每年随访1次,直至死亡。总生存期(Overall survival,OS)定义为自手术后的第一天开始直至最后一次随访或死亡的时间。
1.5 统计学方法
应用SPSS 17.0软件进行统计学分析,ROC曲线确定相关变量最佳临界值,计数资料采用频数和百分比表示,组间比较采用χ2检验或Fisher精确检验,采用Kaplan-Meier法绘制生存曲线,Log-rank检验比较各组生存情况,应用Cox比例风险模型分析相关预后因素,P<0.05为差异具有统计学意义。
2 结果
2.1 三组进展期胃癌患者一般临床资料比较
三组进展期胃癌患者间临床N分期、临床TNM分期和病理TNM分期的差异均具有统计学意义(P<0.05)(表1)。
2.2 进展期胃癌患者的生存情况比较
255例入组进展期胃癌患者术后均进行随访,末次随访时间截止为2017年3月1日,其中有12人未能随访,随访率为95.3%。A、B和C三组术后中位生存时间分别为60.63个月(95%CI:58.00~63.26)、59.23个月(95%CI:52.27-66.19)和57.10个月(95%CI:53.48~60.72),差异无统计学意义(χ2=1.070,P=0.586)(图1)。三组术后1年、3年、5年生存率差异均不具有统计学意义(P>0.05),但A组1年、3年、5年生存率较B组和C组要高(表2)。

图1 三组进展期胃癌术后总生存期曲线比较Figure 1 Comparison of survival curves of advanced gastric cancer patients in the three groups

ParametersGroupAGroupBGroupCχ2PAge(years)0.9670.617<5747(38.8)45(37.2)29(24.0)≥5745(33.6)51(38.1)38(28.4)Gender1.8730.392Male61(33.7)69(38.1)51(28.2)Female31(41.9)27(36.5)16(21.6)BMI1.9420.379<21.9542(33.1)47(37.0)38(29.9)≥21.9550(39.1)49(38.3)29(22.7)Differentiation1.9770.757#Poorly64(39.0)58(35.4)42(25.6)Moderately23(30.3)32(42.1)21(27.6)Well5(33.3)6(40.0)4(26.7)Primarytumorsite3.7190.445Upper1/313(37.2)11(31.4)11(31.4)Middle1/318(40.0)20(44.4)7(15.6)Low1/361(34.9)65(37.1)49(28.0)Borrmannstage2.7260.842Ⅰ12(38.7)12(38.7)7(22.6)Ⅱ7(28.0)12(48.0)6(24.0)Ⅲ62(35.8)65(37.6)46(26.6)Ⅳ11(42.3)7(26.9)8(30.8)Pathology5.5880.384#Adenocarcinoma51(33.8)59(39.1)41(27.2)Mucinouscarcinoma7(28.0)11(44.0)7(28.0)Signetringcellcarcinoma34(44.2)24(31.2)19(24.7)Others0(0.0)2(100.0)0(0.0)ClinicalTstage6.1280.412#T13(42.8)2(28.6)2(28.6)T217(51.5)12(36.4)4(12.1)T354(34.0)61(38.4)44(27.7)T418(32.1)21(37.5)17(30.4)ClinicalNstage11.0430.026N025(51.0)15(30.6)9(18.4)N125(44.6)19(33.9)12(21.4)N242(28.0)62(41.3)46(30.7)

续表1 三组进展期胃癌患者临床病理资料比较[n(%)]
Note:# Fisher exact test.

表2 三组进展期胃癌患者术后生存率比较
所有患者发生淋巴结转移的有206例,中位生存时间为48.14个月(95%CI:43.93~52.35),未发生淋巴结转移的有49例,中位生存时间为63.15个月(95%CI:56.42~69.89),差异具有统计学意义(χ2=11.498,P=0.001)(图2)。
2.3 进展期胃癌患者预后的影响因素分析
多因素Cox回归分析结果显示,肿瘤分化程度、病理T分期、病理TNM分期、清扫淋巴结总数、清扫淋巴结阳性数和淋巴结转移情况为进展期胃癌患者总生存期的影响因素(表3)。

图2 进展期胃癌患者淋巴结转移情况生存曲线比较Figure 2 Comparison of lymph node metastasis of patients with advanced gastric cancer
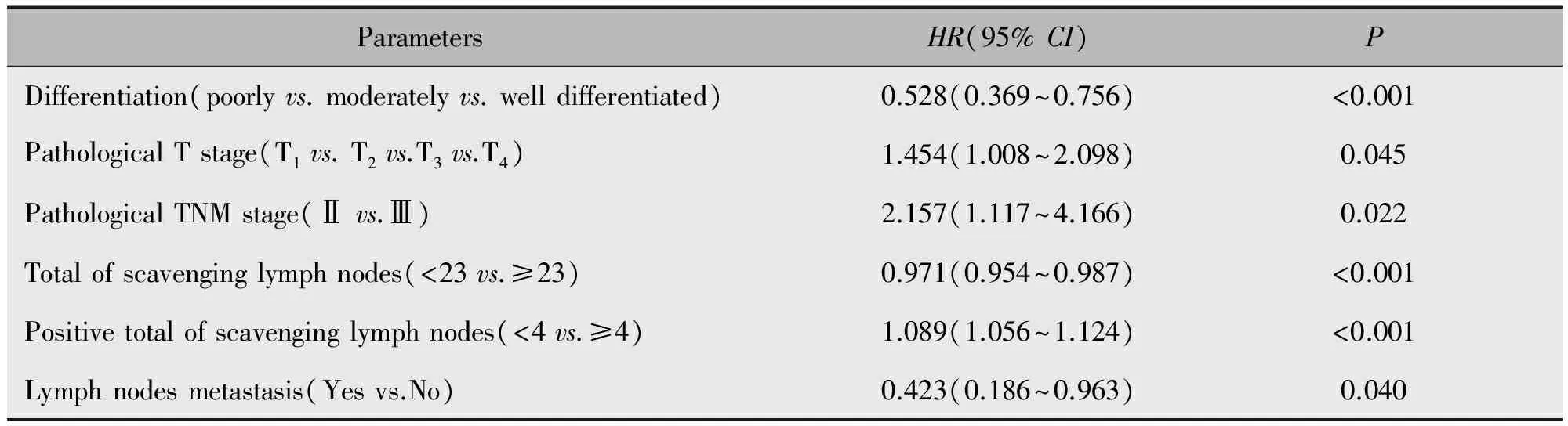
ParametersHR(95%CI)PDifferentiation(poorlyvs.moderatelyvs.welldifferentiated)0.528(0.369~0.756)<0.001PathologicalTstage(T1vs.T2vs.T3vs.T4)1.454(1.008~2.098)0.045PathologicalTNMstage(Ⅱvs.Ⅲ)2.157(1.117~4.166)0.022Totalofscavenginglymphnodes(<23vs.≥23)0.971(0.954~0.987)<0.001Positivetotalofscavenginglymphnodes(<4vs.≥4)1.089(1.056~1.124)<0.001Lymphnodesmetastasis(Yesvs.No)0.423(0.186~0.963)0.040
3 讨论
近年来消化道恶性肿瘤的发病率呈递增趋势,而胃癌是我国消化道系统常见的恶性肿瘤,每年新发病例达40万例,占世界新发病例数的42%,死亡人数约30万[6-7]。胃癌发病的初始阶段常无明显症状,不引起重视,来确诊时多数已是中晚期,常错过最佳治疗时机,这也进一步增加治疗难度和家庭经济负担。因此胃癌的早期发现、早期诊断、早期治疗和及时预防就显得非常重要,以便能有效控制病情,从而提高患者的生活质量。肿瘤标志物是体内肿瘤释放或者组织受到肿瘤刺激后反应性释放的一类物质,具有检测简单、痛苦小、损伤小等特点,已成为临床初步筛查肿瘤的常规手段[8]。根据患者血清中肿瘤标志物的表达水平可以筛选出胃癌的高危人群,进而对患者进行早期预防、综合评估、干预治疗等。
肿瘤标志物的种类很多,通常肿瘤患者体内含量要高于正常人群,测定其在血液中的表达水平对于肿瘤的早期诊断具有重要的临床价值。胃癌的肿瘤标志物主要包括CEA、CA19-9、糖类抗原72-4(Carbohydrate antigen 72-4,CA72-4)、糖类抗原125II(Carbohydrate antigen 125II,CA125II)、甲胎蛋白(Alpha-fetoprotein,AFP)等[9]。但关于胃癌肿瘤标志物的研究结果并不完全一致,单项肿瘤标志物检测其灵敏度和特异度均难以满足临床对胃癌的早期诊断、治疗和预后的要求,因此临床上常采用多项肿瘤标志物联合检测的方法以弥补单项肿瘤标志物检测的不足[10-11]。CEA是一种酸性糖蛋白抗原,属于胚胎性致癌抗原,常用于消化系统肿瘤的诊断,具有较高的特异性。正常情况下,CEA在人体内含量极低,经胃肠道代谢,而在肿瘤状态时CEA进入血液和淋巴循环,进而引起CEA异常增高[12]。CA19-9是一种低聚糖类相关抗原,临床上常用于胰腺癌、胃癌、大肠癌等消化道恶性肿瘤的诊断,是一种特异性较高的肿瘤标志物,对消化道肿瘤的临床诊断和预后评估有着非常重要的价值。
本研究将CEA和CA19-9联合检测并评估进展期胃癌的预后价值。根据两者在外周血中的表达水平进行分组,比较术后中位生存时间,差异不具有统计学意义;但我们发现CEA和CA19-9两者均低表达的中位生存时间要长于两者均高表达或其中一者高表达的中位生存时间。表明肿瘤标记物在外周血中高表达可能是胃癌预后的一个不利因素,表达水平高,提示预后可能差。这与贾笑强[13]研究结果相一致。在近期和远期生存率方面比较,差异也不具有统计学意义。但CEA和CA19-9两者均低表达的1年、3年、5年生存率要高于高表达水平。经单因素和多因素分析,本研究发现肿瘤分化程度、病理T分期、病理TNM分期、清扫淋巴结总数和清扫淋巴结阳性数是进展期胃癌的独立预后因素。进一步分析淋巴结发生转移和未发生转移的进展期胃癌患者的生存曲线,发现未发生淋巴结转移的患者术后生存时间明显长于发生淋巴结转移的患者,两者的差异具有统计学意义。
综上所述,CEA和CA19-9在外周血中的表达可能是进展期胃癌预后的一个不利因素,为确定肿瘤标志物在胃癌的诊断及预后中的作用,仍需要进一步大样本的临床研究。
1 Rebecca LS,Kimberly DM,Ahmedin J,et al.Cancer Statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
2 陈力,张玉新,左艳娇,等.SOX和XELOX在进展期胃癌新辅助化疗中的临床疗效比较[J].实用肿瘤学杂志,2017,31(1):23-30.
3 丁洪基.肿瘤干细胞与肿瘤淋巴管生成及转移的研究进展[J].诊断病理学杂志,2017,24(3):227-231.
4 李凯,王振宁.胃癌术后肿瘤标记物检测及其研究进展[J].中国实用外科杂志,2015,35(10):1137-1140.
5 吴伟晴,廖淑萍,林小兰,等.血清肿瘤标志物在五种消化系统肿瘤诊断中的价值[J].现代消化及介入诊疗,2016,21(4):550-554.
6 Rahman R,Asombang AW,Ibdah JA.Characteristics of gastric cancer in Asia[J].World J Gastroentero,2014,20(16):4483-4490.
7 Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
8 Duffy MJ,Lamerz R,Haglund C,et al.Tumor markers in colorectal cancer,gastric cancer and gastrointestinal stromal cancers:European group on tumor markers 2014 guidelines update[J].J Int Cancer,2014,134(11):2513-2522.
9 Jagric T,Potrc S,Mis K,et al.CA19-9 serum levels predict micrometastases in patients with gastric cancer[J].Radiol Oncol,2016,50(2):204-211.
10 徐巧玲,尤徐阳,吴娜静,等.临床病理学分析结合CEA、CA19-9与CA125检测对诊断胃癌术后腹膜转移的意义[J].标记免疫分析与临床,2016,121(11):1321-1326.
11 Yu J,Zhang S,Zhao B.Differences and correlation of serum CEA,CA19-9 and CA72-4 in gastric cancer[J].Mol Clin Oncol,2016,4(3):441-449.
12 Liu X,Qiu H,Liu J,et al.Combined preoperative concentrations of CEA,CA 19-9,and 72-4 for predicting outcomes in patients with gastric cancer after curative resection[J].Oncotarget,2016,7(23):35446-35453.
13 贾笑强,李永慧,杨晓霞,等.CEA、CA19-9 与CA72-4 用于诊断老年胃癌的临床价值研究[J].现代生物医学进展,2015,15(33):6469-6471.
(收稿:2017-04-12)
Prognostic value of CEA and CA19-9 expression in peripheral blood of patients with advanced gastric cancer
ZHANGXi1,CHENLi2,XUEYingwei1
1.Department of Surgery,Harbin Medical University Cancer Hospital,Harbin 150081,China; 2.Department of Gastrointestinal Surgery,Harbin Medical University Cancer Hospital
Objective The aims of this study were to investigate the prognostic value of CEA and CA19-9 expression in advanced gastric cancer and the prognostic factors of advanced gastric cancer.Methods A total of 255 patients with advanced gastric cancer who underwent radical R0 radical surgery were enrolled in the Department of Gastrointestinal Surgery,Harbin Medical University Cancer Hospital from January 2010 to December 2010,and were divided into group A(CEA<2.19 ng/mL and CA19-9<10.78 U/mL),group B(CEA≥2.19 ng/mL or CA19-9≥10.78 U/mL)and group C(CEA≥2.19 ng/mL and CA19-9≥10.78 U/mL).These groups were analyzed the differences in gastric cancer patients with clinical pathology and survival,and prognostic factors of patients with advanced gastric cancer factors.Results There were statistically significant differences in clinical N staging,clinical TNM staging and pathological TNM staging in three groups of patients with advanced gastric cancer(P<0.05).There was no significant difference in the median survival time in three groups of patients with advanced gastric cancer(P>0.05).The 1-year,3-year and 5-year survival rates of group A were higher than those of group B and group C(P>0.05).The factors affecting the prognosis of gastric cancer included the degree of tumor differentiation,pathological T staging,pathological TNM staging,the total number of lymph nodes,the number of positive lymph nodes and lymph node metastasis.Conclusion Combined detection of CEA and CA19-9 expression indicates a certain reference value for prognosis of gastric cancer.
Advanced gastric cancer;CEA;CA19-9;Overall survival time
1.哈尔滨医科大学附属肿瘤医院外科(哈尔滨 150081);2.哈尔滨医科大学附属肿瘤医院胃肠外科
张锡,男,(1987-),硕士,住院医师,从事胃肠道肿瘤临床与基础的研究。
薛英威,E-mail:xueyingwei1964@163.com
R735.2
A
10.11904/j.issn.1002-3070.2017.04.010
