AEG-1基因促进乳腺癌细胞株MCF-7转移
2017-09-03李英红刘珺珺宁晓明李乐静
李英红 刘珺珺 宁晓明 李 聪 李乐静
AEG-1基因促进乳腺癌细胞株MCF-7转移
李英红1刘珺珺2宁晓明2李 聪3李乐静1
目的 观察AEG-1基因在细胞水平对乳腺癌细胞MCF-7转移的影响。方法 通过将siRNA转染进MCF-7细胞,沉默细胞中AEG-1表达量,以转染阴性siRNA作为对照组。分别采用Transwell小室检测细胞迁移侵袭能力、CCK8实验检测细胞增殖能力。同时通过检测细胞中VEGF的变化及HUVEC细胞体外管腔形成实验考察AEG-1对于血管新生的影响。结果 沉默AEG-1,MCF-7细胞的迁移能力、侵袭能力和增殖能力明显受到抑制。沉默AEG-1,MCF-7细胞的VEGF表达明显降低。上清处理HUVEC细胞,沉默AEG-1组的血管新生能力明显受到抑制。结论 沉默AEG-1基因能显著抑制MCF-7细胞转移的多个层面,包括细胞迁移、侵袭、增殖以及血管新生。表明AEG-1基因在乳腺癌转移过程中起着重要作用,也为将来乳腺癌治疗开拓了新思路。
AEG-1;乳腺癌;转移
乳腺癌是全世界女性常见的恶性肿瘤,也是导致女性癌症死亡的重要原因之一[1-2]。目前临床上主要采用手术、化疗等治疗手段。然而,乳腺癌的调控机制尚不明确。星型细胞上调基因1(Astrocyte elevated gene-1,AEG-1)是一种新型促癌基因,在多种恶性肿瘤中高表达,如结直肠癌、肝癌、卵巢癌、胃癌、乳腺癌等[3-5]。AEG-1可能是乳腺癌形成和发展过程中的一个关键蛋白,选择性抑制AEG-1在乳腺癌中的表达可能成为一种新的基因治疗方法。癌症转移是一个复杂的多步骤的过程,主要包括肿瘤增殖、原位迁移和侵袭、穿透血管壁进入血液循环、再次穿透血管壁达到远端组织、促进血管新生等多个步骤[6-8]。本文重点研究AEG-1参与调控乳腺癌的转移过程,尤其是关于血管新生的作用,这项工作为我们对乳腺癌治疗的研究提供了新的视角。
1 材料与方法
1.1 材料
实时荧光定量PCR检测试剂盒(北京全式金公司),Trizol总RNA提取试剂(北京天根公司),cDNA反转录试剂盒(大连宝生物公司),胶回收试剂盒和质粒大提试剂盒(上海捷瑞生物工程有限公司)。LipofectamineTM2000转染试剂(Invitrogen公司,美国)。胎牛血清、DMEM培养基(Gibco公司,美国),Transwell小室,孔径8 μm(Costar公司,美国),基质胶(BD公司,美国)。siRNA合成(吉玛制药技术有限公司),DNA引物合成(苏州金唯智生物科技有限公司)。MCF-7及HUVEC细胞购自上海中国科学院细胞库。
1.2 siRNA合成
AEG-1的siRNA共合成3对,序列如下:1号(正义链:CCGAAGUACUCGUCAAAAATT,反义链:UUUUUGACGAGUACUUCGGCT),2号(正义链:GAAUCUCCCAAACAAAUAATT,反义链:UUAUUUGUUUGGGAGAUUCCC),3号(正义链:GGAUGUUAGCCGUAAUCAATT,反义链:UUGAUUACGGCUAACAUCCCA),三条链等量混合在一起使用。RNAi阴性对照序列采用随机序列:正义链:UUCUCCGAACGUGUCACGUTT,反义链:ACGUGACACGUUCGGAGAATT。
1.2 细胞培养
MCF-7及HUVEC细胞购自上海中国科学院细胞库。培养使用DMEM培养基,含有10%的胎牛血清,100 U/mL的青霉素和0.1 mg/mL链霉素,置于37℃、5% CO2培养箱中培养,每天换液一次。
1.3 细胞转染
将MCF-7细胞接种于24孔板(105/孔),24 h后采用LipofectamineTM2000试剂转染,将脂质体和siRNA按照比例孵育后,加入到细胞培养板中,4~6 h后换液,待转染24~48 h后取细胞进行后续的实验。转染阴性对照siRNA作为对照组NC,转染AEG-1的siRNA作为实验组siAEG-1,后续的表达量检测实验和功能研究实验均按照如此分组。
1.4 实时荧光定量PCR检测
细胞中去除培养液后加入Trizol溶液直至裂解完全,氯仿抽提总RNA。总RNA反转录成cDNA后进行qPCR检测。以GAPDH作为内参,qPCR条件为94℃变性2 min,94℃变性5 s,60℃退火15 s,72℃延伸30 s,40个循环,每个样品均做3组重复。
1.5 Transwell小室检测细胞迁移和侵袭能力实验
取对数生长期的MCF-7细胞离心后重悬,取5×105个/mL细胞100 μL(不含血清)加入Transwell小室上层,600 μL全培养基加入小室下层,24 h后将小室取出,使用4%多聚甲醛溶液固定,使用棉棒轻轻擦除上层残留细胞,下层细胞使用DAPI染色后置于倒置荧光显微镜下观察。每个小室分别取上下左右中5个视野拍照记录,统计5个视野中细胞总数。细胞侵袭实验为先将Transwell小室预铺基质胶,培养箱中预烘半个小时,然后将细胞离心后重悬,取5×105个/mL细胞100 μL(不含血清)加入Transwell小室上层,600 μL全培养基加入小室下层,48 h后将小室取出,使用4%多聚甲醛溶液固定,使用棉棒轻轻擦除上层残留细胞,下层细胞使用DAPI染色后置于倒置荧光显微镜下观察。每个小室分别取上下左右中5个视野拍照记录,统计5个视野中细胞总数。
1.6 Western blot检测蛋白表达
裂解细胞后提取细胞总蛋白,与缓冲液按比例混合后100℃煮5 min,8% SDS-PAGE上样电泳后电转至PVDF膜。PAGE电泳后电转移至PVDF膜后,5%脱脂牛奶室温封闭1 h,加入一抗anti-AEG-1(Abcam)4℃孵育过夜。TBST洗涤3次,后加入二抗37℃孵育45 min,TBST洗涤3次,在暗室中压片,然后显影、定影。
1.7 ELISA检测MCF-7细胞上清液中VEGF含量
转染siRNA后的细胞培养48 h后,收集细胞上清液,参照ELISA试剂盒说明书检测细胞上清液中VEGF含量。
1.8 统计学处理
2 结果
2.1 siRNA转染对乳腺癌MCF-7细胞AEG-1基因表达水平的影响
通过qRT-PCR和Western blot法分别检测AEG-1 siRNA转染MCF-7细胞后AEG-1 mRNA和蛋白的相对表达水平。实验组中转染AEG-1 siRNA的AEG-1基因mRNA表达量相对于对照组下降了75%(P<0.01)(图1A)。Western blot法检测发现转染AEG-1 siRNA的实验组与对照组相比,AEG-1的蛋白表达量也明显减少(图1B),提示AEG-1基因被有效沉默。

图1 AEG-1 siRNA在MCF-7细胞中沉默效率验证Figure 1 AEG-1 siRNAs decreased the expression of AEG at levels of mRNA and protein in MCF-7 cells
2.2 沉默AEG-1基因对MCF-7细胞迁移、侵袭和增殖的影响
在MCF-7细胞中分别转染AEG-1基因的siRNA和阴性对照siRNA(NC组),利用Transwell方法检测穿到下层的细胞数目,来评估细胞的迁移和侵袭能力的变化,穿到下层的细胞数目越多,则代表细胞迁移或侵袭能力越强。转染AEG-1 siRNA之后,细胞迁移能力下降到18%(P<0.01),而细胞侵袭能力下降到28%(P<0.01)(图2)。通过CCK8法检测AEG-1基因对MCF-7细胞增殖的影响,结果显示:转染AEG-1 siRNA 72 h之后,细胞增殖能力下降了30%(P<0.05)(图3)。
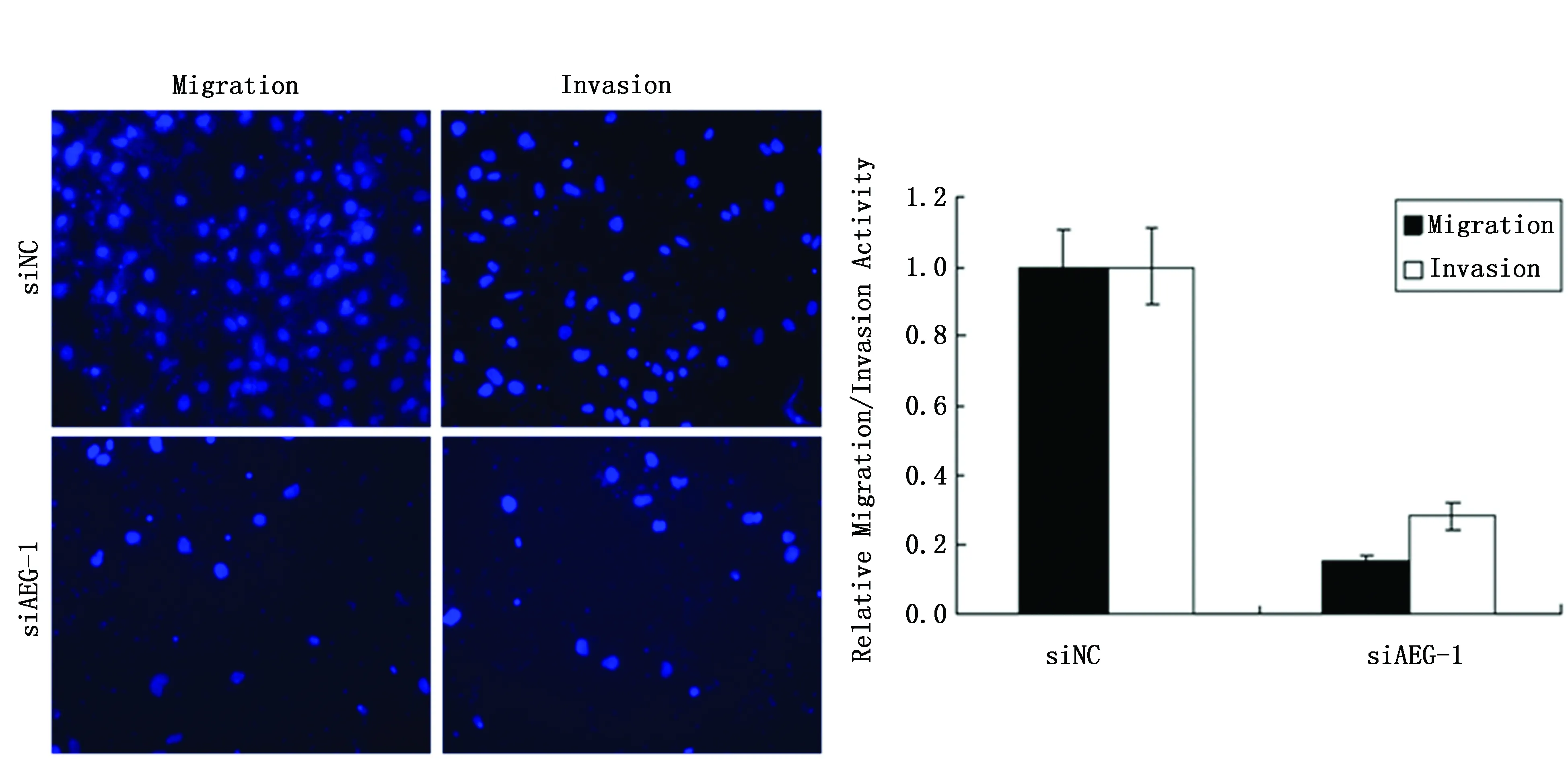
图2 沉默AEG-1抑制MCF-7细胞迁移和侵袭Figure 2 AEG-1 siRNAs inhibited the migration and invasion in MCF-7 cells
2.3 沉默AEG-1基因对VEGF基因在MCF-7细胞中的表达影响
通过qRT-PCR和Western blot法分别检测AEG-1 siRNA转染MCF-7细胞后VEGF基因mRNA和蛋白的相对表达水平。实验组中转染AEG-1 siRNA的VEGF基因mRNA表达量相对于对照组下降了50%(P<0.01)(图4A)。Western blot法检测发现转染AEG-1 siRNA的实验组与对照组相比,VEGF的蛋白表达量也明显减少(图4B)。说明AEG-1基因被沉默后,影响了VEGF的表达。ELISA检测结果也显示转染AEG-1 siRNA组细胞培养上清液中VEGF的含量与对照组相比降低了37%(P<0.05)(图4C)。
2.4 沉默AEG-1基因对HUVEC细胞体外管腔形成的影响
使用MCF-7细胞培养上清处理HUVEC细胞,分为AEG-1 siRNA组和对照组。HUVEC细胞在Matrigel基底包被的培养板中培养。结果表明AEG-1 siRNA组与阴性对照组相比,虽然均可见管腔形成,但是管腔形成明显减少(图5)。
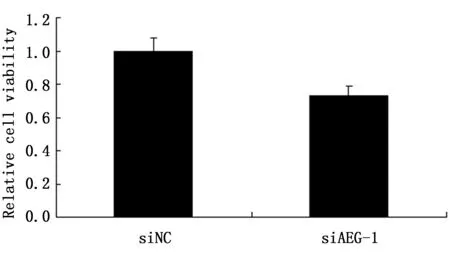
图3 沉默AEG-1抑制MCF-7细胞增殖Figure 3 AEG-1 siRNAs inhibited the proliferation in MCF-7 cells
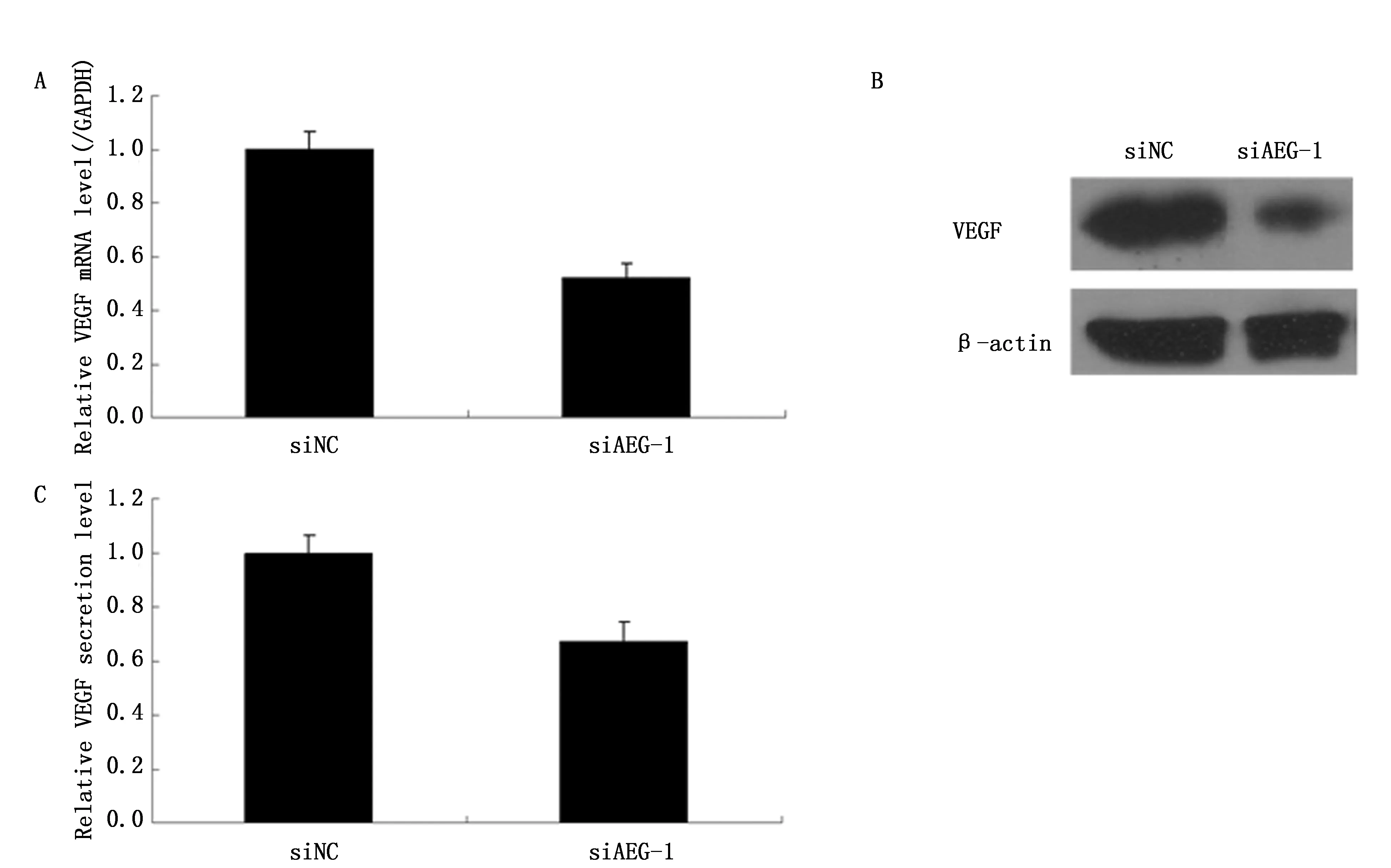
图4 沉默AEG-1抑制 VEGF的表达Figure 4 AEG-1 siRNAs inhibited the expression of VEGF protein in MCF-7 cells

图5 沉默AEG-1抑制 HUVEC的管腔形成Figure 5 AEG-1 siRNAs inhibited the tube formation of HUVEC cells
3 讨论
全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势。我国肿瘤登记地区乳腺癌发病率位居女性恶性肿瘤的第1位。癌症转移是肿瘤患者致死的最主要原因之一。癌症转移是一个复杂的过程,有一个系统的基因网络调控整个过程[9]。一些文章报道了几个关键基因,例如KISS1、MMP9、VEGF等,为正向或者负向的调控因子[10-12]。但是我们对分子机制的理解远远不够。在临床上,我们仍然缺乏有效的控制癌症转移的方法。
AEG-1基因是一个重要的原癌基因,它起初发现在艾滋病和肿瘤坏死因子感染的人类脑星形胶质瘤当中[3]。人类AEG-1蛋白含有582个氨基酸,分子量为64 kD[3]。在许多肿瘤组织当中,其基因扩增要远远高于相邻正常癌旁组织[3]。AEG-1基因的高表达导致了肿瘤的进展,也促进了许多肿瘤细胞的生长和侵袭[13-16]。近年来,有研究表明,AEG-1与著名的原癌基因C-Myc协同作用,促进癌症的发生和肿瘤的生长[17]。因此我们猜测AEG-1在乳腺癌的发展和转移过程中起到重要作用。我们的实验结果发现,沉默乳腺癌细胞MCF-7的AEG-1表达量,可以有效地抑制细胞增殖、迁移和侵袭的能力。这些研究结果表明,AEG-1在乳腺癌的肿瘤生长、局部扩散、组织浸润等过程中都发挥着重要作用。通过靶向沉默AEG-1,可以有效地抑制原发灶乳腺癌的生长和扩散。
血管生成是癌症转移和二级肿瘤组织形成的重要因素,因此很多治疗癌症的策略是基于抑制血管生成。VEGF是新血管形成的关键因子,已被证实是迄今最有效、特异性最高的血管生成因子,它可以促进内皮祖细胞的动员、迁移和分化并参与新血管形成[18-19]。在乳腺癌组织中,AEG-1显著高表达[20],并且与VEGF表达量呈相关性[21]。因此我们猜测AEG-1在乳腺癌中可能调控VEGF,并且在血管生成过程中起到重要作用。我们的实验结果发现,沉默AEG-1可以有效地降低乳腺癌细胞MCF-7细胞VEGF的表达和分泌,并且可以抑制HUVEC的管腔形成。这些研究结果表明,在乳腺癌中AEG-1正向调控VEGF,通过靶向沉默AEG-1可以有效地抑制乳腺癌转移过程中的血管新生。
综上所述,AEG-1基因在乳腺癌转移过程中起着重要作用,通过靶向抑制AEG-1的表达可以有效地抑制乳腺癌转移。这一研究结果为将来乳腺癌治疗开拓了新思路。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
2 Ribeiro JT,Macedo LT,Curigliano G,et al.Cytotoxic drugs for patients with breast cancer in the era of targeted treatment:back to the future?[J].Ann Oncol,2012,23(3):547-555.
3 Huang Y,Li LP.Progress of cancer research on astrocyte elevated gene-1/Metadherin(Review)[J].Oncol Lett,2014,8(2):493-501.
4 Song H,Li C,Li R,et al.Prognostic significance of AEG-1 expression in colorectal carcinoma[J].Int J Colorectal Dis,2010,25(10):1201-1209.
5 Li C,Liu J,Lu R,et al.AEG-1 overexpression:A,novel indicator for peritoneal dissemination and lymph node metastasis in epithelial ovarian cancers[J].Int J Gynecol Cancer,2011,21(4):602-608.
6 Gupta GP,Massague J.Cancer metastasis:building a framework[J].Cell,2006,127(4):679-695.
7 Chiang AC,Massague J.Molecular basis of metastasis[J].New Engl J Med,2008,359(26):2814-2823.
8 Klein CA.Cancer.:The metastasis cascade[J].Science,2008,321(5897):1785-1787.
9 Martin TA,Jiang WG.Tight junctions in cancer metastasis[J].Spring Neth,2013,16(1):224-231.
10 Wang F,Li HM,Wang HP,et al.siRNA-mediated knockdown of VEGF-A,VEGF-C and VEGFR-3 suppresses the growth and metastasis of mouse bladder carcinoma in vivo[J].Exp Ther Med,2010,1(5):899-904.
11 Wang Q,Diao X,Sun J,et al.Regulation of VEGF,MMP-9 and metastasis by CXCR4 in a prostate cancer cell line[J].Cell Biol Int,2011,35(9):897-904.
12 Liu W,Beck BH,Vaidya KS,et al.Metastasis suppressor KISS1 seems to reverse the Warburg effect by enhancing mitochondrial biogenesis[J].Cancer Res,2014,74(3):954-963.
13 Emdad L,Lee SG,Su ZZ,et al.Astrocyte elevated gene-1(AEG-1)functions as an oncogene and regulates angiogenesis[J].P Natl Acad Sci U S A,2009,106(50):21300-21305.
14 Yoo BK,Emdad L,Lee SG,et al.Astrocyte elevated gene-1(AEG-1):A multifunctional regulator of normal and abnormal physiology[J].Pharmacol Therapeut,2011,130(1):1-8.
15 Li C,Wu X,Zhang W,et al.AEG-1 Promotes metastasis through downstream AKR1C2 and NF1 in liver cancer[J].Oncol Res,2014,22(4):203-211.
16 Li C,Wu X,Zhang W,et al.High-content functional screening of AEG-1 and AKR1C2 for the promotion of metastasis in liver cancer[J].J Biomol Screen,2016,21(1):101-107.
17 Srivastava J,Siddiq A,Gredler R,et al.Astrocyte elevated gene-1 and c-Myc cooperate to promote hepatocarcinogenesis in mice[J].Hepatology,2015,61(3):915-929.
18 Miletic H,Niclou SP,Johansson M,et al.Anti-VEGF therapies for malignant glioma:treatment effects and escape mechanisms[J].Expert Opin Ther Tar,2009,13(4):455-468.
19 Mazzone M.Novel alternatives for anti-angiogenetic therapy and therapeutic angiogenesis[J].Verh K Acad Geneeskd Belg,2010,72(3-4):165-175.
20 Wang C,Yang Q.Astrocyte elevated gene-1 and breast cancer(Review)[J].Oncol Lett,2011,2(3):399-405.
21 Benci V,Freguglia P.About emergent properties and complexity in biological theories[J].Riv Biol,2004,97(2):255-268.
(收稿:2017-02-24)
坚决贯彻执行《发表学术论文“五不准”》通知
为弘扬科学精神,加强科学道德和学风建设,抵制学术不端行为,端正学风,维护风清气正的良好学术生态环境,重申和明确科技工作者在发表学术论文过程中的科学道德行为规范,中国科协、教育部、科技部、卫生计生委、中科院、工程院、自然科学基金会共同研究制定了《发表学术论文“五不准”》。
1.不准由“第三方”代写论文。科技工作者应自己完成论文撰写,坚决抵制“第三方”提供论文代写服务。
2.不准由“第三方”代投论文。科技工作者应学习、掌握学术期刊投稿程序,亲自完成提交论文、回应评审意见的全过程,坚决抵制“第三方”提供论文代投服务。
3.不准由“第三方”对论文内容进行修改。论文作者委托“第三方”进行论文语言润色,应基于作者完成的论文原稿,且仅限于对语言表达方式的完善,坚决抵制以语言润色的名义修改论文的实质内容。
4.不准提供虚假同行评审人信息。科技工作者在学术期刊发表论文如需推荐同行评审人,应确保所提供的评审人姓名、联系方式等信息真实可靠,坚决抵制同行评审环节的任何弄虚作假行为。
5.不准违反论文署名规范。所有论文署名作者应事先审阅并同意署名发表论文,并对论文内容负有知情同意的责任;论文起草人必须事先征求署名作者对论文全文的意见并征得其署名同意。论文署名的每一位作者都必须对论文有实质性学术贡献,坚决抵制无实质性学术贡献者在论文上署名。
本“五不准”中所述“第三方”指除作者和期刊以外的任何机构和个人;“论文代写”指论文署名作者未亲自完成论文撰写而由他人代理的行为;“论文代投”指论文署名作者未亲自完成提交论文、回应评审意见等全过程而由他人代理的行为。
本刊编辑部
AEG-1 promotes metastasis of breast cancer MCF-7 cells
LIYinghong1,LIUJunjun2,NINGXiaoming2,LICong3,LILejing1
1.Department of Internal Medicine,Harbin Medical University Cancer Hospital,Harbin 150081,China;2.Department of Pathology,Harbin Medical University Cancer Hospital;3.Department of Hepatobiliary Surgery,China PLA General Hospital
Objective The objective of this study was to observe the effect of AEG-1 gene on the metastasis in breast cancer MCF-7 cells.Methods AEG-1 siRNAs were transfected into MCF-7 cells to silence AEG-1 expression,and negative siRNA was used as a control.Transwell chamber was used to detect the ability of cell migration and invasion of MCF-7 cells.CCK8 assay was used to detect the cell proliferation of MCF-7 cells.At the same time,the effect of VEGF on the angiogenesis was investigated by detecting the changes of lumen formation in HUVEC cells.Results The migration,invasive and proliferative abilities were significantly inhibited in MCF-7 cells transfected with AEG-1 siRNA.Knockdown AEG-1 was significantly decreased the level of VEGF in the supernatant of MCF-7 cells.Knockdown AEG-1 was also significantly inhibited the angiogenesis activity in HUVEC cells.Conclusion Knockdown AEG-1 can significantly inhibit the migration of MCF-7 cells,including cell migration,invasion,proliferation and angiogenesis.These results suggest that AEG-1 plays an important role in the metastasis process of breast cancer and opens up new ideas for future treatment breast cancer.
AEG-1;Breast cancer;Metastasis
黑龙江省教育厅课题面上项目(12521295)
1.哈尔滨医科大学附属肿瘤医院内五科(哈尔滨 150081);2.哈尔滨医科大学附属肿瘤医院病理科;3.中国人民解放军总医院肝胆外科
李英红,女,(1975-),博士,副主任医师,从事实体肿瘤基础与临床的研究。
李乐静,E-mail:xcl_1974@163.com
R735.3+5
A
10.11904/j.issn.1002-3070.2017.04.003
