可乐定ELISA检测试剂盒的研制及其性能评价
2017-09-03李丹妮顾欣黄华陆沛嗣王学生黄士新
李丹妮 ,顾欣,黄华,陆沛嗣,王学生,黄士新*
(1.上海市兽药饲料检测所,上海 201103;2.上海容晖生物科技有限公司,上海 200231)
可乐定ELISA检测试剂盒的研制及其性能评价
李丹妮1,顾欣1,黄华2,陆沛嗣2,王学生2,黄士新1*
(1.上海市兽药饲料检测所,上海 201103;2.上海容晖生物科技有限公司,上海 200231)
通过制备可乐定完全抗原,免疫新西兰大白兔,得到特异性多克隆抗体,和HRP标记的羊抗兔构建间接ELISA检测法试剂盒,并进行性能测试评价。结果表明,吸光度百分比值与可乐定质量浓度的对数在0.1~8.1 μg/L呈线性关系,相关系数R2为0.977,半数抑制浓度(IC50)为0.675 ng/mL,检测限为0.2 ng/mL,在浓度为0.15~0.5 ng/mL添加范围内,回收率为81%~109%,具备良好的特异性,可用于动物尿样、血清和组织中的可乐定残留检测。
可乐定;酶联免疫吸附测定;多克隆抗体;试剂盒
可乐定(Clonidine)化学名[2-(2,6-二氯苯基)亚氨基]咪唑啉,是一种通过刺激脑干α2-肾上腺受体动剂,能抑制中枢神经降低血压药物。同时可乐定是咪唑啉衍生物具有激发与促进垂体增加分泌生长激素(GH)的作用,故可乐定还可提高动物生长和改善胴体品质[1-3],畜禽类饲养含有可乐定的饲料可以增加畜禽类体重和瘦肉率,但可乐定毒副作用大、易积累,食用含有可乐定残留的动物源性食品,对人体健康具有相当的危害。农业部2010年发布了1519号公告,向社会公布了禁止在饲料、动物饮用水和畜禽水产养殖过程中使用的药物和物质清单,可乐定已明确被列入其中[4]。
近年来由于国家对瘦肉精类药物的监管力度不断加大,加强对饲料、经济动物尿样的可乐定残留检测是保障食品安全重要手段,目前检测动物组织、血液中可乐定残留的方法,主要是液相色谱-串联质谱法(LC/MS/MS)[5-7],该方法灵敏度较高,但检测时间长、操作较繁琐、检测成高,不适用于养殖业和现场快速筛查。本研究通过制备可乐定完全抗原,免疫新西兰大白兔产生特异性抗体,根据免疫竞争原理,采用抗原抗体特异性反应,建立了一种适用于动物尿液、组织中可乐定残留检测的酶联免疫检测试剂盒,具有操作简单、灵敏度高、特异性好、检测时间短等优点,适合基层和现场快速检测。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂 可乐定标准品(纯度≥99%),碳化二亚胺盐酸盐(EDC·HCl)(纯度≥99%),牛血清白蛋白(BSA),卵白蛋白(OVA),弗氏完全佐剂、弗氏不完全佐剂,3,3',5,5'-四甲基联苯胺(TMB)等均购自美国Sigma公司;辣根过氧化物酶(HRP)购自上海雪满生物公司;N ,N -二甲基甲酰胺(GR)等其他化学试剂购自国药集团。
1.1.2 仪器与设备 酶标仪360T,上海科华公司;旋转蒸发仪R-215,BuchiLabortechnik AC;高速冷冻离心机CT14RDII,上海天美;紫外分光光度仪UV-7502PC,上海欣茂仪器有限公司;WatersXevo TM TQ MS,超高效液相色谱—串联质谱仪,配有电喷雾(ESI+)离子源(美国Waters公司);MassLynx v4.1质谱工作站(美国Waters公司)。
1.2 方法
1.2.1 可乐定完全抗原的制备[8-9]在可乐定的苯环4位上引入胺基为商品化的阿可乐定(Apraclonidine),阿可乐定和丁二酸酐酰化反应形成CLD-COOH即接臂的可乐定半抗原,其合成过程见图1,再经过缩合剂EDC·HCl和载体蛋偶联成完全抗原。560 mg盐酸阿可乐定(Apraclonidine hydrochloride)、200 mg丁二酸酐置于1 mL吡啶和3 mL苯于反瓶,加热搅拌回流5 h,待反应完全后,减压蒸去溶剂,固体加无水乙醇和活性炭一起搅拌,加热回流,滤除活性炭,滤液加入氯化氢乙醇溶液冷却形成结晶,过滤,用冷无水乙醇洗结晶,干燥得到可乐定的半抗原CLD-COOH。将10 mg CLD-COOH半抗原、8 mg NHS和10 mg EDC溶于0.5 mL DMF中(混合物A),4 ℃搅拌过夜。次日,先将30 mg BSA(OVA)溶于3 mL 0.02 mol/L的磷酸氢二钠溶液中,并将混合物A逐滴加入,室温搅拌6 h。装入透析袋,用0.01 mol/L pH7.2的PBS透析,并换液4次,得到可乐定的完全抗原CLD-BSA或CLD-OVA。

图1 半抗原可乐定接臂合成路线Fig 1 Synthesis scheme of clonidine hapten
1.2.2 可乐定多克隆抗体的制备[10-11]体重大约2 kg的新西兰雄性大白兔,采取背部皮下多点注射的方式进行免疫。基础免疫时,取200 μg(0.4 mg/mL)的可乐定的完全抗原CLD-OVA溶液与等量的CFA(弗氏完全佐剂)混匀乳化,直至形成乳白色的油包水型乳浊液,然后进行注射。2周后进行加强免疫,免疫剂量为100 μg与等量的IFA(不完全佐剂),以后每7 d加强免疫,次数为3~4次具体视情况定,取耳缘静脉血,测血清效价,直到效价不再升高,采用颈动脉取血,离心得到血清。采用CLD-BSA免疫吸附凝胶进行亲和层析纯化,将得到的多克隆抗体加入一定比例的甘油,置-20 ℃保存。
1.2.3 可乐定完全抗原的包被[11-12]用50 mmol/L pH9.6碳酸盐缓冲液将可乐定抗原(CLD-BSA)稀释成系列浓度(0.5~8 μg/μL),依次包被到96孔酶标板,每孔包被量100 μL。4 ℃孵育过夜,将孔中液体倾去,每孔加入250 μL 0.5% BSA 0.01 mol/L PBS pH7.4封闭,于37 ℃恒温箱中孵育2 h,将孔中封闭液倾去,放入温度37 ℃、相对湿度20%的烘房烘干,铝箔包装放存4 ℃待用。
1.2.4 样品检测 动物尿液直接用于检测,如尿液浑浊,将尿液于5000 r/min离心5 min取上清液用于检测。在每孔中加入50 μL系列浓度的可乐定标准品溶液(或样品溶液)和50 μL稀释后的可乐定抗体,25 ℃反应30 min;洗涤4~5次后加入100 μL稀释后的酶标二抗,25 ℃反应30 min;洗涤4~5次后加入50 μL底物液A和50 μL底物液B,25 ℃显色反应15 min;最后加入50 μL终止液终止反应,设定酶标仪于波长450 nm处测定吸光度值。
1.2.5 线性范围 称取可乐定盐酸盐标准品10 mg,溶于1 mL甲醇溶液中制备CLD储备液,放在4 ℃冰箱中备用。将储备液用磷酸盐缓冲液(0.01 mol/L,pH7.2 PBS)稀释成 0、0.1、0.3、0.9、2.7、8.1 ng/mL系列质量浓度,在最优抗原-酶标抗体工作浓度下,测定OD450值。各质量浓度所对应的抑制率I=B/B0×100%(B0对应0 ng/mL的OD值),以CLD药物浓度对数为横坐标,抑制率为纵坐标做标准曲线。
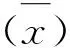
1.2.7 抗体的特异性 可乐定试剂盒与常见的β-兴奋剂类,如莱克多巴胺、沙丁胺醇、克伦特罗等物质进行交叉反应,得出各种药物的半数抑制浓度(IC50),然后计算交叉率,交叉率=IC50(可乐定)/IC50(其他药物)×100。
1.2.8 试剂盒的精密度和准确度 在空白猪尿样中分别添加0.15、0.2、0.5 ng/mL的可乐定标准品,每个浓度重复3次,对3批试剂盒进行测定,计算变异系数(CV),以及计算回收率,回收率=实际测定的浓度/添加的浓度×100%。
1.2.9 试剂盒的符合性 对已确认的阴性样品中进行添加或不添加可乐定标准品进行测定,检测试剂盒的假阳性和假阴性,来评估它的符合性。
2 结 果
2.1 线性范围 以吸光值为纵坐标和质量浓度为横坐标绘成曲线图2,在0.1~8.1 ng/mL之间曲线呈指数形,图3是以吸光值B/B0的百分比值为纵坐标和质量浓度的对数为横坐标作图,表明此试剂盒在0.1~8.1 ng/mL范围呈良好的线性,对曲线进行线性回归得直线方程为y=-40.01x+42.84,相关系数R2=0.9777,半数抑制浓度IC50为0.675 ng/mL。

图2 在450nm下不同可乐定浓度吸光值Fig 2 Absorbance values of different clonidine concentration at 450nm

图3 可乐定浓度对数吸光度百分比Fig 3 Standard curve of clonidine-Kit

2.3 抗体的特异性 可乐定试剂盒与常见的β-兴奋剂类,例莱克多巴胺、沙丁胺醇、克伦特罗等物质的交叉情况检测结果见表1,表明可乐定试剂盒与β-兴奋剂类无交叉反应。

表1 可乐定抗体对其他药物的交叉反应率Tab 1 The percent cross reactivity of clonidine-Kit with beta-agonists
2.4 试剂盒的准确度和精密度 平均添加回收率及变异系数计算结果如表2所示,从表中看到可乐定药物在猪尿中的添加回收率在81%~109%之间;在批内、批间的变异系数3.7%~9.2%之间,表明该ELISA试剂盒具有良好的准确性和精密性。
2.5 试剂盒的符合性 从试剂盒的假阴性、假阳性测定以及仪器检测样品比对情况,评估其符合性。
2.5.1 假阴性率 在已确认的阴性样品中添加不同浓度的可乐定标准品,评价试剂盒的假阴性。添加6份样本,测定结果见表3,均为阳性,未发现假阴性。

表2 准确度和精密度测定结果Tab 2 Recovery test of clonidine added to sample by clonidine-Kit

表3 可乐定的试剂盒假阴性评价结果Tab 3 False negative result of clonidine -Kit ng/mL
2.5.2 假阳性率 取20份经仪器确认的阴性尿样,试剂盒测定结果浓度低于0.1 ng/mL的有18份,浓度低于0.2 ng/mL的有2份,结果判定均为阴性,未出现假阳性。
2.5.3 与仪器测定进行比对 取50份空白猪尿样品,随机添加可乐定标品,制得50份盲样,分别采用ELISA试剂盒和液相色谱-串联质谱进行测定,仪器方法参照文献[10]所述进行操作。经检测40份样品确认为阴性,10份检测结果大于0.2 ng/mL,判定为阳性,ELISA检测结果与液相色谱-串联质谱检测结果相符,表明此试剂盒的符合性高。
3 讨 论
3.1 包被抗原-可乐定抗体-酶标二抗工作浓度选择 采用方阵试验法对间接竞争ELISA法中包被抗原、可乐定抗体和酶标二抗的稀释度进行筛选并确定工作浓度,工作浓度优化根据实际使用时阴性样的检测OD450为2.0左右原则进行调试。将HRP-羊抗兔IgG分别作1︰3000、1︰4000、1︰5000和1︰6000倍稀释,用包被好的ELISA板测其0D值,选择最合适酶标二抗浓度和包被浓度。通过方阵试验得到最优浓度组合为:抗原包被浓度为1~2 μg/mL,可乐定抗体浓度为10 μg/mL,酶标二抗稀释比1︰5000,此时的OD450值2.1左右。
3.2 试剂盒的性能 关键影响因素抗体的特异性和效价决定了试剂盒的性能,这两点又和免疫抗原及免疫方式相关,本研究在不改变可乐定分子结构特征基础上进行接臂,通过臂上基团偶联到载体蛋白上,以避免载体蛋白(BSA或OVA)掩蔽可乐定小分子的抗原性,提高免疫效果和效价。在免疫方式上采用抗原和弗氏完全佐剂及不完全佐剂联合应用,适当减少每次免疫剂量,采用小剂量延长免疫周期方式来提多克隆抗体的效价和特异性。
本研究建立了竞争ELISA试剂盒,经性能分析测试,证明此试剂盒具有特异性好、准确性和重复性高等特点,适用于对动物尿样、血清和组织中的可乐定残留快速检测,为可乐定残留的监控提高了灵敏高、准确性好、快速便捷的检测方法。
[1] 吴剑平, 张鑫, 顾 欣, 等.高效液相色谱法测定饲料中盐酸赛庚啶和盐酸可乐定含量[J]. 中国饲料, 2014, 13: 33-36.
Wu J P, Zhang X, Gu X. Determination of cyproheptadine hydrochloride and clonidine hydrochloride in feed by high performance liquid chromatography[J]. China Feed, 2014, 13: 33-36.
[2] 陈其煌. 高效液相色谱-串联质谱法测定猪尿液中盐酸可乐定和盐酸赛庚啶[J]. 福建农业学报, 2012,27(6):596-600.
Chen Q H. HPLC-MS/Ms determination of clonidine hydrochloride and cyproheptadine hydrochloride contents in swine urine [J].Fujian Journal of Agricultural Sciences,2012,27(6):596-600.
[3] 黄士新, 李丹妮, 顾欣, 等. 赛庚啶ELISA检测试剂盒的研制及其性能测试[J]. 中国兽药杂志, 2016, 50(11): 44-48.
Huang S X, Li D N, Gu X. Development and performance measurement of cyproheptadine ELISA test kit[J]. Chinese Journal of Veterinary Drug, 2016, 50(11): 44-48.
[4] 农业部第1519号公告. 禁止在饲料和动物饮水中使用的物质名单[S].
Announcement of the Department of Agriculture No. 1519. The prohibited list of substances used in feed and animal drinking water[S].
[5] 许秀琴, 杨挺, 赵健, 等. 高效液相色谱-串联质谱法测定猪肉中盐酸可乐定和盐酸赛庚啶[J]. 安徽农业科学, 2015, (22): 216-218, 244.
Xu X Q, Yang T, Zhao J. Determination of clonidine hydrochloride and cyproheptadine hydrochloride in swine tissue by ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Anhui Agri Sci, 2015, 43(22): 216-218, 244.
[6] 杨挺, 许秀琴, 赵健, 等. 高效液相色谱-串联质谱法测定猪血中盐酸可乐定和盐酸赛庚啶[J]. 肉类研究, 2015, (6): 25-28.
Yang T, Xu X Q, Zhao J. Determination of clonidine hydrochloride and cyproheptadine hydrochloride in swine tissue by ultra performance liquid chromatography-tandem mass spectrometry[J]. Meat Research,2015, (6): 25-28.
[7] 陈其煌. 高效液相色谱—串联质谱法测定猪肝中可乐定和赛庚啶[J]. 浙江农业学报, 2013, (3): 623-629.
Chen Q H. High performance liquid chromatography tandem mass spectrometry method for the determination of clonidine and cyproheptadine in pork liver[J]. Acta Agriculturae Zhejiangensis, 2013, (3): 623-629.
[8] 李卫芬, 程敬丽, 朱国念, 等.一种克伦特罗半抗原化合物、合成方法及其用途[P]. CN 1793108A, 2006-01-06.
Li W F, Cheng J L, Zhu G N.A type of cronterol semi-antigen compound, synthetic method and its use[P]. CN 1793108A, 2006-01-06.
[9] Yan Zhang, Fengxia Wang, Li Fang,etal. Rapid Determination of ractopamine residues in edible animal products by enzyme-linked immunosorbent assay: development and investigation of matrix effects[J]. J Biomed Biotechnol, 2009, ID 579175, 9.
[10]Cooper K M,Caddell A,Elliott C T,etal. Production and charactersation of polyclonal antibodies to a derivative of 3-amino-2- oxazo1idinone, a metabolite of the nitrofuranfurazolidone[J]. Anal Chim Acta, 2004, (520):79-86.
[11]朱立平,陈学清. 免疫学常用实验方法[M]. 北京:人民军医出版社,2000: 451-457.
Zhu L P, Chen X Q. Experimental methods for immunology [M]. Beijing: People 's Military Medical Publishing House,2000: 451-457.
[12]巴德年. 当代免学技术与应用[M]. 北京: 北京医科大学、中国协和医科大学联合出版社,1998: 357.
Ba D N. Contemporary technology and application. [M].Beijing: Beijing Medical University, China Union Medical University Joint Publishing House , 1998: 357.
(编辑:李文平)
Development and Performance Measurement of Clonidine ELISA Test Kit
LI Dan-ni1, GU Xin1, HUANG Hua2, LU Pei-si2, WANG Xue-sheng2, HUANG Shi-xin1*
(1.Shanghai Muncipal Institute of Veterinary Drug and Feedstuff Control, Shanghai 201103, China;2.Rohi Biotechnology Co.Ltd, Shanghai 200231, China)
HUANG Shi-xin, E-mail: yure@yeah.net
An indirect competitive ELISA assay with preparing specific anti-clonidine polyclonal antibody was developed for the rapid detection of clonidine in the animal urine. The results showed that the logarithm of clonidine concentration with the absorbance percentage shows a linear relationship between 0.1~8.1 ng/mL, the correlation coefficientR2is 0.977, the half inhibitory concentration (IC50) is 0.675 ng/mL, the detection limit for the clonidine assay is 0.159 ng/mL, the sample recovery is 81%~109%, the variation coefficient is 3.7%~9.2%. This assay exhibits good specificity with no any cross reactions to β-agonists. It could be used as rapid detection for the residual clonidine in the samples such as animal urine, serum and tissues.
clonidine; competitive ELISA; polyclonal antibody; test kit
10.11751/ISSN.1002-1280.2017.8.07
国家公益性行业(农业)科研专项(201203023);上海市科技兴农重点攻关项目[沪农科攻字(2014)第3-3号]
李丹妮,高级畜牧师,从事兽药残留检测与方法开发。
黄士新。E-mail:yure@yeah.net
2017-01-28
A
1002-1280 (2017) 08-0040-06
S859.84
