3株H9亚型禽流感毒株的分离鉴定和交叉攻毒保护试验比较
2017-09-03蔡青秀张园园魏波蒋贻海凌红丽
蔡青秀,张园园,魏波,蒋贻海,凌红丽
(青岛蔚蓝生物制品有限公司,山东青岛 266114)
3株H9亚型禽流感毒株的分离鉴定和交叉攻毒保护试验比较
蔡青秀,张园园,魏波,蒋贻海,凌红丽*
(青岛蔚蓝生物制品有限公司,山东青岛 266114)
为了解山东部分地区H9亚型禽流感病毒变异情况,将2015年采自潍坊、聊城、烟台的H9N2禽流感疑似病料,进行RT-PCR扩增、测序、遗传进化分析,并将3株分离株纯化后进行了血清学和交叉攻毒保护试验。结果显示: 3株分离株之间的HA和NA基因同源性很高,分别为97%~97.6%和93.5%~94.4%,而与早期分离株和疫苗株的同源性较低,分别为74.9%~90.3%和86.3%~92.3%;遗传进化分析显示3株分离株与GenBank中近年的H9N2分离株亲缘关系近,同属Y280-like分支,而与早期分离株的亲缘关系较远。交叉攻毒保护实验结果证明,不同地点分离的H9N2禽流感流行毒株间有较好的交叉保护力。本研究为指导禽流感疫情防控以及疫苗研制提供了依据。
H9N2亚型禽流感病毒;HA基因;NA基因;遗传进化分析;交叉攻毒保护
禽流感是由禽流感病毒引起的禽类的一种传染病,分为高致病性禽流感和低致病性禽流感,高致病性禽流感引起家禽高发病率和死亡率,而低致病性禽流感则导致家禽出现呼吸道症状、生长发育受阻及产蛋下降等,严重危害养禽业的健康发展[1]。我国自1992年首次报道从鸡群中分离到H9N2亚型禽流感病毒以来,目前绝大部分省市都有H9亚型禽流感的流行,给我国养禽业造成了巨大的经济损失[2-3]。
禽流感基因组为8节段的负链RNA,很容易发生基因突变和重排现象[4],尤其是在免疫压力等因素的作用下,国内外已有许多关于禽流感在家禽中不断发生变异的报道[5-6]。H9亚型禽流感灭活疫苗的广泛应用使得该病得到了有效控制,但是近几年来H9亚型禽流感在免疫鸡群中仍时有发生[7],仍然是影响我国养禽业健康发展的重要疾病之一。因此,加强H9N2 AIV遗传演化的检测和分析十分必要。本研究通过对2015年在山东地区分离得到的3株H9N2 禽流感毒株进行序列遗传变化的分析和交叉攻毒保护试验,以期了解山东部分地区近年来H9N2亚型AIV的遗传变异情况,为H9亚型禽流感的防控策略及疫苗研制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 病料和鸡胚 病料分别采自2015年山东潍坊、聊城、烟台地区疑似禽流感病死鸡的肺、气管等组织。10日龄SPF鸡胚购自北京梅里亚维通试验动物技术有限公司。
1.1.2 毒株和血清 NDV阳性血清、EDSV阳性血清及SPF鸡阴性血清均购自中国兽医药品监察所;H9亚型、H7亚型、H5亚型AIV阳性血清购自中国农业科学院哈尔滨兽医研究所。
1.1.3 试剂和载体 Trizol reagent、DEPC 水购于Invitrogen 公司;RT-PCR试剂盒、凝胶回收试剂盒购自Takara公司;pET-32a载体为本实验室保存;无水乙醇、异丙醇、氯仿等均为国产分析纯。
1.1.4 引物设计与合成 根据GenBank上公布的禽流感H9N2的HA和NA基因序列,利用Primer 5软件分别设计了2对扩增引物,各引物的序列用途及扩增长度详见表1。
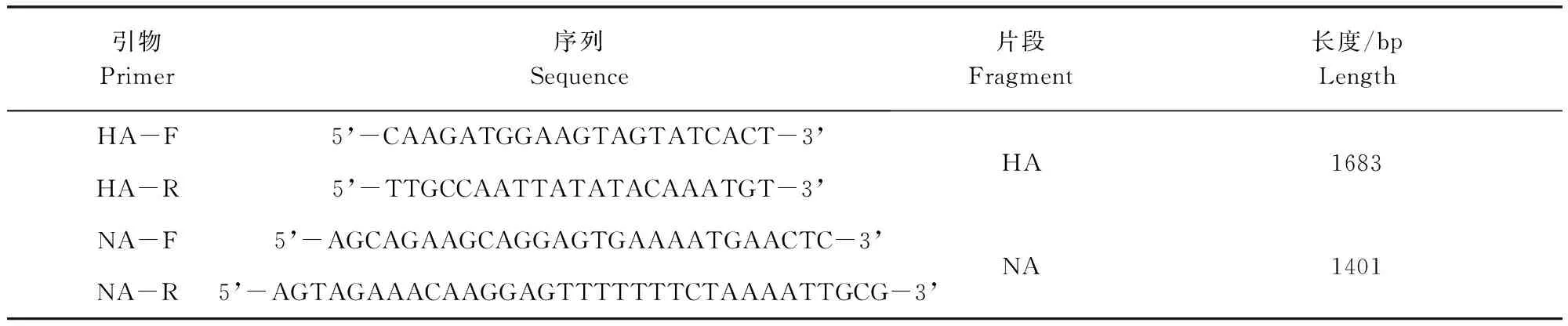
表1 PCR扩增所用引物Tab 1 Primers used for PCR
1.2 方法
1.2.1 病料的处理 将山东不同区域采集的疑似禽流感病鸡的肺、气管等组织病料分别剪碎研磨后,按1∶5比例加入灭菌生理盐水(内含1000 U/mL双抗),制成匀浆。在-20 ℃反复冻融3次,8000 r/min离心15 min,取上清,经0.22 μm滤膜无菌过滤。
1.2.2 鸡胚接种 将上述3份滤液分别经尿囊腔接种10日龄SPF鸡胚各5枚,0.2 mL/胚,37 ℃继续孵育。24 h内死亡鸡胚弃去,观察至96 h,无论死胚、活胚逐胚收获尿囊液,标记后冻存。
1.2.3 血清学鉴定
1.2.3.1 红细胞凝集试验(HA) 按现行《中国兽药典》附录进行,分别测定各鸡胚液对1%鸡红细胞的凝集效价。
1.2.3.2 血凝抑制试验(HI) 将有血凝性的鸡胚液用灭菌生理盐水稀释成4HA单位的抗原液,分别与H9亚型AIV阳性血清、NDV阳性血清、ESDV阳性血清、H5、H7亚型AIV阳性血清和SPF鸡阴性血清作HI试验。
1.2.4 分子生物学鉴定
1.2.4.1 RNA的提取和RT-PCR扩增 病毒RNA的提取参照Trizol Reagent说明书进行。所用试剂均为RNase-free,器皿均用DEPC水处理并经过高压灭菌。RT-PCR反应根据Takara公司One-step RT-PCR试剂盒说明书进行。
1.2.4.2 HA、NA基因的TA克隆和序列分析 HA基因、NA基因全长PCR产物经核酸电泳鉴定大小正确后,利用凝胶回收试剂盒回收,回收产物分别连接pET-32a进行TA克隆,每个毒株的HA和NA基因分别选3株PCR鉴定阳性克隆株送南京金斯瑞公司测序,测序结果与GenBank中的参考序列(表2)进行同源性和遗传进化分析。

表2 参考序列Tab 2 Reference strains
1.2.5 毒种纯化与增殖 采用鸡胚终点稀释法并结合血清中和试验方法进行:将WF株、LC株、YT株抗原液做1000倍稀释后与等量的ND阳性血清、H5亚型AIV阳性血清(体积比为1∶1∶1),室温作用1小时,进一步做10倍递进稀释,取10-2、10-3、10-4三个稀释度(最终稀释度为10-5、10-6、10-7)各接种10日龄SPF鸡胚5枚,每胚0.1 mL,置37 ℃继续孵育。选接种后72~120 h死亡且病痕明显的鸡胚,逐枚收获鸡胚液并测定HA效价,选择最高稀释度的一枚感染胚液为传代接种物。按照上述方法将毒种纯化3代。将第三代感染胚液用灭菌生理盐水作10-4稀释,经尿囊腔接种10日龄SPF鸡胚,每胚0.1 mL,选接种后72~120 h死亡且病痕明显的鸡胚,收获鸡胚液混合,定量分装。
1.2.6 病毒含量测定 将鸡胚液用灭菌生理盐水作10倍系列稀释,取10-6、10-7、10-8、10-9 4个稀释度,各尿囊腔内接种10日龄SPF鸡胚各5枚,0.1 mL/胚,置37 ℃继续孵育。24 h以前死去的鸡胚弃去不计,观察至120 h,无论死胚、活胚逐胚收获鸡胚液,分别测定红细胞凝集价,凝集价不低于1︰16(微量法)者判为感染,按照Reed-Muench法计算EID50。
1.2.7 单因子血清的制备 取1月龄SPF鸡12只,分3组,分别颈部皮下注射WF、LC、YT病毒株弗氏完全佐剂灭活疫苗0.5 mL/只,免疫后7 d、14 d采血检测HI抗体,免疫后第14天分别免疫WF、LC、YT病毒株弗氏不完全佐剂灭活疫苗,免疫后21 d、28 d采血检测,直至血清HI效价达9~10log2,若免疫后21 d仍未达到,则加强免疫,达到要求后,采血分离血清。
1.2.8 交叉血凝抑制试验 在同一条件下,用4个血凝单位的病毒抗原分别交叉测定三种单因子血清对每种病毒的HI效价。HA和HI试验参照现行《中国兽药典》方法进行。
1.2.9 交叉免疫攻毒保护试验
1.2.9.1 疫苗制备 将WF株、LC株及YT株分别用灭菌生理盐水作1000倍稀释,分别经尿囊腔途径接种10日龄SPF鸡胚,0.1 mL/胚,接种后继续在37 ℃孵育至120 h,每8~12 h照蛋一次,弃去接种后24 h内死亡的鸡胚,收获24~120 h的死胚及120 h的活胚尿囊液,测定病毒液的血凝效价及EID50。收获的病毒液中分别加入终浓度为0.2%的甲醛溶液,置37 ℃恒温摇床内灭活24 h。分别取3个毒种的灭活病毒抗原液,以吐温-80及司本-80为乳化剂,白油为佐剂,分别乳化制成WF株、LC株及YT株共3个毒株的油包水型灭活疫苗,油水比为2︰1。
1.2.9.2 免疫 将60只21日龄的SPF鸡分成4个组,每组15只鸡,第1、2、3组为免疫组,分别经颈部皮下注射WF株、LC株及YT株灭活疫苗,0.3 mL/只,第4组为对照,不免疫。
1.2.9.3 HI效价测定 于免疫后21 d,所有试验鸡采血,对各试验组鸡分别用WF株、LC株及YT株3种HI试验抗原进行HI效价测定。
1.2.9.4 交叉攻毒保护试验 采血后,各试验鸡分别用禽流感H9亚型流行毒株攻击,每组15只鸡,各取5只分别攻WF毒株、LC毒株和YT毒株。攻毒剂量为100倍稀释毒0.5 mL/只,翅静脉注射,攻毒后第5天采集所有试验鸡的泄殖腔及咽拭子进行病毒分离,观察不同毒株灭活疫苗对不同毒株攻击的交叉保护情况。
2 结 果
2.1 病毒的分离培养 WF株、LC株及YT株病料分别接种5枚SPF鸡胚观察至96 h分别有2枚、3枚和2枚死亡,逐胚收获鸡胚液,标记。将收获的鸡胚液进行HA试验,结果死亡胚都有血凝性,接种存活胚和对照组的HA效价1︰2。接种死亡胚的检测情况详见表3。

表3 病毒分离结果Tab 3 Results of virus isolation
2.2 HI试验 将有血凝活性的分离物分别用灭菌生理盐水稀释成4HA单位的抗原液,血凝抑制试验结果表明,分离病毒只被禽流感病毒H9亚型阳性血清特异性抑制,血凝抑制效价为27~28,不被禽流感病毒H5、H7亚型阳性血清、新城疫病毒阳性血清抑制,初步判定分离毒株是H9亚型禽流感病毒。
2.3 RT-PCR检测和TA克隆 HA基因、NA基因PCR产物经核酸电泳鉴定大小正确后(图1、图2),利用凝胶回收试剂盒回收并分别连接pET-32a进行TA克隆,每个毒株的HA、NA基因分别选3株PCR鉴定阳性克隆株送南京金斯瑞公司测序,测序结果与GenBank中H9N2禽流感毒株的参考序列进行核苷酸序列同源性比较,并用MEGA 4.0软件绘制基因进化树。
M. Marker DL2000; 1. WF株HA; 2. LC株HA; 3.YT株HA; 4.SPF鸡胚液; 5.阳性对照M. Marker DL2000; 1. HA of WF strain; 2. HA of LC strain; 3. HA of YT strain; 4. Negative control; 5. Positive control图1 H9N2 AIV分离株HA基因RT-PCR扩增结果Fig 1 HA genes amplified by RT-PCR of H9N2 AIV isolate strains

M. Marker DL2000; 1.WF株NA; 2.LC株NA;3.YT株NA; 4. SPF鸡胚液; 5.阳性对照M. Marker DL2000; 1. NA of WF strain; 2. NA of LC strain; 3. NA of YT strain; 4. Negative control; 5. Positive control图2 H9N2 AIV分离株NA基因RT-PCR扩增结果Fig 2 NA genes amplified by RT-PCR of H9N2 AIV isolate strains
2.4 HA基因序列分析 测序结果显示,WF株、LC株、YT株的HA基因全长大小相同,都为1683 bp,其与GenBank中H9N2参考序列进行比对发现,本研究中分离到的WF株、LC株、YT株之间核苷酸同源性为97%~97.6%,推导的氨基酸同源性为97.8%~98.2%;与GenBank中早期分离株(HongKongY439、HongKong Y280)、经典疫苗株(Shandong/6/96、Shanghai/F/98)的同源性较低,为74.9%~90.3%,推导的氨基酸序列为80.0%~91.7%。与GenBank上发表的2009~2015年的H9亚型禽流感毒株的同源性较高,高达92.1%~98.9%,推导的氨基酸序列同源性为93.5%~98.6%。遗传进化分析结果与同源性分析结果一致,近年分离株和早期分离株明显分为不同簇,而本研究中的3个分离株与近年分离株的亲缘关系最近,属于Y280-like分支(图3)。
2.5 NA基因序列分析 测序结果显示,WF株、LC株、YT株的NA基因全长大小相同,都为1401 bp,其与GenBank中H9N2参考序列进行比对发现,本研究中3个分离株之间核苷酸同源性为93.5%~94.4%,推导的氨基酸同源性为94.6%~95.3%;与GenBank中早期分离株(HongKongY439、HongKong Y280)、经典疫苗株(Shandong/6/96、Shanghai/F/98)的同源性较低,为86.3%~92.3%,推导的氨基酸序列为87.1%~93.7%。与GenBank上发表的2009~2015年的H9亚型禽流感毒株的同源性较高,高达94.2%~99.2%,推导的氨基酸序列同源性为95.3%~99.6%。遗传进化分析结果与同源性分析结果一致,近年分离株和早期分离株明显位于不同簇,而本研究中的3个分离株与近年分离株的亲缘关系最近,同属Y280-like分支(图4)。
2.6 毒种纯化与增殖 采用鸡胚终点稀释法并结合血清中和试验方法将WF株、LC株和YT株毒种连传三代进行了纯化,选择三代时最高稀释度的一枚感染胚液作为毒种进行病毒繁殖。
2.7 病毒含量 经测定,WF株、LC株、YT株毒种病毒含量分别为108.17、107.83和107.68EID50/0.1mL。

图3 HA基因全长遗传进化树分析Fig 3 Phylogenetic tree based on complete HA genes

图4 NA基因全长遗传进化树分析Fig 4 Phylogenetic tree based on complete NA genes
2.8 HI抗体测定 不同地点分离的3株禽流感H9亚型流行毒株所制备出的3种灭活疫苗免疫SPF鸡21 d后,分别用同样3株抗原进行HI抗体效价检测,结果WF株、LC株和YT株制备的疫苗HI效价分别为8.8~10.0log2、9.4~9.8log2和6.0~10.4log2(表4),可见同一灭活苗免疫组鸡的血清样品采用不同毒株作为抗原进行测定,其HI抗体效价几何平均值存在较大差异,差异范围为0.2~4.4log2,用同源毒株作为抗原测定免疫组鸡的血清样品,可获得较高的HI抗体效价。
2.9 流行毒株间的交叉攻毒保护试验 结果显示
攻毒对照组均5/5分毒阳性,对照成立。不同区域分离的WF株和YT株制备的疫苗对WF株和YT株交叉攻毒均能达到100%(5/5)保护;但对LC株攻毒均为80%(4/5)保护;LC株制备的疫苗用3种不同毒株攻毒均能达到100%(5/5)保护(表5)。

表4 3个不同毒株灭活疫苗免疫后用不同抗原进行HI试验的结果Tab 4 HI test results based on three strains of three different inactivated vaccines

表5 流行毒株间的交叉攻毒保护试验Tab 5 Cross-immunity protection among epidemic isolates
3 讨 论
H9N2亚型禽流感在国内的发生最早可追溯到1994年[8],直到1998年下半年至1999年上半年,在山东省大面积爆发该病[9]。目前该病在中国多省地区广泛存在,不仅是严重危害中国养禽业的主要疾病之一,而且还危害到人类的健康。1998年大面积推广应用针对疫情的H9N2亚型禽流感疫苗,对控制疫情的流行发挥了重要作用,BJ94-like类型的毒株在临床上的分毒率明显下降[10]。但Y280-like亚群禽流感毒株逐渐增多,在国内养殖场广泛流行,免疫失败的比例逐年增加,在2010年达到高峰,系统进化树发现,该类型的毒株目前已经成为优势流行株[11]。娄本红等[12]在鸡胚上研究了H9N2亚型禽流感的HA基因在抗体选择压力下的变异,结果显示某些非优势毒株的HA基因在抗体免疫选择压力下发生了抗原性变化,抗原表位变异后能抵抗特异性抗体的中和作用进而由非优势毒株演变为优势毒株。本研究中分离得到的三株禽流感毒株属于Y280-like这一簇,与目前H9N2 AIV经典疫苗株SH/F/98、SD/6/96的同源性低,亲缘关系较远,而与近年流行株的亲缘关系密切。因此,疫苗株与流行株之间的抗原差异可能是导致近年来H9亚型禽流感免疫保护效果不好的重要原因之一。
本研究中的WF株、LC株和YT分离株与不同地域分离株进行遗传进化分析显示,本研究中的3株山东分离株和国内不同地域分离的H9N2亚型禽流感毒株并没有表现出特殊的地域偏好性,与地理位置上相隔较远的广东、广西、上海、浙江等地的近年分离株的同源性亦较高。提示包括山东省在内的全国H9N2亚型禽流感的HA和NA基因可能处在一个比较稳定的遗传演化过程[13],而病毒是通过候鸟或者运输发生传播是值得研究的一个问题,明确病毒的传播途径和方式对禽流感的防控具有重要意义。
本研究采用2015年在山东分离的3株H9亚型禽流感病毒流行毒株,分别制备灭活疫苗,免疫SPF鸡,免疫后21 d,采血测定HI效价,然后分别用上述3株毒株进行攻击,观察不同区域分离的H9亚型流行毒株的交叉免疫攻毒保护效果,结果显示,用不同地点分离的这3株H9N2 AIV流行毒株所制备出的3种灭活疫苗免疫SPF鸡21 d后,HI抗体效价均明显上升,达到6.0~10.4log2;这3种灭活疫苗所诱导产生的HI抗体效价存在一定的差异,差异范围为0.2~4.4log2,用同源毒株作为抗原测定免疫鸡的血清样品可获得较高的HI抗体效价。每个疫苗免疫组分别用WF株、LC株、YT株进行攻毒后,对照鸡均100%分毒阳性,3种灭活疫苗对这3株流行毒株攻毒的保护率80%~100%(4/5~5/5)。结果证明了本研究中这3个不同地点分离的H9N2 AIV流行毒株相互间有较好的交叉保护力,这也与序列分析结果显示3株流行毒株的亲缘关系较近相一致。
当前H9N2亚型禽流感病毒在中国很多地区流行,又因为禽流感病毒是分节段的单股负链RNA病毒,同一毒株在复制的过程中以及不同毒株之间很可能发生基因突变和基因重组,所以加强对H9N2亚型禽流感病毒的生物学特性和分子流行病学研究,对于家禽养殖和公共卫生安全方面具有重要的现实意义。本研究通过对3株不同地点分离的H9N2 AIV毒株进行了HA、NA基因的遗传进化分析和生物学特性分析,为了解山东省H9N2 AIV的流行变异情况和疫苗研制提供了依据。
[1] 卡尔尼克B W. 禽病学[M].10版.高福, 苏敬良, 译. 北京:中国农业出版, 1999: 742-758.
Karnik B W. Diseases of poultry[M]. 10th Edition. Gao F, Su J L, Translate. Beijing: China Agriculture Press, 1999: 742-758.
[2] Li C, Yu K, Tian G,etal. Evolution of H9N2 Influenza viruses from domestic poultry in Mainland China[J]. Virology, 2005, 340(1): 70-83.
[3] 孙泉云, 陈琦, 夏炉明. H9N2 亚型禽流感流行现状[J].动物医学进展,2011, 32(10): 107-111.
Sun Q Y, Chen Q, Xia L M. The epidemic situations of H9N2 subtype avian influenza [J]. Progress in Veterinary Medicine, 2011, 32(10): 107-111.
[4] Zhao M J, Liu Q T, Sun Q,etal. Full genome sequence of a natural reassortant H9N2 avian influenza virus isolated from domestic ducks in Jiangsu Province, China[J]. Genome Announcements, 2013, 1(4): e00463-13.
[5] Meng F, Xu H Y, Zhang W,etal. Genetic evolution and substitution frequency of avian influenza virus HA gene in chicken H9N2 subtype in China in the last 20 years[J]. PubMed, 2016, 56(1): 35-43.
[6] Duong M T, Thomas P P, Vu Thi N B,etal. Prevalence and diversity of H9N2 avian influenza in chickens of Northern Vietnam, 2014[J]. Infection, Genetics and Evolution,2016,44:530-540.
[7] Su X N, Xie Q M, Liao C T,etal. Sequence and phylogenetic analysis of hemagglutinin genes of H9N2 influenza viruses isolated from chicken in China from 2013 to 2015[J]. Journal of Integrative Agriculture, 2016, 15(11): 2604-2612.
[8] 陈伯伦,张泽纪,陈伟斌.禽流感研究I.鸡A型禽流感病毒的分离与血清学初步鉴定[J]. 中国兽医杂志,1994, 20(10): 3-5.
Chen B L, Zhang Z J, Chen W B. Avian influenza research I. Separation of chicken type A avian influenza and serological preliminary identification[J]. Chinese Journal of Veterinary Medi-cine, 1994, 20(10): 3-5.
[9] Li C J, Yu K Z, Tian G B,etal. Evolution of H9N2 influenza viruses from domestic poultry in Mainland China[J]. Virology, 2005, 340(1): 70-83.
[10]王泽霖, 刘岩, 李建丽, 等. H9N2亚型禽流感病毒抗原性变异的研究[J].中国兽医学报, 2007, 27(3): 351-354.
Wang Z L, Liu Y, Li J L,etal. Research on antigenic drift of H9N2 subtype avian influenza viruses[J]. Chinese Journal of Veterinary Science, 2007, 27(3): 351-354.
[11]刘红旗, 张评浒, 刘秀梵, 等. 封闭式饲养鸡场H9N2亚型禽流感病毒HA基因在5年内的遗传变异[J].微生物学报, 2003, 43(6): 706-711.
Liu H Q, Zhang P H, Liu X F,etal. Genetic mutations of heamagglutinin genes of H9N2 subtype influenza A viruses in the field in a five-year period[J]. Acta microbiologica Sinica, 2003, 43(6): 706-711.
[12]娄本红, 朱秀同, 孙贝贝, 等. 抗体选择压作用下H9N2亚型禽流感病毒HA基因的变异[J].微生物学报,2009,7:955-957.
Lou B H, Zhu X T, Sun B B,etal. Mutations of the hemagglu-tinin gene of H9N2 subtype avian influenza viruses under selective pressure of antibody[J]. Acta microbiologica Sinica, 2009, 7: 955-957.
[13]张伟, 徐怀英, 孟芳, 等. 1999~2013年山东H9N2亚型禽流感病毒HA基因的演化和HI抗原性差异分析[J].中国科学, 2015, 45(2): 190-199.
Zhang W, Xu H Y, Meng F,etal. Phylogenetic analysis of hem-agglutinin genes and HI antigen variance analysis[J]. Science China, 2015, 45(2): 190-199.
(编辑:李文平)
Isolation and Identification of Three H9 Subtype Avian Influenza Virus and Cross-immunity Protection Comparison
CAI Qing-xiu, ZHANG Yuan-yuan, WEI Bo, JIANG Yi-hai, LING Hong-li*
(Qingdao Vland Biological Products Co., Ltd, Shandong 266114, China)
LING Hong-li, E-mail:linghl@vlandgroup.com
To explore the genetic mutations of H9 subtype avian influenza virus in Shandong province, tissues suspected of being infected with AIV H9 subtype from Weifang, Liaocheng and Yantai were collected in 2015. They were detected by RT-PCR method. After sequencing, genetic evolution was analyzed and cross-immunity protection was carried out. The results show that the isolates have high homologies with H9N2 strains of recent years up to 97%~97.6% and 93.5%~94.4% respectively, while shared low homologies with H9N2 strains of early years and vaccine strains, 74.9%~90.3 and 86.3%~92.3% respectively. Genetic evolution analysis results show that the three strains belonged to genetic Y280-like sublineage. There was a good cross protection force among the three H9 subtype isolates from different places. This study has provided guidance for the avain influenza epidemic prevention and control, and also a basis for the research and development of vaccine.
H9N2 subtype avian influenza virus; HA gene; NA gene; genetic evolution analysis; cross challenged test
10.11751/ISSN.1002-1280.2017.8.02
国家国际科技合作专项(2014DFA31830)
蔡青秀,硕士,从事动物疫苗的研发。
凌红丽。E-mail:linghl@vlandgroup.com
2017-03-08
A
1002-1280 (2017) 08-0006-08
S852.65
