骨碎补对微重力下共培养骨细胞中成骨细胞分化的影响
2017-09-03尹文哲张小玲叶义杰田鑫铎
尹文哲,张小玲,叶义杰,田鑫铎
(哈尔滨医科大学附属第二医院骨外四科,黑龙江 哈尔滨 150086)
骨碎补对微重力下共培养骨细胞中成骨细胞分化的影响
尹文哲,张小玲,叶义杰,田鑫铎
(哈尔滨医科大学附属第二医院骨外四科,黑龙江 哈尔滨 150086)
目的:观察模拟微重力下骨碎补对成骨细胞破骨细胞共培养中成骨细胞分化影响及ALP、OPG、Runx2表达作用机制。方法:建立成骨细胞破骨细胞共培养系统,模拟微重力下加骨碎补总黄酮。正常重力组(A组)和微重力空白组(B组)加等容生理盐水组大鼠血清。骨碎补低剂量组(C组)加含低浓度骨碎补血清0.054 g/(kg·d),骨碎补中剂量组(D组) 加含中浓度骨碎补血清0.162 g/(kg·d),骨碎补剂量组(E组)加入高浓度骨碎补血清0.486 g/(kg·d)。A组置于培养箱中,B、C、D、E置于摸拟微重力回转器48 h。测成骨细胞ALP活性、OPG、Runx2表达。结果:与正常对照组比较,微重力组成骨细胞ALP活性降低(P<0.05);与微重力空白对照组比较,含药组ALP活性、OPG和 Runx2表达升高,中剂量组差异显著(P< 0.05)。结论:中剂量骨碎补能提高微重力下成骨细胞破骨细胞共培养系统中提高成骨细胞ALP活性、OPG、Runx2表达,促成骨细胞增殖、分化。
骨碎补;微重力;成骨细胞;破骨细胞;OPG;Runx2
微重力引起宇航员的骨丢失,导致骨质疏松。骨碎补总黄酮(Total Flavonoidsin Drynaria Fortunei, TFDF)作为黄酮类物质,具有一定抗骨质疏松的作用。体外间充质干细胞(mesenchymal stem cells, MSCs)诱导,成骨细胞破骨细胞共培养系统可以模拟体内内环境,能更好地观察骨碎补总黄酮对成骨细胞和破骨细胞的增殖作用。检测不同剂量骨碎补总黄酮作用于三维细胞培养系统模拟微重力下下成骨细胞破骨细胞共培养系统中成骨细胞碱性磷酸酶(alkaline phosphatase, ALP)、破骨细胞抑制因子(osteoclastogenesis inhibitory factor, OPG)、Runt 相关转录因子2(Runt-Related Transcription Factor 2, Runx2)表达,探索骨碎补微重力下对成骨细胞和破骨细胞增殖的作用。
1 材料
1.1 实验动物
10只SD仔鼠(3~5日龄),提取骨髓间充质干细胞。32只个体体质量300~350 g SD雄性大鼠(10月龄),制备低、中、高剂量骨碎补总黄酮含药血清和对照组血清。哈尔滨医科大学附属第二医院实验动物中心,合格证号:SCXK(黑)2013-001。
1.2 实验试剂
1,25(OH)2D3维生素D3(美国Sigma公司),胎牛血清(美国Hyclone公司),破骨细胞分化因子(美国Sigma公司), 低糖DMEM培养液(GIBCO公司),地塞米松(美国Sigma公司),β-甘油磷酸钠(美国Sigma公司),巨噬细胞集落刺激因子(美国Sigma公司),维生素 C(美国Sigma公司),抗酒石酸酸性磷酸酯酶试剂盒 (美国Sigma公司),逆转录试剂盒(日本 Toyobo 公司);Trizol ( 美国Invitrogen公司) ,Triton X-100(美国Sigma公司);RIPA裂解液(中国上海碧云天生物技术有限公司) ; PCR Mix 试剂盒(中国北京天根生化科技公司);碱性磷酸酶试剂盒(中国南京建成生物工程研究所);骨碎补总黄酮(中国北京岐黄制药有限公司)。
1.3 实验仪器
电泳仪 (美国Bio-Rad公司);酶标仪(奥地利,Authos HT2);倒置相差显微镜(日本Olympus公司);CO2培养箱(德国Heraeus公司);PCR仪、核酸电泳仪(美国Bio-Rad公司);图像分析软件(德国Leica公司),全自动数码凝胶成像系统(上海天能公司);培养板、培养瓶、培养皿( 美国Costar公司);易扩三维细胞培养系统(美国Equl公司)。
2 方法
2.1 MSCs培养及诱导分化
2.1.1 分离提取MSCs
断颈处死仔鼠后浸于75%酒精10 min。于超净工作台内在无菌条件下钝性剥离显露左右股骨,剪断股骨的两端。低糖DMEM培养液反复冲洗骨髓腔至半透明,吹打冲洗液使之成为细胞悬液, 以1.0 ×107cells/mL密度接种于培养板内,37℃、5% CO2条件下培养。80%~90%细胞贴壁聚集后,以胰蛋白酶对已贴壁的骨髓间充质干细胞进行消化后,加入培养液以1∶2的比例扩增传代。
2.1.2 诱导MSCs分化为成骨细胞
选择P3代MSCs,诱导剂诱导分化(DMEM 培养液为基础培养液,含地塞米松10-7mmol/ L、20%胎牛血清、β-甘油磷酸钠10 mmol/L和维生素C 50 mg/L),培养诱导10日。
2.1.3 诱导MSCs分化为破骨细胞
P3代MSCs,诱导剂诱导分化(α-MEM培养基为基础培养液,含地塞米松1×10-8mol/L、15%胎牛血清、破骨细胞分化因子1×10-8mol/L 、1,25(OH)2D31×10-7mol/L、巨噬细胞集落刺激因子1×10-8mol/L),诱导MSCs分化破骨细胞10日。
2.1.4 建立成骨细胞和破骨细胞的共培养系统
利用杨德鸿等建立的共培养系统[1]。选择24孔培养板,距离培养孔底2 mm处打孔(孔直径为4 mm),连通临近的4孔,于相邻2孔间增加0.45 μm隔膜,用质量分数3%琼脂糖凝胶密封膜和培养板接触处,膜可通透培养液,但可隔绝细胞,成骨细胞放入成骨细胞培养孔,破骨细胞放入成骨细胞培养孔,在各自培养孔内分别培养(见图1)。

图1 成骨细胞与破骨细胞的共培养系统的示意图
2.1.5 建立微重力条件
采用易扩三维细胞培养系统,30 rpm/min (10-2G),共培养细胞置回转器内48 h。
2.1.6 含药血清及空白血清的制备
32只SD 10月龄SD鼠,随机分为低﹑中、高剂量给药组,和空白对照组。每组8只:以大鼠体表面积比值计算,低剂量0.054 g/(kg·d),中﹑高剂量给予低剂量的3倍和9倍量,即0.162 g/(kg·d)和0.486 g/(kg·d),给予空白血清对照组灌胃等容生理盐水。第8日末次给药后1.5 h,乙醚麻醉无菌取心血,4 ℃ 4 h,离心血液(3 000 r/min) 15 min,混匀同组上清,放入56 ℃水浴内持续30 min,灭活各组血清内所含的补体后,以0.45 μm滤膜进行分装,放入-80 ℃条件下进行保存。
2.1.7 各实验组的给药
5组:正常重力组(A组)加等容生理盐水灌胃组大鼠血清。微重力空白组(B组)加等容生理盐水灌胃组大鼠血清。微重力下,骨碎补低剂量组(C组) 加含低浓度骨碎补灌胃大鼠血清,骨碎补中剂量组(D组) 加含中浓度骨碎补灌胃大鼠血清,骨碎补高剂量组(E组)加入含高浓度骨碎补灌胃大鼠血清。正常重力组置于培养箱中,微重力组置于摸拟微重力回转器48 h。
2.2 检测实验指标
2.2.1 鉴定破骨细胞
Trap染色后细胞形态学观察:于4 ℃条件下,2.5%戊二醛对细胞进行固定,持续1 0 min后,进行冲洗,冲洗后将细胞浸入Trap孵育液,于37 ℃条件下孵育50 min, 以甘油明胶封片,倒置相差显微镜观察细胞形态学,阳性为胞浆红染。
2.2.2 鉴定成骨细胞
碱性磷酸酶染色(钙钴法)细胞形态学观察:于预放盖玻片6孔板内,接种诱导10日的细胞。PBS冲洗, 95%乙醇10 min,蒸馏水冲洗。37℃孵育4~6 h,自来水冲洗,入2%硝酸钴3~5 min,蒸馏水冲洗。入1%硫化铵2 min,自来水冲。自然干燥,倒置相差显微镜观察。
2.2.3 测定碱性磷酸酶活性
DMEM冲洗3遍,加200 μL 0.2% TritonX-100,4℃过夜。倒置相差显微镜观察,细胞结构消失后振荡,每孔取50 μL,50 μL蒸馏水空白对照,入96孔培养板。加缓冲液、基质液, 37 ℃水浴15 min,加显色剂混匀, 405 nm波长,酶标仪测定光密度(OD)值,各组均取6孔作平均值,测定碱性磷酸酶活性。
2.2.4 PCR检测Runx2、OPG
Runx2上下游引物为:5′-CACTGGCGGTGCAACAAGA-3′,5′-ATGACGGTAACCACAGTCCCATC-3′,退火温度58 ℃,产物长度86bp。OPG上下游引物为:5′-CCCTTGCCCTGACCACTACTAC-3′,5′-TTGCCGTTTTATCCTCTCTACACTC-3′,退火温度58 ℃,产物长度210 bp。内参上下游引物为:5′-ACTCTTCCAGCCTTCCTTCC-3′,5′-ACTCGTCATACTCCTGCTTGC-3′,退火温度58 ℃,产物长度100 bp。内参为β-actin,由上海博亚生物技术有限公司设计合成引物。RNA 抽提试剂盒对总RNA抽提,一步法扩增,进行琼脂糖凝胶电泳后,以图像处理系统进行分析。PCR反应体系(25 μL):SYBR Premix Ex Taq II 12.5 μL,Primer F (10 μM)1 μL,Primer R (10 μM) 1 μL,cDNA 2 μL,dH2O 8.5 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s,40个循环,60 ℃ 30 s。5 μL产物琼脂糖凝胶电泳。标记为DNA Marker,EB染色后使用紫外透射仪进行拍摄观察。
2.3 统计学处理
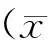
3 实验结果
3.1 破骨细胞鉴定
倒置相差显微镜细胞形态学观察可见内含4~6个较大细胞核的破骨细胞,细胞向周围延伸出片状、丝状的细胞伪足(图2A、图2B)。细胞核为阴性,散在于细胞胞浆内呈红色的TRAP染色酶活性部位(图2C)。将骨片放入破骨细胞与之共培养24h,可见在骨片上出现形状为不规则圆形的吸收陷窝(图2D)。

图2 破骨细胞鉴定注:A:骨髓间充质干细胞破骨诱导7日;B:骨髓间充质干细胞破骨诱导10日;C:TRAP染色的破骨细胞;D:与骨片共培养的TRAP染色的破骨细胞
3.2 鉴定成骨细胞
倒置相差显微镜下观察成骨细胞形态多呈现为不规则的三角形和多角形,细胞之间以突起相互连接;细胞具有丰富的胞浆,可见较大圆形含1~2核仁的胞核,(图3A、图3B)。ALP染色:对骨髓间充质干细胞成骨诱导后,ALP染色明显,细胞质内可见块状沉淀灰或黑色颗粒为阳性反应,棕黑色则为ALP部位(图3C)。
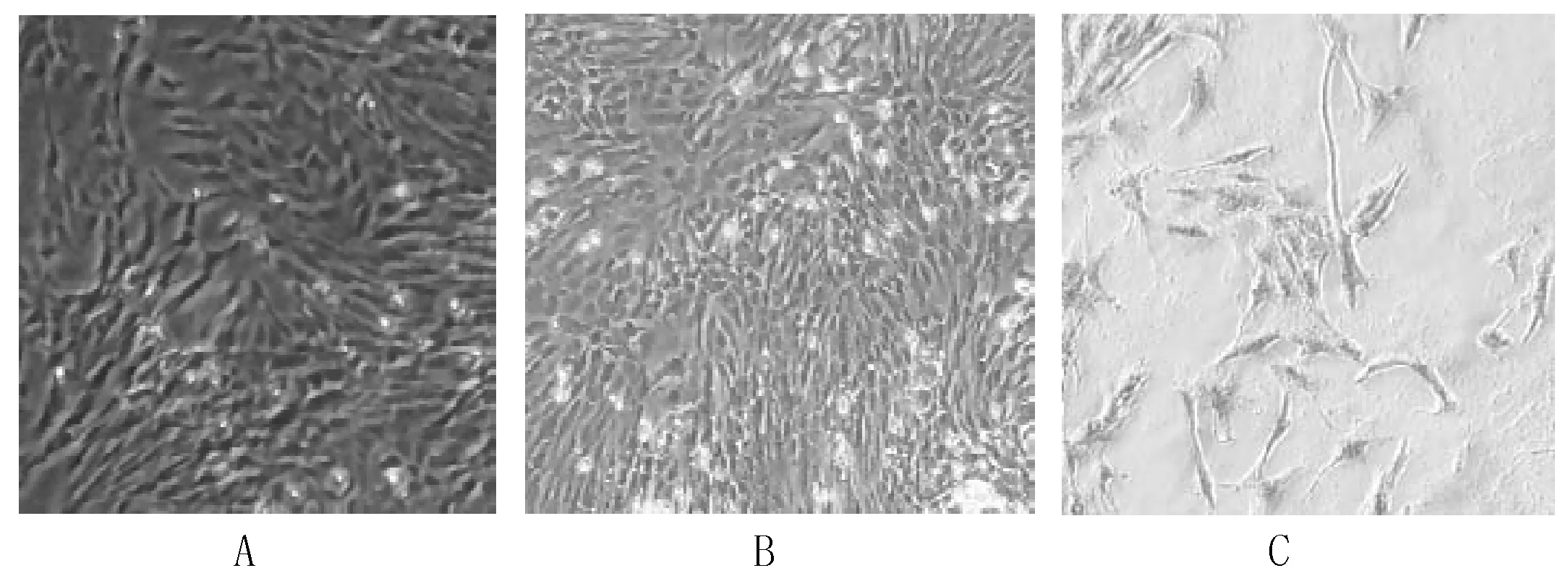
图3 碱性磷酸酶染色鉴定成骨细胞 注:A.大鼠骨髓基质间充质干细胞成骨诱导7天;B.大鼠骨髓基质间充质干细胞成骨诱导10天;C.碱性磷酸酶染色成骨细胞
3.3 骨碎补影响成骨细胞ALP活性
微重力空白组与含药血清高剂量组相比较, ALP活性降低,差异显著(P<0 05)。微重力状态下的骨碎补中剂量组、骨碎补低剂量组与正常重力组比较,无显著差异,但与微重力空白组比较,升高显著(P<0.05)。低、中剂量组之间两两比较,未见差异显著 (P<0.05)。骨碎补高剂量组细胞ALP活性比骨碎补低剂量组和骨碎补中剂量组降低(P<0.05),未随药量增加而增强ALP活性(见表1)。

表1 骨碎补总黄酮影响ALP活性
注:与正常重力组比较,*P<0.05;与微重力空白对照组比较,#P<0.05;与骨碎补低剂量组比较,▲P<0.05;与骨碎补中剂量组比较,●P<0.05
3.4 骨碎补对Runx2、OPG表达的影响
低、中、高浓度骨碎补总黄酮对共培养骨细胞Runx2、OPG表达水平的影响见(图4,表2)。各组均表达OPG,微重力空白血清对照组和微重力骨碎补低剂量组表达Runx2较正常重力对照组、微重力骨碎补中剂量组和微重力骨碎补高剂量组少,但未见显著差异。骨碎补高剂量组与微重力空白对照组、骨碎补低剂量组比较, Runx2、OPG的表达增加显著;微重力条件下的骨碎补中剂量组中OPG、Runx2表达增加显著,微重力条件下骨碎补高剂量组相对于骨碎补中剂量组未表现继续显著促进表达Runx2、OPG。
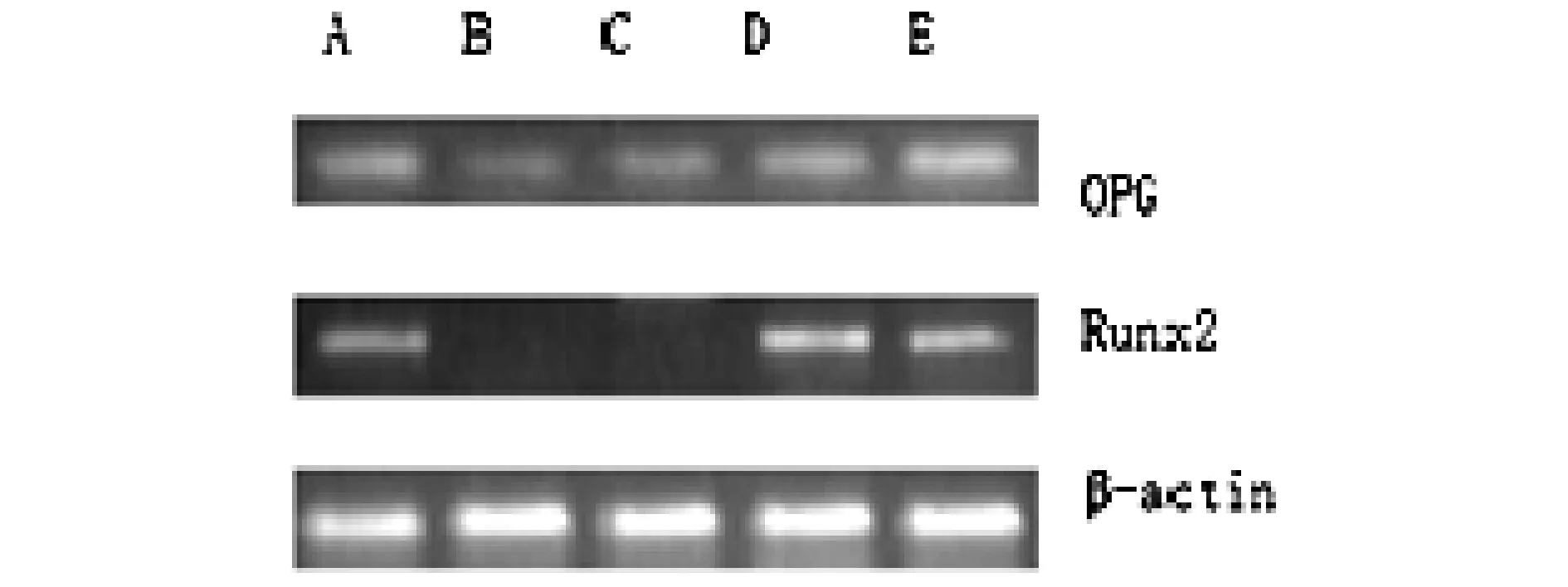
图4 OPG、Runx2的表达 注:A.正常重力对照组;B.微重力空白对照组;C.微重力骨碎补低剂量组;D.微重力骨碎补中剂量组;E.微重力骨碎补高剂量组

组别OPGRunx2正常重力对照组0.801±0.0310.805±0.016微重力空白对照组0.746±0.0240.105±0.021微重力骨碎补低剂量组0.753±0.0360.133±0.032#微重力骨碎补中剂量组0.785±0.0130.843±0.027#▲微重力骨碎补高剂量组0.814±0.0220.861±0.018▲
注:Runx2:与微重力空白对照组比较,#P<0.05;与骨碎补低剂量组比较,▲P<0.05
4 讨论
细胞间存在着功能活动的相互作用,影响着互相的代谢活动和各自的信号转导过程。破骨细胞与成骨细胞是骨形态发生和代谢的两种重要细胞,成骨细胞促进骨的形成,破骨细胞则对已形成的骨质进行分解。这种互相作用的生物协作关系是骨形态发生和代谢的重要调节因素[2]。微重力下骨代谢研究较少,体外成骨细胞和破骨细胞联合培养更能反映骨代谢实际情况。成骨细胞成熟后会合成﹑分泌碱性磷酸酶,骨代谢和形态发生过程中的钙化与碱性磷酸酶相关,在成骨细胞增殖期和分化期碱性磷酸酶表达最多,是成骨细胞增殖、分化的特异性因子。有研究表明骨碎补改善骨质疏松症状,与碱性磷酸酶相关[3]。在间充质干细胞成骨化过程中,碱性磷酸酶是成骨化的特异性因子[4],可以调节骨形态发生[5],代表成骨细胞功能成熟和分化,可以增加破骨细胞和成骨细胞协同活性[6],促进二者共同完成骨形态发生的过程[7]。
骨碎补中剂量组与空白对照组、骨碎补低剂量组对比,显著促进ALP表达(P<0.05);骨碎补低、中剂量之间表现出的量效关系,暗示中剂量骨碎补更能促成骨细胞成熟分化。骨碎补高剂量组没有能表现出更高的碱性磷酸酶活性,且相对于中剂量组表现出一定程度的降低。微重力骨碎补中剂量组促Runx2表达(P<0.05),在微重力骨碎补高剂量组中未出现Runx2未见表达进一步显著增高。Runx2高表达代表抑制破骨细胞分化,不具备骨吸收能力[8]。破骨细胞骨吸收活动受到抑制,和成骨细胞的成骨活动共同协同作用,在保证了骨结构稳定性多样化基础上,完成了骨的形态发生。有研究表明OPG/RANKL/RANK系统可能与此过程存在关联[9]。在共培养系统内对成骨细胞和破骨细胞进行共培养,可能会发生骨碎补总黄酮对破骨细胞的直接生物学作用,进而改变破骨细胞的细胞生物活性;或加入骨碎补总黄酮后,使成骨细胞OPG、Runx2高表达,与破骨细胞之间细胞通讯发生改变,作用于破骨细胞,影响破骨细胞分化。
中医学中具有补肾健脾功效的一系列中药,如骨碎补、淫羊藿、杜仲、蛇床子及相关复方能够补肾健骨,改善骨质疏松。骨碎补入肝、肾经,味苦而温性。对于骨伤、跌打闪挫、风湿痹痛、肾虚腰痛有显著疗效,功用为补肾、活血、止血[10]。以上述中医学理论可确定骨碎补能够治疗肾虚所致骨质疏松。而且从生物大分子层面,骨碎补总黄酮可影响骨代谢和形态发生,进而骨折愈合,副作用很小[11]。骨碎补总黄酮可能是对破骨细胞活性有直接的抑制作用,或可能当碎补总黄酮血清加入共培养系统后,增强成骨细胞产生OPG表达,进而对破骨细胞产生抑制作用。试验结果表明模拟微重力下骨碎补总黄酮增强成骨细胞功能,但尚不能揭示骨碎补总黄酮增强共培养系统内成骨细胞功能的机制,是通过直接抑制破骨细胞,还是间接抑制破骨细胞,尚需进一步研究。
骨髓间充质干细胞作为干细胞,具有向成骨细胞和破骨细胞分化的能力,有研究显示骨碎补和其它中药中的黄酮类物质可以干预骨髓间充质干细胞增殖[12-14],调控骨髓间充质干细胞的进一步细胞生物行为功能分化[15]。有研究者对骨碎补总黄酮干预单独培养的成骨细胞进行过研究[16-17],也有对间充质干细胞生物学行为改变的信号转导通路进行研究[18-19],或研究成骨细胞细胞生物行为改变[20-21]。
在共培养系统内,模拟微重力下,可以排除重力对成骨细胞、破骨细胞共培养系统的影响,能够从细胞相互作用的角度观察并分析骨碎补对破骨细胞、成骨细胞相互活动的调节作用,骨碎补可以促进成骨细胞的Runx2、OPG表达,进而促进成骨细胞成熟分化,并更多地表达ALP,Runx2、OPG作用于破骨细胞,进一步改善二者在骨代谢和形态发生过程中的生物协同性。中剂量骨碎补能够直接增强成骨细胞表达抑制破骨细胞功能的骨保护素和Runx2表达,进而促进骨的形态发生,保证骨的结构稳定,达到治疗骨质疏松症目的。对实验中发现中剂量骨碎补促成骨细胞分化增殖,与破骨细胞的关系,尚需以骨碎补总黄酮作用机制为切入点,进一步研究此过程中的相关细胞信号转导通路。
[1] 杨德鸿,金大地,陈建庭,等.共育体系中成骨细胞和破骨细胞生物学特性观察[J].中华骨科杂志,2001,21(11):676-680.
[2] 刘康,吴风晴,吴连国,等.骨碎补总黄酮对骨质疏松模型大鼠OPG/RANKL/RANK轴系统的影响[J].中国现代应用药学,2015,32(6):652-656.
[3] 匡立华,贾庆运,谭国庆,等.骨碎补防治骨质疏松症的研究进展[J].中国骨质疏松杂志,2015,21(8):1000-1004.
[4] 李彬,张柳.RUNX2与骨代谢的调控[J].中国骨质疏松杂志,2009,15(1):63-67.
[5] 赵秀敏,艾红军,常新.成骨细胞和破骨细胞的传导通路和相关因子[J].中国实用口腔科杂志,2009,2(3):176-179.
[6] 邹世恩,张绍芬.雌激素对成骨细胞和破骨细胞凋亡的调节机制[J].现代妇产科进展,2006,15(7):547-551.
[7] 傅淑平,蔡宇,张荣华.成骨细胞在破骨细胞性骨吸收中的调节作用[J].陕西医学杂志,2004,33(11):1040-1048.
[8] 董伟,冯晓洁,梁永强,等.双膦酸盐对破骨细胞分化中组织蛋白酶K及骨吸收功能的影响[J].中国组织工程研究,2014,33(18):5293-5298.
[9] Khosla S. The OPG/RANKL/RANK System[J]. Endocrinology, 2001,142(12):5050-5055.
[10] 谢雁鸣,秦林林,于向东.骨碎补、淫羊藿、菟丝子总黄酮对成骨细胞体外培养影响的比较研究[J].中国中医药信息杂志,2005,12(7):22-23.
[11] 王建舫,安亚兰,张大丙.骨碎补总黄酮对小鼠成骨细胞中骨保护素和核因子-κB受体活化因子配体mRNA体外表达的影响[J].中国兽医杂志,2009,12(12):67-69.
[12] 梁广胜,陈伟才,殷嫦嫦,等.淫羊藿总黄酮对大鼠骨髓间充质干细胞成骨分化过程BMP-2/RunX2/OSX通路的影响[J].中国中西医结合杂志,2016,36(5):614-618.
[13] 梁广胜,陈伟才,殷嫦嫦,等.复叶耳蕨总黄酮对大鼠骨髓间充质干细胞的增殖和成骨分化的影响[J].中成药,2014,36(3):456-461.
[14] 孙奇峰,尹文哲,高原,等.失重下骨碎补总黄酮经MAPK通路促间充质干细胞向成骨细胞分化研究[J].中医药学报,2016,44(4):10-13.
[15] 刘伟,赵劲民,苏伟,等.骨碎补总黄酮可促进兔骨髓间充质干细胞的增殖和分化[J].中国组织工程研究与临床康复,2011,32(15):6021-6026.
[16] 张虎林,张自强,许宏斌,等.不同剂量骨碎补对兔骨髓间充质干细胞增殖分化的影响[J].中国组织工程研究,2014,41(18):6650-6654.
[17] 刘国岩,徐展望,徐琬梨,等.骨碎补提取物对骨髓间充质干细胞向成骨细胞分化Cbfα-1表达的影响及意义[J].中国骨质疏松杂志,2013,19(12):1224-1227.
[18] 林治平,曾荣,林颢,等.基因芯片技术分析骨髓间充质干细胞神经分化中Wnt信号通路的激活[J].中国组织工程研究,2016,20(10):1389-1395.
[19] 翁诗阳,朱振中,汤春,等.锂介导的Wnt/β-catenin信号转导通路对骨髓间充质干细胞的影响[J].国际骨科学杂志,2016,37(3):183-186.
[20] 李云矗,徐刚,徐成福.Wnt/β-catenin信号通路及其对骨髓间充质干细胞多向分化调节研究进展[J].牡丹江医学院学报,2016,37(1):99-102.
[21] 杨先炯,毛新建,罗庆,等.Wnt3a/β-catenin信号通路调节模拟微重力诱导的骨髓间充质干细胞增殖抑制[J].空间科学学报,2016,31(6):63-69.
Effect of TFDF on the Differentiation of Co-culturing Osteoblasts under Microgravity
YIN Wen-zhe, ZHANG Xiao-ling, YE Yi-jie, TIAN Xin-duo
(TheSecondAffiliatedHospitalofHarbinMedicalUniversity,Harbin150086,China)
Objective:To observe the effect of TFDF on the differentiation of osteoblasts in osteoblasts/osteoclasts co-culturing under microgravity, to explore its mechanism on the expressions of ALP, OPG, and Runx2. Methods: Osteoblasts/osteoclasts were incubated in the same culturing condition, TFDF was given under microgravity. There were five groups involved in this research as follows: the normal gravity group(group A), the microgravity group(group B), low-dose TFDF group(group C), medium-dose TFDF group(group D), and high-dose TFDF group(group E). Rats serum was added to group A and group B, which were given 0.9% Nacl. Rats serum was added to group C at 0.054 g/kg, at 0.162 g/kg in group D, and at 0.486 g/kg in group E. Placed group A in normal gravity, groups B, C, D and E were placed under microgravity gyrator and cltured for 48 hours. ALP, OPG and Runx2 expression were measured. Results:Compared to group A, ALP was decreased in group B(P<0.05); compared to group B, ALP, OPG and Runx2 expression were elevated in the TFDF intervention groups, in which group D had significant difference (P<0.05). Conclusion: The medium-dose TFDF can increase LP, OPG, and Runx2 expression, promote growth and differentiation of the osteoblasts/osteoclasts under microgravity.
TFDF; Microgravity; Osteoblasts; Osteoclasts; OPG; Runx2
2016-11-29
2016-12-15
黑龙江省中医药科研项目(ZHY12-Z160)
尹文哲(1964-),男,博士,主任医师,研究方向:骨质疏松的治疗。
R285.5
A
1002-2392(2017)04-0016-05
