丹参注射液对体外培养兔膝关节软骨细胞MMP-9、TIMP-1表达的影响
2017-09-03徐西林张晓峰吴兴杰吕航夏联恒李小东宿慧刘沛然王顺
徐西林,张晓峰,吴兴杰 ,吕航,夏联恒,李小东,宿慧,刘沛然,王顺
(1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
丹参注射液对体外培养兔膝关节软骨细胞MMP-9、TIMP-1表达的影响
徐西林1,张晓峰2,吴兴杰1,吕航1,夏联恒1,李小东1,宿慧1,刘沛然1,王顺1
(1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:观察丹参注射液对体外培养兔膝关节软骨细胞MMP-9、TIMP-1表达情况的影响。方法:取12只6月龄新西兰大白兔关节软骨作体外细胞培养,培养后软骨细胞随机分为正常组、模型组、玻璃酸钠组、丹参组4组。采用Western blot法测定软骨细胞内MMP-9、TIMP-1蛋白表达,RT-PCR检测软骨细胞内MMP-9 mRNA、TIMP-1mRNA相对表达量。结果:Western Blot检测结果:相对正常组,OA模型组的软骨细胞组织中MMP-9、TIMP-1蛋白表达明显上调(P<0.01);玻璃酸钠组MMP-9、TIMP-1蛋白表达低于空白模型组(P<0.05),丹参组MMP-9、TIMP-1蛋白表达低于空白模型组(P<0.01);丹参组MMP-9蛋白表达低于玻璃酸钠组,TIMP-1蛋白表达高于玻璃酸钠组。荧光定量PCR检测结果:与空白组相比,OA模型组家兔关节软骨组织MMP-9 mRNA相对表达量显著升高(P<0.01),MMP-9/TIMP-1失衡;治疗后,与OA模型组相比,玻璃酸钠组、丹参组MMP-9mRNA相对表达量显著降低(P<0.01),TIMP-1mRNA相对表达量显著升高(P<0.01);与玻璃酸钠组相比丹参组MMP-9mRNA相对表达量显著降低(P<0.01),TIMP-1mRNA相对表达量显著升高(P<0.01)。结论:丹参注射液能够有效纠正MMP-9和TIMP-1在骨性关节炎软骨组织中异常表达,减轻软骨损伤,有效治疗骨性关节炎。
丹参注射液;软骨细胞;MMP-9;TIMP-1
骨性关节炎(Osteoathritis,OA)是一种以关节软骨损害为特征的退行性病变,临床表现关节软骨破坏、滑膜细胞增生、滑膜炎等,多累及膝关节。随着我国人口老龄化,OA发病率呈上升趋势,55~64岁人群的发病率高达40%,严重影响人们的健康[1],目前针对缺乏有效治疗方法预防及延缓本病的发病和致残。研究表明[2]基质金属蛋白酶(MMP)与基质金属蛋白酶抑制剂(TIMP)之间的异常表达是影响OA重要因素,如能有效抑制MMP活性,可能会减轻软骨损伤,延缓骨性关节炎病变进展。
我们采用丹参注射液关节腔注射治疗OA,可以显著缓解疼痛、肿胀等症状,延缓膝关节软骨退变,其疗效机制尚不清楚,是否与MMP/TIMP表达相关,值得进一步研究。本实验通过观察丹参注射液治疗软骨细胞中的MMP-9和TIMP-1表达的变化,分析丹参注射液对MMP-9/TIMP-1的影响,探究丹参注射液治疗OA的疗效机制。
1 实验材料
1.1 实验动物
12只6月龄健康新西兰大白兔,体质量(2.1±0.1)kg,雌雄各半,天津裕达实验动物养殖有限公司提供,许可证号:SCXK(津)2016-0001,一笼一兔喂养,适应性喂养1周。实验方案符合医学实验动物伦理委员会要求。
1.2 主要药物仪器
丹参注射液(正大青春宝药业有限公司,国药准字Z33020177),玻璃酸钠(阿拉丁,批号:K1513011),一抗二抗去除液(wanleibio),全蛋白提取试剂盒(wanleibio),BCA蛋白浓度测定试剂盒(wanleibio),SDS-PAGE凝胶快速制备试剂盒(wanleibio),MMP-9(wnlaeibio),TIMP-1 antibody(wnlaeibio),羊抗兔IgG-HRP(wanleibio),内参抗体β-actin(wanleibio),Super M-MLV(BioTeke),高纯总RNA快速提取试剂盒(BioTeke),50×TAE(Amresco),2×PowerTaqPCRMasterMix(BioTeke),SYBR Green(Solarbio)。
1.3 主要仪器
凝胶成像系统(WD-9413B型),超速冷冻离心机(H-2050R),双垂直蛋白电泳仪(DYCZ-24DN),酶标仪(ELX-800),超纯水系统(NW10LVF),微量移液器(Proline),真空干燥箱(DZF-6050),紫外分光光度计(NANO 2000),荧光定量PCR仪(Exicycler 96)。
2 实验方法
2.1 模型的制备
在无菌条件下,取12只兔膝关节软骨,加少许10%FCS DMEM培养液,剪碎,离心取沉渣加0.1%Ⅱ型胶原酶,0.2%胰酶组成的消化液,在37℃消化3 h后,将细胞悬液过滤,离心后,接种培养瓶37℃,5%CO2培养箱培养。实验研究用三代软骨细胞,实验前用甲苯胺蓝染色鉴定软骨细胞。
2.2 实验分组及药物处理
取三代培养的软骨细胞,用含10%小牛血清培养液配成2×105/mL的细胞悬液,放入CO2培养箱内孵育24 h,采用SNP(2 mmol/L的硝普钠(SNP))诱导软骨细胞凋亡模型建立后进行分组,接种于96孔培养板,每组3孔,分别加入同体积药液。
分组为①正常组:未经任何处理的正常培养的软骨细胞;②模型组:SNP单独处理软骨细胞;③玻璃酸钠组:细胞中加入玻璃酸钠100 μg/mL,24 h后加入SNP;④丹参组:向细胞中加入含5%丹参注射液的培养液,24 h后加入SNP。上述各组在加药后,培养24 h后进行相关指标检测。
2.3 观察指标及测定
Western blot检测:采用Western blot法检测软骨细胞MMP-9、TIMP-1蛋白表达。按照试剂盒说明,提取每组标本软骨细胞的总蛋白。取每组300 μg总蛋白进行SDS-PAGE电泳,电泳后转至PVDF膜上,采用5%脱脂奶粉封闭1 h。用相应一抗(1∶500)与PVDF膜4℃孵育过夜,洗去3次后,相应二抗(1∶5 000)37℃孵育45 min。最后ECL发光剂显影,暗室中观察。以β-actin作为内参照,凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的灰度分析。
RT-PCR检测:RT-PCR检测软骨细胞MMP-9 mRNA、TIMP-1mRNA相对表达。采用高纯总RNA快速提取试剂盒提取每组软骨细胞的总RNA,所得RNA样本进行反转录以得到对应的cDNA。利用ExicyclerTM 96荧光定量仪(BIONEER)进行荧光定量分析,引物信息见表1。反应条件,95 ℃预变性10 min;95 ℃变性10 s,退火30 s,60℃延伸30 s,40个循环;引物信息见表1;以β-actin作为内参照;采用2-△△CT方法分析荧光定量分析仪得到的数据。

表1 引物信息表
2.4 统计学方法
3 结果
3.1 Western Blot检测结果
相对正常组,OA模型组的软骨细胞组织中MMP-9、TIMP-1蛋白表达明显上调(P<0.01);玻璃酸钠组MMP-9、TIMP-1蛋白表达低于空白模型组(P<0.05),丹参组MMP-9、TIMP-1蛋白表达低于空白模型组(P<0.01);丹参组MMP-9蛋白表达低于玻璃酸钠组,TIMP-1蛋白表达高于玻璃酸钠组。检测到MMP-9蛋白条带位于78 kDa,内参照β-actin反应条带位于43 kDa处;TIMP-1蛋白条带位于21 kDa,内参照β-actin反应条带位于43 kDa处(见图1、2、表2)。
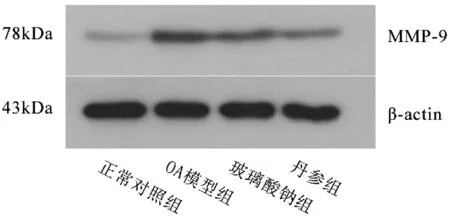
图1 各组兔软骨细胞MMP-9蛋白表达的Western Blot检测结果
3.2 荧光定量PCR检测结果
与空白组相比,OA模型组家兔关节软骨组织MMP-9 mRNA相对表达量显著升高(P<0.01),MMP-9/TIMP-1失衡,证实OA发病与MMP-9/TIMP-1失衡相关。治疗后,与OA模型组相比,玻璃酸钠组、丹参组MMP-9mRNA相对表达量显著降低(P<0.01),TIMP-1mRNA相对表达量显著升高(P<0.01);与玻璃酸钠组相比丹参组MMP-9mRNA相对表达量显著降低(P<0.01),TIMP-1mRNA相对表达量显著升高(P<0.01)(见表3)。
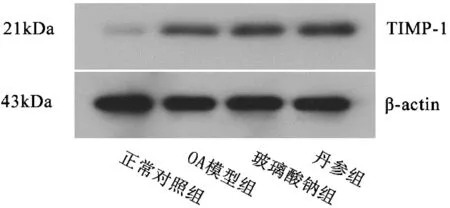
图2 各组兔软骨细胞TIMP-1蛋白表达的Western Blot检测结果

组别MMP-9TIMP-1正常组1.00±0.001.00±0.00OA模型组3.03±0.08#3.65±0.09#玻璃酸钠组2.69±0.09#▲2.88±0.10##▲丹参组2.09±0.08#▲▲*3.11±0.09#▲▲*
注:与正常组相比,#P<0.01;与模型组相比,▲P<0.05,▲▲P<0.01;与玻璃酸钠组相比,*P<0.01
表3 膝骨关节炎模型兔软骨组织MMP-9 mRNA、TIMP-1 mRNA相对表达量
注:与正常组相比,#P<0.01;与模型组相比,▲P<0.01;与玻璃酸钠组相比,*P<0.01
4 讨论
现代医学认为OA主要由于软骨细胞、细胞外基质(ECM)、软骨下骨的失衡[3-4],其中MMPs和TIMPS异常表达起着重要作用。OA在关节软骨受损时,软骨细胞、滑膜细胞会分泌大量MMPs,打破MMP/TIMP平衡,导致软骨基质降解,关节软骨抗应力能力也随之下降,最终遭到关节软骨的破坏[5]。因此MMPs与TIMPs之间失衡,是骨性关节炎重要发病机制。
MMPs是具有降解几乎所有细胞外基质功能的一族酶,MMP-9主要降解明胶和基底膜胶原,在细胞与基质间粘附起着重要的作用[6-7]。姜海军[2]应用ELISA法检测OA患者和健康人血清MMP-9的含量,发现二者存在显著差异。管剑龙等[8]的研究结果也证实这一点,MMP-9通过影响关节软骨的正常合成与代谢平衡导致关节软骨的退变。Mohtai等[9]发现OA患者MMP-9 mRNA表达明显增高,认为MMP-9表达增高可能造成关节软骨的破坏。吴振彪等[10]在临床中也发现OA患者血清中MMP-9浓度显著高于正常人。Janusz等[11]观察到MMP抑制剂可以减轻OA动物模型的关节软骨损伤,推测抑制MMP活性可能是防治OA的重要方法。
TIMPs由关节滑膜和软骨细胞合成,正常状态下与MMPs结合成1∶1的复合物,从而抑制大部分MMPs的活性,是维持软骨基质正常代谢、转化的重要调节因子[12]。MMPs与TIMPs能够相互结合和制约,使MMPs/TIMPs维持在平衡状态,阻止MMPs降解关节软骨内蛋白多糖[13]。Hegemann N等[14]发现,虽然OA软骨MMP-9和TIMP-1分泌均显著增加,但TIMP -1增加低于MMP-9,影响MMP-9和TIMP-1的平衡性,因此造成膝关节软骨退变。
研究结果显示,正常组、玻璃酸钠组、丹参组MMP-9/TIMP-1表达保持基本平衡,意味着MMP-9与TIMP-1动态平衡是保护软骨细胞的关键。虽然模型组MMP-9、TIMP-1表达均增加,但TIMP-1的增加低于MMP-9,破坏了MMP-9/TIMP-1平衡,因而造成关节软骨损伤和破坏。玻璃酸钠组、丹参组软骨细胞的MMP-9显著降低,TIMP-1显著升高,是维持了MMP/TIMP-1动态平衡。而丹参组在维持MMP/TIMP-1平衡方面明显优于玻璃酸钠组,因此丹参注射液临床疗效也优于玻璃酸钠。
本研究通过观察丹参注射液对SNP诱导膝骨关节炎体外模型软骨细胞的影响,发现丹参注射液能有效纠正MMP-9和TIMP-1异常表达,为丹参注射液治疗OA提供了有效理论依据。
[1] 蓝常贡,劳山.骨关节炎后致病因素和发病机制研究进展[J].右江医学,2007,35(2):211-213.
[2] 姜海军.基质金属蛋白酶-9在膝关节骨性关节炎患者血清中的表达及意义[D].长春:吉林大学,2010.
[3] Andrianakos AA,Kontelis LK,Karamitsos DG,et al.Prevalence of symptomatic knee,hand,and hip osteoarthritis in Greece.The ESOR-DIGstudy[J].The Journal of rheumatology,2006,33(12):2507-2513.
[4] 陈晖,朱丽华.细胞凋亡与关节破坏[J].中华骨科杂志,1999,19(12):743.
[5] 王忠仁.骨关节炎相关病因分析[J].中国实用医学,2009,4(1):58-60.
[6] Ogata Y,Miura K,Ohkita A,et al.Imbalance between matrix metalloproteinase 9 and tissueinhibitor of metalloproteinases 1 expression by tumor cells implicated in liver metastasis from colorectal carcinoma[J].Kurume Med J, 2001,48: 211-218.
[7] Zhang S,LiL,Lin Jy,et al.Imbalance between expression of matrix metalloproteinase-9 and tissue inhibitor of metallop roteinase-1in invasiveness and metastasis of human gastric carcinoma[J].World J Gastroenterol,2003,9(5):899-904.
[8] 管剑龙,施桂英,韩星海,等.骨关节炎患者血清和滑液中金属蛋白酶-2和-9的研究[J].中华风湿病学杂志,2001,5(2):102-105.
[9] Mohtai M,Smith RL,Schurman DJ,et al.Expression of 92-kd typeⅣcollagenase/ gelatinase(gelatinase B)in osteoporosis cartilage and its induction in normal human articular cartilage by interleukin-1[J].Clin Invest,1993,92:179-185.
[10] 吴振彪,卢宁,王彦宏.基质金属蛋白酶MMP-2、MMP-9与类风湿性关节炎破坏的关系[J].中国免疫学杂志,2006,22:260-262.
[11] Janusz MJ,Bendele AM,Brown KK,et al.Induction of osteoarthritis in the rat by surgical tear of the meniscus:inibition of joint damage by matrix metalloproteinase inhibitor Janusz[J].Osteoarthristis Cartilage,2002,10(10):785-791.
[12] 李卫平,蹇睿,胥方元.基质金属蛋白酶及其抑制物与骨性关节炎[J].西南军医,2010,12(6):1165-1167.
[13] Fukui N,Zhu Y,Maloney WJ.Stimulation of BMP-2 expression by pro inflammatory cytokines IL-1 and TNF-alpha in normal and osteoarthritic chondrocytes[J].The Journal of Bone&Joint Sur gery,2003,85(3):59-66.
[14] Hegemann N,Wondimu A,Ullrich K,et al.Synovial MMP-3 and TIMP-1 levels and their correlation with cytokine expression in ca-nine rheumatoid arthritis[J].Veterinary immunology and immunopathology,2003,91(3):199-204.
2016-12-11
2016-12-28
黑龙江省自然科学基金(H2015024);哈尔滨市应用技术研究与开发项目(青年后备人才)(2015RAQYJ098)
徐西林(1975-),男,硕士,副主任医师,从事骨坏死与骨关节疾病的临床与基础研究。
R285.5
A
1002-2392(2017)04-0021-04
