熊果酸对人喉鳞状细胞癌Hep-2细胞增殖和凋亡的影响及其机制研究
2017-09-03周晓红彭丽娜杨雪连蕾
周晓红,彭丽娜,杨雪,连蕾
(邯郸市中心医院,河北 邯郸 056001)
熊果酸对人喉鳞状细胞癌Hep-2细胞增殖和凋亡的影响及其机制研究
周晓红,彭丽娜,杨雪,连蕾
(邯郸市中心医院,河北 邯郸 056001)
目的:研究熊果酸(Ursolic Acid, UA)对人喉鳞状细胞癌Hep-2细胞增殖和凋亡的影响及其机制。方法:体外培养并取对数生长期的人喉鳞状细胞癌Hep-2细胞分为空白对照组、UA(12.5、25、50 μmol/L)组和顺铂(6 μmol/L)组,每组设10个复孔。药物干预24h后,采用MTT比色法测定增值抑制率,通过流式细胞术检测细胞周期、观察细胞凋亡状况并计算凋亡率,逆转录-PCR(RT-PCR)法检测bcl-2 mRNA和Bax mRNA表达并计算Bax/bcl-2表达比值,Western blotting法检测caspase-3蛋白表达。结果:UA(25、50 μg/mL)组和顺铂组Hep-2细胞增殖抑制率较空白对照组显著升高,G0/G1期显著增长、G2/M期显著缩短,细胞凋亡率显著升高,细胞中bcl-2 mRNA表达显著下调且Bax mRNA显著上调、Bax/bcl-2表达比值显著升高,caspase-3蛋白表达显著上调,上述差异均具有统计学意义(P<0.05,P<0.01)。结论:UA具有抑制人喉鳞状细胞癌Hep-2细胞增殖并促进其凋亡的作用,其机制可能与UA能够改变细胞周期以及调节凋亡相关基因和蛋白表达有关。
熊果酸;人喉鳞状细胞癌;Hep-2细胞;增殖;凋亡
喉癌是头颈部常见的恶性肿瘤之一,每年新发男性病人比例约为4.5/10万、女性约为0.6/10万,其中95%以上的患者为鳞状细胞癌。随着环境污染的日益严重,喉癌的发病率呈逐年上升的趋势[1]。目前,临床上对于喉癌的治疗主要采取手术结合放化疗的治疗方案,能取得一定的疗效,但仍有部分患者因局部复发或转移而难以救治。近年来中药抗癌引起了广泛关注[2],熊果酸(Ursolic Acid, UA)是一种具有多种生物学活性的五环三萜类化合物,近年来研究发现,UA对肺癌、肝癌、卵巢癌、乳腺癌等均可能具有一定的治疗作用[3-6],但UA是否对人喉鳞状细胞癌具有一定的疗效尚未见文献报道。本实验通过体外培养人喉鳞状细胞癌Hep-2细胞并给予UA进行干预,以顺铂为阳性对照药物,研究UA对人喉鳞状细胞癌Hep-2细胞增殖和凋亡的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 细胞、药物与试剂
人喉鳞状细胞癌Hep-2细胞由中国医学科学院肿瘤研究所惠赠;熊果酸购自陕西慧科植物开发有限公司(批号:141007,纯度≥98%);注射用顺铂购自山东齐鲁制药有限公司;RPMI1640培养基、胎牛血清、胰蛋白酶购自美国Gibco公司; Annexin V/PI细胞凋亡检测试剂盒购自德国Bendermed公司;MTT、DMSO购自美国Sigma公司;bcl-2、Bax上下游引物购自上海博亚生物公司;caspase-3单克隆抗体购自碧云天生物技术有限公司。
1.2 主要仪器
超净工作台(江苏苏净集团);恒温CO2细胞培养箱(美国forma scientific公司);iMark型酶标仪、PCR仪(美国 Bio-Rad公司); DYY-11 型多用电泳仪、DYCZ-40B 转印泳槽(北京六一仪器厂);流式细胞仪(美国BD公司);倒置光学显微镜(日本Olympus公司);VCX750型超声波细胞破碎仪(美国SONICS公司)。
1.3 方法
1.3.1 细胞培养与分组
将人喉鳞状细胞癌Hep-2细胞株复苏后植入RPMI1640培养基进行体外培养,取对数生长期细胞,经0.25%胰酶消化后调整细胞浓度至5×104/mL,继续培养24 h后随机分为空白对照组、UA(12.5、25、50 μmol/L)组和顺铂(6 μmol/L)组,每组设10个复孔;经药物干预24 h后进行各指标检测。
1.3.2 细胞增值抑制率的测定
药物干预24 h后调整细胞浓度至5×104/mL,接种于96孔板(n=10),每孔滴加MTT溶液20 μL,继续培养4 h后去上清,每孔加入DMSO 200 μL并振荡10 min,然后通过酶标仪测定波长570 nm处吸光度(OD)值,细胞增殖抑制率(%)=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.3.3 细胞周期及细胞凋亡状况的检测
经药物干预24 h后离心(10 000 rpm,5 min)取细胞,经PBS溶液洗涤后加5 mL 70%乙醇,低温(4℃)放置48 h,离心(10 000 rpm,5 min)取细胞,经PBS溶液洗涤后采用1 mL PBS溶液打散细胞团后加5 μL水解酶Rnase(10 mg/mL),37℃放置1 h后加入碘化丙啶染液,避光孵育30 min后通过流式细胞仪进行检测,采用CELL Quest软件分析各组细胞的细胞周期时相及凋亡状况。
1.3.4 细胞中bcl-2 mRNA和Bax mRNA表达的检测及Bax/bcl-2比值的计算
通过基因文库查询并设计合成大鼠bcl-2、bax、β-actin基因上、下游引物,并计算扩增片段长度,见表1;经药物干预24 h后,经0.25%胰酶消化并离心(10 000 rpm,5 min)收集各组细胞,加入TRizol提取总RNA并测定总RNA浓度,反转录为cDNA后进行PCR反应,扩增完毕后提取PCR产物行琼脂糖凝胶电泳,最后通过凝胶成像仪观察并照相。以β-actin为内参,半定量分析bcl-2 mRNA、Bax mRNA表达,计算Bax/bcl-2表达比值。

表1 bcl-2、bax、β-actin基因上、下游引物及扩增片段长度
1.3.5 细胞中caspase-3蛋白表达的检测
参照1.3.4方法离心取细胞并用PBS溶液洗涤,超声碎裂细胞后低温(4℃)离心(12 000 rpm,20 min)取沉淀,采用BCA法蛋白定量后行蛋白变性,上样、电泳(待溴酚蓝接近胶底部时停止)、转膜、丽春红溶液染色、室温下经5%脱脂奶粉封闭2 h、一抗(caspase-3,β-actin)4℃孵育过夜、洗膜、二抗室温摇床上孵育1 h后经ECL显色,实验结果应用Quantity One软件进行分析。
1.3.6 统计学方法
2 结果
2.1 各组人喉鳞状细胞癌Hep-2细胞增殖抑制率
通过MTT法检测发现,UA各组和顺铂组人喉鳞状细胞癌Hep-2细胞增殖抑制率较空白对照组均显著升高(P<0.01),其中UA 50 μmol/L组细胞增殖抑制率较顺铂组显著升高(P<0.05),结果见表2。
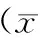
表2 各组人喉鳞状细胞癌Hep-2细胞增殖抑制率±s)
注:与正常对照组比较,*P<0.05,**P<0.01;与顺铂组比较,△P<0.05
2.2 各组人喉鳞状细胞癌Hep-2细胞周期的变化
UA(25、50 μmol/L)组和顺铂组人喉鳞状细胞癌Hep-2细胞G0/G1期较空白对照组显著延长、G2/M期显著缩短(P<0.05,P<0.01);而UA(25、50 μmol/L)组G0/G1期、G2/M期与顺铂组比较均无显著性差异(P>0.05);说明UA能够将人喉鳞状细胞癌Hep-2细胞周期阻滞于G0/G1期,从而抑制Hep-2细胞增殖,结果见表3。
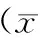
表3 各组人喉鳞状细胞癌Hep-2细胞周期的变化±s)
注:与空白对照组比较,*P<0.05,**P<0.01
2.3 各组人喉鳞状细胞癌Hep-2细胞凋亡状况
通过流式细胞术分析发现,UA各组和顺铂组人喉鳞状细胞癌Hep-2细胞凋亡数量较空白对照组呈不同程度增多,见图1;计算细胞凋亡率发现,UA各组和顺铂组人喉鳞状细胞癌Hep-2细胞凋亡率较空白对照组均显著升高(P<0.01),其中UA 50 μmol/L组Hep-2细胞凋亡率较顺铂组显著升高(P<0.05),结果见表4。

图1 各组人喉鳞状细胞癌Hep-2细胞凋亡状况A-空白对照组;B-UA 12.5 μmol/L组;C-UA 25μmol/L组;D-UA 50 μmol/L组;E-顺铂 6 μmol/L组

组别孔数(n)凋亡率(%)空白对照组102.6±1.1UA12.5μmol/L组1014.8±3.6**UA25μmol/L组1030.7±5.2**UA50μmol/L组1051.5±7.3**△顺铂6μmol/L组1026.9±4.2**
注:与空白对照组比较,*P<0.05,**P<0.01;与顺铂组比较,△P<0.05
2.4 各组人喉鳞状细胞癌Hep-2细胞bcl-2 mRNA和Bax mRNA表达及Bax/bcl-2比值
UA(25、50 μmol/L)组和顺铂组人喉鳞状细胞癌Hep-2细胞bcl-2 mRNA表达较空白对照组显著下调(P<0.01),Bax mRNA表达显著上调(P<0.05,P<0.01)、Bax/bcl-2比值显著升高(P<0.01);UA 50 μmol/L组Hep-2细胞bcl-2 mRNA表达较顺铂组显著下调且Bax/bcl-2比值显著升高(P<0.05),结果见表5。

表5 各组人喉鳞状细胞癌Hep-2细胞bcl-2 mRNA和Bax mRNA表达及Bax/bcl-2表达比值
注:与空白对照组比较,*P<0.05,**P<0.01;与顺铂组比较,△P<0.05
2.5 各组人喉鳞状细胞癌Hep-2细胞caspase-3蛋白表达
UA各组和顺铂组人喉鳞状细胞癌Hep-2细胞caspase-3蛋白表达较空白对照组显著上调(P<0.01);UA 50 μmol/L组Hep-2细胞caspase-3蛋白表达量较顺铂组显著升高(P<0.05),结果见图2和表6。

图2 各组人喉鳞状细胞癌Hep-2细胞caspase-3蛋白表达A-空白对照组;B-UA 12.5 μmol/L组;C-UA 25 μmol/L组;D-UA 50 μmol/L组;E-顺铂 6 μmol/L组

组别孔数(n)Caspase-3/β-actin空白对照组100.09±0.04UA12.5μmol/L组100.23±0.10**UA25μmol/L组100.34±0.12**UA50μmol/L组100.47±0.15**△顺铂6μmol/L组100.18±0.05
注:与空白对照组比较,*P<0.05,**P<0.01;与顺铂组比较,△P<0.05
3 讨论
喉癌约占全身恶性肿瘤的5.7%~7.6%,是头颈部较为常见的恶性肿瘤,由于早期诊断率低,导致约40%的患者确诊时已是Ⅲ期或Ⅳ期[1]。于华等[1]研究发现,喉癌发病率呈逐年上升的趋势,其原因可能与环境污染、饮食不健康、吸烟、饮酒等因素有关。目前临床上对于喉癌的治疗,主要采取手术切除、放疗为主并辅以化疗的治疗方案,其中喉癌化疗主要是以顺铂为基础的联合用药;而对于Ⅲ期或Ⅳ期的晚期喉癌患者主要采取综合治疗,能够有效抑制喉癌的进展并延长患者生命,但仍有部分患者因局部复发或转移而难以救治。
近年来随着中医药的发展,中药抗癌已经引起广大医药工作者和癌症患者的关注。熊果酸(Ursolic Acid, UA)是一种广泛存在于熊果、女贞子、夏枯草等植物中五环三萜类化合物,具有抗氧化、抗炎、降血脂等多种生物学活性[7-9],而随着研究的深入,UA抗癌作用也逐渐得到实验证实。付伦等[3]通过体外培养人肺癌细胞株A549并给予UA进行干预研究发现,UA能够改变A549细胞周期而抑制其增殖;崔兵兵等[4]通过UA干预肝癌细胞株SMMC-7721发现,UA能够抑制SMMC-7721细胞增殖并促进其凋亡;此外,实验研究发现UA对人卵巢癌SKOV3细胞、人乳腺癌MCF-7细胞、结肠癌HT-9细胞的增殖均具有抑制作用并对它们的凋亡具有促进作用[5-6,10]。本研究以人喉鳞状细胞癌Hep-2细胞为受试细胞、以顺铂为阳性对照药进行研究发现:经UA干预能够显著提高Hep-2细胞增殖抑制率,并且UA 50 μmol/L组Hep-2细胞增殖抑制率显著高于顺铂6 μmol/L组;流式细胞术分析发现,经UA干预能够将人喉鳞状细胞癌Hep-2细胞周期阻滞于G0/G1期并提高Hep-2细胞凋亡率,且UA 50 μmol/L组Hep-2细胞凋亡率显著高于顺铂6 μmol/L组,提示UA具有抑制人喉鳞状细胞癌Hep-2细胞增殖并促进其凋亡的药理作用。
细胞凋亡是一种继发性程序化死亡过程,有多种基因参与调控。Caspase家族的激活在细胞凋亡过程中发挥着关键作用,其中caspase-3是凋亡过程中的主要效应因子,它的活化能够能够裂解DNA修复相关分子和凋亡抑制蛋白、破坏细胞外基质蛋白和骨架蛋白等,因此caspase-3的活化标志着凋亡进入不可逆阶段[11]。Bcl-2家族在细胞凋亡过程中也发挥着重要的调节作用,bcl-2能够抑制线粒体破裂,可直接与Apaf-1结合而抑制caspase-3激活,抑制促凋亡蛋白Bax细胞毒性作用,调节细胞内钙浓度,从而起到抑制细胞凋亡的作用[12];Bax属于Bcl-2基因家族成员,具有诱导线粒体渗透性改变而释放细胞色素C、激活促凋亡蛋白caspase-9,而表现出促细胞凋亡作用[13-14]。此外,Bax能够与bcl-2聚合成二聚体,从而抑制bcl-2活性而促进细胞凋亡,所以Bax/bcl-2比值更加能够体现bcl-2基因家族对细胞凋亡的调控作用[15]。本实验研究结果显示:经UA干预能够显著上调人喉鳞状细胞癌Hep-2细胞caspase-3蛋白表达,下调bcl-2基因表达并上调Bax基因表达、提高Bax/bcl-2表达比值,这可能是UA促进人喉鳞状细胞癌Hep-2细胞凋亡的重要分子机制之一。
综上所述,熊果酸具有抑制人喉鳞状细胞癌Hep-2细胞增殖并促进其凋亡作用,作用机制可能与熊果酸能够改变Hep-2细胞周期以及调节凋亡相关基因和蛋白表达有关。
[1] 于华,辛玉芬,段晓东,等.喉癌的流行病学病因学动态分析[J].现代生物医学进展,2007,7(3):393-395.
[2] Zhao JL, Rao DS, Boldin MP, et al. NF-kB dysregulation inmicro RNA-146a- deficient mice drives the development of myeloidmalignancies[J]. Proceedings of the National Academy of Sciences,2011,108(22):9184-9189.
[3] 付伦,朱敏,李招云,等.熊果酸对肺癌细胞株A549及SPCA1细胞周期的抑制作用[J].医学研究杂志,2015,44(5):68-73.
[4] 崔兵兵,程丽芳,侯立静,等.熊果酸抑制人肝癌SMMC-7721细胞生长及凋亡的实验研究[J].中国实验方剂学杂志,2013,19(18):181-184.
[5] 张慧锋,郭淑英,申蕾,等.熊果酸诱导SKOV3细胞凋亡与线粒体凋亡通路[J].中药药理与临床,2015,31(2):140-142.
[6] 马于平,孙圣荣.熊果酸对乳腺癌细胞凋亡影响及其机制[J].辽宁中医药大学学报,2014,16(8):59-62.
[7] 卢静,张博超,姜伟,等.熊果酸抗氧化性能的研究[J].食品工业科技,2009,30(4):126-127.
[8] 林科,张太平,张鹤云.山楂中熊果酸的提取及其对小鼠的降血脂作用[J].天然产物研究与开发,2007,19:1052-1054.
[9] Jemal A, Siegel R, Xu J, et al. Cancer Statistics [J]. Ca Cancer Journal for Clinicians,2010,60(5):277-300.
[10] 耿伟,沈志祥,谭洁.熊果酸诱导结肠癌HT-29细胞株凋亡的实验研究[J].肿瘤,2015,25(6):538-541.
[11] Mazumder S, Plesca D, Almasan A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J].Methods Mol Biol,2008,414:13-21.
[12] 吴勃岩,车艳新,孙阳,等.熟地黄多糖对H22荷瘤小鼠细胞色素C和Caspase-3蛋白的影响[J].中医药学报,2015,43(6):34-36.
[13] Farhadi F, Jahanpour S, Hazem K, et al. Garlic (Allium sativum) fresh juice induces apoptosis in human oral squamous cell carcinoma: the involvement of caspase-3, bax and bcl-2[J]. J Dent Res Dent Clin Dent Prospects, 2015,9(4):267-273.
[14] 张彦清,刘保江,田首元.丙泊酚对大鼠离体缺血/再灌注心肌细胞凋亡和Bcl-2/Bax蛋白表达的影响[J].中西医结合心脑血管病杂志,2011,9(1):55-57.
[15] 秦蕾,马秀丽,薛晓鸥.苦参碱对SiHa细胞增殖及其凋亡相关蛋白表达的影响[J].中医药学报,2016,44(1):25-27.
Effects and Mechanism of Ursolic Acid on the Proliferation and Apoptosis of Laryngeal Squamous Hep-2 Cells
ZHOU Xiao-hong, PENG Li-na, YANG Xue, LIAN Lei
(HandanCentralHospital,Handan056001,China)
Objective: To investigate the effects and mechanism of ursolic acid on the proliferation and apoptosis of laryngeal squamous Hep-2 cells. Methods: The laryngeal squamous Hep-2 cells in logarithmic growth phase were divided into five groups: the blank control group, UA groups (12.5, 25, 50 μmol/L), and Cisplatin group (6 μmol/L). Twenty-four hours after the intervention, the cellular growth inhibition rate was calculated by MTT, cell cycle and apoptosis rate were analyzed by flow cytometry, the expression of Bax mRNA and bcl-2 mRNA were detected by RT-PCR to calculate the ratio of Bax/bcl-2, and the expression of caspase-3 protein was detected by western blotting method. Results: Compared to the blank control group, the cellular growth inhibition rate of UA groups (25, 50 μmol/L) and Cisplatin group (6 μmol/L) were significantly increased, with increased G0/G1 and decreased G2/M, the apoptosis rate was significantly increased; the expression of bcl-2 mRNA was significantly decreased, while the expression of Bax mRNA was significantly increased, and the ratio of Bax/bcl-2 were significantly increased; the expression of caspase-3 protein were significantly elevated; all of the differences above were significant(P<0.05,P<0.01). Conclusion: Ursolic Acid has inhibitive effects on the proliferation and accelerating effects on the apoptosis of laryngeal squamous Hep-2 cells; which is perhaps related to its effects of altering cell cycle, altering the expression of apoptosis-related genes and proteins.
Ursolic acid; Laryngeal squamous; Hep-2 cell; Proliferation; Apoptosis
2016-07-27
2016-09-05
周晓红(1979-),女,主治医师,主要从事鼻喉疾病研究。
R285.5
A
1002-2392(2017)04-0025-04
