不同脉宽骶神经根电刺激对兔膀胱排尿功能的影响研究
2017-09-03包天翼杨小玉昝春芳
陈 雪,闫 鹏,夏 鹏,包天翼,杨小玉*,昝春芳*
(1.吉林大学第二医院 骨科,吉林 长春130041;2.吉林省人民医院 脊柱外科,吉林 长春130021)
不同脉宽骶神经根电刺激对兔膀胱排尿功能的影响研究
陈 雪1,闫 鹏2,夏 鹏1,包天翼1,杨小玉1*,昝春芳1*
(1.吉林大学第二医院 骨科,吉林 长春130041;2.吉林省人民医院 脊柱外科,吉林 长春130021)
目的 探讨不同脉宽电刺激对膀胱排尿功能产生的影响,明确能够产生完全阳极阻滞的脉宽。方法 本实验共纳入60只兔,用于解剖学研究10只,余50只随机分为对照组(10只)和脊髓损伤组(40只)。采取尿流动力学检查证实,造模之后分为模型组和电刺激组。采用不同脉宽对电刺激组实验兔的骶神经根进行电刺激,检测阴极电流到达阳极并能发生完全阳极阻滞的脉宽。结果 在电流升至0.03 mA时,尿道压力随之递增,但膀胱内压并无波动;刺激电流达0.15 mA时,膀胱内压开始有所变化;直至刺激电流达1 mA时,在刺激结束时可见少量尿液流出。在此基础上,逐步升高电刺激组的刺激参数,尿道内压表现为先升高再下降;直至刺激的脉宽为300 μs,同时电流升至1.05 mA时,尿道内压降到零,膀胱内压缓慢升高,此时膀胱内压约为43.99 cmH2O,有尿液流出。结论 刺激参数:脉宽为300 μs且电流为1.05 mA可作为后续实验的阳极阻滞电刺激参数。
脊髓损伤;神经源性膀胱;电刺激;电极;骶神经根
(ChinJLabDiagn,2017,21:1453)
脊髓损伤致神经源性膀胱继而引发的尿路感染、急慢性肾功能不全或衰竭等重度病症是此类病人最常见的死因[1-3],而神经电刺激技术现已可作为重新建立膀胱代偿功能的治疗方式[4-6]。阳极阻滞电刺激技术[7,8]有希望为脊髓损伤致神经源性膀胱患者创建一项能够代替生理性排尿的新型模式。由于当前脊髓神经可塑性研究暂无出现实质性进展,所以此项技术很有可能成为帮助脊髓损伤后神经源性膀胱患者重建排尿功能的突破口。明确能够产生完全阳极阻滞的脉宽是进行后续功能性实验的基础。因此,本实验将探讨不同参数脉宽电刺激对膀胱排尿所能够产生的功能变化。
1 材料与方法
1.1 对象与分组
60只清洁级新西兰白兔(由吉林大学白求恩医学部动物实验场提供),雌雄不限,体重2.2-2.4 kg,在正规动物房历经两周的喂养之后开展预期实验。
选取10只动物仅仅用于解剖结构探究,余50只白兔随机分为对照组(n=10)和脊髓损伤组(n=40)。后组采用尿流动力学检查证实,分为模型组和电刺激组。实验相关处理均满足伦理学要求。
1.2 实验仪器
多通道电生理仪/BL420-E生物机能试验系统(成都泰盟科技有限公司),实验用骶神经根电刺激器和刺激电极(吉林大学)。
1.3 实验试剂
速眠新Ⅱ和苏醒灵4号(吉林大学农学部)。
1.4 实验方法和步骤
1.4.1 解剖学观察 取10只实验兔进行解剖学研究,熟悉白兔骶神经根的解剖结构,同时取实验兔双侧S2-S3前根,福尔马林固定、切片、HE染色,光镜下测量。
1.4.2 尿流动力学检测 对50只实验兔行尿流动力学检查,具体检查过程详见参考文献[9]。本实验中检测的客观指标大概包含:排尿容积、残存尿量、膀胱静息压、膀胱顺应性、逼尿肌最大压及尿道括约肌肌电等。
1.4.3 神经源性膀胱模型建立及筛选 于手术之前禁食水(6 h),先利用速眠新II麻醉(0.15 mL/kg),备皮及皮肤消毒后铺无菌单,依次切开,暴露棘突及椎板,脊髓损伤组动物切除椎板,以止血钳阻断全部脊髓大概1 min,至观察到其抖动消失为止,即建立完全性脊髓损伤模型[10]。
脊髓损伤组于术后10天复查尿流动力学检查,筛选神经源性膀胱动物模型,具体检查过程同前。再次随机分组,分为模型组和电刺激组。
1.4.4 骶神经前根电刺激 ⓐ尿道及膀胱压力测定 将2根测压管插入电刺激组兔膀胱内,并将测压管另一端与压力换能器相连,此时两测压管读数相等为膀胱静息压,将测压管向外渐渐移动,直到膀胱测压管读数不变但尿道测压管读数最大[11]。对测压管缝合并加固之后,调零压力传感器并校准其基线。 ⓑ刺激电极植入 移除电刺激组兔椎板之后,暴露骶神经前根和后根,分离并切断两侧S1-S4骶神经后根完成去传入。利用电极对骶神经前根行电刺激,按照电刺激期间膀胱内压的升高水平来评估能够支配膀胱逼尿肌的神经根,之后各自放入一枚刺激电极,缝合并加固电极。术后次日拍腰椎X线片,查看电极是否还处于良好的位置之中。ⓒ刺激及记录 采用电极行电刺激期间,于尿道内压为零时,汇总刺激参数;继而向膀胱内缓慢输注适温盐水,按该参数继续电刺激,记录排尿体积、膀胱内压及残余尿量。电刺激组动物在电极移植后第二天起,每天进行6次阳极阻滞电刺激排尿和排便,每次约15-30分钟,并在刺激四周后,均复查尿流动力学,作组间比较。
1.5 统计学处理

2 结果
2.1 测量骶神经前根直径
处死用于解剖学研究的兔10只,切其两侧S2和S3神经前根,固定、染色、切片后于镜下测定其直径。数据示:S2和S3神经前根的直径均是0.05cm,基于此数据,我们设置实验所用电极的直径是0.05cm。
2.2 实验动物存活及排除情况
白兔共50只,术后对照组死1只,脊髓损伤组死6只,神经源性膀胱组检查之后未纳入3只。再次随机分组后,模型组死7只,电刺激组死1只(见表1)。于置入电极和行电刺激期间,因为神经根受损导致尿道及膀胱内压的电刺激反应程度降低而未纳入6只,终究纳入对照组(9只)、模型组(9只)、电刺激组(8只)。
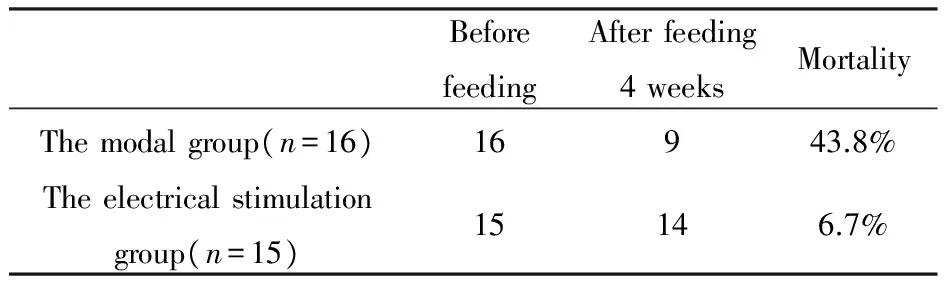
表1 实验动物存活情况
2.3 阳极阻滞电刺激参数的选择结果
电刺激开始阶段,设置脉宽是50 μs,电流是0.01 mA,频率是20 Hz开始刺激。当平均刺激电流达0.03 mA时,尿道压力升高,此时双下肢轻微抖动,膀胱内压仍为零。增加刺激电流达0.15 mA,膀胱内压逐步缓慢上升,直至刺激电流达1 mA,此过程仍未见尿液排出,仅在刺激结束时,见少量尿液流出,另在增加刺激电流过程中可见双下肢抖动逐渐增强。
在此基础上,逐步升高电刺激组刺激的参数,尿道内压表现为先升高再下降;直至刺激的脉宽为300 μs,同时电流升至1.05 mA时,尿道内压降低为零。此过程中膀胱内压缓慢升高(见图2),当尿道内压降到零时,膀胱内压约43.99 cmH2O,有尿液流出。在刺激量递增的过程之中,兔双下肢的抖动渐渐变少,最终无抖动。

图1 刺激电流增加过程中尿道内压变化趋势
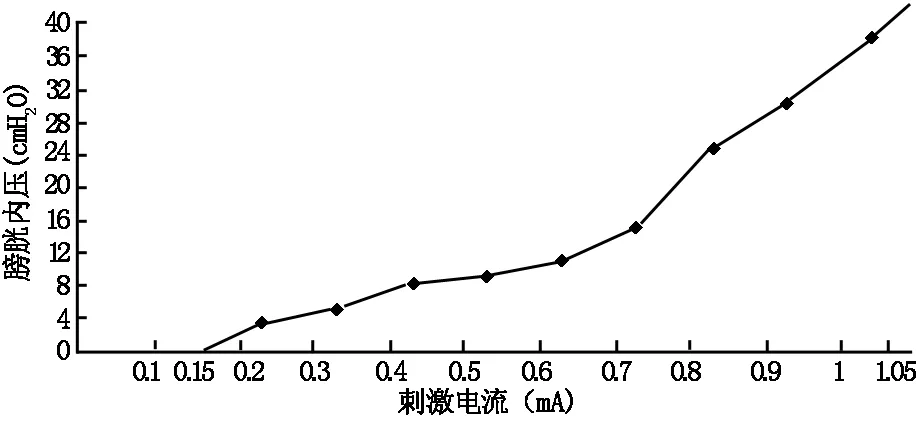
图2 刺激电流增加过程中膀胱内压变化趋势
3 讨论
本实验符合标准而纳入的8只兔全部成功在电刺激下排尿,且每只兔至少有1对神经根在电刺激时引起了膀胱内压及尿道内压的升高,这显示所建模型的传出神经通路是完整的,符合实验标准。另有6只兔因在电刺激时其膀胱内压和尿道内压变化不典型或未测及,不符合标准而未纳入。究其原因,可能是骶神经前根分离或者刺激电极的置入造成神经损伤,亦可能是电刺激时测压管脱管所导致,因此未进行后续电刺激实验。8只电刺激组兔,开始阶段采取短时脉宽,间断刺激。其原理与Brindley的SARS技术[12-14]类似,主要是基于横纹肌和平滑肌两者不同的收缩特性。与正常人排尿机制所不同,电刺激下的膀胱功能基本是依靠间歇期逐步升高的膀胱内压来完成。我们的实验研究结果亦证实了这一点,往往要通过有限次数的间歇式电刺激才能够排出尿液。
在此实验中,我们还发现以50 μs的脉冲,低电流(0.01-0.1 mA)刺激两侧骶神经根时,外尿道和肛门括约肌、盆底和下肢肌肉可产生一定的变化。但是电流并未达膀胱逼尿肌的变化阈值,所以并未测到膀胱内压是否增加。仅仅在刺激电流高到一定程度时(>0.15 mA),才能测到膀胱内压升高(图2)。然而,高电流刺激并未导致尿液的排出,这可能是因为尿道外括约肌亦发生作用,在尿道关闭后压力超过逼尿肌的压力。我们还发现在刺激电流递增的过程中,由于支配下肢的躯体运动神经逐渐兴奋,下肢抖动也会逐渐剧烈,这就启发我们可以采用长时脉宽,递增刺激电流的办法克服上述缺点。
Rijkhoff[15-17]在犬类阳极阻滞电刺激实验中发现,起始的阻滞在脉宽为150 μs时发生,当脉宽超过400 μs时,能获得最大阻滞。基于这些数据,本实验设定初始的刺激脉宽为50 μs。数据显示尿道内压表现为先升高后下降(图 1),缘由也许为在刺激初始阶段,当刺激电流强度高于躯体运动神经的阈值时,尿道外括约肌最先变化,当刺激电流达某个强度时,躯体运动神经均已被激活,递增刺激电流强度,尿道内压虽不会变动,但在远端的阳极电流高于躯体运动神经的停滞阈值,呈现阳极阻滞,尿道内压降落,直到刺激电流达全部躯体运动神经都被滞碍的强度。
另外,尽管本实验并未探究尿道相关肌肉的具体活性,但电刺激肛周确实可以引起脊髓反射,所以进一步亦可引起尿道外括约肌兴奋[18-20]。因此,功能性电刺激手段确实可作为重新建立膀胱代偿功能的重要方式。综上,本实验明确了能够产生完全阳极阻滞的脉宽,以期为更多研究提供理论基础。
[1]Tsang B,Stothers L,Macnab A,et al.A systematic review and comparison of questionaires in the management of spinal cord injury,multiple sclerosis and the neurogenic bladder[J].Neurourol Urodyn,2016,35(3):354.
[2]Wada N,Shimizu T,Takai S,et al.Combinational effects of muscarinic receptor inhibition and β3-adrenoceptor stimulation on neurogenic bladder dysfunction in rats with spinal cord injury[J].Neurourol Urodyn,2017,36(4):1039.
[3]Afsar SI,Sarifakioglu B,Yalbuzda A,et al.An unresolved relationship:the relationship between lesion severity and neurogenic bladder in patients with spinal cord injury[J].J Spinal Cord Med,2016; 39(1):93.
[4]McGee MJ,Amundsen CL,Grill WM.Electrical stimulation for the treatment of lower urinary tract dysfunction after spinal cord injury[J].J Spinal Cord Med,2015,38(2):135.
[5]Morlière C,Verpillot E,Donon L,et al.A cost-utility analysis of sacral anterior root stimulation (SARS) compared with medical treatment in patients with complete spinal cord injury with a neurogenic bladder[J].Spine J,2015,15(12):2472.
[6]McCoin JL,Bhadra N,Brose SW,et al.Does patterned afferent stimulation of sacral dermatomes suppress urethral sphincter reflexes in individuals with spinal cord injury[J].Neurourol Urodyn,2015,34(3):219.
[7]Keller O,Jastreboff P,Vyklick L.Anodal blocking of A-delta tooth pulp afferents[J].Act Nerv Super (Praha),1976,18(1-2):61.
[8]Vuckovi A,Rijkhoff NJ,Struijk JJ.Different pulse shapes to obtain small fiber selective activation by anodal blocking-a simulation study[J].IEEE Trans Biomed Eng,2004,51(5):698.
[9]闫 鹏.新型骶神经根刺激器在脊髓损伤后神经源性膀胱功能重建中的初步应用[D].吉林大学,长春,2011.
[10]Fehlings MG,Tator CH.The relationships among the severity of spinal cord injury,residual neurological function,axon counts,and counts of retrogradely labeled neurons after experimental spinal cord injury[J].Exp Neurol,1995,132(2):220.
[11]王诗波,侯春林.膀胱控制器恢复截瘫犬膀耽功能的尿流动力学观察[J].中国脊柱脊髓杂志,2002,12(3):187.
[12]Morlière C,Verpillot E,Donon L,et al.A cost-utility analysis of sacral anterior root stimulation (SARS) compared with medical treatment in patients with complete spinal cord injury with a neurogenic bladder[J].Spine J,2015,15(12):2472.
[13]Lopez de Heredia L,Meagher TM,Jamous MA,et al.Long-term effect of MRI on sacral anterior root stimulator:the Stroke Mandeville experience[J].Spinal Cord,2012,50(4):294.
[14]Chua HC,Tow A,Tan ES.The neurogenic bladder in spinal cord injury-pattern and management[J].Ann Acad Med Singapore,1996,25(4):553.
[15]Rijkhoff NJ,Holsheimer J,Koldewijn EL,et al.Selective stimulation of sacral nerve roots for bladder control:a study by computer modeling[J].IEEE Trans Biomed Eng, 1994,41(5):413.
[16]Koldewijn EL,Rijkhoff NJ,van Kerrebroeck EV,et al.Selective sacral root stimulation for bladder control: acute experiments in an animal model[J].J Urol, 1994,151(6):1674.
[17]Rijkhoff NJ,Hendrikx LB,van Kerrebroeck PE,et al.Selective detrusor activation by electrical stimulation of the human sacral nerve roots[J].Artif Organs,1997,21(3):223.
[18]Ren J,Chew DJ,Biers S,et al.Electrical nerve stimulation to promote micturition in spinal cord injury patients:A review of current attempts[J].Neurourol Urodyn, 2016,35(3):365.
[19]Wang X,Gao Q,Yang X,et al.Long-term anodal block stimulation at sacral anterior roots promoted recovery of neurogenicbladder function in a rabbit model of complete spinal cord injury[J].Neural Regen Res,2012,7(5):352.
[20]Yan P,Yang X,Yang X,et al.Prolonged electrical stimulation causes no damage to sacral nerve roots in rabbits[J].Neural Regen Res,2014,9(12):1217.
Effects of different pulse width sacral nerve root electrical stimulation on bladder micturition function
CHENXue,YANPeng,XIAPeng,etal.
(Orthopedics,theSecondHospitalofJilinUniversity,Changchun,130041,China;Orthopedics,JilinProvincePeople’sHospital,Changchun130021,China)
Objective To investigate the effect of different pulse width electrical stimulation on bladder micturition function and clear the pulse width of producing full anodal blocking.Methods This experiment included 60 rabbits,10 in the study of anatomy and 50 were randomly divided into the control group (10) and the spinal cord injury group (40).The latter group was randomly divided into the neurogenic bladder group and the sacral nerve root stimulation group after urodynamic screening.The sacral nerve roots of the rabbits in the electric stimulation group were stimulated in different pulse width,and the pulse width of producing full anode retardation was detected.Results When the average stimulation current was up to 0.03 mA,urethral pressure could be measured to increase and bladder pressure remained zero.The stimulation current was up to 0.15 mA,bladder pressure could be detected,until the stimulation current was up to 1 mA,a small amount of urine flew.Subsequently,the pulse width and stimulation current of the electric stimulation group gradually increased,and it were observed that the urethral pressure increased and then decreased.When the pulse width of average stimulation was up to 300 s and the average stimulation current was at 1.05 mA,urethral pressure dropped to zero,the intravesical pressure increased slowly,and then the urine flew.Conclusion The stimulation pulse width of 300US and stimulation current of 1.05mA could be used as the stimulus parameters of anodal blocking in the follow-up experiment.
spinal cord injury;neurogenic bladder;electrical stimulation;electrode;sacral nerve root
吉林省科技厅产业技术创新战略联盟项目(20150309002GX) 和吉林省科技型中小企业技术创新基金(SC201502001)
1007-4287(2017)08-1453-04
R681.5+4
A
2017-05-15)
*通讯作者
