超高效液相色谱-串联质谱法测定动物源性食品中10种水杨酰胺类化合物
2017-08-31林森煜黄嘉乐郭新东
周 思,邓 龙,林森煜,黄嘉乐,郭新东*
(1.广州检验检测认证集团有限公司,广东 广州 511447;2.广东食品药品职业学院,广东 广州 510520)
超高效液相色谱-串联质谱法测定动物源性食品中10种水杨酰胺类化合物
周 思1,邓 龙2,林森煜1,黄嘉乐1,郭新东1*
(1.广州检验检测认证集团有限公司,广东 广州 511447;2.广东食品药品职业学院,广东 广州 510520)
建立了动物源性食品中10种水杨酰胺类化合物(5-氯水杨酰苯胺、4′-溴水杨酰苯胺、3′,4′ -二氯水杨酰苯胺、4′,5-二氯水杨酰苯胺、3′,4′,5 -三氯水杨酰苯胺、5-溴-4′-氯水杨酰苯胺、3,5-二溴水杨酰苯胺、4′,5-二溴水杨酰苯胺、3,4′,5-三溴水杨酰苯胺、3,3′,4′,5-四氯水杨酰苯胺)的超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法。样品经乙腈萃取,氨基固相萃取小柱(SPE)净化,T3色谱柱分离后,以甲醇-0.1%甲酸溶液梯度洗脱,串联质谱电喷雾负模式扫描,多反应监测模式检测,外标法定量。结果表明,10种目标物在一定范围内线性关系良好,相关系数(r2)不小于0.995 7,检出限为0.5~1.0 μg/kg,定量下限为1.5~3.0 μg/kg;加标水平为1.5~30.0 μg/kg时,回收率为81.0%~106%,相对标准偏差(RSD,n=6)不大于7.5%。该方法净化效果好、定量准确、灵敏快速,适用于动物源性食品中10种水杨酰胺类化合物的检测与确证。
动物源性食品;固相萃取(SPE);水杨酰胺类化合物;超高效液相色谱-串联质谱法(UPLC-MS/MS)
水杨酰胺类化合物是一类人工合成的抗菌防霉剂,具有化学性质稳定、抗菌广谱、高效低毒的特点,被广泛应用于化工产品及农用饲料的防霉处理,亦作为除虫药和抗原生动物用药在畜牧业和水产养殖中使用,对于肝片吸虫、蛔虫、绦虫、血吸虫等具有较好的驱杀作用[1-3]。然而,这类药物的不当或过量使用会导致其在农产品中残留,人体摄入后经血液循环分布于皮肤表面,接触日光照射时发生光变态反应,导致日光荨麻疹或接触性光过敏性皮炎,危害人体健康[4]。日本肯定列表制度中的“现行标准”(MRLs List)规定牛肉及组织中3,4′,5-三溴水杨酰苯胺的限量为0.04 mg/kg,牛奶中的限量为0.01 mg/kg,其他未作限定的人工合成抗菌物质视作“一般标准”(Uniform Limit),总量不得超过0.01 mg/kg[5]。
目前,水杨酰胺类化合物的报道集中在化妆品[6-8]、皮革[9-10]、纺织品[11]和环境水体[12-14]等方面,有关食品中水杨酰胺类化合物的报道局限于某种组织或少数药物残留的检测[2-3]。检测方法以液相色谱法[3,6-7,14-15]居多,气相色谱-质谱法[8-9,11-13]和液相色谱-质谱法[2]亦有少量报道。其中液相色谱法多以溶剂萃取后直接进行测试,但水杨酰胺类化合物的种类繁多,存在多种结构相似物和同分异构体,根据保留时间对目标物进行定性分析时易受干扰物影响而造成假阳性。本文选取10种水杨酰胺类化合物作为目标物,结合超高效液相色谱-串联质谱仪在多残留组分分析中准确、高效的特点[16-17],通过优化样品前处理方法、色谱条件,建立了动物源性食品中10种水杨酰胺类化合物的UPLC-MS/MS测定方法,可用于动物源性食品中水杨酰胺类化合物的检测和确证,亦可作为过敏原排查的辅助手段。
1 实验部分
1.1 仪器与试剂
ACQUITYTM超高效液相色谱仪(美国Waters公司),AB 4000QTRAP 三重四极杆串联质谱仪(美国Absciex公司);Milli-Q 去离子水发生器(美国Millipore公司);MS3旋涡混合器(德国IKA公司);XHF-D匀浆机(宁波新芝生物科技公司);3K15 高速离心机(美国Sigma公司);N-EVAP 112水浴氮吹仪(美国 OA 公司);固相萃取装置(美国Waters公司);WAX、MAX、HLB、C18固相萃取柱(3mL/60 mg,美国Waters公司),NH2固相萃取柱(3 mL/200 mg,美国Supelco公司)
3′,4′-二氯水杨酰苯胺(3′,4′-Dichloro-salicylanilid)、4′,5-二氯水杨酰苯胺(4′,5-Dichloro-salicylanilid)、3′,4′,5-三氯水杨酰苯胺(3′,4′,5-Trichloro-salicylanilid)购于美国Sigma公司,5-氯水杨酰苯胺(5-Chlorosalicylanilid)、4′-溴水杨酰苯胺(4′-Bromosalicylanilid)、5-溴-4′-氯水杨酰苯胺(5-Bromo-4′-chlorosalicylanilide)、3,5-二溴水杨酰苯胺(3,5-Dibromo-salicylanilid)、4′,5-二溴水杨酰苯胺(4′,5-Dibromo-salicylanilid)、3,4′,5-三溴水杨酰苯胺(3,4′,5-Tribromo-salicylanilid)、3,3′,4′,5-四氯水杨酰苯胺(3,3′,4′,5-Tetrachloro-salicylanilid)购于安谱公司,所有标准品纯度均大于98%。甲酸(色谱纯,德国CNW公司),乙腈、甲醇、二氯甲烷、正己烷(色谱纯,德国Merck公司),去离子水(18.0 MΩ·cm,由Milli-Q去离子水发生器制备)。
10种目标物用乙腈配成1.00 g/L的单标储备液,保存于4 ℃冰箱;分别吸取适量的单标储备液,用乙腈稀释成浓度均为5.00 mg/L的混合标准溶液,使用时,用乙腈逐级稀释成浓度为1.0、2.5、5.0、20.0、100、500 μg/L的系列标准工作溶液。
试样包括牛肉、羊肉、鱼肉、牛肝、牛奶等共17个样品,均购于广州市农贸市场。
1.2 仪器条件
1.2.1 色谱条件 色谱柱:Waters UPLCTMHSS T3 柱(100 mm×2.1 mm,1.8 μm);流动相:A为甲醇,B为 0.1%甲酸水溶液,流动相梯度洗脱程序:0 ~2.0 min,40%~10% B;2.0~8.0 min,10% B;8.0~8.1 min,10%~40%B;8.1~10 min,40% B;进样体积:5 μL;流速:0.30 mL/min;柱温:30 ℃。
1.2.2 质谱条件 离子源:电喷雾离子源(ESI-);监测方式:多反应监测(MRM)模式;电喷雾电压:-4 200 V;离子源温度:500 ℃;气帘气压力:25 psi;雾化气压力:50 psi;辅助气压力:50 psi;相应的监测离子对(m/z)、去簇电压和碰撞电压等参数见表 1。
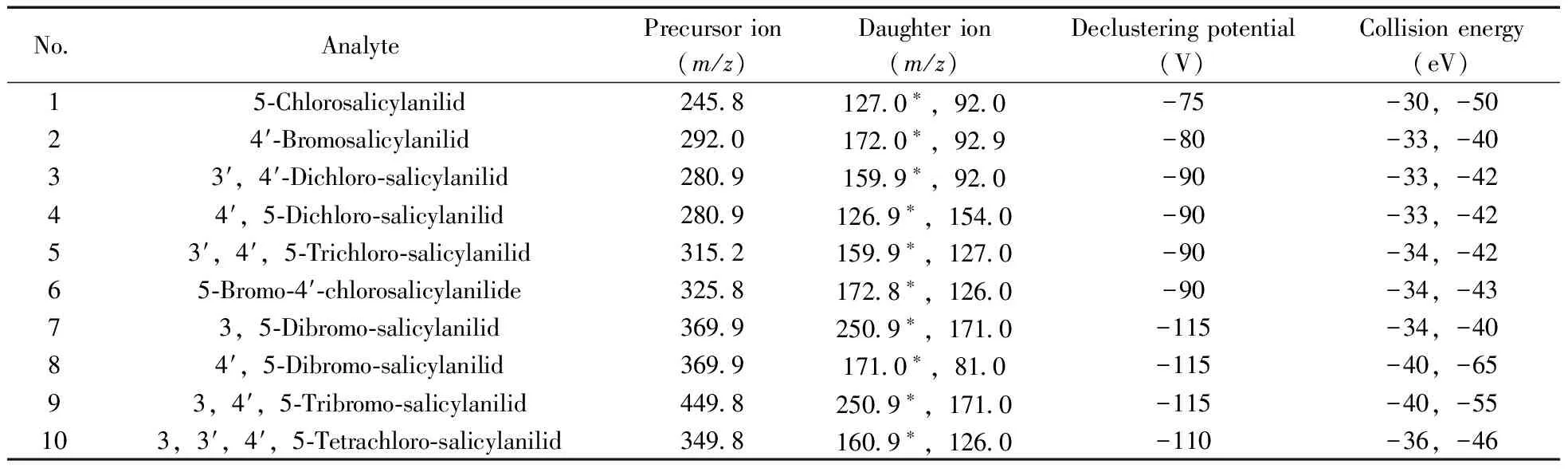
表1 10种水杨酰胺类化合物的监测条件
* quantitative ion
1.3 样品前处理
1.3.1 肌肉、内脏、水产品 称取匀浆后的样品2.0 g(精确至0.01 g)于50 mL具塞离心管中,加入5 mL水,涡旋1 min,加入5 mL乙腈和2 g氯化钠,涡旋2 min,超声10 min,以4 000 r/min离心2 min,吸取乙腈层至25 mL氮吹管中,残渣中加入5 mL乙腈重复萃取,合并乙腈提取液。常温下氮气吹干,加入2 mL正己烷-二氯甲烷(9∶1,体积比)溶解残渣,涡旋混匀,待净化。
1.3.2 牛 奶 称取摇匀后的样品2.0 g(精确至0.01 g)于50 mL具塞离心管中,加入10 mL乙腈和2 g氯化钠,涡旋2 min,超声10 min,4 000 r/min离心2 min,吸取乙腈层至25 mL氮吹管中,常温下氮气吹干,加入2 mL正己烷-二氯甲烷(9∶1)溶解残渣,涡旋混匀,待净化。
1.4 样品净化
氨基固相萃取柱预先加入10 mL丙酮和5 mL正己烷活化,将前述提取溶液转移至氨基固相萃取柱中,以 1.0 mL/min流速过柱。待上清液流出后,用5 mL正己烷洗涤,负压抽干后用6 mL 5%甲酸丙酮溶液洗脱,常温下水浴氮气吹干,加入1.0 mL乙腈溶解残渣,15 000 r/min高速离心后,供 UPLC-MS/MS分析。
2 结果与讨论
2.1 提取条件的优化
动物源性食品种类众多,成分较为复杂,主要干扰物为蛋白质及脂肪,此外还有少量色素,需结合水杨酰胺类化合物的特性,筛选出一种通用的提取条件。向匀浆后的样品中加入少量水可起分散样品的作用,有利于有机萃取溶剂与样品的充分接触,提高样品的提取效率。根据目标物的理化性质,并参考文献报道[2,6-7],本实验对比了乙腈、甲醇、乙酸乙酯、正己烷4 种萃取溶剂的提取效果。实验发现,用乙酸乙酯萃取易发生乳化,甲醇与水互溶,不利于后续净化,而采用乙腈(加氯化钠饱和)和正己烷进行萃取,均有较好的回收率,但用正己烷萃取样品的同时萃取出大量脂肪,增加了后续净化处理的难度,而乙腈对脂肪的溶解性较差,在萃取目标物的同时还能沉淀样品中的蛋白质,减少了样品基质的干扰,因此选择乙腈作为最佳萃取溶剂。
2.2 净化条件的选择
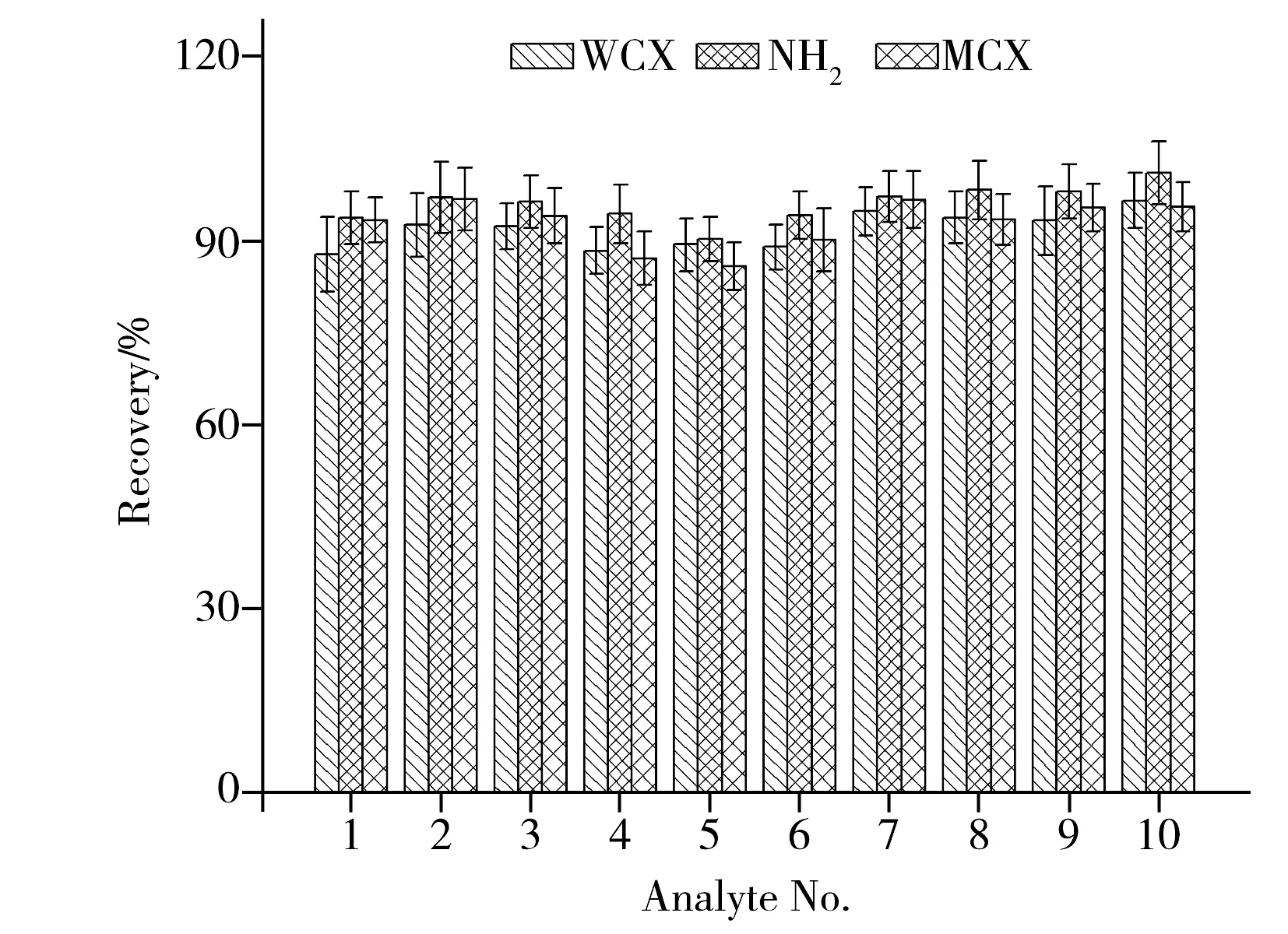
图1 3种固相萃取柱对目标物提取效果的比较(n=4)Fig.1 Comparison on recoveries of targets on three different SPE columns(n=4) the number denoted was the same as that in Table 1
为了进一步除去提取液中的干扰物质,本实验采用固相萃取技术对样品提取液进行净化。鉴于酰胺类化合物具有微弱的碱性,本实验选取C18、HLB、WCX、MCX和NH2固相萃取柱进行净化。称取阴性畜肉样品2.0 g,加500 μL质量浓度为100 μg/L的混合标准溶液,用溶剂萃取后,进行固相萃取净化。实验发现,HLB和C18柱通过反相吸附机理发生作用,对于目标物和大部分共萃杂质的区分度不高,使用HLB和C18柱净化后,在对洗脱液进行浓缩处理时,有少量固体析出,较难进行后续处理;其他3种柱的加标回收情况如图1所示。NH2柱在用极性较小的溶剂上柱时,既可通过偶极-偶极作用吸附酰胺类化合物,也可通过形成氢键与目标物发生较强的相互作用,与WCX柱和MCX柱相比,NH2柱对目标物具有更好的选择性。综合比较,选择NH2固相萃取柱对提取液进行净化。
进一步考察了甲醇、二氯甲烷、丙酮和5%甲酸丙酮4种溶剂的洗脱效果。结果表明,由于目标物与吸附剂之间作用强烈,丙酮、甲醇和二氯甲烷均难以将3,4′,5-三溴水杨酰苯胺和3,3′,4′,5-四氯水杨酰苯胺洗脱下来,以5%甲酸丙酮为洗脱液时的回收率最佳。实验进一步考察了洗脱溶剂用量(1~7 mL)对待测化合物回收率的影响,结果表明,洗脱溶剂体积为6 mL时目标物的回收率基本达到平衡。
2.3 仪器条件的优化
2.3.1 质谱条件的优化 将质量浓度为0.5 mg/L的水杨酰胺单标溶液,在电喷雾离子源下分别进行正离子和负离子模式全扫描分析,所有待测化合物均在负离子模式下获得响应最佳的准分子离子峰,这与目标物的结构特点相符合。在此基础上,通过选择离子监测方式分别优化每个化合物的碎裂电压,然后采用子离子全扫描分析,优化碰撞能量;根据欧盟2002/657/EC决议中有关质谱分析方法必须不少于4分的规定[18],为每个待测物选取最佳的两对MRM离子对及相应的参数作为最终的质谱采集参数(见表1)。
2.3.2 色谱柱的选择 已有文献显示[6-7],测定酰胺类化合物的常用液相色谱柱为C18色谱柱,因此本实验考察了UPLC常用的HSS T3 柱(100 mm × 2.1 mm,1.8 μm)、BEH C18柱(50 mm × 2.1 mm,1.7 μm)和PFP 柱(50 mm × 2.0 mm,2.6 μm)的分离效果。结果显示,PFP柱对于3,5-二溴水杨酰苯胺和4′,5-二溴水杨酰苯胺,3′,4′-二氯水杨酰苯胺和4′,5-二氯水杨酰苯胺两对同分异构体的分离效果不佳,而这两组化合物的离子碎片相似,难以单独定量。BEH C18柱上色谱峰的峰形较HSS T3柱宽,这是由于HSS T3柱的填充颗粒比表面积大,理论塔板数高,因而峰形更加尖锐,目标物在HSS T3柱上分离效果更好,故本文选用HSS T3柱作进一步的色谱条件优化。

图2 10种目标物的MRM色谱图Fig.2 MRM chromatogram of 10 target compounds the number denoted was the same as that in Table 1
2.3.3 流动相的选择 本文涉及的10种目标物结构性质相似,选择梯度洗脱有利于改善峰形,提高极性相似化合物的分离度。实验比较了甲醇-水、乙腈-水、甲醇-0.1%甲酸水溶液和乙腈-0.1%甲酸水溶液4种流动相对10种目标物色谱峰行为的影响。结果表明,4种流动相组合均可实现目标物的分离,使用甲醇作有机相时,目标物中的2组同分异构体的分离度更高,使用0.1%甲酸溶液作水相时,酸的加入抑制了目标物上酚羟基的电离,减少了氢键等相互作用,获得了更好的峰形。因此,选择甲醇-0.1%甲酸水溶液作为梯度洗脱溶剂。在优化条件下,10种目标化合物的多反应监测色谱图如图2所示。
2.4 线性范围与检出限
在优化条件下,对“1.1”配制的混合标准溶液进行测试。以目标物的质量浓度(x,μg /L)为横坐标,定量离子的峰面积(y)为纵坐标作图,得到10种水杨酰胺类化合物的线性方程(见表2)。由表2可知,10种目标物在一定浓度范围内线性关系良好,相关系数均不小于0.995 7。以3倍信噪比(S/N=3)计算检出限(LOD),S/N=10计算定量下限(LOQ),得10种水杨酰胺类化合物的LOD为0.5~1.0 μg/kg,LOQ为1.5~3.0 μg/kg,表明本方法具有较高的灵敏度。
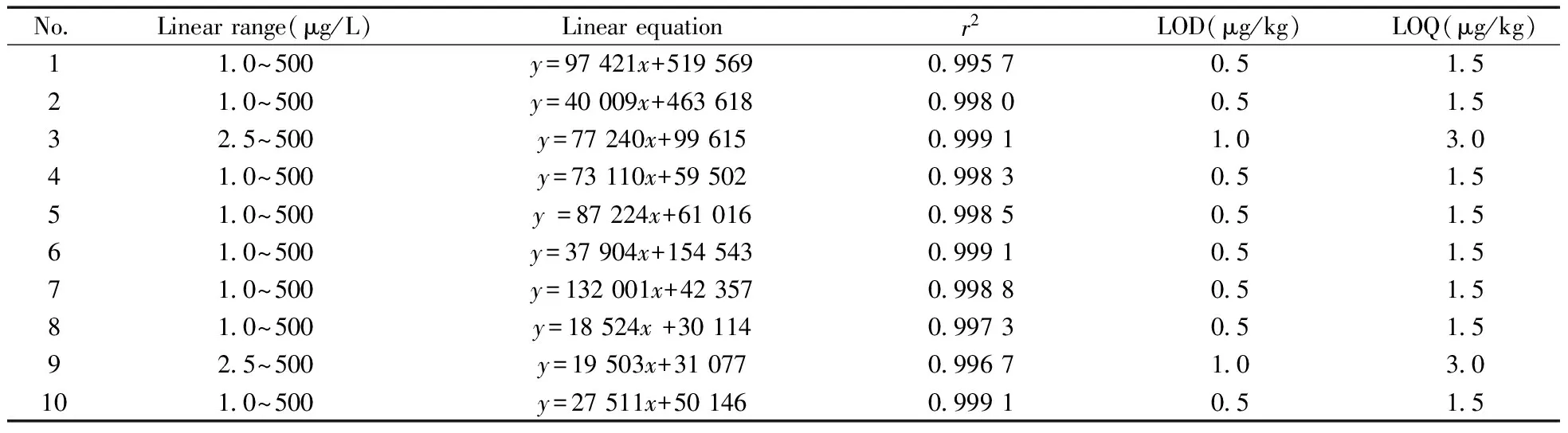
表2 10种待测物的线性范围、线性方程、相关系数、方法检出限及定量下限
the number denoted was the same as that in Table 1
2.5 回收率与精密度
选取阴性的牛肉、猪肝、虾、牛奶样品分别进行3个水平的加标回收实验,6次平行实验的结果见表3。由表可知,在加标浓度范围内,10种待测物的平均回收率为81.0%~106%,相对标准偏差(RSD,n=6)为3.5%~7.5%,说明该方法具有良好的回收率与精密度。
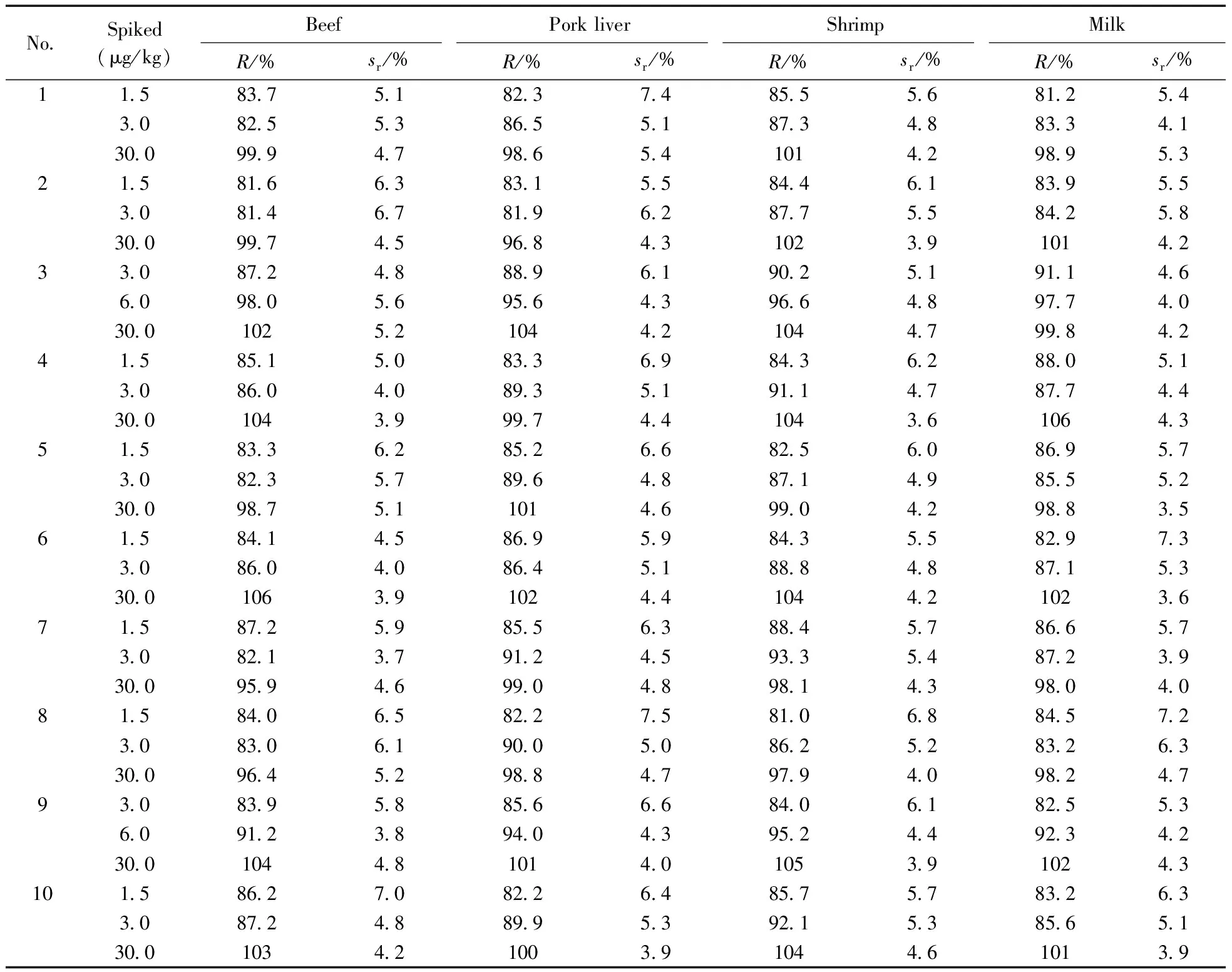
表3 加标回收率与相对标准偏差测定结果(n=6)
the number denoted was the same as that in Table 1
2.6 实际样品的检测
日本肯定列表制度中规定了牛肉及组织、牛奶中3,4′,5-三溴水杨酰苯胺的限量[5],表明这类化合物有可能被使用并在动物源性食品中残留。本方法检出限低至1.5 μg/kg以下,满足限量监测要求。随机购买的17个样品均未检出目标化合物,在一定程度上表明该类药物在行业性和区域性使用情况良好。
3 结 论
本文建立了超高效液相色谱-串联质谱同时测定动物源性食品中5-氯水杨酰苯胺、4′-溴水杨酰苯胺、3′,4′ -二氯水杨酰苯胺、4′,5-二氯水杨酰苯胺、3′,4′,5-三氯水杨酰苯胺、5-溴-4′-氯水杨酰苯胺、3,5-二溴水杨酰苯胺、4′,5-二溴水杨酰苯胺、3,4′,5-三溴水杨酰苯胺、3,3′,4′,5-四氯水杨酰苯胺10种水杨酰胺类化合物的检测方法。方法准确、灵敏,具有良好的回收率和精密度,可为动物源性食品中水杨酰胺类化合物的定性定量分析提供一种可靠的检测方法。
[1] Zhang Z R,Liu Y S.ActaPharm.Sin.(张照瑞,刘怡孙.药学学报),1986,21(12): 935-938.
[2] Li S P,Huang X H,Wang W,Yan C Y,Kong X K.Chin.J.Anal.Chem.(李帅鹏,黄显会,王伟,严常燕,孔祥凯.分析化学),2014,42(3): 423-428.
[3] Wang W,Huang X H,Wang H,Yan C Y,Kong X K.Chin.J.Chromatogr.(王伟,黄显会,王辉,严常燕,孔祥凯.色谱),2013,3(10): 1028-1032.
[4] Jenkins F P,Welti D,Baines D.Nature,1964,20(4921): 827-828.
[5] Ministry of Health,Labourand Welfare of Japan.Positive List System for Agricultural Chemical Residues in Foods.[2017-04-11].http://www.ffcr.or.jp/zaidan/FFCRHOME.nsf/pages/MRLs-p.
[6] Guo X Y,Ma Q,Meng X S,Wang B,Bai H.Chin.J.Anal.Lab.(郭项雨,马强,孟宪双,王斌,白桦.分析试验室),2016,35(9): 1033-1037.
[7] Li S Y,Liu X J,Zhang Y L,Lin S Y,Huang J F,Li X Y,Guo X D,Xian Y P,Dong H.Anal.Methods,2016,8:5129-5135.
[8] Dong H,Guo X D,Xian Y P,Luo H Y,Wang B,Wu Y L.J.Chromatogr.A,2015,1422: 82-88.
[9] Wang C Y,Li L X,Xie T T,Lin J F,Zhu N Q,Tang L C,Li Y H.Chin.J.MassSpectrom.(王成云,李丽霞,谢堂堂,林君峰,褚乃清,唐莉纯,李燕华.质谱学报),2016,37(2): 121-133.
[10] Wu Y L,Wang L,Luo H Y,Xian Y P,Dong H,Wang B,Han W Q.J.Instrum.Anal.(吴玉銮,王莉,罗海英,冼燕萍,董浩,王斌,韩婉清.分析测试学报),2016,35(9): 1116-1120.
[11] Zhan Q,Yang X H,Liu W L.ChinaDyeingandFinishing(湛权,杨欣卉,刘文莉.印染),2013,13: 39-56.
[12] Zhao R S,Diao C P,Wang X,Jiang T,Yuan J P.Anal.Bioanal.Chem.,2008,391(8): 2915-2921.
[13] Hu R,Elia D,Berthion J M,Poliak S.Chromatographia,2001,53(5): 306-310.
[14] Zhang M,Tang F L,Fan X K,Xu J F,Chen F,Wu Z X.Chin.J.Anal.Chem.(张明,唐访良,范晓开,徐建芬,陈峰,吴志旭.分析化学),2012,40(10): 1555-1560.
[15] Cukor P,Persiani C,Woehler M,Bischak N.J.Chromatogr.A,1978,10(266): 496-500.
[16] Zhan S X,Kuang Y Q,Li X Y,Guo X D.J.Instrum.Anal.(湛社霞,匡耀求,李秀英,郭新东.分析测试学报),2015,34(8): 874-879.
[17] Gremmel C,Frömel T,Knepper T P.Anal.Bioanal.Chem.,2017,409(6): 1643-1655.
[18] 2002/657/EC Implementing Council Directive 96/23/EC Concerning the Performance of Analytical Methods and the Interpretation of Results,Commission Decision.
Determination of 10 Kinds of Salicylamides in Foods of Animal Origin by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
ZHOU Si1,DENG Long2,LIN Sen-yu1,HUANG Jia-le1,GUO Xin-dong1*
(1.Guangzhou Inspection and Testing Certification Group Company Limited,Guangzhou 511447,China;2.Guangdong Food and Drug Vocational College,Guangzhou 510520,China)
A new method was developed for the determination of 10 kinds of salicylamides,including 5-chlorosalicylanilid,4′-bromosalicylanilid,3′,4′-dichloro-salicylanilid,4′,5-dichloro-salicylanilid,3′,4′,5-trichloro-salicylanilid,5-bromo-4′-chlorosalicylanilide,3,5-dibromo-salicylanilid,4′,5-dibromo-salicylanilid,3,4′,5-tribromo-salicylanilid and 3,3′,4′,5-tetrachloro-salicylanilid in foods of animal origin using solid phase extraction(SPE) combined with ultra-performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS).Samples were extracted using acetonitrile,and purified with an amino(NH2) SPE column.The eluent was concentrated by nitrogen gas blowing.10 target compounds were separated on a T3 column(100 mm×2.1 mm,1.8 μm) by gradient elution with methanol-0.1% formic acid as mobile phase,ionized by negative electrospray ionization(ESI-),detected under multiple reaction monitoring(MRM) mode,and quantified by the external standard method.Under the optimized condition,the calibration curves of 10 kinds of salicylamides were linear in a certain concentration range with correlation coefficients(r2) no less than 0.995 7.The limits of detection(LODs,S/N=3) and limits of quantitation(LOQs,S/N=10) for the target compounds were in the ranges of 0.5-1.0 μg/kg and 1.5-3.0 μg/kg,respectively.The average recoveries at three spiked levels ranged from 81.0% to 106%,with relative standard deviations(RSD,n=6) no more than 7.5%.The method was suitable for the identification and quantification of 10 kinds of salicylamides in foods of animal origin.
foods of animal origin;solid phase extraction(SPE);salicylamides;ultra-performance liquid chromatography tandem mass spectrometry(UPLC-MS/MS)
2017-04-05;
2017-05-15
广东省质量技术监督局科技项目(2016PZ09)
10.3969/j.issn.1004-4957.2017.08.003
O657.72;TQ572.41
A
1004-4957(2017)08-0963-06
*通讯作者:郭新东,博士,教授级高级工程师,研究方向: 色谱-质谱检测方法,Tel: 020-83376692,E-mail: gdone@21cn.com
