氧化铜-过氧化聚吡咯-还原氧化石墨烯复合膜修饰电极非酶检测葡萄糖
2017-08-31陈小霞王姗姗
于 浩,陈小霞,冯 晓,王姗姗,金 君
(延安大学 化学与化工学院,延安市分析技术与检测重点实验室,陕西 延安 716000)
氧化铜-过氧化聚吡咯-还原氧化石墨烯复合膜修饰电极非酶检测葡萄糖
于 浩*,陈小霞,冯 晓,王姗姗,金 君
(延安大学 化学与化工学院,延安市分析技术与检测重点实验室,陕西 延安 716000)
先以氧化石墨烯(Graphen oxide,GO)为阴离子掺杂剂,采用电化学聚合法制备了聚吡咯-氧化石墨烯复合膜(PPy-GO)。分别在0.10 mol/L NaCl和0.10 mol/L NaOH溶液中对其进行还原和过氧化处理,制得过氧化聚吡咯-还原氧化石墨烯复合膜(OPPy-ERGO)。再以此OPPy-ERGO复合膜为载体,采用电化学沉积法制备了氧化铜-过氧化聚吡咯-还原氧化石墨烯复合膜修饰电极(CuO-OPPy-ERGO/CCE)。通过扫描电镜和电化学方法对此电极进行表征,研究了葡萄糖在此修饰电极上的电化学行为。结果表明,此电极对葡萄糖的电氧化过程表现出高的催化活性和良好的抗干扰能力。在0.20 mol/L NaOH溶液中,安培法检测葡萄糖的线性范围为5.0×10-7~1.0×10-3mol/L,检出限(3Sb)为2.0×10-7mol/L,灵敏度为121.8 μA/(mmol·L-1)。该电极用于血清中葡萄糖含量的测定,加标回收率为96.0%~110.1%。
氧化铜;过氧化聚吡咯;还原氧化石墨烯;葡萄糖;电催化
近年来,利用金属催化剂对葡萄糖的高效催化氧化性能制备非酶葡萄糖电化学传感器引起了广泛关注[1-2]。其中,铜及其氧化物凭借对葡萄糖催化氧化活性高、化学稳定性好及价廉易得等特点得到了广泛的研究及应用[2-4]。
石墨烯作为一种具有二维结构的碳基纳米材料,具有比表面积大、导电性好和化学稳定性高等特点,已被广泛用作电化学的修饰材料[5]。同时,石墨烯具有大的比表面积,非常适合作为载体来负载金属粒子,提高其电催化活性[6]。最近,利用铜-石墨烯复合材料化学修饰电极非酶检测葡萄糖已有不少报道[7-13]。但非酶葡萄糖电化学传感器在实际应用中易受样品中共存易氧化物质(如抗坏血酸(AA)、多巴胺(DA)及尿酸(UA)等)的干扰。聚吡咯(Polypyrrole,PPy)是一种重要的导电聚合物,在电化学传感领域已被广泛应用[14]。PPy在一定条件下会被过氧化成过氧化聚吡咯(OPPy),导致结构中产生大量的含氧基团,这些含氧基团使OPPy对带负电荷的物质具有一定的静电斥力作用,从而可有效提高电极的抗干扰能力[15]。但OPPy膜的导电性差,不利于电化学检测。最近,Chang等[16]以带负电荷的氧化石墨烯(GO)作为掺杂阴离子,从含有GO和吡咯单体的混合溶液中采用电化学方法制备了GO-PPy复合物,进一步还原后,得到了还原氧化石墨烯(ERGO)-聚吡咯复合物,此复合物中的ERGO能提高PPy膜的导电性。
本研究采用逐层电化学沉积法制备了CuO-OPPy-ERGO/CCE电极,研究了其对葡萄糖的电催化氧化性能。采用过氧化聚吡咯改善了电极的选择性和稳定性;利用还原氧化石墨烯提高了过氧化聚吡咯膜的导电性,同时提供了更多活性位点,得到了粒径小、分散均匀的CuO粒子。在三者的协同作用下,此修饰电极对葡萄糖表现出高的电催化活性和良好的抗干扰能力,可用于血清中葡萄糖含量的检测。
1 实验部分
1.1 仪器与试剂
CHI660D电化学工作站(上海辰华仪器公司)和Parstat 2273电化学工作站(美国普林斯顿研究所)用于电化学实验,三电极系统:工作电极为修饰电极,铂丝电极为对电极,饱和甘汞电极(SCE)为参比电极。所用的电位值均是相对于饱和甘汞电极的电位。扫描电子显微镜(S4800,日立/Hitachi,Japan)用于记录电极表面修饰层的SEM照片。
氧化石墨烯(GO,苏州碳丰科技有限公司)。无水葡萄糖(D(+)-Glucose,Glu,国药集团化学试剂有限公司),吡咯(国药集团化学试剂有限公司),用前2次减压蒸馏。其它试剂均为分析纯,实验用水为二次蒸馏水。
1.2 修饰电极的制备
以复合陶瓷碳电极(Composite ceramic carbon electrode,CCE)为基础电极,此电极制作方法参照文献[17]。采用逐层电化学沉积法制备目标修饰电极,首先参照文献[16]的方法制备聚吡咯-还原氧化石墨烯复合膜电极(PPy-ERGO/CCE):将5.0 mg GO超声分散在10 mL水中,通氮除氧,加入0.10 mol/L 吡咯,在氮气保护下超声分散30 min。将处理好的CCE电极浸入上述溶液中,于0.8 V电位下电沉积400 s。取出电极,冲洗后浸入氮气饱和的0.10 mol/L NaCl溶液中,采用循环伏安法在0.0~-1.0 V的电位范围内电还原,即得PPy-ERGO/CCE。再将PPy-ERGO/CCE置于0.10 mol/L NaOH溶液中,采用循环伏安法在-0.2~0.8 V进行过氧化处理,制得过氧化聚吡咯-还原氧化石墨烯复合膜电极(OPPy-ERGO/CCE)。将OPPy-ERGO/CCE电极浸入含有10 mmol/L Cu(NO3)2、30 mmol/L EDTA和0.10 mol/L KNO3(pH 6.0)的混合溶液中,在-1.0 V电位下沉积500 s,制得铜-过氧化聚吡咯-还原氧化石墨烯复合膜电极(Cu-OPPy-ERGO/CCE)。取出电极,冲洗干净后在0.10 mol/L NaOH溶液中于-0.2~0.7 V电位范围内循环扫描至稳定,得到氧化铜-过氧化聚吡咯-还原氧化石墨烯复合膜电极(CuO-OPPy-ERGO/CCE)。作为对比,以0.10 mol/L Na2SO4为支持电解质电化学沉积聚吡咯膜(PPy),再按相似方法沉积铜和过氧化处理,得到氧化铜-过氧化聚吡咯复合膜电极(CuO-OPPy/CCE)。将CuO直接沉积在裸CCE电极表面,得到CuO/CCE电极。
1.3 实验方法
循环伏安法实验(CV):将制备好的电极浸入含有不同浓度Glu的0.20 mol/L NaOH溶液中,记录-0.2~0.7 V电位范围内的CV图。电化学阻抗实验(EIS):将制备好的电极浸入含有5.0 mmol/L K3Fe(CN)6/K4Fe(CN)6(1∶1)的0.1 mol/L KCl溶液中,在0.01 Hz~100 kHz频率范围内,以10 mV交流振幅记录Nyquist图。安培法实验:控制工作电位为0.55 V,加入不同浓度Glu,记录电流 ~时间曲线(I~t)。扫描电镜实验(SEM):将制好的电极端部截取约0.5 cm,置于仪器样品台上记录SEM照片。
2 结果与讨论
2.1 CuO-OPPy-ERGO/CCE修饰电极的制备及表征

图1 不同电极的电化学阻抗图谱Fig.1 Electrochemical impedance spectroscopic patterns of different electrodesa.bare CCE,b.PPy-GO/CCE,c.PPy-ERGO/CCE,d.OPPy-ERGO/CCE,e.Cu-OPPy-ERGO/CCE,f.CuO-OPPy-ERGO/CCE;solution containing of 5.0 mmol/L K3Fe(CN)6/K4Fe(CN)6(1∶1) and 0.1 mol/L KCl;frequency range:0.01 Hz~100 kHz;amplitude:10 mV
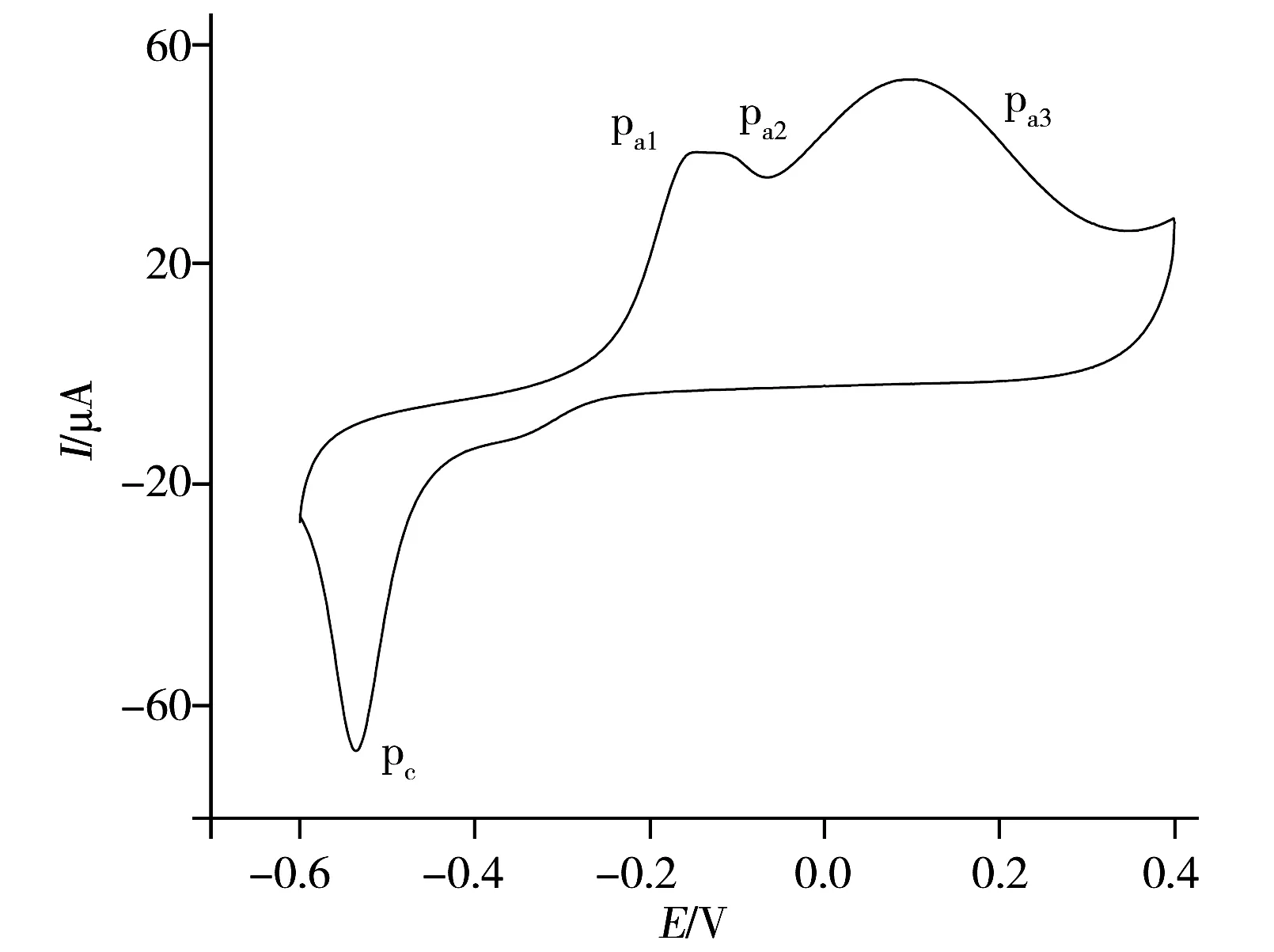
图2 Cu-OPPy-ERGO/CCE在0.20 mol/L NaOH中的循环伏安图Fig.2 Cyclic voltammogram of Cu-OPPy-ERGO/CCE in 0.20 mol/L NaOH v=50 mV/s
采用电化学阻抗谱法对电极的修饰过程进行表征。图1为不同修饰电极的电化学阻抗图谱(Nyquist图)。由图可见,裸CCE电极(曲线a)的界面电荷传递电阻(Rct,Nyquist图高频部分半圆的直径)约为1 183 Ω。当向电极表面沉积PPy-GO复合膜后(曲线b),Rct减小,这是由于聚吡咯具有较好的导电性所致。当将PPy-GO膜还原处理后(PPy-ERGO,曲线c),Rct进一步减小,说明经电化学还原后,复合膜中的GO已被还原成ERGO,增强了膜的导电性。当将PPy-ERGO膜过氧化处理成OPPy-ERGO后(曲线d),Rct值增大(约为1 449 Ω),这是由于过氧化时,PPy结构中的共轭结构被部分破坏,形成疏松多孔的膜,使膜的导电性有所降低[18]。当继续向电极表面沉积铜后(Cu-OPPy-ERGO/CCE),Rct值迅速减小(372 Ω,曲线e),这是由于铜粒子具有良好的导电性,加快了界面电荷传递速率。当将Cu-OPPy-ERGO/CCE电极在NaOH溶液中电化学扫描后,电极的Rct值又有所增大(660 Ω,曲线f),这是由于在NaOH溶液中扫描时,电极表面的Cu生成了导电性较差的CuO所致。
图2为Cu-OPPy-ERGO/CCE电极在0.20 mol/L NaOH溶液中记录的CV图。可以看出,在-0.6~0.4 V电位范围内,循环伏安图上出现了3个氧化峰(pa1,pa2,pa3)和1个还原峰(pc)。根据文献,3个氧化峰分别为Cu(0)/Cu(Ⅰ)、Cu(Ⅰ)/Cu(Ⅱ)和Cu(Ⅱ)/Cu(Ⅲ)电对的氧化峰,而pc则是电极表面铜氧化物被还原成Cu(Ⅰ)时产生的还原峰[11]。随着扫描圈数的增加,上述氧化还原峰峰电流均减小至稳定,表明电极表面的Cu已被衍生成CuO,得到了CuO-OPPy-ERGO/CCE。
图3为CuO-OPPy/CCE(A)和CuO-OPPy-ERGO/CCE(B)表面的扫描电镜照片(SEM)。由图可以看出,以Na2SO4为支持电解质电化学制备的OPPy呈大片状,在片状间隙看到团聚的无定型CuO,在OPPy片上,CuO则很少,这是由于OPPy导电性差,不利于Cu粒子的沉积。而在OPPy-ERGO/CCE电极表面,均匀分布着许多粒径小、球形的CuO颗粒。且在GO的存在下得到的过氧化聚吡咯呈均匀的膜。这可能是由于掺杂进聚吡咯中的GO被还原后,使复合膜的导电性增强,提供了更多Cu沉积的活性位点,有利于Cu在其表面生长。而且以GO为掺杂剂沉积聚吡咯时,沉积速度慢,有利于得到均匀的膜[16]。


图3 CuO-OPPy/CCE(A)和CuO-OPPy-ERGO/CCE(B)电极表面的扫描电镜图
2.2 葡萄糖在CuO-OPPy-ERGO/CCE电极上电化学行为
图4为不同电极在0.20 mol/L NaOH溶液中加入2.0 mmol/L Glu后的循环伏安图。由图可见,裸CCE电极对Glu基本无电流响应(曲线a);CuO/CCE电极上加入Glu后,于0.65 V左右产生1个氧化峰,峰电位高(曲线b);而CuO-OPPy/CCE电极上Glu的氧化电位有所降低(曲线c),其电流比CuO/CCE电极小,这可能是由于过氧化聚吡咯的导电性差,Cu的负载量小所致。而在CuO-OPPy-ERGO/CCE电极上,Glu于0.53 V处产生1个峰形较好的氧化峰(曲线d)。通过对比可以看出,Glu在CuO-OPPy-ERGO/CCE电极上的电流响应最大,且过电位最低,说明此电极对Glu的电催化氧化活性有所增大。这一方面是由于ERGO改善了聚吡咯膜的导电性;同时,ERGO为Cu的负载提供了活性位点,有利于得到粒径小、分布均匀的CuO粒子,因而催化活性更高。

图4 2.0 mmol/L 葡萄糖(Glu)在不同电极上的循环伏安图Fig.4 Cyclic voltammograms of 2.0 mmol/L glucose (Glu) on various electrodes a.CCE,b.CuO/CCE,c.CuO-OPPy/CCE,d.CuO-OPPy-ERGO/CCE;supporting electrolyte: 0.20 mol/L NaOH,scan rate:20 mV/s
采用循环伏安法研究了电位扫描速率(v)对Glu在CuO-OPPy-ERGO/CCE电极上峰电流(Ip)和峰电位(Ep)的影响。结果表明,在10~250 mV/s的扫速范围内,Ip与v1/2成正比,线性方程为Ip=5.732+0.982v1/2(mV/s),r=0.999 4,表明电极过程受Glu的扩散速率控制;另一方面,随着v增大,Ep逐渐正移,说明电极过程还受异相催化速率控制,故Glu在该电极上的电极过程是一个同时受扩散和异相催化速率控制的不可逆过程。
进一步考察了NaOH浓度对Glu峰电流(Ip)和峰电位(Ep)的影响。结果表明,在0.05~1.0 mol/L范围内,随着NaOH浓度的增大,Ep逐渐负移,Ip有所增大。但NaOH浓度过高时,电极表面析氧严重,影响电极的稳定性。综合考虑,实验选择0.20 mol/L NaOH作为支持电解质溶液。
2.3 安培法检测Glu
2.3.1 工作电位的选择 采用动力学计时安培法研究了工作电位的影响,结果显示,在0.10~0.60 V电位范围内,随着工作电位的升高,电极对Glu的电流响应先增大后基本不变,至0.55 V时电流已达到最大值,故选择0.55 V作为安培法检测Glu的工作电位。
2.3.2 线性范围与检出限 控制工作电位为0.55 V,每隔50 s向连续搅拌的0.20 mol/L NaOH溶液中加入不同浓度Glu后的安培电流~时间曲线见图5。 由图可以看出,随Glu浓度的增加,电流以台阶状增加,符合稳态电流的特征。在5.0×10-7~1.0×10-3mol/L范围内,电流与Glu的浓度呈良好线性关系,线性方程为:I(μA)=-0.015 9+0.121 8c(μmol/L),r=0.997 3,检出限(3Sb)为2.0×10-7mol/L,灵敏度为121.8 μA/(mmol·L-1)。与文献报道的基于铜-石墨烯复合材料修饰电极相比,CuO-OPPy-ERGO/CCE电极具有检出限低、线性范围宽和灵敏度高等特点(见表1)。

表1 铜-石墨烯复合材料修饰电极安培法检测葡萄糖的分析性能比较

图5 加入不同浓度葡萄糖时CuO-OPPy-ERGO/CCE电极的安培响应Fig.5 Amperomertic response of CuO-OPPy-ERGO/CCE with the successive addition of different concentrations of glucose glucose concentration(a-k):0.000 5,0.001,0.002,0.005,0.01,0.02,0.05,0.10,0.20,0.50,1.0 mmol/L,insert:response of glucose from 0.000 5 to 0.002 mmol/L and 0.005 to 0.02 mmol/L
2.3.3 干扰试验 图6分别为CuO-OPPy-ERGO/CCE(a)和CuO/CCE(b)电极每隔50 s先后加入0.15 mmol/L Glu,0.050 mmol/L AA、DA、UA和L-Cys时的动态计时安培图。可以看出,在CuO/CCE电极上,上述干扰物质均产生了一定的电流响应。而在CuO-OPPy-ERGO/CCE电极上,加入相同量的上述干扰物质几乎未引起电流的变化。实际血液中Glu的含量是上述干扰物质的30倍以上,所以测定实际样品时上述物质引起的干扰可以忽略。以上结果说明,CuO-OPPy-ERGO/CCE电极具有良好的抗干扰能力,这归因于聚吡咯在过氧化过程中产生了含氧基团,这些含氧基团使膜对带负电荷的离子有排斥力作用。而在碱性条件下,上述干扰物质主要以带负电荷离子的形式存在,在静电斥力作用下其不易到达电极表面的活性中心,故有效减少了测定Glu时的干扰。
2.3.4 修饰电极的稳定性与重现性 在优化条件下,对0.01 mmol/L Glu溶液连续进行7次平行测定,相对标准偏差(RSD)为3.3%。同一批制备的5支修饰电极对0.01 mmol/L Glu溶液测定结果的RSD为5.5%,电极室温下放置15 d后对相同浓度的Glu溶液重新测定,电流为初始的98.2%。采用安培法研究了电极的工作稳定性,连续30次加入0.01 mmol/L Glu时CuO-OPPy-ERGO/CCE和CuO/CCE电极的安培I~t曲线显示,在CuO/CCE电极上,随Glu的连续加入,电流响应逐渐减小,这主要是Glu氧化产物吸附在电极表面后引起了电极钝化所致。而在CuO-OPPy-ERGO/CCE电极上,电流响应几乎不变,说明过氧化聚吡咯能减少电极反应产物的吸附以及电极的钝化,改善电极的工作稳定性。以上结果说明此修饰电极具有较好的重现性和稳定性。
2.4 样品分析

表2 人血清中葡萄糖含量的测定结果(n=5)
取新鲜血液1份,经离心后得血清,准确向10 mL 0.20 mol/L NaOH底液中加入100 μL血清和不同量Glu标准溶液,记录I~t曲线,用标准加入法定量测定并计算加标回收率,并将结果换算为血清中Glu的含量,结果见表2。对样品进行5次平行测定,平均值为4.8 mmol/L,RSD为2.5%,加标回收率为96.0%~110.1%。该样品用医院采用的酶联免疫比色法进行测定,3次平行测定结果的平均值为4.7 mmol/L,RSD为3.2%,经对照试验,本法测定结果与医院测定结果间无显著性差异。
3 结 论
本文采用逐层电化学沉积法制备了氧化铜-过氧化聚吡咯-还原氧化石墨烯复合膜修饰电极(CuO-OPPy-ERGO/CCE),并用于葡萄糖(Glu)的非酶电化学检测。复合膜中的过氧化聚吡咯(OPPy)显著改善了电极的选择性和稳定性;还原氧化石墨烯(ERGO)后提高了复合膜的导电性,同时为CuO粒子的负载提供了更多活性位点,得到了粒径小、分散均匀的CuO粒子,提高了电极的电催化活性。将该电极采用安培法检测葡萄糖时具有检出限低、线性范围宽、选择性高和稳定性好等特点,可用于血清中葡萄糖含量的测定。
[1] Bai H Y,Wang X H,Dai Z H.Chin.J.Appl.Chem.(白红艳,王秀华,戴志辉.应用化学),2012,29(6):611-616.
[2] Zhu H,Li L,Zhou W,Shao Z P,Chen X J.J.Mater.Chem.B,2016,4:7333-7349.
[3] Zhang W L,Li R,Chang X X,Gou X L.J.Instrum.Anal.(张文丽,李容,常晓璇,苟兴龙.分析测试学报),2016,35(5):508-513.
[4] Luo M R,Wang L L,Zhang Y J,Zhao S.Chin.J.Anal.Chem.(罗明荣,王良良,张亚静,赵爽.分析化学),2016,44(6):882-887.
[5] Huang H P,Zhu J J.Chin.J.Anal.Chem.(黄海平,朱俊杰.分析化学),2011,39(7):963-971.
[6] Gao H L,Li X L,He W,Guo R T,Chai B.ActaPhys.Chim.Sin.(高海丽,李小龙,贺威,国瑞婷,柴博.物理化学学报),2015,31(11):2117-2123.
[7] Wang Q,Wang Q,Li M S,Szunerits S,Boukherroub R.RSCAdv.,2015,5:15861-15869.
[8] Luo J,Zhang H Y,Jiang S S,Jiang J Q,Liu X Y.Microchim.Acta,2012,177:485-490.
[9] Zhou D L,Feng J J,Cai L Y,Fang Q X,Chen J R,Wang A J.Electrochim.Acta,2014,115:103-108.
[10] Zhao Y,Bo X J,Guo L P.Electrochim.Acta,2015,176:1272-1279.
[11] Mani V,Devasenathipathy R,Chen S M,Wang S F,Devi P,Tai Y.Electrochim.Acta,2015,176:804-810.
[12] Zheng W R,Hu L S,Lee L Y,Wong K Y.J.Electroanal.Chem.,2016,781:155-160.
[13] Yang S L,Li G,Wang D,Qiao Z H,Qu L B.Sens.ActuatorB,2017,238:588-595.
[14] Lange U,Roznyatovskaya N V,Mirsky V M.Anal.Chim.Acta,2008,614:1-26.
[15] Pihel K,Walker Q D,Wightman R M.Anal.Chem.,1996,68:2084-2089.
[16] Chang H H,Chang C K,Tsai Y C,Liao C S.Carbon,2012,50:2331-2336.
[17] Rabinovich L,Lev O.Electroanalysis,2001,13:265-275.
[18] Jiang X H,Lin X Q.Analyst,2005,130:391-396.
Non-enzymatic Detection of Glucose Using a Copper Oxide-Overoxidized Polypyrrole-Reduced Graphene Oxide Composite Film Modified Electrode
YU Hao*,CHEN Xiao-xia,FENG Xiao,WANG Shan-shan,JIN Jun
(College of Chemistry and Chemical Engineering,Yan’an University,Yan’an Key Laboratory of Analytical Technology and Detection,Yan’an 716000,China)
A copper oxide-overoxidized polypyrrole-reduced graphene oxide composite film(CuO-OPPy-ERGO/CCE) modified electrode was fabricated by using layer by layer electrochemical deposition technique.Firstly,a polypyrrole(PPy)-graphene oxide(GO) composite film was prepared by electropolymerization of pyrrole while using GO as the anionic dopant.After the electrochemical reduction in 0.10 mol/L NaCl solution and peroxidation in 0.10 mol/L NaOH solution,an overoxizied polypyrrole-reduced graphene oxide(OPPy-ERGO) composite film was obtained.Then,copper oxide was electrochemically deposited on this OPPy-ERGO film,and the modified electrode was obtained.The surface morphology and the electrochemical behavior of this modified electrode were investigated by scanning electron microscopy(SEM) and cyclic voltammetry.Furthermore,the electrochemical behavior of glucose on this electrode was also investigated carefully.The results showed that this modified electrode exhibited a high electrocatalytic activity and a good anti-interference ability for the oxidation of glucose.Under the optimum conditions,the linear range for the determination of glucose by amperommetry was in the range of 5.0×10-7-1.0×10-3mol/L.The detection limit(3Sb=3) and the sensitivity was 2.0×10-7mol/L and 121.8 μA/(mmol·L-1),respectively.The modified electrode was successfully used to determine glucose in human serum sample with recoveries of 96.0%-110.1%.
copper oxide;overoxidized polypyrrole;reduced graphene oxide;glucose;electrocatalysis
2017-03-21;
2017-05-09
延安市科技局工业攻关项目(2014KG-01)
10.3969/j.issn.1004-4957.2017.08.004
O657.1;TS245.4
A
1004-4957(2017)08-0969-06
*通讯作者:于 浩,博士,副教授,研究方向:电化学传感器,Tel:0911-2332037,E-mail:yananyh2013@163.com
