LTα和NQO1基因多态性与儿童毛细支气管炎易感性的关联性
2017-08-31王祎星张慧峰廖洁莹
王祎星,张慧峰,廖洁莹,周 辉*
(1北京大学公共卫生学院劳动卫生与环境卫生学系,北京 100191;2中国科学院海西研究院厦门稀土材料研究所;*通讯作者,E-mail:zhouhui@bjmu.edu.cn,hardhui@126.com)
LTα和NQO1基因多态性与儿童毛细支气管炎易感性的关联性
王祎星1,张慧峰1,廖洁莹2,周 辉1*
(1北京大学公共卫生学院劳动卫生与环境卫生学系,北京 100191;2中国科学院海西研究院厦门稀土材料研究所;*通讯作者,E-mail:zhouhui@bjmu.edu.cn,hardhui@126.com)
目的 探讨LTα和NQO1单核苷酸多态性(SNPs)与儿童毛细支气管炎易感性的联系。 方法 对北京某幼儿园98名儿童进行问卷调查与DNA采集,将明确诊断为毛细支气管炎的46名研究对象归为病例组,未诊断的52名研究对象归为对照组,得到成组病例对照设计,检测LTα的rs2844484位点和NQO1的rs2917666位点的基因型,采用配对t检验、配对χ2检验及条件Logistic回归进行共显性、显性、隐性模型分析和危险因素分层分析。 结果 经被动吸烟、购置新家具情况、动物皮毛接触史、雾霾天佩戴口罩习惯校正后,在隐性模型中,rs2844484位点基因型在毛细支气管炎病例组和对照组中的分布差异具有统计学意义(P<0.05),共显性和显性模型下的rs2844484位点及所有模型下rs2917666位点基因型在毛细支气管炎中的分布差异均无统计学意义(P>0.05)。对隐形模型按被动吸烟、购置新家具、动物皮毛接触、雾霾天佩戴口罩4个相关危险因素分层,无被动吸烟史、儿童出生后未购置新家具、无动物皮毛接触史条件下,与AG/GG基因型相比,rs2844484携带AA基因型的个体发生毛细支气管炎的风险明显增加(校正OR分别为3.649,3.985,5.202,95%CI分别为1.270-10.486,1.053-15.088,1.685-16.058,均P<0.05)。 结论 LTα基因rs2844484位点SNP可能是儿童毛细支气管炎发生的易感因素,而NQO1基因rs2917666位点SNP在儿童毛细支气管炎发病过程中不是主要易感因素。
毛细支气管炎; 单核苷酸多态性; LTα; NQO1
毛细支气管炎(bronchiolitis)是儿童常见的呼吸系统疾病,通常由病毒感染引起,而个体遗传因素和环境因素在疾病发生中也起到一定作用。国内外均有报道毛细支气管炎是诱发幼儿反复喘息和支气管哮喘(bronchial asthma)的重要启动因子[1,2]。目前关于哮喘候选基因的研究相对较多,而毛细支气管炎易感基因的研究却十分有限,因此筛选其易感基因对易感者筛查和实现毛细支气管炎、支气管哮喘两种疾病的一级预防十分重要。
淋巴毒素α(lymphoxin-α,LTα),是与TNF-α分子结构和活性区域相似的免疫相关因子,与TNF-α紧密连锁。目前已有文献报道TNF-α多态性与儿童支气管哮喘易感性的关联,亦有研究提及LTα单核苷酸多态性与哮喘发病的关联性。国内研究[3]发现TNF-α-308A可能是幼儿呼吸合胞病毒毛细支气管炎易感性的重要候选位点之一,而LTα与哮喘及其他呼吸道疾病的相关研究尚欠缺。
醌氧化还原酶(NAD(P)H:quinone oxidoreductase, NQO1)是一种Ⅱ相反应酶,可以还原醌类化合物,清除自由基,降低香烟烟雾中致癌底物的活性,改善外源物质对细胞的毒性作用。现有研究主要关注于NQO1与呼吸系统癌症易感性的关系,仅欧洲一项研究提到NQO1rs2917666基因多态性与暴露于交通污染的人群哮喘患病率相关[4]。同样,NQO1基因多态性与其他呼吸道疾病的关联性研究亟待补充。
近年来,城市发展引发的空气污染问题引起社会的广泛关注。有害气体的排放和PM2.5的升高成为人群呼吸系统疾病发病增多的潜在元凶。在高暴露地区,儿童是空气污染所致呼吸道疾病的重点人群之一。因此本研究以空气污染高暴露地区儿童为研究对象,基于气道免疫反应的共同特征及现有资料对毛细支气管炎支气管哮喘间关联性的确定,选取了LTα、NQO1两个哮喘相关易感基因位点(rs2844484、rs2917666),探究其单核苷酸多态性(single nucleotide polymorphisms,SNPs)与毛细支气管炎易感性之间的关联。
1 研究对象与方法
1.1 研究对象
本研究将北京某幼儿园大班儿童纳入研究对象。在NCBI网站查阅资料获得rs2844484、rs2917666两位点在健康人群中易感等位基因概率,根据病例对照设计样本量计算公式计算理论样本量为110人。根据排除标准:在京居住年限低于2年,筛选符合条件的98名儿童作为研究对象,平均在京居住年限(5.14±0.98)年。通过问卷调查,将曾经在医院获得明确诊断(毛细支气管炎)的对象归为病例组,未下诊断的对象归为对照组,得到成组病例对照设计。
1.2 调查问卷
调查问卷在征得调查对象及其监护人的知情同意(告知本研究的内容、需采集的生物样本及个人基本信息保密等内容)并签字后交予监护人如实填写,问卷内容包括:人口统计学特征,如性别、年龄、身高、体质量等;环境暴露情况,如被动吸烟暴露和饲养宠物情况等;生活习惯,如雾霾天口罩的佩戴情况;既往病史,包括个人及家庭感染史和过敏史等。在幼儿园开展科普课程的过程中通过咽拭子收集儿童口腔黏膜上皮细胞。
1.3 目的基因SNP检测
用咽拭子收集研究对象的口腔黏膜上皮细胞,每个研究对象采集两个平行样。样品交由北京爱康远创医疗科技有限公司负责进行DNA的提取和LTα、NQO1基因rs2844484、rs2917666位点基因型检测,采用荧光定量PCR的方法获得目标SNP位点的基因型。
1.4 统计学方法
样本群体代表性通过在研究样本对照组中进行Hardy-Weiberg平衡检验获取。统计分析采用SPSS 20.0软件,对计量资料采用配对t检验,结果以均数±标准差表示;对计数资料采用配对χ2检验;采用条件Logistic回归分析计算OR值和95%CI,对被动吸烟、购置新家具、动物皮毛接触、雾霾天佩戴口罩等因素进行校正。根据结果选取模型对被动吸烟、购置新家具、动物皮毛接触、雾霾天佩戴口罩等因素进行分层分析。双侧检验水准α=0.05。
2 结果
2.1 一般情况
毛细支气管炎病例组共46例,其中男孩27名,女孩19名,年龄(5.8±0.4)岁,身高(117.9±5.0)cm,体质量(21.3±3.1)kg;对照组共52例,男孩24名,女孩28名,年龄(5.7±0.3)岁,身高(115.4±5.7)cm,体质量(21.5±3.0)kg。病例组与对照组性别、年龄、身高和体质量差异无统计学意义(P>0.05)。两组研究对象的被动吸烟、购置新家具情况、雾霾天佩戴口罩习惯、个体和家族过敏史间的分布差异均无统计学意义(P>0.05)。病例组动物皮毛接触史、个体感染史和家族感染史的人数构成比均高于对照组,差异具有统计学意义(P<0.05,见表1)。
表1 病例组和对照组的一般情况比较
Table 1 Comparison of general data between case group and control group
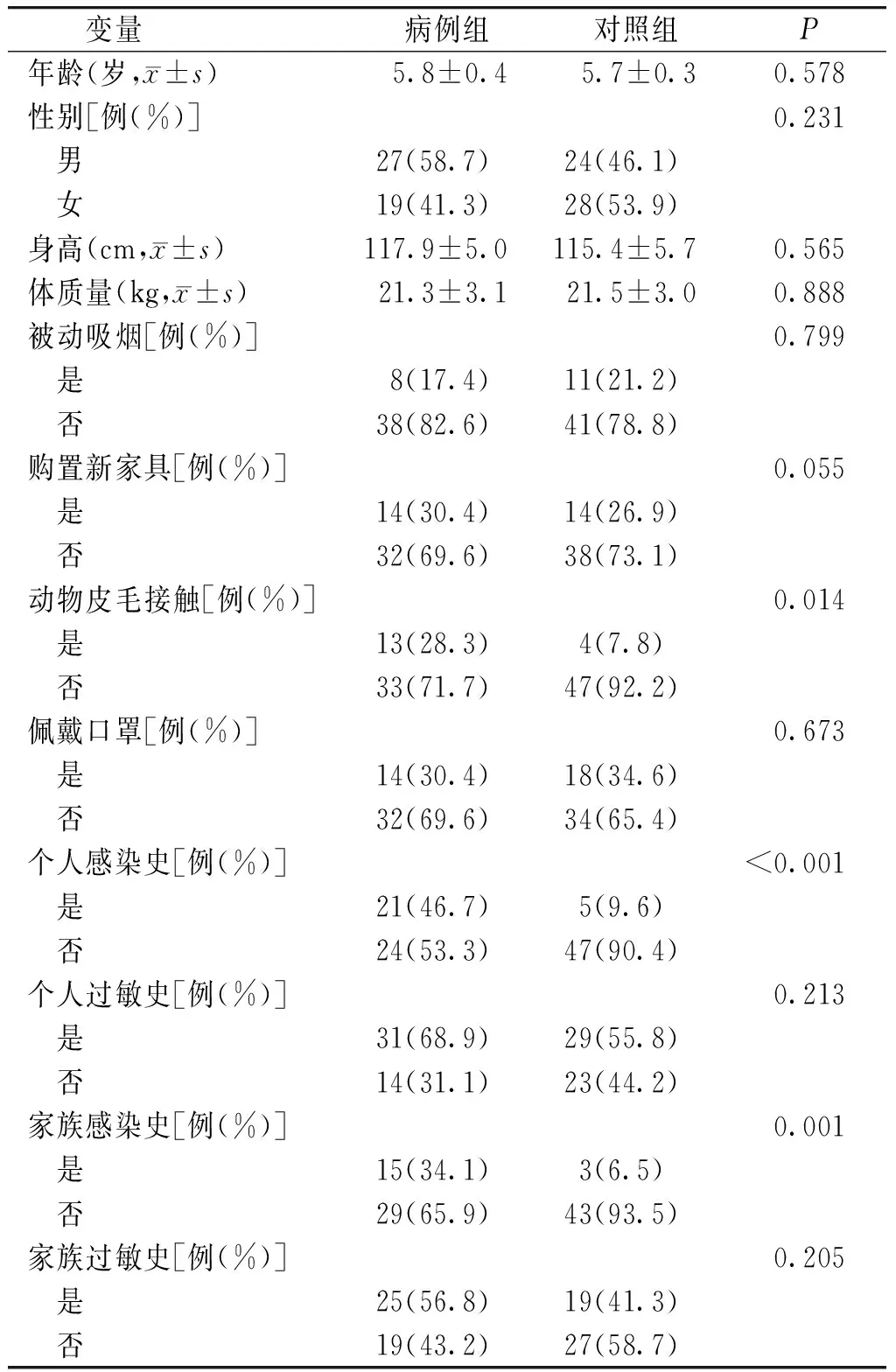
变量 病例组 对照组P年龄(岁,x±s) 5.8±0.4 5.7±0.30.578性别[例(%)]0.231 男27(58.7)24(46.1) 女19(41.3)28(53.9)身高(cm,x±s)117.9±5.0115.4±5.70.565体质量(kg,x±s) 21.3±3.1 21.5±3.00.888被动吸烟[例(%)]0.799 是 8(17.4)11(21.2) 否38(82.6)41(78.8)购置新家具[例(%)]0.055 是14(30.4)14(26.9) 否32(69.6)38(73.1)动物皮毛接触[例(%)]0.014 是13(28.3) 4(7.8) 否33(71.7)47(92.2)佩戴口罩[例(%)]0.673 是14(30.4)18(34.6) 否32(69.6)34(65.4)个人感染史[例(%)]<0.001 是21(46.7) 5(9.6) 否24(53.3)47(90.4)个人过敏史[例(%)]0.213 是31(68.9)29(55.8) 否14(31.1)23(44.2)家族感染史[例(%)]0.001 是15(34.1) 3(6.5) 否29(65.9)43(93.5)家族过敏史[例(%)]0.205 是25(56.8)19(41.3) 否19(43.2)27(58.7)
2.2 各基因型在两组中的分布及与两种疾病的关系
rs2844484、rs2917666基因型在毛细支气管炎的对照组内的分布均符合Hardy-Weinberg平衡(毛细支气管炎对照组P=0.231和0.494)。分别对rs2844484、rs2917666进行共显性、显性、隐性模型分析,结果显示,经被动吸烟、购置新家具情况、动物皮毛接触史、雾霾天佩戴口罩习惯校正后,在隐性模型中,rs2844484位点基因型在毛细支气管炎病例组和对照组中的分布差异具有统计学意义(P<0.05,见表2),表明AA基因型较AG/GG基因型发生毛细支气管炎的风险更高;共显性和显性模型下的rs2844484位点基因型在毛细支气管炎中的分布差异不具有统计学意义(P>0.05,见表2)。在所有模型中,rs2917666位点基因型在毛细支气管炎中的分布差异均无统计学意义(P>0.05,见表2)。
对rs2844484、rs2917666等位基因分布分析,经被动吸烟、购置新家具情况、动物皮毛接触史、雾霾天佩戴口罩习惯校正后,rs2844484位点等位基因分布差异具有统计学意义(P<0.05,见表3),表明等位基因G→A的突变增加了毛细支气管炎的患病风险。rs2917666位点等位基因在毛细支气管炎各组的分布差异不具有统计学意义(P>0.05,见表3)。
2.3 分层分析
为进一步探讨两个基因位点与疾病的关联性,根据2.2结果,本研究选取了毛细支气管肺炎与rs2844484位点具有统计学意义的隐性模型,对被动
表2 2个位点基因多态性与毛细支气管炎易感性的关联分析 例(%)
Table 2 Association of genetic variations in LTα and NQO1 genes with susceptibility of bronchiolitis in children cases(%)
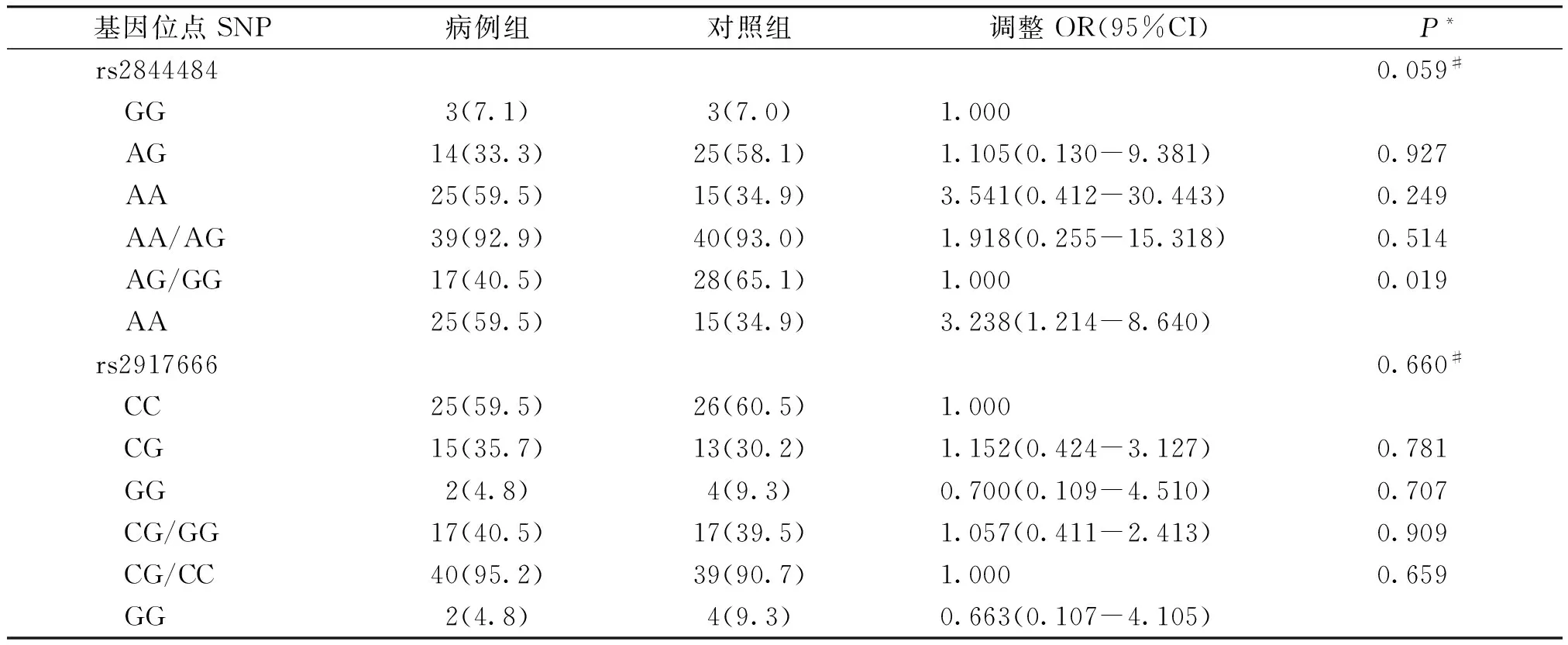
基因位点SNP病例组对照组调整OR(95%CI)P*rs28444840.059# GG3(7.1)3(7.0)1.000 AG14(33.3)25(58.1)1.105(0.130-9.381)0.927 AA25(59.5)15(34.9)3.541(0.412-30.443)0.249 AA/AG39(92.9)40(93.0)1.918(0.255-15.318)0.514 AG/GG17(40.5)28(65.1)1.0000.019 AA25(59.5)15(34.9)3.238(1.214-8.640)rs29176660.660# CC25(59.5)26(60.5)1.000 CG15(35.7)13(30.2)1.152(0.424-3.127)0.781 GG2(4.8)4(9.3)0.700(0.109-4.510)0.707 CG/GG17(40.5)17(39.5)1.057(0.411-2.413)0.909 CG/CC40(95.2)39(90.7)1.0000.659 GG2(4.8)4(9.3)0.663(0.107-4.105)
*经被动吸烟、购置新家具、动物皮毛接触、雾霾天佩戴口罩校正;#各SNP位点3种基因型在病例组及对照组中频数分布差异比较
表3 2个位点基因等位基因分布与毛细支气管炎发生的关联分析 例(%)
Table 3 Association of the frequency of rs2844484 and rs2917666 with susceptibility of bronchiolitis in children cases(%)
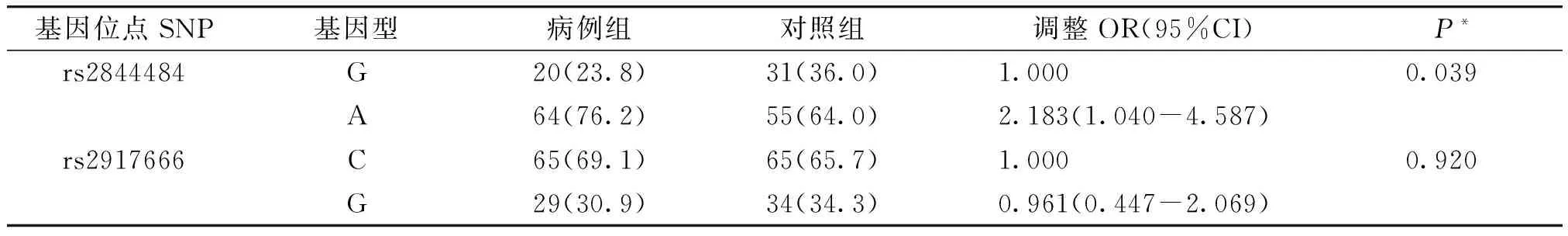
基因位点SNP基因型病例组对照组调整OR(95%CI)P*rs2844484G20(23.8)31(36.0)1.0000.039A64(76.2)55(64.0)2.183(1.040-4.587)rs2917666C65(69.1)65(65.7)1.0000.920G29(30.9)34(34.3)0.961(0.447-2.069)
*经被动吸烟、购置新家具、动物皮毛接触、雾霾天佩戴口罩校正
吸烟、购置新家具、动物皮毛接触、雾霾天佩戴口罩4个相关危险因素进行分层分析。无被动吸烟史、儿童出生后未购置新家具、无动物皮毛接触史条件下,隐性模型以携带AG/GG基因型的个体为参照,携带AA基因型的个体发生毛细支气管炎的风险增高(校正OR分别为3.649,3.985,5.202,95%CI分别为1.270-10.486,1.053-15.088,1.685-16.058,P<0.05,见表4);而具有以上接触史的条件下,rs2844484位点的隐性模型并不再具有统计学意义(P>0.05),按雾霾天是否佩戴口罩分层也未见结果有统计学意义(P>0.05)。
表4 rs2844484位点隐形模型按危险因素分层分析 例(%)
Table 4 Risk stratification of rs2844484 in the recessive model cases(%)
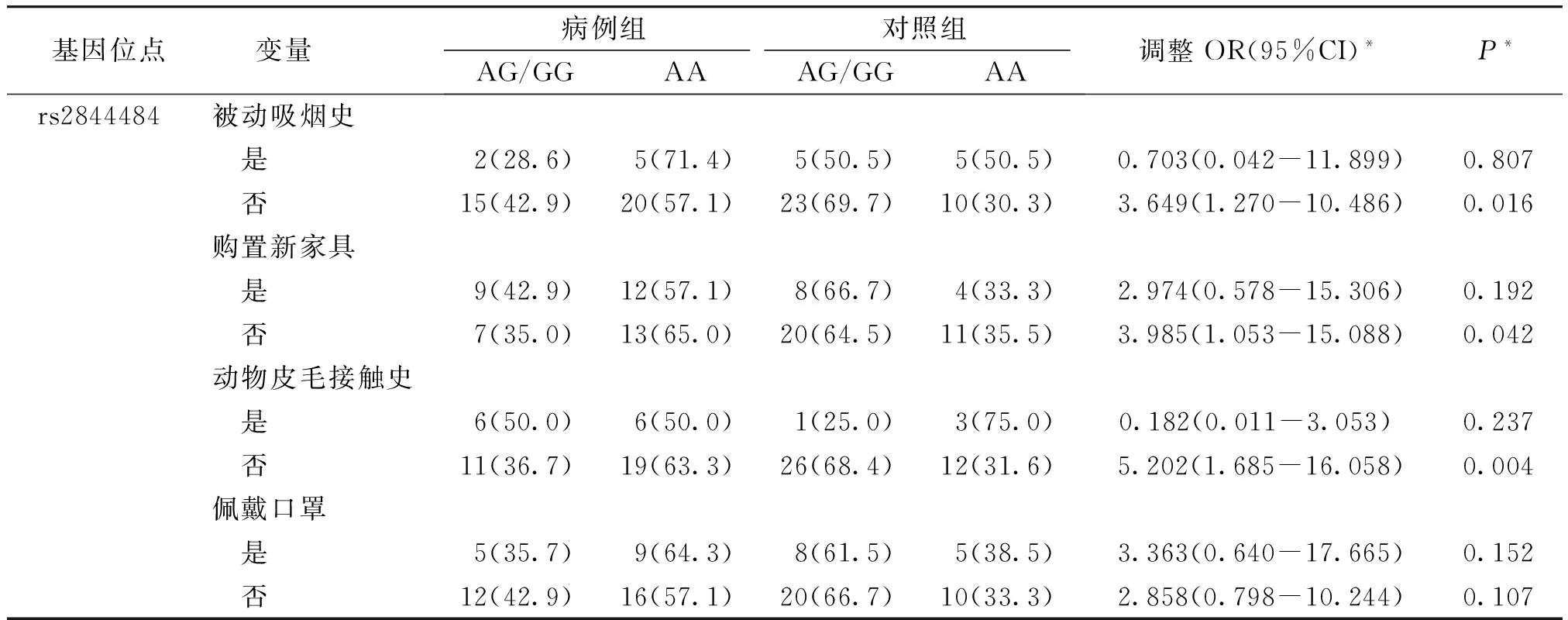
基因位点变量 病例组对照组AG/GGAAAG/GGAA调整OR(95%CI)*P*rs2844484被动吸烟史 是2(28.6)5(71.4)5(50.5)5(50.5)0.703(0.042-11.899)0.807 否15(42.9)20(57.1)23(69.7)10(30.3)3.649(1.270-10.486)0.016购置新家具 是9(42.9)12(57.1)8(66.7)4(33.3)2.974(0.578-15.306)0.192 否7(35.0)13(65.0)20(64.5)11(35.5)3.985(1.053-15.088)0.042动物皮毛接触史 是6(50.0)6(50.0)1(25.0)3(75.0)0.182(0.011-3.053) 0.237 否11(36.7)19(63.3)26(68.4)12(31.6)5.202(1.685-16.058)0.004佩戴口罩 是5(35.7)9(64.3)8(61.5)5(38.5)3.363(0.640-17.665)0.152 否12(42.9)16(57.1)20(66.7)10(33.3)2.858(0.798-10.244)0.107
rs2844484位点隐性模型结果以AG/GG基因型为参照;*经被动吸烟、购置新家具、动物皮毛接触、雾霾天佩戴口罩校正
3 讨论
毛细支气管炎是儿童常见的呼吸系统疾病,通常由病毒感染引起,最常见的病原体为呼吸合胞病毒(RSV),但流感病毒、副流感病毒、腺病毒等亦可诱发此病。研究表明,住所空气条件不佳、被动吸烟等环境因素对疾病发生具有协同作用[5]。个体遗传因素和环境因素都是此类疾病的发病原因,而目前疾病相关的遗传因素仍不很清晰。本研究对淋巴毒素α(LTα)与醌氧化还原酶(NQO1)两个基因的多态性位点rs2844484(LTα)与rs2917666(NQO1)与这两种疾病的相关性进行人群分析,发现LTα基因rs2844484位点SNP与儿童毛细支气管炎发生有明显相关性。
LTα(TNF-β),位于第六号染色体短臂MHCⅢ类区域,是淋巴细胞受抗原或有丝分裂原等刺激活化后及在某些肿瘤、自身免疫病的情况下产生分泌的一种细胞因子,结构类似于肿瘤坏死因子α(tumor necrosis factor,TNF-α),同隶属于肿瘤坏死因子基因超家族,因此又被称为TNF-β,与TNF-α紧密连锁。其基因多态性表现在第一内含子区的NcoⅠ酶切位点。已有大量研究提示了TNF-α基因多态性与支气管哮喘易感性的交互作用,在中国汉族人及英国白种人中已得到验证[6,7]。目前已有文献报道多个TNF-α多态性位点的单核苷酸多态性可能与儿童支气管哮喘易感性有关[8,9]。国外个别研究提及LTα单核苷酸多态性与哮喘发病的关联性,但结果尚有争议[9,10]。国内研究[3]发现TNF-α-308A可能是幼儿呼吸合胞病毒毛细支气管炎易感性的重要候选位点。一项涵盖34项研究共11 439名研究对象的Meta分析显示,隐型模型下,TNF-α-308A单核苷酸多态性与哮喘发生显著相关(OR=1.46,95% CI=1.21-1.76,P<0.0001),但这一结果受到人种差异的影响[11]。研究发现,10岁以内发生过呼吸合胞病毒毛细支气管炎的儿童更容易发生哮喘[2,12],提示毛细支气管炎与哮喘发生具有较强的关联性。另一项关于呼吸道病毒与TNF-α-308A位点基因多态性的研究表明,GA/AA基因型在腺病毒、流感病毒和呼吸合胞病毒刺激下更易产生高浓度的TNF-α,提示TNF-α-308A位点SNP可能影响病毒性呼吸道疾病的易感性[13]。国内亦有研究显示TNF-α-308A是儿童呼吸合胞病毒毛细支气管炎的易感位点。然而目前关于LTα在支气管哮喘和毛细支气管炎易感性的影响尚未有针对性的研究。
本研究结果表明,在经被动吸烟、购置新家具情况、动物皮毛接触史、雾霾天佩戴口罩习惯校正后的隐性模型中,rs2844484位点基因多态性与毛细支气管炎发生风险间存在关联。携带GG基因型的个体发病风险较低,当位点发生G→A的突变后,毛细支气管炎发生风险增加,携带AA基因型的个体表现出显著的发病风险。在本研究群体中,GG基因型比例较少,AG基因型未表现出明显的发病风险,因此rs2844484位点与毛细支气管炎易感性关系为AA>AG/GG。
此外,对4个环境危险因素分层分析后,该关联仅在无被动吸烟史、儿童出生后未购置新家具、无动物皮毛接触史的群体中存在。这一结果提示在未有以上三类暴露的情况下,LTα可能是儿童毛细支气管炎的易感基因。香烟烟雾中含有烟尘、挥发性烃类、氮氧化物及一氧化碳等物质,是诱发多种呼吸系统疾病的重要因素。新家具的黏合剂及板材释放的甲醛和挥发性有机化合物也会对呼吸系统疾病发生产生影响[14]。在动物皮毛接触与毛细支气管炎患病情况的关联性分析中,病例组接触动物皮毛的比例高于对照组,而动物皮毛是接触病原体的一种重要途径。经雾霾天口罩佩戴习惯分层后,基因多态性与毛细支气管炎易感性间不再存在关联,提示雾霾可能会影响儿童毛细支气管炎的患病情况,如PM2.5吸附有害物质及病原体等,佩戴口罩并不能完全改善这一不良影响。由于毛细支气管炎是由环境因素与遗传因素共同作用而发生的,而环境因素(病原体感染)是其发生的主要原因,因此基因多态性对疾病的影响可能会被掩盖。
本研究进行TNF-α-308A位点疾病易感性分析时,发现该位点与两种疾病间均无统计学意义(P>0.05),表明LTα rs2844484位点与毛细支气管炎易感性之间的关联未受到TNF-α-308A位点的影响。Yang等[11]提出,经人群分层后,东亚人群中TNF-α-308A位点与哮喘易感性不具有关联性,进一步猜想该位点亦可能在东亚人群中不是影响毛细支气管炎易感性的因素。由于TNF-α与LTα两基因的多个位点间还可能存在交互作用,因此结果仍需更多SNP间交互作用方面的研究进行验证。
NQO1是一种重要的双电子还原酶,可将醌类化合物还原为更稳定的氢醌,清除自由基,从而预防醌类的致癌作用,其代谢作用是清除外源有害物质的重要的氧化应激途径。现有研究主要关注了NQO1与呼吸系统癌症易感性的关系。国内一项研究发现其抑制了p53基因产物的降解而对非小细胞型肺癌具有抑癌作用[15]。然而国内外关于NQO1与哮喘的报道十分有限,仅一项欧洲病例对照研究提到NQO1rs2917666基因多态性与暴露于当地交通污染的人群哮喘患病率具有相关性[4],并且危险性随NO2暴露浓度升高而增加,提示抗氧化途径在空气污染条件下对哮喘发生具有重要意义。而这一项研究的人群是欧洲成人,其他国家和地区的人群及儿童的相关研究十分匮乏,其他呼吸系统疾病易感性的研究亦鲜有报道。
在本研究中,用显性模型、共显性模型及隐型模型进行分析均未发现rs2917666位点与毛细支气管炎发生风险间存在关联。按4种环境危险因素分层分析,二者仍不存在显著关联性。结果提示,NQO1基因rs2917666位点SNP在儿童毛细支气管炎的发生发展过程中可能不发挥作用。但是综合考虑到人种、地区遗传易感性差异及样本量,这一结果尚不可外推。北京空气条件复杂,污染情况严重,机动车数量逐年上升,NO2等有害气体的排放量也十分可观。因此在这种高暴露环境中,rs2917666位点遗传易感性可能受到影响。另外儿童是一个对外界环境因素敏感且免疫力较低的特殊人群,提示需要在不同的人群中扩充样本量,进一步验证结果。
本研究存在一些局限性。一方面,儿童日常生活轨迹与活动区环境情况复杂,难以做到精确测量与控制,势必对结果产生影响。因此本研究在研究对象选择时进行了年龄、性别等基本条件的匹配,并严格控制在京居住年限。选择同一幼儿园的研究对象在一定程度上可以有效控制由主要活动区环境造成的差异,而5岁左右的儿童在保证在京生活时间的同时,对DNA采集也具备更好的依从性,从而尽可能控制混杂因素。另一方面,本研究样本量有限,可能会影响到结果的把握度,尤其对分层分析影响较大,因此在后续研究中需要更大的样本量进行验证。
综上所述,LTα基因rs2844484位点SNP可能是儿童毛细支气管炎发生的易感因素,不过在强环境危险因素影响下,该遗传易感性不再显著。NQO1基因rs2917666位点SNP在儿童毛细支气管炎发病过程中不是主要易感因素。该结果受到样本量、人种、暴露环境等原因的影响,因此对LTα及NQO1基因在儿童毛细支气管炎易感性中发挥的作用需要在更多人群中进行重复,并综合考虑SNP之间及与环境因素的相互作用,为儿童易感基因SNP在预防毛细支气管炎过程中提供理论支持。
[1] 罗运春,黄达枢,方水富,等.毛细支气管炎病后的P物质和气道反应性检测与哮喘发病关系的研究[J].中华儿科杂志,1999,37(9):43-45.
[2] Sigurs N, Bjarnason R, Sigurbergsson F,etal.Respiratory syncytial virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7[J].Am J Respir Crit Care Med,2000,161(5):1501-1507.
[3] 张亚丽,董琳,陈小芳.TNF-α-308G/A和IL-6-174G/C基因多态性与呼吸道合胞病毒毛细支气管炎的相关性[J].中国当代儿科杂志,2009,11(10):821-824.
[4] Castro-Giner F, Kunzli N, Jacquemin B,etal.Traffic-related air pollution, oxidative stress genes, and asthma (ECHRS)[J].Environ Health Perspect,2009,117(12):1919-1924.
[5] Law BJ, Carbonell-Estrany X, Simoes EA.An update on respiratory syncytial virus epidemiology: a developed country perspective[J].Respir Med,2002,96 (Suppl B):S1-S7.
[6] 高金明,林耀广,邱长春,等.肿瘤坏死因子α/淋巴毒素α基因多态性与支气管哮喘的关系[J].基础医学与临床,2003,23(5):512-516.
[7] Chagani T, Pare PD, Zhu S,etal. Prevalence of tumor necrosis factor-alpha and angiotensin converting enzyme polymorphisms in mild/moderate and fatal/near-fatal asthma[J]. Am J Respir Crit Care Med,1999,160(1):278-282.
[8] Aoki T, Hirota T, Tamari M,etal. An association between asthma and TNF-308G/A polymorphism: meta-analysis[J]. J Hum Genet,2006,51(8):677-685.
[9] Wu H, Romieu I, Sienra-Monge JJ,etal. Parental smoking modifies the relation between genetic variation in tumor necrosis factor-alpha (TNF) and childhood asthma[J]. Environ Health Perspect,2007,115(4):616-622.
[10] Randolph AG, Lange C, Silverman EK,etal. Extended haplotype in the tumor necrosis factor gene cluster is associated with asthma and asthma-related phenotypes[J]. Am J Respir Crit Care Med,2005,172(6):687-692.
[11] Yang G, Chen J, Xu F,etal. Association between tumor necrosis factor-alpha rs1800629 polymorphism and risk of asthma: a meta-analysis[J]. PLoS One,2014,9(6):e99962.
[12] Henderson J, Hilliard T N, Sherriff A,etal. Hospitalization for RSV bronchiolitis before 12 months of age and subsequent asthma, atopy and wheeze: a longitudinal birth cohort study[J]. Pediatr Allergy Immunol,2005,16(5):386-392.
[13] Patel JA, Nair S, Ochoa EE,etal. Interleukin-6(-)(1)(7)(4) and tumor necrosis factor alpha(-)(3)(0)(8) polymorphisms enhance cytokine production by human macrophages exposed to respiratory viruses[J]. J Interferon Cytokine Res,2010,30(12):917-921.
[14] Herr M, Nikasinovic L, Foucault C,etal. Can early household exposure influence the development of rhinitis symptoms in infancy? Findings from the PARIS birth cohort[J]. Ann Allergy Asthma Immunol,2011,107(4):303-309.
[15] Liu F, Yu G, Wang G,etal. An NQO1-initiated and p53-independent apoptotic pathway determines the anti-tumor effect of tanshinone IIA against non-small cell lung cancer[J]. PLoS One,2012,7(7):e42138.
Association of genetic variations in LTα and NQO1 genes with susceptibility of bronchiolitis in children
WANG Yixing1,ZHANG Huifeng1,LIAO Jieying2,ZHOU Hui1*
(1DepartmentofOccupationalandEnvironmentalHealthSciences,PekingUniversity,Beijing100191,China;2XiamenInstituteofRare-earthMaterials,HaixiInstitutes,ChineseAcademyofSciences;*Correspondingauthor,E-mail:zhouhui@bjmu.edu.cn,hardhui@126.com)
ObjectiveTo investigate the association between genetic variations of LTα or NQO1 and susceptibility of bronchiolitis in children.MethodsIn this case-control study, 98 children in Beijing were enrolled and their personal information and DNA sample were collected separately. Among them, 46 children with bronchiolitis were divided into case group while the other 52 children were used as control group. Genotypes of rs2844484 and rs2917666 located to LTα and NQO1 respectively were detected. The association between gene polymorphism of the two loci and the susceptibility of bronchiolitis was analyzed by conditional Logistic regression.ResultsIn the recessive model, the genetic variation of rs2844484(LTα) was significantly related to the incidence of child bronchiolitis after adjusting for passive smoking, purchasing of new furniture, animal fur contact history, and wearing masks in haze days(P<0.05). Meanwhile, there was no significant association between polymorphism of rs2844484 or rs2917666 and occurrence of this disease in the co-dominant or dominant models(P>0.05). In the recessive model, based on the risk stratification of passive smoking, purchase of new furniture, animal fur contact and wearing masks in haze days, the results showed that the risk of child bronchiolitis with AA genotype was significantly higher than that of AG/GG genotype in rs2844484(adjusted OR=3.649, 3.985, 5.202, 95%CI=1.270-10.486, 1.053-15.088, 1.685-16.058,P<0.05, respectively).ConclusionThe genetic variations of rs2844484 in LTα may be a risk factor in the development of child bronchiolitis, while the polymorphism of rs2917666 in NQO1 may not affect the development of child bronchiolitis.
bronchiolitis; single nucleotide polymorphisms; LTα; NQO1
国家自然科学基金资助项目(21577004);北京市自然科学基金资助项目(7162104);北京大学医学部杰出青年人才基金资助项目(BMU20130340)
王祎星,女,1992-05生,硕士,E-mail:freya9259@126.com
2017-04-07
R725.6
A
1007-6611(2017)08-0861-06
10.13753/j.issn.1007-6611.2017.08.023
